Ski在 大鼠脊髓損傷后不同時間的表達變化①
周開升,朱彥東,趙鑫,郭永強,寇江力,汪靜,李森,龍在云,伍亞民,張海鴻
Ski在 大鼠脊髓損傷后不同時間的表達變化①
周開升1,2,朱彥東1,2,趙鑫1,2,郭永強1,2,寇江力1,2,汪靜2,李森3,龍在云3,伍亞民3,張海鴻1
目的探究ski在大鼠正常及損傷后脊髓中的表達及隨時間變化的規律。方法60只成年雌性Sprague-Daw ley大鼠,隨機分為假手術組(n=30)和損傷組(n=30),各組設1周、2周、4周、8周、12周亞組,每個亞組6只大鼠。用Allen法制備T10打擊損傷模型。損傷后1 d、3 d、1周、2周、4周、8周、12周行BBB后肢功能評分;術后1周、2周、4周、8周、12周,各組取3只大鼠行HE染色,觀察損傷后脊髓病理變化及空洞形成;另3只大鼠行ski免疫熒光染色及半定量分析。結果損傷組各時間點BBB評分均低于假手術組(P<0.05)。損傷后1周、2周,脊髓主要以壞死為主;4周時空洞完全形成,空洞周圍有致密瘢痕組織;8周、12周空洞及瘢痕無明顯變化,但損傷中心及附近脊髓明顯變細。ski在正常脊髓中表達較低,損傷后ski表達逐漸增高,8周時達到高峰,12周時有所降低;ski在正常及損傷后12周脊髓中主要分布于白質;損傷后2周、4周和8周時灰質中出現明確ski表達。在損傷中心,ski在空洞周圍密集表達。結論ski在脊髓損傷后表達。它可能作用于星形膠質細胞,并調控其活化、增生以及膠質瘢痕形成。
脊髓損傷;ski;星形膠質細胞;瘢痕;大鼠
[本文著錄格式]周開升,朱彥東,趙鑫,等.Ski在大鼠脊髓損傷后不同時間的表達變化[J].中國康復理論與實踐,2016,22(9):1015-1019.
CITED AS:Zhou KS,Zhu YD,Zhao X,etal.Expression and change of skiafter spinal cord injury in rats[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(9):1015-1019.
脊髓損傷后神經功能的恢復一直是醫學研究中的熱點及難點,迄今尚未取得突破性進展。原癌基因ski及其編碼的蛋白作為一種細胞類型特異性的多功能分子,在腫瘤發生、創傷愈合、肝臟再生等多個領域發揮著重要作用[1]。相關研究證實,ski在胚胎神經發育和部分中樞及周圍神經系統病理生理過程中也扮演著重要角色[2-5];轉化生長因子-β、骨形態發生蛋白、Wnt/β-catenin等多種信號通路是其發揮調控作用的主要途徑[2,6-7];脊髓損傷后一系列病理生理變化也與這些信號通路密切相關。我們推測,ski可能在脊髓損傷過程中發揮重要調控作用。
1 材料與方法
1.1實驗動物及分組
60只成年雌性Sprague-Daw ley大鼠,體質量200 g左右,由第三軍醫大學大坪醫院動物中心提供。實驗前1周,飼養動物于實驗室,自然晝夜采光,自由飲食、水,保持室溫25~28℃。動物飼養及實驗過程均遵守實驗動物管理及保護的有關規定。動物編號,隨機數字法分為假手術組和損傷組,每組30只。每組再分為1周、2周、4周、8周、12周五個亞組。
1.2主要儀器和試劑
RM 2007 A llen打擊器:美國新澤西州大學。CM 1900冰凍切片機、SP-2激光共聚焦顯微鏡:LEICA公司。無毒環保蘇木素-伊紅(HE)染液:南京建成科技有限公司。ski(H-329,sc-9140):SANTA CRUZ。Alexa Fluor?488標記山羊抗兔IgG(H+L,ZF-0511):北京中杉金橋。Image J1.50i圖像分析軟件:National Institutesof Health。
1.3模型建立
大鼠術前禁食12 h。1%戊巴比妥鈉4m l/kg腹腔注射麻醉,角膜反射消失表明麻醉成功。俯臥位固定于手術臺上,剃去背部皮毛,碘伏及酒精術區皮膚消毒。定位T10,以T10為中心背部正中切口,長約2 cm,鈍性分離棘突及椎旁肌肉,咬開T9-11椎板,顯露脊髓(未損傷硬脊膜)。用A llen打擊器打擊T10脊髓,打擊強度10 g×25mm,打擊后立即移開打擊棒。打擊成功標志:打擊后大鼠后肢發生不同程度抽搐之后癱軟,尾巴發生痙攣性擺動。
假手術組僅咬開椎板,不打擊。
逐層縫合肌肉和皮膚,放回籠中,置25~28℃動物房內。術后予青霉素16萬U肌肉注射,連續3 d;每天擠壓膀胱協助排尿3次,直至恢復自主排尿。
1.4檢測方法
1.4.1行為學評分
分別于造模后1 d、3 d、1周、2周、4周、8周、12周時,采用Basso-Beattie-Bresnahan(BBB)評分法評估大鼠后肢行為學功能。1 d、3 d評分時,偏離平均值2分以上者視為造模失敗,予以剔除,重新造模補充。評分由2名熟悉BBB評分方法的非本組實驗人員進行,將大鼠逐一放入曠場內,觀察其活動4min,評估其后肢功能。
1.4.2HE染色
造模后1周、2周、4周、8周、12周時,每亞組各取3只動物,0.01mol/L PBS左心室快速灌注,至右心耳流出清亮液體后,改用4%多聚甲醛灌注固定。取出脊髓組織,4%多聚甲醛固定24 h。30%蔗糖PBS溶液充分脫水至沉糖,以損傷為中心、上下各3~4mm,截取長約6~8mm脊髓組織,OCT冰凍切片包埋劑包埋,縱行連續切片,HE染色,光鏡下觀察。
1.4.3免疫熒光染色
各亞組另3只大鼠,取脊髓,經上述方法處理后,連續冰凍橫切片,行免疫熒光單標ski染色。0.01 mol/L PBS沖洗5 min,共3次;0.3%Triton X-100破膜25min,0.01mol/L PBS沖洗5min,共3次;10%正常山羊封閉血清封閉30 min,甩干后不洗,滴加ski一抗(1∶50),4℃冰箱過夜;自然復溫至室溫,0.01 mol/L PBS沖洗5 min,共3次(避光操作),滴加山羊抗兔A lex fluor488(1∶200),37℃烤箱孵育1 h,0.01mol/L PBS沖洗5min,共3次;DAPI染核2min,0.01mol/L PBS沖洗5min,共3次;晾干后甘油封片,激光共聚焦顯微鏡下觀察。
盡量選取離損傷中心同樣距離的組織切片,激光共聚焦顯微鏡下掃描拍照時全程以同樣參數掃描,掃描過程中除可調整焦距以外,其他參數均保持不變,選取同一部位、同一視野熒光照片,Image J 1.50i軟件分析,計算平均光密度值。
1.5統計學分析
采用SPSS 21.0軟件進行統計分析。BBB評分、平均光密度值均用(xˉ±s)表示,采用獨立樣本t檢驗。顯著性水平α=0.05。
2 結果
2.1一般情況
損傷組大鼠術后蘇醒,精神狀態較差,雙側后肢運動功能完全喪失,并開始出現尿潴留;術后1周內,部分大鼠出現血尿和腹部脹氣,之后逐漸恢復,10 d左右基本恢復自主排尿。假手術組大鼠術后蘇醒即可有部分運動,基本無后肢功能障礙,無尿潴留及血尿,無明顯腹部脹氣,但術后3 d內部分大鼠有脊柱不穩,3 d后運動功能基本恢復正常。
2.2BBB評分
損傷組大鼠3 d內評分均為0~1分;術后1周內后肢功能恢復較慢,1~4周功能恢復較為迅速,4~12周功能恢復速度再次放緩。假手術組術后1~3 d部分大鼠可有尾巴下垂或損傷部位脊柱不穩現象,3 d后基本恢復。損傷組各時間點評分均低于假手術組(P<0.05)。見圖1。

圖1 術后兩組各時間點BBB評分比較
2.3HE染色
假手術組脊髓整體結構完整,無損傷及壞死,細胞排列有序,胞核形態清晰。
損傷組打擊1周后,損傷中心逐漸出現組織壞死,開始出現較小壞死空洞,損傷周圍胞核密集;2周時,壞死區域繼續擴大,損傷中心組織壞死嚴重,空洞逐步增大;4周時,壞死組織逐漸減少,空洞完全形成,空洞周圍細胞增生、胞核排列密集,圍繞空洞形成致密瘢痕組織;8周時,損傷部位脊髓開始萎縮變細,空洞基本穩定,局部可見纖維組織長入空洞,形成致密條索,空洞周圍有明顯的瘢痕形成;12周時,損傷部位及附近脊髓明顯變細,空洞無明顯變化,空洞周圍瘢痕穩定。見圖2。
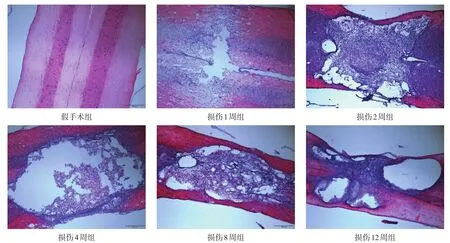
圖2 假手術組及損傷各亞組脊髓縱切(HE染色,bar=500μm)
2.4免疫熒光染色
損傷中心上端、位置相對統一、組織結構相對完整的切片中,ski在假手術組及損傷各亞組均有表達。假手術組中,ski表達較弱,分布均勻,主要位于白質,灰質中無明顯表達。損傷組1周和2周時,ski表達較假手術組有所增強,且灰質中出現明顯表達;4周和8周時,灰質及白質中ski表達明顯增加;12周時,ski表達較4周、8周時有所下降,灰質中表達信號再次減少。
與假手術組比較,打擊后1周,ski表達無顯著性差異(P>0.05);2~12周時ski表達顯著增高(P<0.001),表達量在8周時達到高峰。見圖3、圖4。

圖3 假手術組及損傷各亞組ski表達平均光密度值
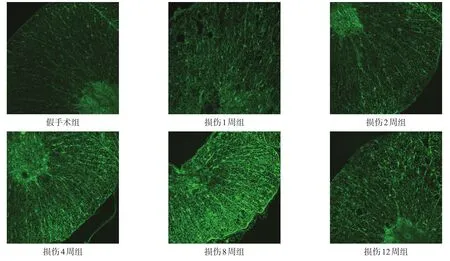
圖4 假手術組及損傷各亞組脊髓上端ski表達(免疫熒光染色,200×)
選擇ski表達與假手術組有顯著性差異的2周、4周、8周、12周四個損傷亞組損傷中心組織切片,不同時間點,ski均在損傷空洞周圍密集表達;其中,4周、8周、12周時,ski在空洞周圍形成一圈致密的高表達帶;空洞周圍陽性細胞與空洞遠端陽性細胞相比,細胞體積明顯增大。見圖5。
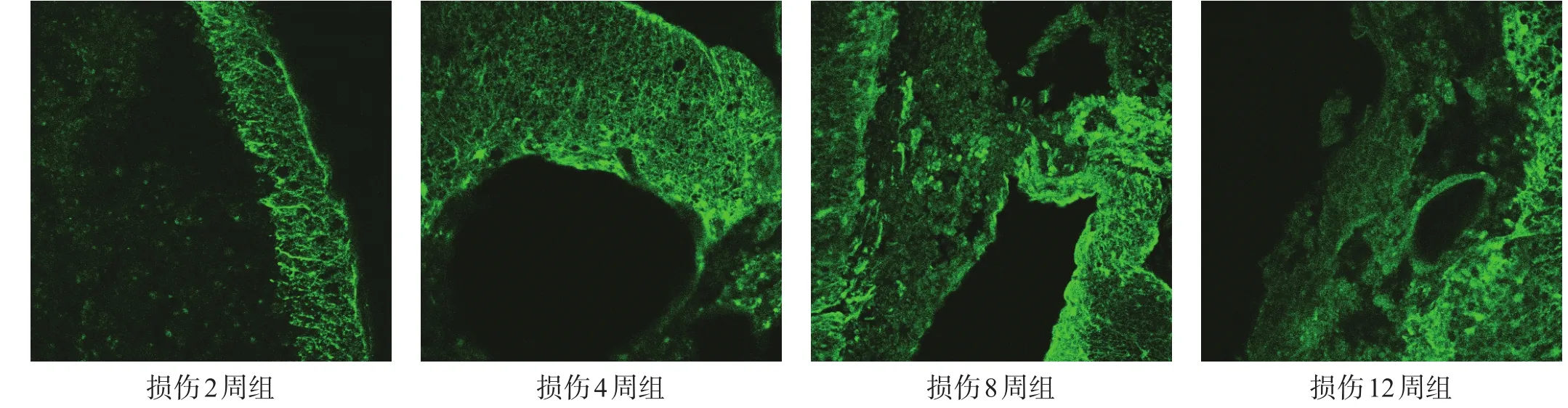
圖5 損傷部分亞組脊髓損傷中心ski表達(免疫熒光染色,200×)
3 討論
脊髓損傷后神經功能的康復依然是醫學所面臨的重大挑戰。脊髓損傷后一系列病理變化的深入研究及新的分子機制的發現依然被視為解開這一難題的關鍵。
ski作為一種進化保守蛋白,在不同物種中廣泛參與調節多種細胞的增殖及分化過程[2]。在神經系統中,ski不但可以調控神經系統胚胎發育[3],而且在施萬細胞增殖、膠質母細胞瘤等一些神經系統病理變化中發揮重要作用[4-5]。
本研究顯示,ski在正常脊髓組織中處于持續低表達狀態;脊髓損傷后ski表達逐漸增高,8周時達到頂峰,12周時稍有降低。病理觀察發現,從第4周開始,空洞周圍有明顯致密瘢痕組織形成;8~12周時,瘢痕組織基本處于穩定狀態,無明顯變化;與既往研究基本相符[8]。ski表達與脊髓損傷后膠質瘢痕形成有一定相關性。
在損傷中心,ski在空洞周圍形成密集的高表達帶,4周、8周及12周時,這種現象尤為明顯。ski的分布與膠質瘢痕形成高度吻合。我們推測,ski可能與膠質瘢痕的形成有關。
有研究表明,脊髓損傷可刺激神經前體細胞(如室管膜區細胞等)分化為活化的星形膠質細胞,從而形成膠質瘢痕[9]。本研究顯示,ski在正常脊髓中主要表達于白質,灰質中基本不表達;損傷后,灰質中開始出現ski,12周時ski在灰質中的表達再次減少。相關研究證實,室管膜區及室管膜下區的神經祖細胞在脊髓損傷后1周時可分化為星形膠質細胞,并從位于灰質的中央管周圍向損傷周圍遷移聚集,最終形成膠質瘢痕;在瘢痕形成穩定后逐步消失[8]。這與我們發現的ski在不同時期灰質與白質中的表達變化規律基本吻合,但是兩者的明確關系有待進一步研究。
活化的星型膠質細胞肥大、增生,并向損傷部位遷移聚集,是膠質瘢痕形成的重要過程[10]。近年來,關于膠質瘢痕是否有利于神經損傷的修復一直存在爭議。有學者認為,膠質瘢痕既是一種質密的物理屏障,也分泌一些細胞因子,共同抑制神經修復過程中的軸突再生和突觸形成[11-13];也有研究者提出,膠質瘢痕可以抑制神經炎癥反應的擴散,保護神經組織免受創傷后的次級損傷[10,14]。星形膠質細胞活化、增生與膠質瘢痕形成機制的研究是至關重要的課題。
從ski表達陽性細胞的形態及變化分布規律來看,ski極有可能表達于星形膠質細胞,且在活化后的星形膠質細胞中表達明顯增多。結合ski表達與脊髓損傷后病理變化的相關性,以及ski在空洞周圍形成致密的高表達帶的現象,我們推測,ski可能作為一種新的信號分子,調控星形膠質細胞的活化、增生等過程,并且可能以此調控膠質瘢痕的形成。這一假設需要ski表達的細胞定位證據及后續的研究進一步證明。
綜上所述,本研究首次明確ski在脊髓損傷后的表達變化及分布規律,結合已被證實的膠質瘢痕形成規律,我們推測,ski可能是一種作用于星形膠質細胞并調控其活化、增生以及膠質瘢痕形成的信號分子。
[1]周開升,朱彥東,張海鴻,等.Ski在神經系統中的作用及機制的研究進展[J].中國康復理論與實踐,2016,22(7):797-800.
[2]Bonnon C,Atanasoski S.c-Ski in health and disease[J].Cell Tissue Res,2012,347(1):51-64.
[3]Sleeman JP,Laskey RA.Xenopus c-skicontainsanovel coiled-coilprotein domain,and ismaternally expressed during development[J].Oncogene,1993,8(1):67-77.
[4]Atanasoski S,Notterpek L,Lee HY,et al.The protooncogene Ski controls Schwann cell proliferation and myelination[J].Neuron,2004,43(4):499-511.
[5]Jiang H,Jin C,Liu J,etal.Nextgeneration sequencing analysisofmiRNAs:MiR-127-3p inhibits glioblastoma proliferation and activates TGF-beta signaling by targeting SKI[J].Omics,2014,18(3):196-206.
[6]Chen D,XuW,Bales E,etal.SKIactivatesWnt/beta-catenin signaling in humanmelanoma[J].Cancer Res,2003,63(20):6626-6634.
[7]Deheuninck J,Luo K.Ski and SnoN,potent negative regulators of TGF-beta signaling[J].CellRes,2009,19(1):47-57.
[8]Mao Y,Mathews K,Gorrie CA.Temporal response of endogenousneural progenitor cells following injury to the adult rat spinal cord[J]. FrontCellNeurosci,2016,10:58.
[9]Meletis K,Barnabe-Heider F,Carlen M,etal.Spinal cord injury reveals multilineage differentiation of ependymal cells[J].PLoS Biol,2008,6(7):e182.
[10]Voskuhl RR,Peterson RS,Song B,et al.Reactive astrocytes form scar-like perivascularbarriers to leukocytesduring adaptive immune inflammation of the CNS[J].JNeurosci,2009,29(37):11511-11522.
[11]Davies SJ,Fitch MT,Memberg SP,et al.Regeneration of adultaxons in whitematter tracts of the central nervous system[J].Nature,1997,390(6661):680-683.
[12]Barnabe-Heider F,Goritz C,Sabelstrom H,et al.Origin of new glial cells in intact and injured adult spinal cord[J].Cell Stem Cell,2010,7(4):470-482.
[13]Wang YF,Zu JN,Li J,etal.Curcumin promotes the spinal cord repair via inhibition of glial scar formation and inflammation[J].Neurosci Lett,2014,560:51-56.
[14]Wanner IB,Anderson MA,Song B,etal.Glialscar bordersare formed by new ly proliferated,elongated astrocytes that interact to corral inflammatory and fibrotic cells via STAT3-dependentmechanisms after spinal cord injury[J].JNeurosci,2013,33(31):12870-12886.
Expression and Changeof Skiafter SpinalCord Injury in Rats
ZHOU Kai-sheng1,2,ZHU Yan-dong1,2,ZHAO Xin1,2,GUO Yong-qiang1,2,KOU Jiang-li1,2,WANG Jing1,2,LISen3,LONG Zai-yun3,WU Ya-min3,ZHANG Hai-hong1
1.Department of Orthopedics,Second Clinical Medical College of Lanzhou University,Lanzhou,Gansu 730030,China;2.Key Laboratory of Orthopedics of Gansu Province,Lanzhou,Gansu 730030,China;3.State Key Laboratory of Trauma,Burns and Combined Injury,the Third Departmentof Research Institute of Surgery,Daping Hospital,Third Military MedicalUniversity,Chongqing 400042,China
ZHANG Hai-Hong.E-mail:zhanghaihong1968@sina.com
Objective To explore the expression and the changes of skiwith time in the injured spinal cord in rats.Methods Sixty adult female Sprague-Daw ley ratswere random ly divided into sham group(n=30)and injury group(n=30),each group were further divided into 1 week,2weeks,4weeks,8weeksand 12weekssubgroups,with 6 rats in each subgroup.Spinal cord injury at T10wasestablished withmodified A llen's technique(10 g×25mm)in the injury group.The hindlimbs behavior of rats was rated with Basso-Beattie-Bresnahan(BBB)scores 1 day,3 days,1 week,2 weeks,4 weeks,8 weeks and 12 weeks after spinal cord injury.Three rats in each subgroup were stained with HE staining to observe the pathological changesof the spinal cord and the formation of cavity.The other 3 ratswere analyzed with immunofluorescence staining of skiand semiquantitative analysis.Results The BBB scores of each time pointwere less in the injury group than in the sham group(P<0.05).Necrosiswas themajor pathological change in the injury groups 1 and 2 weeks after injury;cystic cavity completely formed 4 weeks after injury,with dense scar tissue around it;there was no significant change in the cavity and scar 8 and 12 weeks after injury,however,the adjacent spinal cord was obviously thinner.Ski expressed little in the normal spinal cord,and expressed more andmore after injury,peaked at8weeksand decreased then.Skiwasmainly observed inwhitematter in the sham group and 12weeks injury subgroup,which was in gray matter 2,4 and 8 weeks after injury.Skiwas highly expressed around the cavity in injury center and formed high expression band.Conclusion Skiexpressesafter spinal cord injury in rats,thatmay be associated with the activation and proliferation of astrocytesand the formation of glialscar.
spinal cord injury;ski;astrocyte;scar;rats
10.3969/j.issn.1006-9771.2016.09.006
R651.2
A
1006-9771(2016)09-1015-05
2016-06-02
2016-06-13)
國家自然科學基金項目(No.30772299)。
1.蘭州大學第二醫院骨科,甘肅蘭州市730030;2.甘肅省骨關節疾病研究重點實驗室,甘肅蘭州市730030;3.第三軍醫大學大坪醫院野戰外科研究所三室,創傷、燒傷與復合傷國家重點實驗室,重慶市400042。作者簡介:周開升(1990-),男,漢族,甘肅武威市人,碩士研究生,主要研究方向:脊柱脊髓損傷。通訊作者:張海鴻,主任醫師,副教授,碩士研究生導師,主要研究方向:脊柱外科。E-mail:zhanghaihong1968@sina.com。

