不同運動強度對急性心肌梗死大鼠心功能的影響及循環miRNAs差異表達
夏昆,丁榮晶,陸凱,王歷
(1.首都醫科大學附屬北京朝陽醫院心內科,北京100043;2.北京大學人民醫院心內科,北京100044;3.重慶醫科大學附屬第一醫院心內科,重慶630042;4.重慶醫科大學附屬永川醫院心內科,重慶402160)
不同運動強度對急性心肌梗死大鼠心功能的影響及循環miRNAs差異表達
夏昆1,丁榮晶2,陸凱3,王歷4
(1.首都醫科大學附屬北京朝陽醫院心內科,北京100043;2.北京大學人民醫院心內科,北京100044;3.重慶醫科大學附屬第一醫院心內科,重慶630042;4.重慶醫科大學附屬永川醫院心內科,重慶402160)
研究不同運動強度對急性心肌梗死大鼠心功能的影響,分析循環微小RNA(microRNAs,miRNAs)的差異表達與靶基因及基因功能.制作急性心肌梗死大鼠模型40只,分為4組,每組10只,分別為假手術組、單純心肌梗死組、中等強度持續運動(continuous moderate training,CMT)組和間歇高強度運動(high intensity interval training,HIT)組,CMT組和HIT組大鼠接受運動治療8周,用超聲心動圖評估心功能,用基因芯片技術測定4組大鼠模型循環miRNAs差異表達,用生物信息學技術分析不同運動強度下循環miRNAs相關靶基因及基因功能.CMT組和HIT組的治療顯著改善了心肌梗死大鼠心功能和運動耐量,HIT組顯著優于CMT組.單純心肌梗死組與假手術組相比,明顯上調的循環miRNAs有14個,明顯下調的循環miRNAs有4個.與單純心肌梗死組相比,CMT組明顯上調的循環miRNAs有11個,明顯下調的循環miRNAs有2個;HIT組明顯上調的循環miRNAs有53個,明顯下調的關鍵miRNAs有41個.與假手術組相比,單純心肌梗死組心肌相關循環miRNAs的差異表達有miR-26a-5p,miR-92a-3p和miR-378a-3p;與單純心肌梗死組相比,CMT組有miR-92a-3p,HIT組有miR-34c-3p,miR-23a-3p,miR-98-3p,miR-208a-5p和miR-92-3p.高強度間歇運動對心肌梗死大鼠心功能和運動耐量的改善作用優于中等強度持續運動,其循環miRNAs及心肌相關循環miRNAs的差異表達數量明顯高于中等強度持續運動,循環miRNAs差異表達有望作為運動強度和運動效果判斷的分子生物學標志物.
急性心肌梗死;運動強度;循環miRNAs;差異表達
心肌梗死后由于心肌部分壞死導致左室重構,是發生心力衰竭最常見的原因之一.隨著我國心肌梗死發病率的逐年增加以及心肌梗死急性期治療技術的逐漸進步,心肌梗死后心力衰竭的患病率逐年遞增,心力衰竭導致的患者反復住院、醫療花費高、生活質量低,是致殘致死的重要原因.改善心肌梗死后左室重構和心肌壞死可減少心力衰竭的發生.已有研究發現,除急性期救治技術以及交感和血管緊張素系統阻斷藥物外,運動療法可進一步減少心肌梗死后心肌纖維化和心肌細胞凋亡,并且改善左室射血分數和左室重構[1],高強度間歇運動療效優于中等強度持續運動[2-4].目前評價運動療法的獲益主要根據運動能力的增加、有氧運動耐力的提高、生活質量的改善以及心功能、再住院率、死亡率等指標.由于運動訓練的強度不易控制,如何評價運動療法對個體心肌功能的改善,及時調整運動方案,從而獲得最佳運動治療效果,尚沒有相關報道.循環微小RNA(microRNAs,miRNAs)是非編碼小分子RNA,已有研究結果顯示,循環miRNAs可作為癌癥特異診斷標志物和心肌損傷標志物[5-7].對健康個體運動的研究發現,有氧運動可上調或下調生理狀態心肌相關循環miRNAs的基因表達,不同運動方式下循環miRNAs表達譜不同[8-9].心肌損傷后,運動對心肌相關循環miRNAs的表達產生何種影響,不同運動強度的循環miRNAs表達譜是否不同,目前尚不明確.本研究制作心肌梗死大鼠模型,通過中等強度持續運動(continuous moderate training,CMT)和高強度間歇運動(high intensity interval training,HIT),了解不同運動強度對心功能和運動耐力的改善程度,檢測運動前后心肌梗死模型大鼠循環miRNAs的差異表達,分析與心肌相關循環miRNAs對運動的反應,為尋找心肌病理狀態下運動治療效果評價的分子生物標志物提供思路.
1 資料與方法
1.1心肌梗死大鼠模型
選取成年清潔級Sprague Dawley雌性大鼠44只,8~10周齡,體重180~230 g,由中國科學院動物研究所提供.分籠飼養,每籠6只,用國家標準嚙齒類動物干燥飼料喂養,自由飲食.動物室內溫度20~29°C,相對濕度40%~50%.適應性喂養1周后,采用4%烏拉坦10 mL/kg腹腔注射麻醉,正壓通氣,胸骨左緣3~4肋間橫行切口,剪開心包,暴露心臟,以肺動脈圓錐與左心耳交界處的左冠狀靜脈為標志,于左心耳下緣約0.15 cm處繞左室支穿線結扎,縫合關胸,繼續正常飼養.以心電圖ST段明顯上抬(>0.2mV),QRS波寬大畸形、T波高聳及結扎線以下心肌顏色變暗為結扎成功標志.假手術組同樣開胸暴露心臟,在左室支穿線但未結扎,縫合關胸,繼續正常飼養.術后存活40只,隨機分為4組,即假手術(Sham)組、單純心肌梗死(MI)組、中等強度持續運動(CMT)組、高強度間歇運動(HIT)組.本研究遵守由北京大學人民醫院倫理委員會討論通過的《實驗室動物照護和使用指南》.
1.2運動干預方案
本運動方案參照文獻[10-11].大鼠心肌梗死穩定3d后,將大鼠置于平板跑步機上進行低速適應性訓練2周,之后開始有氧運動訓練,跑步機傾斜度為15°.CMT組以60%峰值攝氧量(peak oxygen intake)VO2max對應的速度恒速運動,HIT組以60%VO2max對應的速度運動3 min后繼續以85%VO2max對應的速度運動4 min,如此作為一個運動周期,每次運動訓練進行7個周期,共49 min.CMT組和HIT組總的運動距離相等,以此來確定CMT組每次的有氧運動時間.CMT組和HIT組大鼠每次訓練前以40%VO2max對應的速度運動5min進行熱身,共進行8周運動,每周連續運動5d.A組和B組大鼠每周進行兩次5 min運動,運動速度和40%VO2max對應,以保持大鼠在跑步機上的運動能力.
1.3大鼠運動能力測試
分別在心肌梗死模型制作成功后運動前和8周運動訓練后評估大鼠運動能力,參照文獻[12]采用跑步機運動距離測試.跑步機傾斜度為15°,大鼠從6 m/s開始運動,每3min運動速度提高3m/s,直到大鼠不能奔跑為止.總運動距離即為大鼠的運動能力.
1.4心功能檢測
采用超聲心動圖評價心功能,分別在心肌梗死模型制作成功后運動前和8周運動訓練后評估心臟功能.使用Vevo770超聲系統(Visualsonics Inc.,Toronto,ON,Canada),以4%烏拉坦10mL/kg腹腔注射麻醉,平臥位,剃去胸前區毛發,涂抹超聲耦合劑,探頭頻率17.5MHz,M-型超聲采樣頻率1 000 s-1,掃描速度50~500 mm/s.由動物超聲專業醫師進行操作,主要從心臟橫軸切面觀察,觀察指標有左室射血分數(left ventricular ejection fraction,LVEF)、左室縮短分數(fraction shortening,FS)、左室收縮末期內徑(left ventricular end-systolic diameters,LVESd)、左室舒張末期內徑(left ventricular end-diastolic diameters,LVEDd).
1.5miRNAs基因表達譜的檢測
1.5.1血樣留存方法
各組大鼠在基線狀態和運動干預8周后,分別于尾靜脈取血2~4mL放于乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝管中,直接置于-80°C保存.
1.5.2總RNA提取及質量檢測
每組取3只大鼠血樣進行循環miRNAs全基因表達譜檢測.取200μL血樣品,加入等體積裂解液MZ提取細胞總RNA,采用紫外吸收測定法測定RNA在260和280nm波長處的吸收值,以計算濃度并評估純度.用甲醇電泳試劑變性瓊脂糖凝膠電泳,檢測RNA純度及完整性.
1.5.3miRNAs的檢測
將純化后的miRNAs利用ULSTM Labeling Kit(Kreatech Diagnostics,The Netherlands)試劑盒進行Cy5熒光標定.標定完成的小RNA雜交于已預雜交的Mouse miRNA OneArray v5芯片(Phalanx Biotech Group,Hsinchu,Taiwan,China),雜交環境37°C,16h;清洗WashⅠ37°C,5 min,WashⅡ37°C,5 min,WashⅢ20次.芯片以離心方式甩干后,使用Axon 4000B(Molecular Devices,Sunnyvale,CA,USA)熒光掃描儀進行信號讀取,并采用GenePix 4.1軟件(Molecular Devices)進行數據處理.芯片數據以R套組(2.12.1)進行數據篩選、均一化及統計計算.去除所有芯片flag<0的探針,對同一探針重復的數據取中位數值,后以Invariant set normalization方法進行樣本間數據均一化.并以Pair-wise T-test方法計算兩兩比對樣本或組別間的差異倍數及P值.差異基因篩選條件設定為≥0.8,P<0.05.
1.5.4miRNAs靶基因及基因功能生物信息學分析
差異miRNAs以miRSystem網站(NTU,Taipei,Taiwan,China)進行靶基因通路分析.
1.6統計分析
所有數據計數資料以“均值±標準差”表示.組間差異采用方差分析及Dunnett's或Mann-Whitney Rank Sum分析.P<0.05為統計學有差異.所有數據采用SPSS 19.0統計分析軟件(IBM SPSS,Armonk,NY,USA)進行分析.基因差異性表達使用校正Fisher Exact檢驗,EASE評分,P<0.05為統計學有差異.
2 結果
2.1運動療法提高心肌梗死大鼠運動能力
如圖1所示,基線狀態3組心肌梗死大鼠模型的運動能力明顯低于假手術組(P<0.05),3組心肌梗死大鼠模型之間的運動能力無統計學差異.CMT組和HIT組大鼠接受8周運動治療后,兩組大鼠的運動能力較MI組明顯提高,同時HIT組大鼠的運動能力較CMT組進一步提高,有顯著統計學差異(856.50±82.60和778.12±78.10;P<0.05).
2.2基線和運動治療后超聲心動圖結果比較
在基線狀態下,MI組大鼠與假手術組相比,LVEF和FS明顯降低.經過8周的隨訪,MI組大鼠的心功能未見明顯改善.接受運動治療的CMT組和HIT組大鼠與MI組大鼠相比,LVEF和FS均明顯改善,HIT組大鼠的LVEF和FS的改善程度顯著優于CMT組大鼠(P<0.05),如表1和圖2所示.
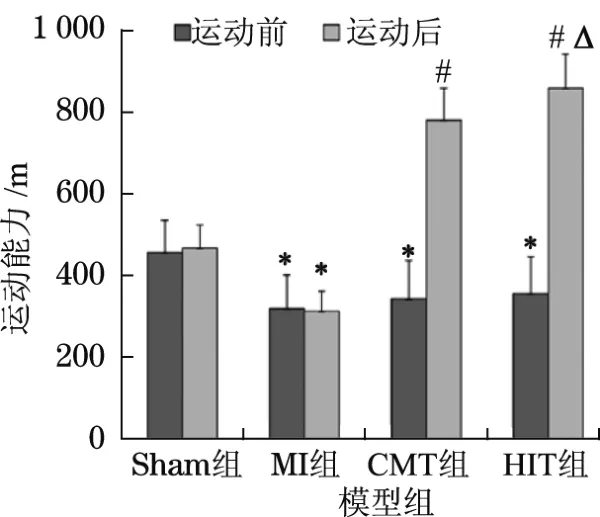
圖1 基線和運動治療后4組大鼠模型運動能力的比較Fig.1 Comparison of functional capacity in 4 rat groups between baseline and after exercise treatment
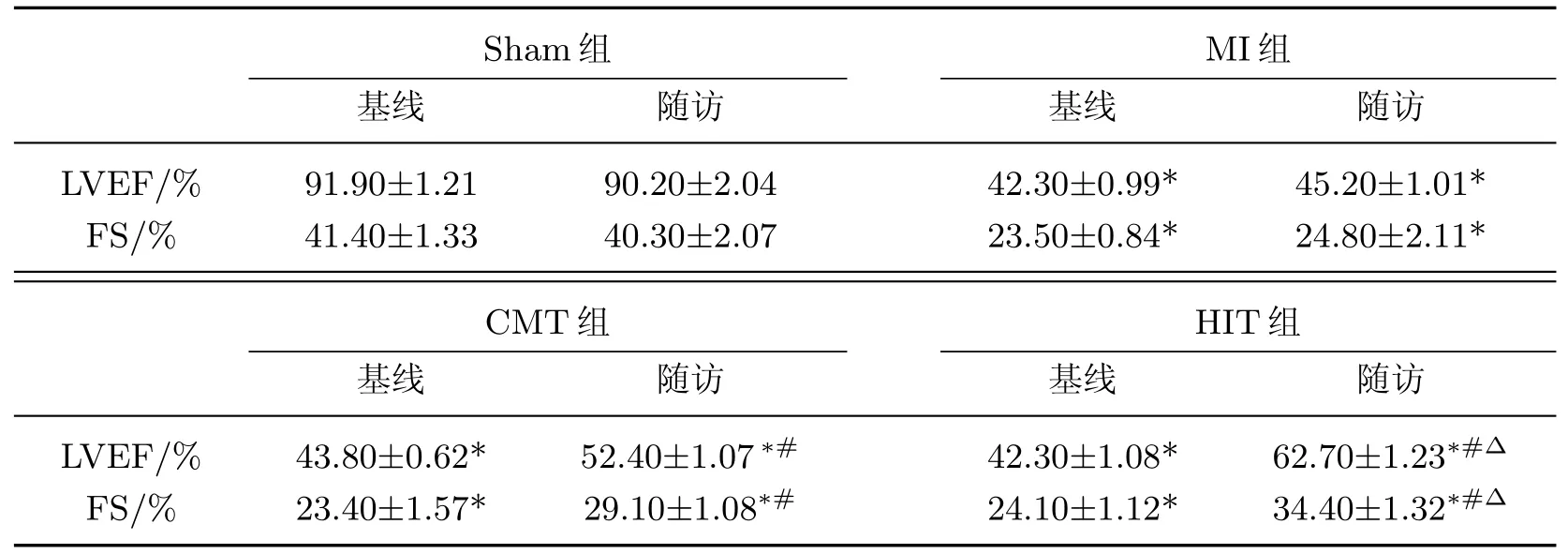
表1 基線和運動治療后4組大鼠模型超聲心動圖心功能比較Table 1 Comparison of heart function with echocardiography(ECHO)in 4 rat groups between baseline and after exercise treatment

圖2 4組大鼠模型超聲心動圖M超收縮功能圖像Fig.2 Contractile function with ECHO M mode in 4 rat groups
2.3循環差異性miRNAs基因芯片結果
單純心肌梗死組與假手術組相比,血液中明顯上調的miRNAs有11個,包括rno-miR-26a-5p,rno-miR-144-3p,rno-miR-106b-5p,rno-miR-92a-3p,rno-miR-378a-3p,rno-miR-16-5p,rno-miR-20a-5p,rno-miR-18a-5p,rno-miR-30e-5p,rno-miR-27b-3p,rno-miR-142-3p;明顯下調的關鍵miRNAs有4個,rno-miR-873-5p,rno-miR-150-5p,rno-miR-505-5p,rno-miR-501-3p(見圖3);CMT組與單純心肌梗死組相比,明顯上調的miRNAs有11個,rno-miR-668,rnomiR-30c-2-3p,rno-miR-18a-3p,rno-miR-17-1-3p,rno-miR-20b-5p,rno-miR-352,rno-miR-542-5p,rno-miR-760-5p,rno-miR-664-1-5p,rno-miR-92a-2-5p,rno-miR-6322;明顯下調的關鍵miRNAs有2個,以rno-miR-300-3p,rno-miR-433-5p為主(見圖4);HIT組與單純心肌梗死組相比,明顯上調的miRNAs有53個,明顯下調的關鍵miRNAs有41個(見圖5和6).
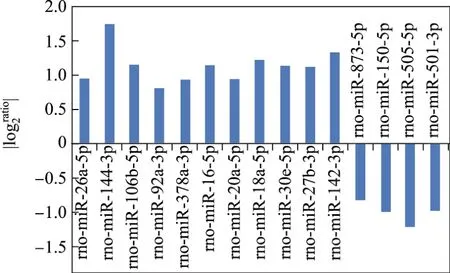
圖3 單純心肌梗死組與假手術組循環差異性miRNAs基因芯片結果Fig.3 Differential expression of circulating miRNAs between MI group and Sham group

圖4 CMT組與MI組循環差異性miRNAs基因芯片結果Fig.4 Differential expression of circulating miRNAs between MI group and CMT group
2.4循環差異表達miRNAs靶基因功能顯著性分析及參與調節的通路
基于miRNAs數據庫得到差異表達miRNAs對應的靶基因,基于Gene Ontology數據庫按照基因功能對靶基因進行功能顯著性分析,得到靶基因參與的調節通路和對應的顯著性基因功能(見表2和3).

圖5 HIT組與MI組循環上調miRNAs基因芯片結果Fig.5 Differential expression of up-regulated circulating miRNAs between MI group and HIT group
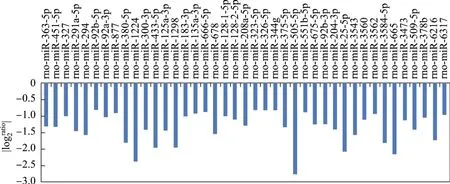
圖6 HIT組與MI組循環下調miRNAs基因芯片結果Fig.6 Differential expression of down-regulated circulating miRNAs between rats group and HIT group
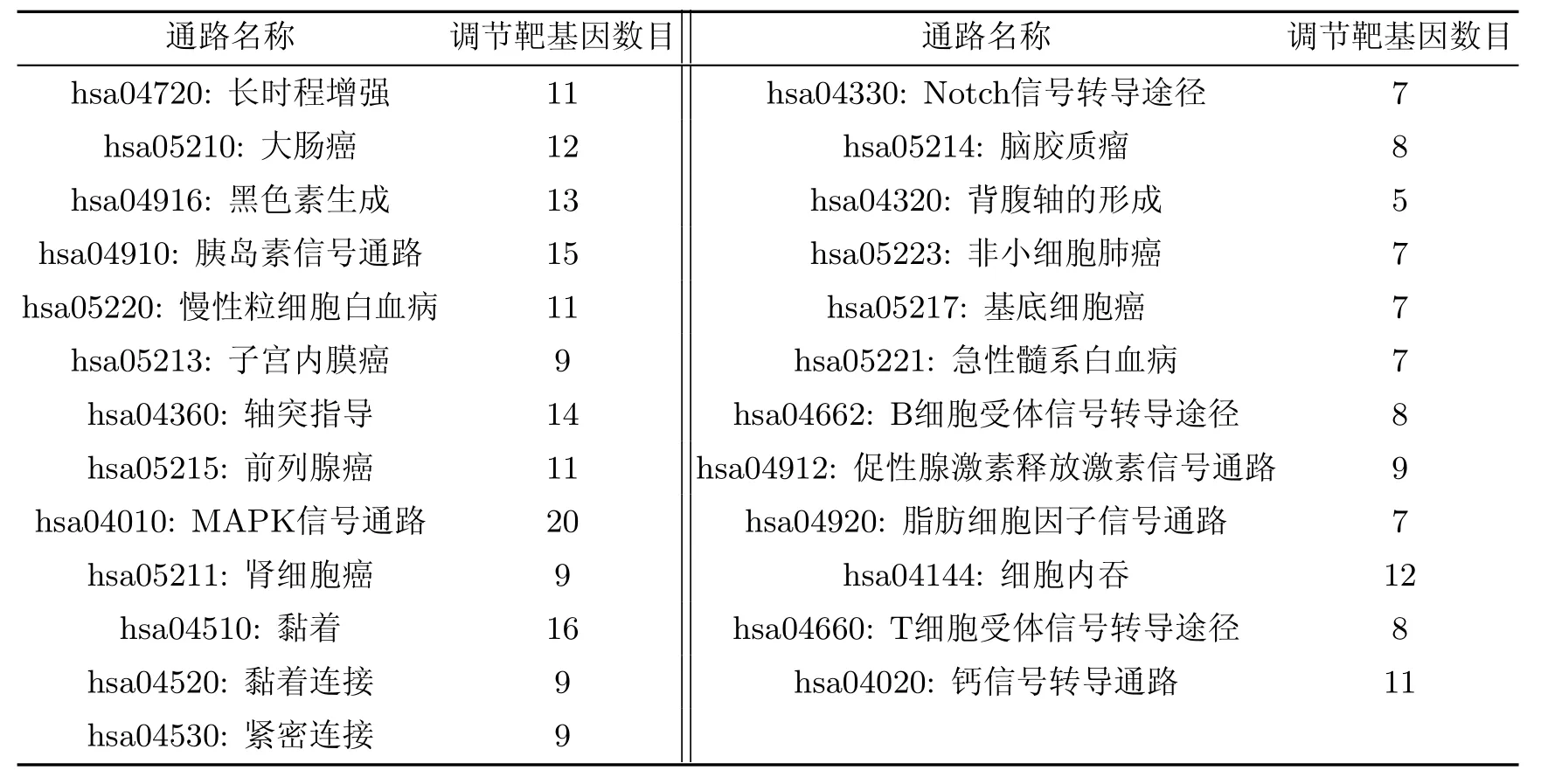
表2 循環差異表達miRNAs靶基因參與調節的通路Table 2 Pathway regulated by differential expression of circulating miRNAs target gene
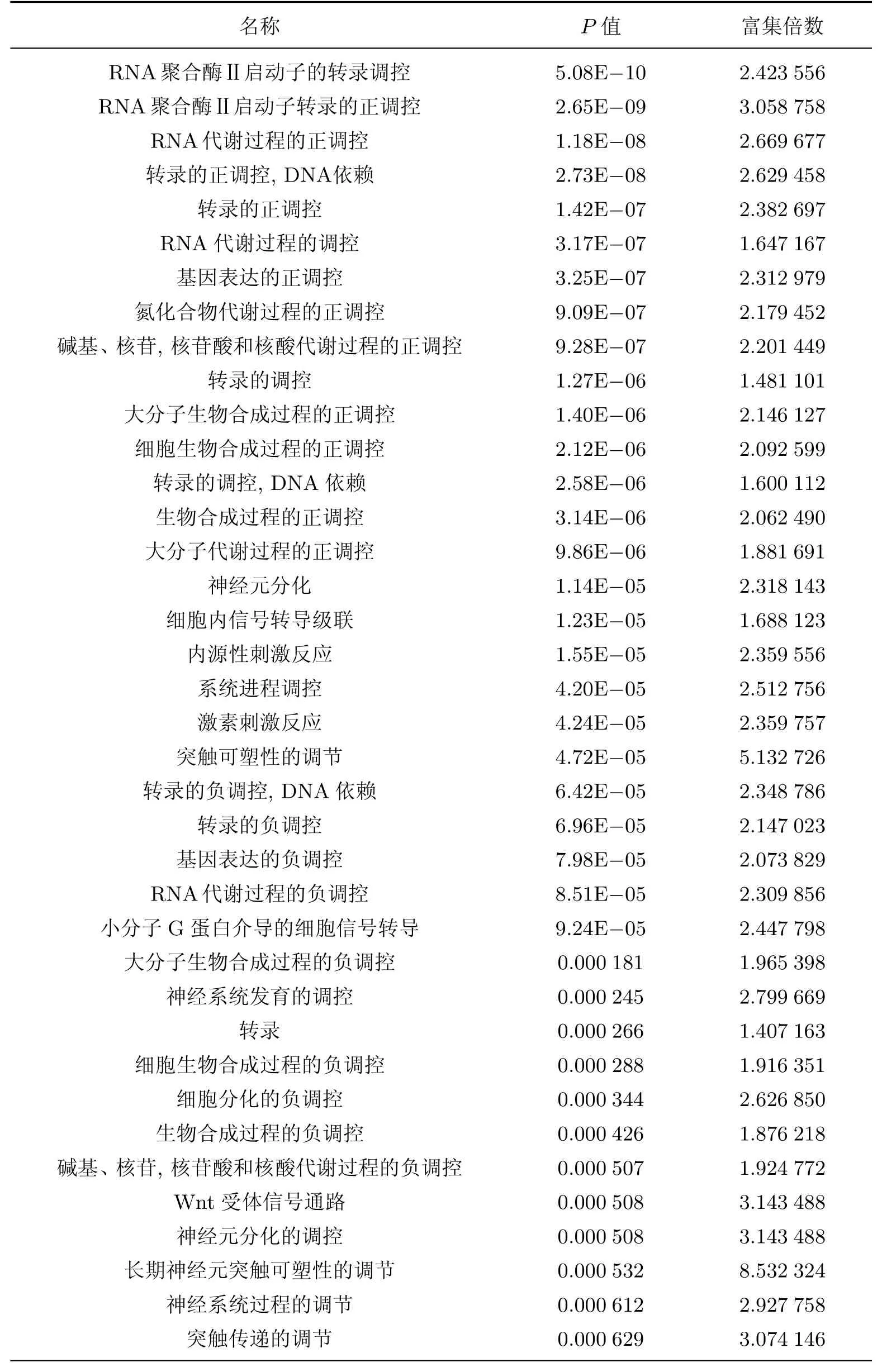
表3 循環差異表達miRNAs對應的靶基因顯著性基因功能Table 3 Genes functions that differential expression of circulating miRNAs matched
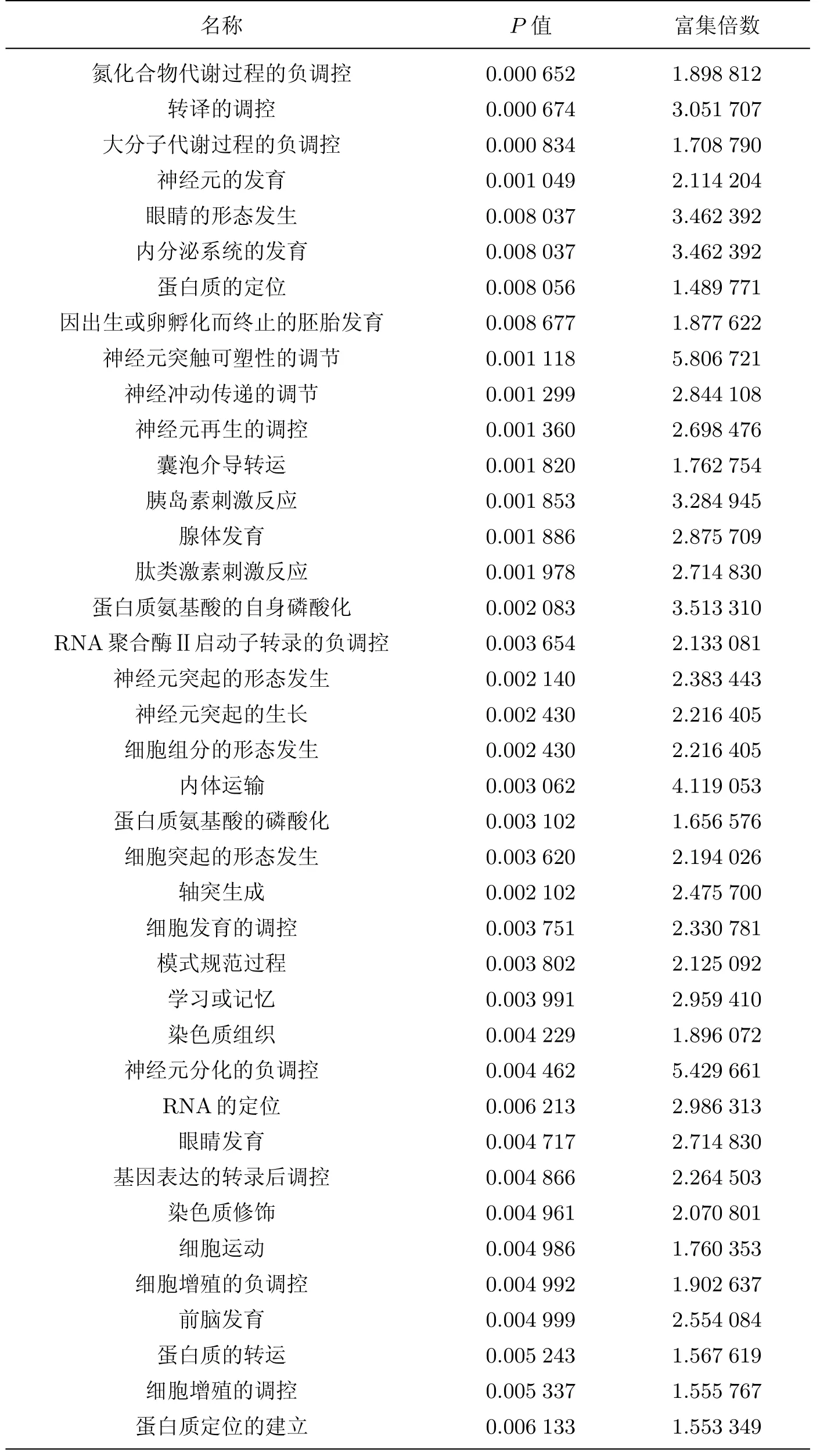
續表

續表
根據文獻[13],目前明確參與心肌細胞功能調節的miRNAs有24個,包括促增殖miRNAs,有miR-1,miR-133,miR-26,miR-98,miR-29,miR-378和miR-145;抗增殖miRNAs,有miR-143,miR-103,miR-130a,miR-146a,miR-21,miR-210,miR-221,miR-222,miR-27a/b,miR-199a/b,miR-208,miR-195,miR-499,miR-34a/b/c,miR-497,miR-23a,miR-15a/b.在心肌缺血時表達下調的心肌miRNAs有miR-494,miR-320,miR-92a,上調的miRNAs有miR-126.將上述與心肌功能相關的miRNAs與本研究結果相對照,MI組與Sham組差異表達循環miRNAs有miR-26a-5p,miR-92a-3p和miR-378a-3p;CMT組與MI組差異表達循環miRNAs有miR-92a-3p;HIT組與MI組差異表達循環miRNAs有miR-34c-3p,miR-23a-3p,miR-98-3p,miR-208a-5p和miR-92-3p.提示心肌梗死后及運動治療后可以檢測到心肌相關循環miRNAs的差異表達,HIT組循環miRNAs差異表達的數量明顯多于CMT組,這可能是HIT組在改善心功能方面更優的機制之一.
3 討論
本研究發現運動治療可改善心肌梗死后左室功能障礙和運動耐量,高強度間歇運動的效果優于中等強度持續運動.心肌梗死后及運動治療后可檢測到循環miRNAs的差異表達,但差異表達miRNAs的數量不同,隨著運動強度的增加,循環miRNAs差異表達的數量增加,心肌相關循環miRNAs差異表達的數量同樣增加,這些心肌相關miRNAs與心肌細胞增殖和心肌缺血調節相關,不僅提示高強度間歇運動獲益更大的機制有miRNAs的參與,miRNAs還有望作為運動強度和運動效果評價的分子生物學標志物.循環miRNAs差異表達靶基因功能分析提示運動對細胞功能具有多種調控作用,參與調節機體多種信號通路,涉及癌癥、胰島素代謝、脂肪代謝、細胞分化、細胞增殖、炎癥等,還提示運動多效性作用機制與多種miRNAs參與調節有關.
目前發現miRNAs在心肌細胞增殖、凋亡、纖維化、血管新生的調控中發揮重要作用[14-15].心肌梗死后心肌miRNAs表達譜發生改變,通過運動治療可調節心肌梗死后心肌miRNAs的表達,包括與血管新生相關的miR-20a,miR-210,miR-221,miR-222,miR-328等;與炎癥相關的miR-21,miR-146a等;與心肌收縮相關的miR-21,miR-133a等;與缺氧缺血適應相關的miR-21,miR-146a,miR-210,miR-499等;以及與心肌干細胞分化相關的miR-1,miR-21,miR-26,miR-27a/b,miR-29,miR-124,miR-133a,miR-144,miR-145,miR-150,miR-208a,miR-222等的表達[13].miRNAs有組織和細胞特異性,不同疾病狀態的miRNAs表達不同.近期研究發現,血液中可檢測到miRNAs,血液中miRNAs的特異性和穩定性特征提示miRNAs有望作為組織損傷的標志物[16].Mitchell等[17]首先發現血液中可檢測到前列腺癌組織特異性miRNAs,其機制可能與外泌體有關[18].miR-208,miR-499是心肌細胞特異性miRNAs,已有研究發現miR-208a和miR-499與心肌損傷程度密切相關[5-7],并且在心肌損傷早期即可在循環中檢測到[5].運動作為一種治療手段可改善心肌重構,減少心肌凋亡和纖維化.目前運動獲益的評價主要是通過運動能力、超聲心動圖等大體檢查項目以及再住院率、死亡率等預后評價指標,而這些評價指標的變化需要在細胞功能改善一段時間后才能顯現,可能已經錯過了運動干預的最佳時機.miRNAs廣義上是表觀遺傳基因,易受外界刺激而變化,已有研究證實不同刺激強度產生的生理功能變化與基因表達相并行[19-20],因此有望將miRNAs作為評價運動效果的分子生物學標志物.
運動是心血管疾病治療中最有效的非藥物治療手段,國內外多個心血管疾病指南推薦心血管病患者應接受運動治療[21-23].運動使心血管獲益程度的大小與運動強度、運動時間和運動類型均有關系[24].本研究發現,運動療法可改善心肌梗死大鼠的心功能,高強度間歇運動優于中等強度運動;進一步分析發現循環中可檢測到心肌相關miRNAs的差異表達,高強度間歇運動的心肌相關循環miRNAs差異表達的數量比中等強度持續運動明顯增加,包括抗增殖、促增殖以及抗心肌缺血基因,不僅提示運動療法對心肌細胞功能的改善有miRNAs參與的因素,而且提示高強度間歇運動中心肌獲益優于中等強度持續運動的機制同樣與miRNAs相關.已有研究報道指出健康個體運動后循環miRNAs存在差異表達[8-9],這些miRNAs與心肌細胞增殖、凋亡、分化、血管新生等密切相關.本研究發現,隨著運動強度的增加,心肌梗死大鼠的心功能獲得更明顯的改善,心肌相關循環miRNAs的差異表達數量顯著增加,提示循環miRNAs有望作為心臟病理狀態下運動治療效果評價的分子生物學標志物.
運動療法可使全身多系統獲益,包括代謝功能、骨骼肌功能、認知功能和心血管功能等,因此目前將運動治療稱為“多效性良藥”,具體機制尚未得到完全闡釋.本研究發現,運動治療可增加運動耐力,高強度間歇運動療法的獲益優于中等強度持續運動.進一步分析發現,運動治療可導致循環miRNAs差異表達,高強度間歇運動循環miRNAs的差異表達數量比中等強度持續運動明顯增加,提示運動的獲益有miRNAs參與的因素.分析本研究獲得的循環miRNAs差異表達靶基因的功能,發現這些靶基因參與調節細胞功能的多個方面,包括增殖、分化、遷移、存活和重編程等,并且參與對機體多種信號通路的調節,初步提示了運動多效性的分子機制,但具體機制還需進一步研究證實.
根據文獻[13]的報道,目前與心肌細胞功能調節相關的miRNAs有28個,本研究顯示心肌損傷后通過運動可調節心肌相關循環miRNAs的差異表達,但文獻[13]報道的心肌相關miRNAs中,只有少部分在本研究中檢測到,如文獻[13]報道miR-499在心肌梗死時的循環血中顯著增加,但是在本研究中并未檢測到.原因也許是由于芯片的敏感性、特異性不足所致,也可能是物種、時項的差異所致,有待進一步研究明確相關影響因素.同時本研究檢測到的循環miRNAs差異表達中,也有很多未在文獻[13]中報道過,這些miRNAs是否與心肌細胞功能調節相關尚有待進一步研究證實.
本研究的局限性如下:只檢測4組大鼠模型的循環miRNAs差異表達,沒有同時進行心肌miRNAs差異表達的檢測,因此循環miRNAs差異表達是否可以反映大鼠心肌損傷程度,無法給予肯定結論.同時,本研究沒有檢測運動干預階段不同時間段的循環miRNAs差異表達.因此循環miRNAs是否能夠實時監測心肌損傷和改善程度,是否可作為運動效果的實時評價指標,需要進一步研究.但本研究在心肌梗死大鼠模型中,評價不同運動強度對心功能和運動耐量的改善程度以及循環miRNAs差異表達,發現不同運動強度下循環miRNAs差異表達數量不同,而且不同運動強度下心肌相關循環miRNAs差異表達的數量也不同,初步提示循環miRNAs差異表達可以反映運動強度和心肌功能改善的關系,循環miRNAs有望作為運動強度和效果評價的分子生物學標志物.
[1]OLDRIDGE N.Exercise-based cardiac rehabilitation in patients with coronary heart disease:Meta-analysis outcomes revisited[J].Future Cardiol,2012,8:729-751.
[2]MOHOLDT T,AAMOT I L,GRAN?IEN I,et al.Aerobic interval training increases peak oxygen uptake more than usual care exercise training in myocardial infarction patients:a randomized controlled study[J].Clin Rehabil,2012,26:33-44.
[3]MOHOLDT T,AAMOT I L,GRAN?IEN I,et al.Long-term follow-up after cardiac rehabilitation:a randomized study of usual care exercise training versus aerobic interval training after myocardial infarction[J].Int J Cardiol,2011,152:388-390.
[4]MAIORANA A.Interval training confers greater gains than continuous training in people with heart failure[J].J Physiother,2012,58:199.
[5]WANG G K,ZHU J Q,ZHANG J T,et al.Circulating microRNA:a novel potential biomarker for early diagnosis of acute myocardial infarction in humans[J].Eur Heart J,2010,31(6):659-666.
[6]CORSTEN M F,DENNERT R,JOCHEMS S,et al.Circulating microRNA-208b and microRNA-499 reflect myocardial damage in cardiovascular disease[J].Circ Cardiovasc Genet,2010,3(6):499-506.
[7]ADACHI T,NAKANISHI M,OTSUKA Y,et al.Plasma microRNA-499 as a biomarker of acute myocardial infarction[J].Clin Chem,2010,56(7):1183-1185.
[8]MA Z,QI J,MENG S,et al.Swimming exercise training-induced left ventricular hypertrophy involves microRNAs and synergistic regulation of the PI3K/AKT/mTOR signaling pathway[J]. Eur J Appl Pysiciol,2013,113:2473-2486.
[9]MARTINELLI N C,COHEN C R,SANTOS K G,et al.An analysis of the gobal expression of microRNAs in an experimental model of physiological left ventricular hypertrophy[J].PLoS One,2014,9:e93271.
[10]H?YDAL M A,WISL?FF U,KEMI O J,et al.Running speed and maximal oxygen uptake in rats and mice:practical implications for exercise training[J].Eur J Cardiovasc Prev Rehabil,2007,14:753-760.
[11]KRALJEVIC J,MARINOVIC J,PRAVDIC D,et al.Aerobic interval training attenuates remodelling and mitochondrial dysfunction in the post-infarction failing rat heart[J].Cardiovasc Res,2013,99:55-64.
[12]MOREIRA J B,BECHARA L R,BOZI L H,et al.High-versus moderate-intensity aerobic exercise training effects on skeletal muscle of infarcted rats[J].J Appl Physiol,2013,114:1029-1041.
[13]FERNANDES T,BARA′UNA V G,NEGR~AO E,et al.Aerobic exercise training promotes physiological remodeling a set of microRNAs[J].Am J Physiol Heart Circ Physiol,2015,309:543-552.
[14]SEEGER F H,ZEIHER A M,DIMMELER S.MicroRNA in stem cell function and regenerative therapy of the heart[J].Arterioscler Thromb Vasc Biol,2013,33:1739-1746.
[15]BOON R A,DIMMELER S.MicroRNA in myocardial infarction[J].Natrure Review Cardiology,2015,12:135-142.
[16]LATERZA O F,LIM L,GARRETT-ENGELE P W,et al.Plasma microRNAs as sensitive and specific biomarkers of tissue injury[J].Clin Chem,2009,55(11):1977-1983.
[17]MITCHELL P S,PARKIN R K,KROH E M,et al.Circulating microRNAs as stable blood-based markers for cancer detection[J].Proc Natl Acad Sci USA,2008,105(30):10513-10518.
[18]HUNTER M P,ISMAIL N,ZHANG X,et al.Detection of microRNAs expression in human peripheral blood microvesicles[J].PLoS One,2008,3(11):e3694.
[19]TIMMONS J A,JANSSON E,FISCHER H,et al.Modulation of extracellular matrix genes reflects the magnitude of physiological adaptation to aerobic exercise training in humans[J].BMC Biol,2005,3:19.
[20]KELLER P,VOLLAARD N,BABRAJ J,et al.Using systems biology to define the essential biological networks responsible for adaptation to endurance exercise training[J].Biochem Soc Trans,2007,35(Pt5):1306-1309.
[21]LEON A S,FRANKLIN B A,COSTA F,et al.Cardiac rehabilitation and secondary prevention of coronary heart disease:an American Heart Association scientific statement from the Council on Clinical Cardiology(Subcommittee on Exercise,Cardiac Rehabilitation,and Prevention)and the Council on Nutrition,Physical Activity,and Metabolism(Subcommittee on Physical Activity),in collaboration with the American Association of Cardiovascular and Pulmonary Rehabilitation[J].Circulation,2005,111(3):369-376.
[22]CORR`A U,PIEPOLI M F,CARR′E F,et al.Secondary prevention through cardiac rehabilitation:physical activity counselling and exercise training:key components of the position paper from the Cardiac Rehabilitation Section of the European Association of Cardiovascular Prevention and Rehabilitation[J].Eur Heart J,2010,31(16):1967-1974.
[23]中華醫學會心血管病學分會,中國康復醫學會心血管病專業委員會,中國老年學學會心腦血管病專業委員會.冠心病心臟康復與二級預防中國專家共識[J].中華心血管病雜志,2013,41(4):267-275.
[24]GOLBIDI S,LAHER I.Exercise and the cardiovascular system[J].Cardiol Res Pract,2012,2012:201-206.
Effects of exercise on cardiac function and differential expression of circulating miRNAs in rats with acute myocardial infarction
XIA Kun1,DING Rongjing2,LU Kai3,WANG Li4
(1.Department of Cardiology,Beijing Chaoyang Hospital Affiliated to Capital Medical University,Beijing 100043,China;2.Department of Cardiology,Peiking University People's Hospital,Beijing 100044,China;
3.Department of Cardiology,First Hospital of Chongqing Medical University,Chongqing 630042,China;4.Department of Cardiology,Yongchuan Hospital Affiliated to Chongqing Medical University,Chongqing 402160,China)
To study the effects of different exercise intensity on cardiac function and differential expression of circulating microRNAs(miRNAs),target genes and gene function in rats with acute myocardial infarction(AMI).Establish AMI models with 40 rats,divide them into 4 groups,such as Sham operation group,isolated myocardial infarction group,continuous moderately training(CMT)group,and high intensity interval training(HIT)group,with 10 AMI rats in each group.CMT and HIT groups received exercise therapies for 8 weeks.Evaluate cardiac function with echocardiography.Analyze differential expression of circulating microRNAs,related target genes and gene function using miRNAs microarray and bioinformatics technology.CMT and HIT therapies significantly improved cardiac function and exercise tolerance in AMI rats.The effect of HIT group is significantly better than that of CMT group.Compared with Sham operation group,14 circulating miRNAs were obviously up-regulated,4 circulating miRNAs were obviously down-regulated in isolated myocardial infarction group.Compared with isolated myocardial infarction group,11 circulating miRNAs were obviously up-regulated,2 circulating miRNAs were obviously down-regulated in CMT group,and 53 circulating miRNAs were obviously up-regulated,41 key miRNAs were obviously down-regulated in HIT group.Compared with Sham operation group,differential expression of myocardium related circulating miRNAs in isolated myocardial infarction group are miR-26a-5p,miR-92a-3p and miR-378a-3p.Compared with isolated myocardial infarction group,there is miR-92a-3p in CMT group,and there are miR-34c-3p,miR-23a-3p,miR-98-3p,miR-208a-5p and miR-92-3p in HIT group.HIT improving cardiac function and exercise tolerance in AMI rats are better than those of CMT.Numbers of differential expression of circulating miRNAs and myocardium related circulating miRNAs with HIT are higher than those of CMT,indicating that circulating miRNAs are expected to be biomarkers for determining exercise intensity and exercise effect.
acute myocardial infarction;exercise intensity;circulating microRNAs;differential expression
R 34
A
1007-2861(2016)03-0344-13
10.3969/j.issn.1007-2861.2016.03.010
2016-04-19
丁榮晶(1971—),女,副主任醫師,研究方向為心肌保護、心血管預防與康復.E-mail:drj2003@sina.com

