2,6-二甲基-3,5-吡啶二甲酰腙衍生物的合成及與DNA的作用
李志芬,喬 俊,陸 均,王君玲,許 琳*
(1.山西大同大學化學與環境工程學院,山西大同037009;2.上海衡欣檢測技術有限公司,上海201821)
2,6-二甲基-3,5-吡啶二甲酰腙衍生物的合成及與DNA的作用
李志芬1,喬 俊1,陸 均2,王君玲1,許 琳1*
(1.山西大同大學化學與環境工程學院,山西大同037009;2.上海衡欣檢測技術有限公司,上海201821)
本文以2,6-二甲基-1,4-二氫吡啶-3,5-二甲酸二乙酯為原料,通過氧化、肼解得到2,6-二甲基-3,5-吡啶二甲酰肼,該甲酰肼和芳香醛反應合成了4個2,6-二甲基-3,5-吡啶二甲酰腙衍生物,合成路線設計合理,反應條件溫和,產率高,目標化合物的結構用氫譜和質譜進行了表征,通過EB競爭實驗測定了它們與DNA的結合常數約為104左右,表明該類酰腙化合物可以與DNA發生作用。
吡啶;酰腙;人工核酸酶;DNA
近十幾年來,人工核酸酶的研究取得了很大進展,這些成果將有助于細胞學、分子生物學的發展,并有可能應用于基因治療中。因為天然核酸酶的活性中心有一個或多個金屬離子參與反應,所以以金屬配合物作為人工核酸酶的研究受到了廣泛的關注,其中就包括許多酰腙金屬配合物[1-2]。但是金屬及金屬配合物類核酸酶涉及到的多數為有氧化或還原活性的金屬離子,很可能發生一些比較復雜的化學反應,比如金屬離子從配合物中解離出來,或發生一些難以控制的氧化還原反應,這樣就使得金屬類人工核酸酶潛在的應用價值受到了限制[3-4]。非金屬人工核酸酶相對更安全。近年來,科研人員逐漸發現了幾類非金屬人工核酸酶,包括短肽、胍類衍生物、大環多胺衍生物、環糊精衍生物、以及酰腙衍生物[5-8]。人工核酸酶對DNA的作用可以分為2步,第1步是與DNA結合,第2步是催化斷裂DNA。因此判斷一種化合物是否為非金屬人工核酸酶的首要條件是其可以與DNA結合,本文通過文獻調研設計合成了4個酰腙化合物,并測定了它們在沒有金屬參與的情況下與DNA的結合能力。
1 實驗部分
1.1 儀器與試劑
主要儀器:瓦里安INOVA-400MHZ核磁共振儀,安捷倫液質儀,瓦里安Cary Eclipse熒光分光光度計。試劑:乙酰乙酸乙酯,磷酸氫二銨,烏洛托品,過硫酸銨,水合肼,4-N,N-二甲氨基苯甲醛,2-羥基-3-甲氧基苯甲醛,4-(2-吡啶基)-苯甲醛,4-吡啶甲醛。小牛胸脅DNA,溴化乙錠(EB),二甲基亞砜(DMSO),乙醇,丙酮,均為市售,分析純。
1.2 合成實驗
根據文獻[9]合成2,6-二甲基-1,4-二氫吡啶-3,5-二甲酸二乙酯(化合物1),化合物1用過硫酸銨氧化得到2,6-二甲基-3,5-吡啶二甲酸乙酯(化合物2),化合物2通過與水合肼反應制備2,6-二甲基-3,5-吡啶二甲酰肼(化合物3),化合物3通過與醛反應合成目標產物2,6-二甲基-3,5-吡啶二甲酰腙(化合物4),共合成了4個不同結構的酰腙化合物,其中4a-c是未見報道的新化合物。具體合成路線見圖1。
1.2.1 2,6-二甲基-3,5-吡啶二甲酸乙酯的合成(化合物2)
250 mL 三口瓶中加入24.80 g(97.93 mmol)2,6-二甲基-1,4-二氫吡啶-3,5-二甲酸二乙酯,丙酮30 mL,冷卻至0 ℃。44.70 g(195.86 mmol)過硫酸銨溶解于120 mL水中,將過硫酸銨水溶液緩慢滴加到上述丙酮溶液中,室溫反應3h后,減壓蒸出部分溶劑直到有白色固體析出,過濾得到2,6-二甲基-3,5-吡啶二甲酸乙酯15.50 g,產率63%。
1.2.2 2,6-二甲基-3,5-吡啶二甲酰肼的合成(化合物3)
250 mL 三口瓶中加入14 g(55.72 mmol)2,6-二甲基-3,5-吡啶二甲酸乙酯,100 mL乙醇,26.50 mL(445.80 mmol)85%水合肼,加熱回流6h后,減壓蒸餾除去乙醇得到粗品,用無水乙醇多次洗滌,干燥后得到白色粉末8.83 g(化合物3),產率71%。

圖1 目標化合物合成路線
1.2.3 2,6-二甲基-3,5-吡啶二甲酰腙(4a-d)
100 mL反應瓶中加入5 mL 2,6-二甲基-3,5-吡啶二甲酰肼(3.98 mmol)水溶液,然后加入15 mL芳香醛(7.96 mmol)的乙醇溶液,滴入5滴冰醋酸,加熱回流3h后,冷卻,抽濾,用水和乙醇分別洗滌三次,得到酰腙化合物。
4a白色固體,產率93%,1H NMR(400 MHz,DMSO-d6)δ 12..20(s,2H),8.68(d,J=4.6 Hz,3H),8.58(d,J=4.6 Hz,1H),8.43(d,J=4.1 Hz,1H),8.30(d,J=6.3 Hz,1H),8.09(d,J=10.6 Hz,1H),7.79-7.62(m,3H),7.38 ~ 7.34(m,1H),2.63,2.48(s,6H)。ESI-MS:m∕z=402.5([M+H]+)。
4b白色固體,產率74%,1H NMR(400 MHz,DMSO-d6)δ 12.12 ~ 12.01(m,2H),8.76 ~ 8.63(m,2H),8.38(d,J=5.3 Hz,1H),8.28 ~ 7.82(m,12H),7.73(s,1H),7.57(t,J=9.4 Hz,1H),7.38(dt,J=16.5,8.4 Hz,2H),2.65,2.50(s,6H)。ESI-MS:m∕z=554([M+H]+)
4c淡黃色固體,產率97%,1H NMR(400 MHz,DMSO-d6)δ 12.08(br,s,2H),10.70(br,s,2H),8.60 ~ 8.40(m,2H),8.11(m,1H),7.24 ~ 7.12(m,2H),7.10 ~ 7.01(m,2H),6.93 ~ 6.82(m,2H),3.84,3.78(s,6H),2.684,2.47(s,6H)。ESI-MS:m∕z=492.8([M+H]+)。
4d 白色粉末,產率84%,1H NMR(400 MHz,DMSO-d6)δ 11.75 ~ 11.57(m,2H),8.16(d,J=6.0 Hz,1H),7.96(d,J=12.8 Hz,1H),7.78(s,1H),7.53(t,J=7.7 Hz,3H),7.25(dd,J=11.7,8.9 Hz,1H),6.76(d,J=8.9 Hz,3H),6.67,6.49(d,J=8.8 Hz,1H),2.99,2.92,2.83(s,12H),2.60,2.47(s,6H)。ESI-MS:m∕z=486.9([M+H]+)。
1.3 2,6-二甲基-3,5-吡啶二甲酰腙與DNA的作用
溴乙啶(EB)本身沒有熒光,當加入DNA后,溴乙啶的平面大環結構插入到DNA的堿基對之間,產生強的熒光,當再加入一個可以和DNA能夠發生作用的小分子化合物后,該熒光會逐漸減弱,甚至被完全萃滅。該試驗常用來證明小分子化合物與DNA的相互作用,并計算兩者的結合常數[10]。
實驗步驟:①配制Tris緩沖溶液(5 mol∕L Tris-HCl∕50 mmol∕L NaCl,pH 7.4)。②將 CT-DNA 溶解在水中,用紫外-可見分光光度計測定CT-DNA的濃度,將其稀釋到100 μmol∕L。③配制10 μmol∕L的EB水溶液。④將CT-DNA加入到EB溶液中,二者濃度比為(10∶1),用熒光分光光度計測定其熒光強度。⑤向上述溶液中加入一定濃度的小分子化合物(0.5~5 mmol),發現隨著小分子化合物的加入。熒光強度逐步減弱,當低于50%時,結束實驗。⑥根據公式KEB·[EB]=Kapp·[compound](KEB=1.0×107L∕mol),計算小分子化合物與DNA的結合常數。圖2~5是酰腙4a~4d與DNA作用的光譜圖,通過計算我們得到4種酰腙化合物與DNA的結合常數分別是:2.4×104L∕mol(4a),2.9×104L∕mol(4b),2.2×104L∕mol(4c),3.6×104L∕mol(4d)。
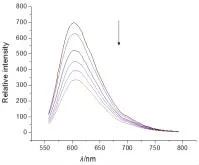
圖2 EB/DNA熒光光譜隨著化合物4a的加入的變化

圖3 EB/DNA熒光光譜隨著化合物4b的加入的變化
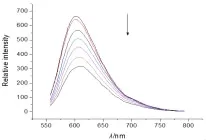
圖4 EB/DNA熒光光譜隨著化合物4c的加入的變化
2 結果與討論
2,6-二甲基-3,5-吡啶二甲酰腙衍生物的合成路線較短,反應條件溫和,產率高,目標產物分別用核磁共振氫譜和質譜進行了表征,結構正確。在與DNA作用的研究中,我們發現隨著酰腙化合物的加入,EB-DNA體系的熒光強度逐漸下降,說明酰腙化合物可以與DNA結合,當熒光強度下降到50%時,我們通過計算得到了這4種化合物與DNA的結合常數約為104L∕mol,其作用機理可能是通過平面芳環對DNA堿基對的插入來完成的。結果表明該類酰腙化合物可作為非金屬人工核酸酶的重要研究對象。
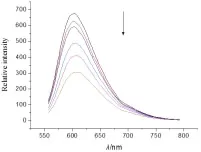
圖5 EB/DNA熒光光譜隨著化合物4d的加入的變化
[1]Morrow J R,Amyes T L,Richard J P.Phosphate binding energy and catalysis by Small and large Molecules[J].Acc Chem Res,2008,41(4):539-548.
[2]Aiba Y,Sumaoka J,Komiyama M.Artificial DNA cutters for DNA manipulation and genome engineering[J].Chem Soc Rev,2011,40(12):5657-5668.
[3]Smith J,Ariga K,Anslyn E V.Enhanced imidazole-catalyzed RNA cleavage induced by a bis-alkylguanidinium receptor[J].J Am Chem Soc,1993,115(1):362-364.
[4]Boerner L J,Zaleski J M.Metal complex-DNA interactions:from transcription inhibition to photoactivated cleavage[J].Curr Opin Chem Biol,2005,9(2):135-144.
[5]Scheffer U,Strick A,Ludwig V,et al.Metal-Free Catalysts for the hydrolysis of RNA derived from guanidines,2-Aminopyridines,and 2-Aminobenzimid-azoles[J].J Am Chem Soc,2005,127(7):2211-2217.
[6]Sheng X,Lu X M,Zhang J J,et al.Synthesis and DNA cleavage activity of artificial receptor 1,4,7-triazacyclononane containing guanidinoethyl and hydroxyethyl side arms[J].J Org Chem,2007,72(5):1799-1802.
[7]Feng Y P,Cao S L,Xiao A S,et al.Studies on cleavage of DNA by N-phosphoryl branched peptides[J].Peptides,2006,27(6):1554-1560.
[8]Li Z F,Qiao J,Jia Z F,et al.Synthesis of the Pyridine Hydrazones as Metal-free Artificial Nucleases[J].Chem.Lett,2015,44(9):1243-1244.
[9]Cui L Y,Zhang M,Xu Z,et al.Synthesis of 2,6-dimethyl-3,5-pyridinediary-hydrazones in Water[J].Shanghai Univ(Nat Sci Ed.),2006,12(4):412-414.
[10]Dong X D,Wang X Y,Lin M X,et al.Promotive Effect of the Platinum Moiety on the DNA Cleavage Activity of Copper-Based Artificial Nucleases[J].Inorg Chem,2010,49(5):2541-2549.
Synthesis and DNA Action of 2,6-Dimethylpyridine-3,5-Dicarbohydrazide
LI Zhi-fen1,QIAO Jun1,LU Jun2,WANG Jun-ling1,XU Lin1*
(1.School of Chemical and Environmental Engineering,Shanxi Datong University,Datong Shanxi,037009;
2.Shanghai Hengxin Testing Technology Co.,Ltd,Shanghai,201821)
2,6-dimethyl-1,4-dihydropyridine-3,5-dicarboxylate was oxided,then reacted with hydrazine hydrate to produce 2,6-dimethylpyridine-3,5-dicarbohydrazide,which reacted with aromatic aldehyde to give four 2,6-Dimethylpyridine-3,5-Dicarbohydrazide with high rate,the reaction conditions was gentle and the title compounds were characterized with1H NMR and MASS.Results indicate that these compounds can bind to calf thymus DNA and the apparent binding constants were about 104.
pyridine;hydrazide;artificial nucleases;DNA
O625.43
A
1674-0874(2016)01-0038-03
2015-11-25
李志芬(1982-),女,山西大同人,博士,講師,研究方向:人工核酸酶的設計與合成。?許琳,女,教授,通信作者。
〔責任編輯 楊德兵〕

