耐高糖面包酵母發酵工藝優化
竇冰然,郭會明,駱海燕,洪厚勝,3,*
(1.南京工業大學化學與分子工程學院,江蘇南京211816;2.南京工業大學生物與制藥工程學院,江蘇南京211816;3.南京匯科生物工程設備有限公司,江蘇南京210009)
?
耐高糖面包酵母發酵工藝優化
竇冰然1,郭會明1,駱海燕2,洪厚勝2,3,*
(1.南京工業大學化學與分子工程學院,江蘇南京211816;2.南京工業大學生物與制藥工程學院,江蘇南京211816;3.南京匯科生物工程設備有限公司,江蘇南京210009)
為了優化耐高糖酵母發酵工藝,基于培養溫度、搖床轉速、裝液量、初始pH、菌體接種量五個因素的單因素實驗的結果,之后對裝液量、初始pH、菌體接種量進行響應面優化實驗。結果表明,最佳工藝條件為:培養溫度30 ℃,搖床轉速200 r/min,裝液量8.4%,pH4.7,接種量7.4%,在此條件下,酵母細胞干重提高了55.72%。同時,利用5.0 L機械攪拌罐以溶氧反饋流加、恒速流加、間歇流加三種糖蜜補充方式進行酵母細胞培養,繪制生長曲線,發現以溶氧反饋流加方式補充糖蜜更有利于酵母繁殖,最大酵母濕重達到143.95 g/L,達到了耐高糖面包酵母高密度發酵的實驗水平,確定了酵母最佳的流加補料方式。
耐高糖面包酵母,響應面法,流加培養,優化
面包酵母是一種氨基酸含量較高的單細胞微生物,蛋白質含量在50%左右,并且含有豐富的B族維生素,酶系與生理活性物質[1]。早在幾千年前人類就使用面包酵母來發酵面包以及酒類,在現代食品工業中,也被廣泛用作人類主食的制作,如作為饅頭、面包、包子、餅干糕點等面制食品的優良發酵劑與營養劑[2-4]。在多數情況下,烘烤制品是需要加糖的,有時蔗糖與面粉比高達25%,普通的酵母在這種高糖情況下生長會受到抑制,傳統的高糖類面包制作利用加大酵母的使用量來彌補發酵力的不足,但是為了降低制作成本,這就需要使用耐高糖的酵母來保證良好的發酵特性[5-7]。
近年來針對耐高糖面包酵母的研究,多主要集中于菌種的分離篩選及應用方面,但對于其發酵過程的相關優化研究則報道不多。劉青等[8]通過制備的耐高糖酵母單倍體發酵篩選出了具有高發酵力的菌株。杜鵑[9]通過椴樹蜜篩選分離出耐高糖酵母菌株,并將其應用于發酵生產蜂蜜醋飲料。Saksinchai S等[10]通過從蜂蜜中篩選出耐高糖酵母菌種,并研究了所選菌種的基因序列相關性。本實驗利用市售耐高糖面包酵母分離篩選出菌株,并通過單因素與響應面法進一步優化該菌株的搖瓶條件下發酵工藝參數,通過分析確定最優工藝參數,有效提高酵母生物量并提供有效的理論依據。
1 材料與方法
1.1材料與儀器
安琪牌耐高糖面包活性干酵母市售;斜面培養基(YPD固體培養基)葡萄糖2%,酵母膏1%,蛋白胨2%,瓊脂1.5%~1.7%;一級種子培養基(YPD液體培養基)葡萄糖2%,蛋白胨2%,酵母膏1%;二級種子培養基(糖蜜培養基)處理稀釋后含糖量25%的甘蔗糖蜜10%,MgSO40.1%,(NH4)2SO40.05%;發酵培養基處理稀釋后含糖量25%的甘蔗糖蜜37%,尿素(含氮量10 g/100 mL)14%,(NH4)H2PO4(含磷量以P2O5計10 g/100 mL)1.2%,MgSO47.5 g,維生素B10.2 g,維生素B50.2 g,維生素B60.2 g,生物素0.1 g。
UVmini-1240紫外可見分光光度計島津制作所;TGL-20B高速臺式離心機上海安亭科學儀器廠;MGF-5 5.0 L機械攪拌玻璃發酵罐南京匯科生物工程設備有限公司。
1.2實驗方法
1.2.1種子液培養稱取1%活性干酵母于YPD 液體培養基中,30 ℃,200 r/min,振蕩培養24 h;取0.1 mL菌液,稀釋涂布于YPD固體培養基平板上,置于 30 ℃恒溫培養箱培養2 d;挑取菌體劃線培養,經1次活化,挑取單菌落,斜面保藏。將斜面保藏的酵母菌接一環于YPD液體培養基中,30 ℃,200 r/min 培養,作為發酵用種子液。
1.2.2初始發酵培養條件250 mL三角瓶裝40 mL培養基,接種量10%,初始pH4.8,30 ℃,220 r/min,搖瓶培養24 h。
1.2.3菌體生物量的測定比濁法:酵母菌體的生長引起發酵液混濁度的增高。通過紫外分光光度計測定一定波長下的OD值,以此判斷酵母的生長狀況。在600 nm下測定適當稀釋的發酵液的OD值。
酵母濕重:取發酵液10 mL,10000 r/min離心兩次,每次10 min。
酵母干重:將上述離心后棄去上清液的酵母菌體,在105 ℃烘箱中干燥至恒重,即為酵母干重。
1.2.4酵母發酵時間的測定將酵母種子液按10%的接種量接種于裝有250 mL YPD液體培養基的三角瓶中,再分裝于15個50 mL三角瓶中,裝液量均為10 mL,搖床培養,設置溫度30 ℃,轉速200 r/min。以剛放入搖床為0 h,每隔2 h取出一個三角瓶,測定發酵液的OD600 nm。以時間為橫坐標,OD600 nm值為縱坐標繪制出酵母的生長曲線。
1.3實驗設計
1.3.1溫度單因素實驗在二級種子培養基的基礎上,對酵母的發酵條件進行優化,以溫度為單因素進行實驗,設置五個水平,分別為26、28、30、32、34 ℃。其他培養條件為轉速200 r/min,裝液量16%,接種量10%,初始pH4.8。測定酵母細胞干重,繪制曲線進行對比,設置3次重復。
1.3.2轉速單因素實驗以轉速為單因素,設置五個水平,分別為140、160、180、200、220 r/min。其他培養條件為溫度30 ℃,裝液量16%,接種量10%,初始pH4.8。測定酵母細胞干重,繪制曲線進行對比,設置3次重復。
1.3.3裝液量單因素實驗以裝液量為單因素,設置五個水平,分別為4%、10%、16%、22%、28%。其他培養條件為溫度30 ℃,轉速200 r/min,接種量10%,初始pH4.8。測定酵母細胞干重,繪制曲線進行對比,設置3次重復。
1.3.4初始pH單因素實驗以初始pH為單因素,設置五個水平,分別為4.2、4.5、4.8、5.1、5.4。其他培養條件為溫度30 ℃,轉速200 r/min,接種量10%,裝液量10%。測定酵母細胞干重,繪制曲線進行對比,設置3次重復。
1.3.5接種量單因素實驗以接種量為單因素,設置五個水平,分別為4%、8%、12%、16%、20%。其他培養條件為溫度30 ℃,轉速200 r/min,初始pH4.8,裝液量10%。測定酵母細胞干重,繪制曲線進行對比,設置3次重復。
1.3.6響應面設計在單因素實驗的基礎上,選取對酵母生長影響大的三個因素:裝液量、pH、接種量,以酵母干重為響應值利用Design-Expert8.0.5b軟件進行3因素3水平的Box-Behnken響應面設計,優化耐高糖面包酵母培養條件。響應面實驗的因素水平表見表1。

表1 響應面設計因素水平表
1.3.7酵母流加方式對比實驗5.0 L罐中糖蜜流加策略對比實驗 取一環斜面保藏的酵母菌于一級種子培養基,以30 ℃,200 r/min,搖瓶培養24 h為條件制備一級種子液;取一級種子液30 mL以接種量7.4%制備二級種子液350 mL,pH4.7,其他培養條件與一級種子液相同。將二級種子液以10%接種量接于5.0 L機械攪拌罐中,分別以恒速流加、間歇流加、溶氧反饋流加三種方式流加糖蜜,發酵26 h后,以時間為橫坐標,酵母菌體濕重為縱坐標,繪制酵母發酵曲線。
1.4數據處理
實驗所用到的數據分析軟件:Design-Expert(8.0.5b),SPSS Statistics(17.0)。
2 結果與討論
2.1酵母發酵時間的確定
從圖1可知,耐高糖活性干酵母在YPD液體培養基中,0~6 h處于遲滯期,6~24 h處于對數生長期,24 h之后達到平穩期,因此將優化實驗的發酵時間設為24 h。

圖1 酵母生長曲線Fig.1 Growth curve of yeast
2.2單因素實驗
2.2.1培養溫度對酵母干重的影響由圖2中可以看出,當培養溫度由26~30 ℃,隨著溫度的升高,酵母的細胞干重隨之增加,當培養溫度達到30 ℃時,酵母干重達到最大值,當培養溫度大于30 ℃,酵母干重逐漸下降,但26~32 ℃之前酵母干重變化不大,隨著溫度的增加,酵母干重并沒有較大的改變,當溫度為34 ℃時,酵母干重下降明顯,因此選擇酵母培養的最佳溫度30 ℃作為響應面實驗培養溫度。

圖2 溫度對酵母干重的影響Fig.2 Effect of temperature on dry weight of yeast
2.2.2轉速對酵母干重的影響由圖3可以看出,當轉速由140 r/min增加到200 r/min時,酵母的干重隨之增加,但轉速在140~200 r/min之間變化趨勢較為平穩;當轉速大于200 r/min時,酵母干重逐漸下降,當轉速增加到220 r/min時,酵母干重低于180 r/min時的酵母干重,因此選擇酵母培養的最佳轉速200 r/min作為響應面實驗搖床轉速。
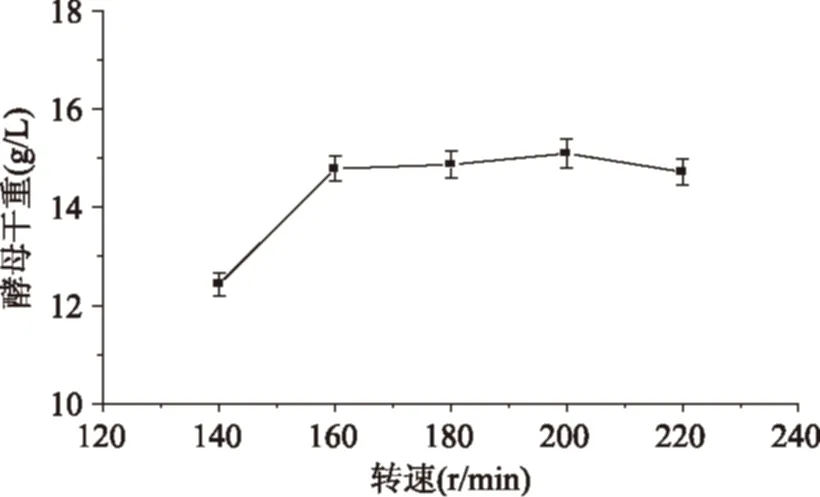
圖3 轉速對酵母干重的影響Fig.3 Effect of rotational speed on dry weight of yeast
2.2.3搖瓶裝液量對酵母干重的影響由圖4可以看出,當搖瓶裝液量從4%~10%時酵母的干重隨之增加,在10%時達到最大值;當裝液量大于10%,酵母干重逐漸下降。從裝液量4%~16%的變化過程中,酵母干重有一個明顯的先增加后減少的趨勢,故選擇搖瓶裝液量為10%較為合理。
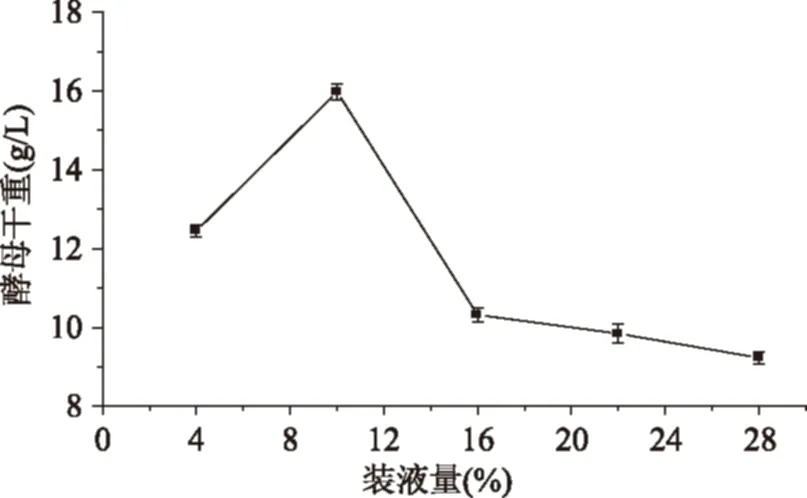
圖4 裝液量對酵母干重的影響Fig.4 Effect of broth content on dry weight of yeast
2.2.4初始pH對酵母干重的影響由圖5中可以得出,當初始pH由4.2~4.8時,酵母的干重隨之增加,在pH4.8時達到最大值;當初始pH大于4.8時,酵母干重逐漸降低。因此,選擇培養基初始pH為4.8較為適宜。
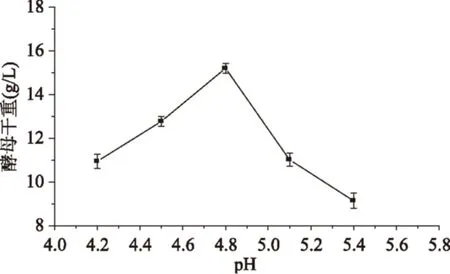
圖5 pH對酵母干重的影響Fig.5 Effect of pH on dry weight of yeast
2.2.5接種量對酵母干重的影響由圖6可以看出,當接種量從4%~8%時,酵母的干重隨之增加,在8%時達到最大值;當菌體接種量大于8%時,酵母干重逐漸下降。因此,選擇菌體接種量8%較為適宜。

圖6 接種量對酵母干重的影響Fig.6 Effect of inoculation amount on dry weight of yeast
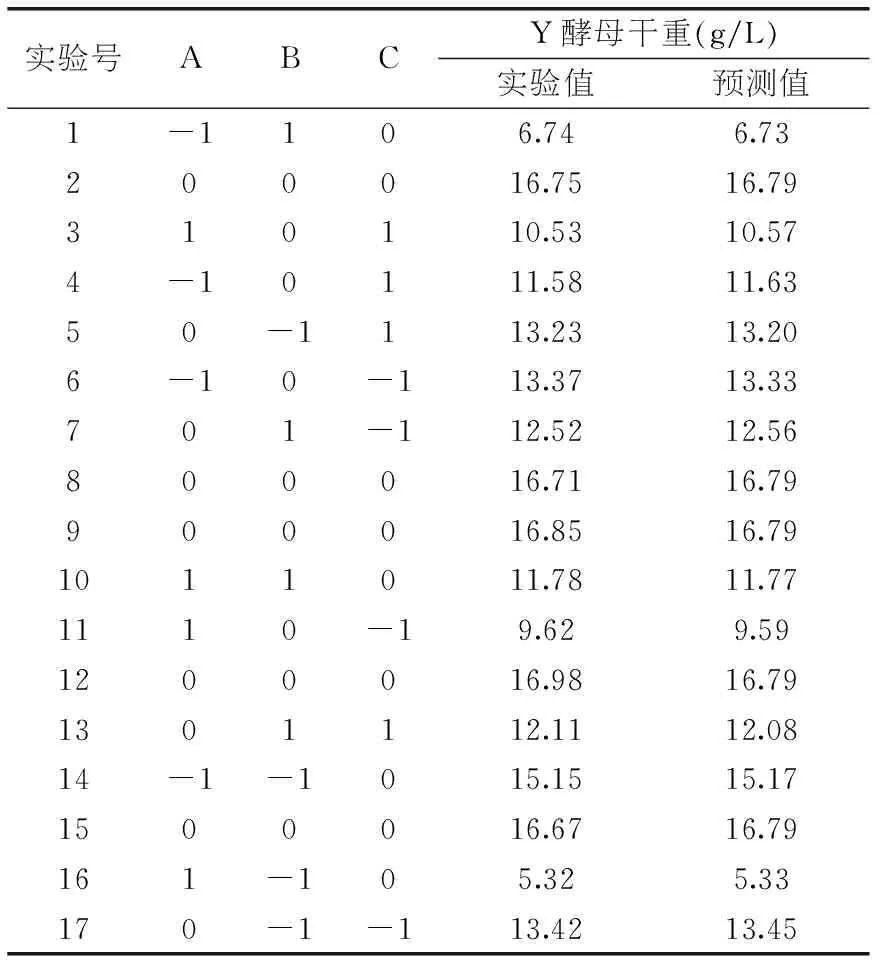
表2 響應面實驗設計方案與結果
2.3響應面優化實驗
2.3.1實驗結果與模型建立響應面優化實驗方案與結果見表2。利用Design-Expert 8.0.5對表2數據進行二次多元多元回歸擬合,得到以酵母干重對編碼自變量A、B、C的二次多項回歸方程:酵母干重(g/L)=16.79-1.20A-0.50B-0.18C+3.72AB+0.68AC-0.05BC-4.29A2-2.75B2-1.22C2。對數學模型進行的方差分析及顯著性結果見表3。由表3可知,此回歸方程模型極顯著(p<0.0001<0.05),失擬項p=0.8755>0.05,說明該模型失擬性檢驗結果不顯著,此模型對于實驗數據的擬合度較高,實驗誤差較小,該模型可以用于分析和預測酵母干重的結果[11]。對于模型回歸方程系數的顯著性實驗表明,一次項系數A、B、C,交互系數AB、AC,二次項系數A2、B2、C2影響極顯著。F值反映了各個因子對于響應值得重要性,F(A)>F(B)>F(C),說明3個影響因子對于酵母干重的影響強弱順序為:裝液量>pH>接種量。
注:*:表示差異顯著,p<0.05;**:表示差異極顯著,p<0.01。
2.3.2響應面分析與優化根據上述擬合出的回歸方程繪制響應面分析圖,以確定裝液量、pH、接種量3個因素對酵母細胞干重的影響,響應面曲面和等高線圖見圖7~圖9。由圖7~圖9可知,搖瓶裝液量和初始pH、裝液量和接種量的交互作用較強,pH與接種量交互作用較弱。該模型預測的最佳搖瓶發酵工藝條件為:裝液量8.39%,pH4.69,接種量7.42%,此條件下酵母細胞干重的預測值為17.0325 g/L。
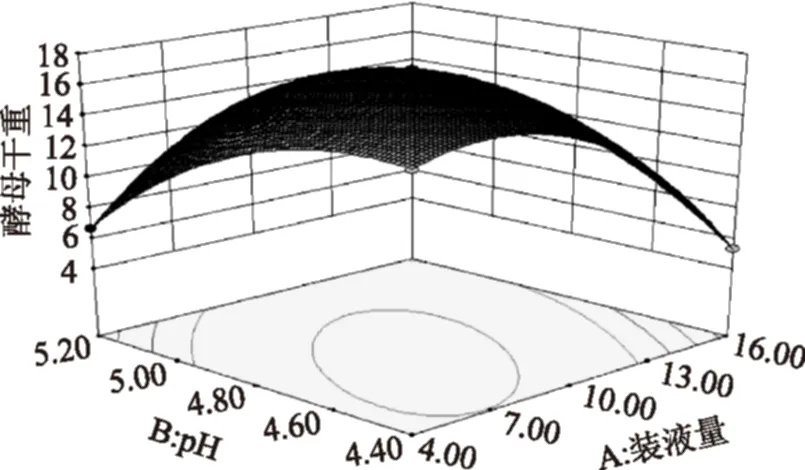
圖7 pH、裝液量及其交互作用對酵母干重影響的響應面圖Fig.7 Response surface for the effect of pH and liquid volume on dry weight of yeast

圖8 接種量、裝液量及其交互作用對酵母干重影響的響應面圖Fig.8 Response surface for the effect of inoculation amount and liquid volume on dry weight of yeast

圖9 接種量、pH及其交互作用對酵母干重影響的響應面圖Fig.9 Response surface for the effect of inoculation amount and pH on dry weight of yeast
2.3.3最佳搖瓶發酵工藝條件的驗證在預測出最佳工藝條件的基礎上,考慮到實際操作中的簡便性等問題將該條件修正為:培養溫度30 ℃,搖床轉速200 r/min,裝液量8.4%,pH4.7,接種量7.4%,在此工藝條件下,重復實驗3次,得到酵母細胞干重16.88 g/L,驗證值和模擬值較為接近,說明采用響應面法得到的該模型結果較為可靠[12],擁有一定實用價值。與初始發酵培養結果酵母細胞干重10.84 g/L相比,優化后結果提高了55.72%。
2.45 L罐中糖蜜流加策略對比實驗
將工藝優化后的二級種子液接種于5 L機械攪拌罐中,通過三種不同的糖蜜流加方式進行培養,繪制酵母生長曲線實驗結果見圖10,由圖10可知,0~7 h流加方式不同對于酵母生長沒有產生明顯差別,7 h之后,通過在使用溶氧反饋流加方式補充糖蜜條件下,酵母的生長情況明顯優于恒速流加與間歇流加方式,在26 h發酵結束時,利用溶氧反饋流加培養的酵母最大濕重為143.95 g/L。

圖10 三種不同流加方式對酵母菌體濃度的影響Fig.10 The effects of three different feedingmethods on yeast concentration
溶氧反饋式流加是一種底物限制性流加方式。在糖蜜限制培養的條件下,補入的葡萄糖很快會被菌體利用,根據菌體的底物比消耗速率的改變,溶氧也隨之改變。因此,隨著糖蜜的不斷流加,溶氧處于振蕩狀態,能夠給予菌體生長一定的氧氣,有利于菌體的快速增殖,同時可有效避免副產物積累。與恒溶氧流加比較,恒速流加方式下,菌體增長較慢,酵母濕重稍小[13]。這是因為補料初期糖蜜濃度充足,有利于細胞生長,但補料后期,糖蜜濃度較低,菌體生長所需要的碳源無法及時供應,使得在細胞生長最旺盛時,沒有及時補加充足的營養和氧氣,從而導致酵母菌體的生產強度減弱,效率降低[14]。而間歇流加方式是一種每隔一段時間一次性補入較多的糖蜜的方式,其在罐內的糖濃度容易產生殘留,且瞬時殘糖較高,波動較大,造成底物抑制,菌體生長也就變得緩慢且生產效率低[15]。
3 結論
對耐高糖面包酵母的培養條件進行了優化,在單因素實驗的基礎上,利用響應面優化的方法確定了其二級種子最佳工藝條件:培養溫度30 ℃,搖床轉速200 r/min,裝液量8.4%,pH4.7,接種量7.4%,在此工藝條件下,與優化前的初始發酵條件下培養的酵母細胞干重10.84 g/L相比,優化后結果提高了55.72%。而在酵母上罐培養階段,實驗發現相比于恒速流加和間歇流加,以溶氧反饋流加方式補充糖蜜更有利于酵母的快速繁殖,上罐過程中最大菌體濕重為143.95 g/L。
[1]Bontempo V,Di Giancamillo A,Savoini G,et al. Live yeast dietary supplementation acts upon intestinal morpho-functional aspects and growth in weanling piglets[J]. Animal Feed Science and Technology,2006,129(3-4):224-236.
[2]于景芝. 酵母生產與應用手冊[M]. 北京:中國輕工業出版社,2008:320-321.
[3]王衛國,張仟偉,趙永亮,等. 釀酒酵母的選育及其應用研究進展[J]. 河南工業大學學報:自然科學版,2015,36(6):104-112.
[4]田曉菊. 酵母屬在食品工業中的應用[J]. 中國釀造,2015,34(4):13-16.
[5]齊向輝,王旭,林靜,等. 耐高糖酵母的篩選鑒定及其產多元醇分析[J]. 食品與發酵工業,2014,40(10):16-21.
[6]封冰,張翠英,肖冬光. 耐高糖面包酵母單倍體的分離篩選[J]. 釀酒科技,2014(11):10-13.
[7]趙碩. 耐高滲(高糖)酵母菌株的選育[D]. 合肥:安徽農業大學,2010:23-16.
[8]劉青,姜天笑,畢琳,等. 高適應性面包酵母菌株的雜交選育[J]. 食品與發酵工業,2005,31(3):30-32.
[9]杜鵑. 椴樹蜜中產酯耐高糖酵母菌的篩選及其發酵飲料研究[D]. 哈爾濱:哈爾濱商業大學,2015.
[10]Saksinchai S,Suzuki M,Chantawannakul P,et al. A novel ascosporogenous yeast species,Zygosaccharomyces siamensis,and the sugar tolerant yeasts associated with raw honey collected in Thailand[J]. Fungal Diversity,2012,52(1):123-139.
[11]Kowalski J. Optimal estimation in rotation patterns[J]. Journal of statistical planning and inference,2009,139(4):1405-1420.
[12]楊輝,黃麗梅,羅建華. 海紅果酒酵母篩選及其發酵工藝的響應面法優化[J]. 食品工業科技,2014,35(9):221-225.
[13]徐桂轉,袁超,常春. 活性干酵母流加培養的動力學研究[J]. 河南農業大學學報,2005,39(3):287-289.
[14]李寅,陳堅,宋祺,等. 高發酵活力面包酵母的高產率流加培養策略研究[J]. 生物工程學報,1997(2):160-167.
[15]宋娜,李竹生,牛芳方. 流加培養生產玉米酵母工藝研究[J]. 食品科技,2012(10):20-23.
Optimization of fermentation process of sugar-tolerant bread yeast
DOU Bing-ran1,GUO Hui-ming1,LUO Hai-yan2,HONG Hou-sheng2,3,*
(1.Nanjing Tech University,College of Chemistry and Molecular Engineering,Nanjing 211816,China;2.Nanjing Tech University,College of Biotechnology and Pharmaceutical Engineering,Nanjing 211816,China;3. Nanjing Highke Bioengineering Equipment Co.,Ltd.,Nanjing 210009,China)
In order to optimize the sugar-tolerant bread yeast fermentation process,the conditions including fermentation temperature,rotation speed,liquid volume,initial pH,inoculation amount were optimized by experiment of single factor at first. Based on the experimental result,liquid volume,initial pH,inoculation amount were chosen to study on response surface optimization. The experimental results indicated that the optimum conditions were as follows:temperature at 30 ℃,rotation speed 200 r/min,8.4% liquid volume,pH4.7,7.4% inoculation amount. The condition increased dry weight of yeast by 55.72%. At the same time,by making growth curve to compare three methods including dissolved oxygen feedback feeding,constant feeding,intermittent feeding in 5.0 L mechanical stirring fermentation tank. It showed that the dissolved oxygen feedback feeding is best and the maximum wet yeast weight reached 143.95 g/L,the experiment reached the level of high density fermentation of sugar-tolerant bread yeast,and determine the optimal feeding mode of yeast.
sugar-tolerant bread yeast;response surface method;feeding cultivation;optimization
2016-03-24
竇冰然(1991-),女,碩士研究生,研究方向:食品發酵與分析檢測,E-mail:835066485@qq.com。
洪厚勝(1965-),男,博士,教授,研究方向:生物過程及生化反應設備, E-mail:hhs@njtech.edu.cn。
國家高技術研究發展計劃(863計劃)-生物過程關鍵技術及裝備開發(2012AA021201)。
TS201.3
A
1002-0306(2016)18-0208-05
10.13386/j.issn1002-0306.2016.18.031

