丙酮酸脫氫酶競爭性抑制劑調控裂殖壺菌脂肪酸合成的研究
程鈺蓉,孫志杰,崔 球
(1.山東省能源生物遺傳資源重點實驗室,中國科學院青島生物能源與過程研究所,山東青島 266100;2.青島單細胞油脂工程實驗室,山東青島 266100;3.中國科學院大學,北京 100040;4.生物燃料重點實驗室,中國科學院青島生物能源與過程研究所,山東青島 266100)
?
丙酮酸脫氫酶競爭性抑制劑調控裂殖壺菌脂肪酸合成的研究
程鈺蓉1,2,3,孫志杰1,*,崔球1,2,4,*
(1.山東省能源生物遺傳資源重點實驗室,中國科學院青島生物能源與過程研究所,山東青島 266100;2.青島單細胞油脂工程實驗室,山東青島 266100;3.中國科學院大學,北京 100040;4.生物燃料重點實驗室,中國科學院青島生物能源與過程研究所,山東青島 266100)
本研究以合成乙酰輔酶A的丙酮酸脫氫酶復合體為擾動目標,通過應用底物特異競爭抑制劑——氟化丙酮酸(FP)來擾動乙酰輔酶A的合成,在考察擾動后裂殖壺菌的碳消耗、菌體生長、油脂合成、脂肪酸成分的基礎上,分析了工業生產二十二碳六烯酸(DHA)菌株——裂殖壺菌中的乙酰輔酶A在普通脂肪酸合成途徑(FAS途徑)和類聚酮合酶途徑(PKS途徑)的分配比例變化。結果發現裂殖壺菌可轉化利用FP;1 mmol/L FP在抑制總油脂合成的同時也顯著改變了乙酰輔酶在FAS和PKS途徑中的分配比率;降低了生物質合成,增強了二氧化碳生成量。表明裂殖壺菌的FAS途徑對乙酰輔酶A的親和力可能高于PKS途徑;通過降低乙酰輔酶A供給量并不能提高總脂肪酸中多不飽和脂肪酸(DHA和DPA)的含量。這一結果解釋了FAS途徑和PKS途徑的碳流分配調控機制,對于選育DHA高產菌株以及工業發酵過程優化具有重要意義。
氟化丙酮酸,二十二碳六烯酸,丙酮酸脫氫酶復合體,乙酰輔酶A,裂殖壺菌
二十二碳六烯酸(docosahexaenoic acid,DHA,C22∶6 n-3)又稱“腦黃金”,在人體中具有重要的生理和保健功能[1-3]。裂殖壺菌(Aurantiochytrium)由于其具有DHA含量高、生長快、易于大規模培養等優勢,是目前工業生產DHA使用的主要菌株。但由于缺乏精確的分子靶向調控工具和深入的脂肪酸代謝調控機制的了解[4],目前提高裂殖壺菌發酵生產DHA產量主要依賴于培養基組分優化以及控制發酵條件[1,5-6]。了解裂殖壺菌脂肪酸合成和油脂積累調控機制有利于優化DHA工業發酵工藝和菌株的代謝工程改造。
線粒體中的丙酮酸脫氫酶復合體(pyruvate dehydrogenase complex,PDC)將丙酮酸轉化為乙酰輔酶A,而后三羧酸轉運體系再將線粒體內的乙酰輔酶A轉運至胞質中進行脂肪酸的合成。已有大量研究發現調節PDC活性可以改變細胞內脂肪酸含量[7-8]。目前研究表明,裂殖壺菌具有非常復雜而特殊的脂肪酸合成途徑,其飽和脂肪酸(包括棕櫚酸和油酸)是由生物界普遍利用的脂肪酸合成途徑(FAS途徑)合成,而多不飽和脂肪酸(DHA和DPA)卻是由特殊的類聚酮合酶途徑(PKS途徑)合成[9-10]。雖然,目前已知乙酰輔酶A是這兩個途徑的共同碳源前體分子,但研究人員對于乙酰輔酶A在這兩種途徑中的分配調節機制尚不清晰[11]。
因此,本研究以乙酰輔酶A在FAS和PKS途徑中的分配調控機制為研究目標,通過應用PDC的底物特意競爭抑制劑——FP(fluoropyruvate,FP)來調節乙酰輔酶A供給量,在考察擾動后裂殖壺菌的碳消耗、菌體生長、油脂合成、脂肪酸成分的基礎上,分析乙酰輔酶A在FAS和PKS途徑中分配比例的變化。
1 材料與方法
1.1材料與儀器
菌株裂殖壺菌菌株(Aurantiochytriumsp. SD116,CG-MCC No. 6208)由青島生物能源與過程研究所代謝物組學實驗室篩選并保藏[12];FPFP美國Sigma公司,純度≥98%;尿素氮檢測試劑盒南京建成生物工程研究所;酵母粉英國Oxoid公司;葡萄糖、丙磺酸、海水晶、硫酸銨、磷酸二氫鉀、七水合硫酸鋅、四水合氯化錳、七水合硫酸亞鐵、六水合氯化鈷、五水合硫酸銅、二水合鉬酸鈉國藥集團化學試劑上海分公司,分析純。
RIGOL-L3000液相色譜北京普源精電科技有限公司;Agilent GC-6890氣相色譜安捷倫科技公司;SBA-40葡萄糖分析儀山東省科學院生物研究所;MiniSpin小型高速離心機Eppendorf公司;vario EL Ⅲ元素分析儀Elementar公司。
1.2實驗方法
1.2.1培養基種子培養基:葡萄糖60 g/L,酵母粉20 g/L,海水晶15 g/L,pH6.4。
分析培養基:葡萄糖60 g/L,丙磺酸60 g/L,硫酸銨7 g/L,磷酸二氫鉀4 g/L,海水15 g/L,七水合硫酸鋅22 mg/L,四水合氯化錳5 mg/L,七水合硫酸亞鐵5 mg/L,六水合氯化鈷1.6 mg/L,五水合硫酸銅1.6 mg/L,二水合鉬酸鈉7.5 mg/L。
1.2.2培養方法
1.2.2.1種子活化從菌種保存平板上挑取單菌落,接入裝有50 mL新鮮種子培養基的250 mL錐形瓶中,培養溫度25 ℃,轉速200 r/min,培養時間48 h。
1.2.2.2FP濃度篩選配制分別含有0、0.1、0.5、1、2、5 mmol/L FP的分析培養基。按照接種OD600為0.02的接種量將種子接入裝有50 mL新鮮分析培養基的250 mL錐形瓶中,培養溫度25 ℃,轉速200 r/min,培養時間96 h。從36 h開始每12 h對葡萄糖消耗進行測定,培養60 h時對生物量以及油脂含量進行測定。
1.2.2.3FP代謝擾動分析按照接種密度為0.02 OD600的接種量將種子接入裝有50 mL新鮮分析培養基的250 mL錐形瓶中,培養溫度25 ℃,轉速200 r/min。培養至40 h時,分別向擾動組發酵液中添加FP母液至1 mmol/L和對照組加入等體積的水后繼續在25 ℃、200 r/min培養至84 h。在培養40、48、60、72、84 h分別取樣,測定發酵參數。
1.2.3發酵參數測定
1.2.3.1葡萄糖含量測定采用生物傳感器分析儀測定上清液中葡萄糖含量。
1.2.3.2銨根離子含量測定采用尿素氮檢測試劑盒分析上清液中氨離子含量。
1.2.3.3FP含量測定采用高效液相色譜法分析發酵液中胞外代謝物和FP濃度變化。色譜柱:Bio-RadAminex HPX-87H Colum,300 mm×7.8 mm;柱溫:50 ℃;流速:0.5 mL/min;進樣量:10 μL;流動相:5 mmol/L H2SO4。等度洗脫25 min。紫外檢測器:320 nm。通過高效液相色譜法測定FP在320 nm的紫外吸收,通過外標法測定標準曲線計算得到發酵液中FP的含量,并計算FP的消耗速率。FP標準曲線(R2=0.9913):不同濃度FP標準品(mmol/L)=色譜峰面積×(7×10-6)+0.0076。FP消耗速率計算:FP消耗速率(mmol/g·h)=樣品中FP濃度÷生物量÷加入FP的時間。
1.2.3.4生物量的測定取2 mL菌體,經蒸餾水洗滌、4000×g離心和真空冷凍干燥后,稱得菌體干重。
1.2.3.5菌體油脂含量和脂肪酸組成的測定按文獻報道方法提取菌體油脂并稱重[12]。硫酸-甲醇法處理油脂后,GC-MS分析脂肪酸成分。色譜分離條件:色譜柱(Agilent HP-INNOWax 30 m×250 μm×0.25 μm)。程序升溫條件:初始溫度為100 ℃,升溫過程為15 ℃/min直至240 ℃并保持10 min,進樣口溫度為250 ℃,FID檢測器溫度為260 ℃。含油率(%)=提取的油脂重量/細胞干重×100;特定油脂百分含量(%)=該油脂氣相色譜峰面積/總油脂氣相色譜峰面積×100。
1.2.3.6菌體元素分析取2 mg干燥后的菌體,經元素分析儀測定菌體中C、H、N、S元素的組成。
2 結果與分析
2.1FP濃度的確定
FP是丙酮酸的結構類似物,由于它與丙酮酸脫氫酶亞基的親和力是丙酮酸的100倍,因此在非常低的濃度下FP就可以有效抑制PDC的催化活性[13]。本研究首先考察了不同濃度FP對裂殖壺菌生長行為和代謝特征的影響研究。
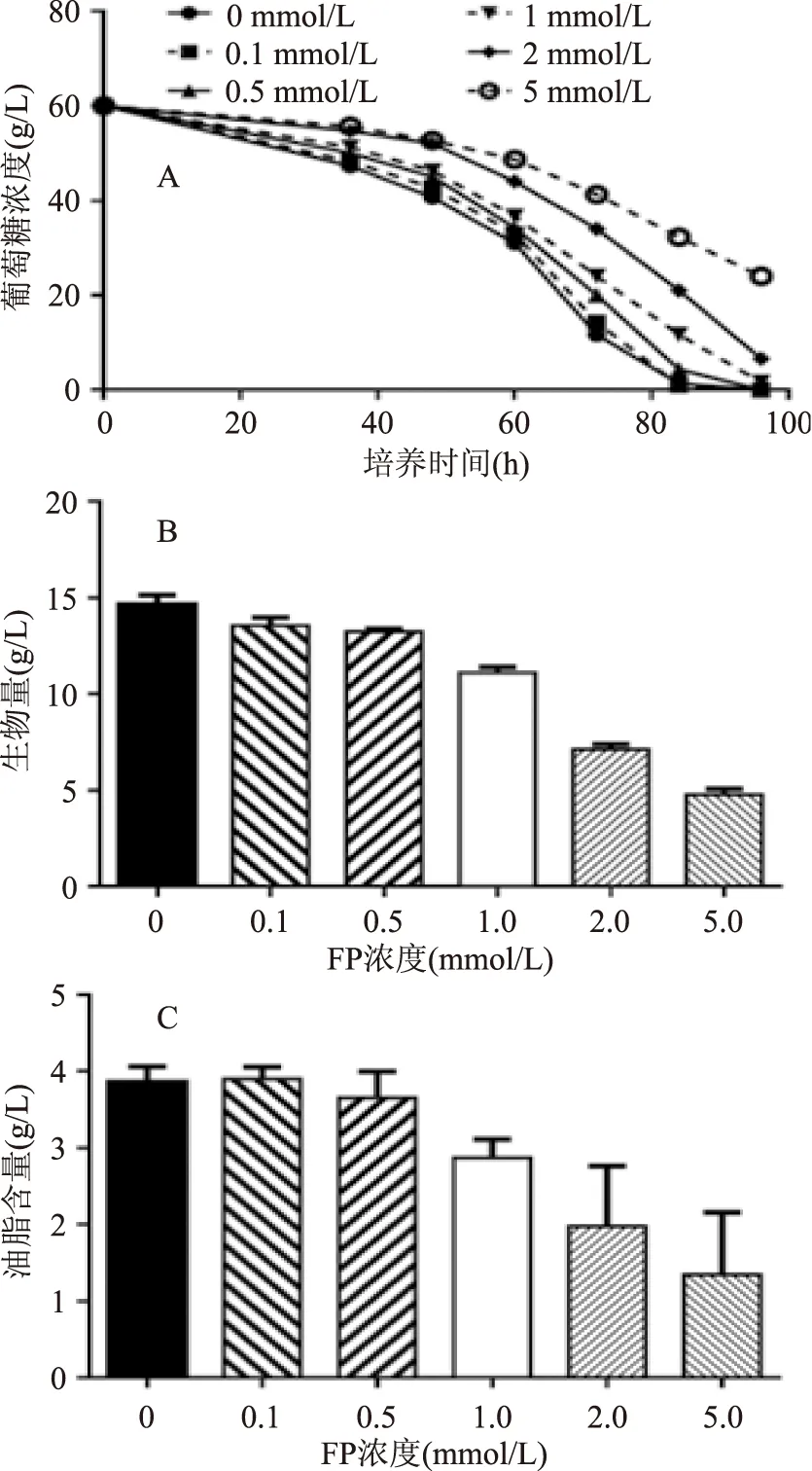
圖1 不同FP濃度下裂殖壺菌生長和代謝行為變化Fig.1 The growth and metabolism changesin Aurantiochytrium sp. under different concentration of FP注:(A)葡萄糖消耗;(B)培養60 h后生物量積累;(C)培養60 h后油脂含量。
由圖1A中的對照組可知,60 h處于細胞的對數生長期,這一時期的細胞代謝處于平衡狀態,可以更真實的反應胞內正常代謝水平,且60 h的細胞較多,帶來的分析誤差更小,因此本研究比較了對照組和FP處理組在該時期細胞生物量和油脂含量的差異。由圖1A和B可知,FP濃度為0.1 mmol/L和0.5 mmol/L時,葡萄糖消耗速率和生物量積累并沒有受到明顯影響;當濃度增加到1 mmol/L時,葡萄糖消耗速率為對照組的94.28%,生物量為對照組的75.85%;濃度為2 mmol/L時,生物量為對照組的48.75%,達到了半抑制生長濃度;當FP濃度為5 mmol/L時,葡萄糖殘糖量升高,生物量僅為對照組的32.57%,生長受到了嚴重抑制。根據未添加FP的實驗組結果,這種培養條件下裂殖壺菌在40~70 h處于對數生長期,這一階段細胞處于快速分裂狀態,從發酵水平上來說可以認為這是細胞生長的代謝穩態。由圖1C可知,加入FP后雖然會抑制生物量的增長,油脂含量也隨之下降,但是油脂占細胞干重的比例基本維持在28%左右。當FP濃度達到2 mmol/L和5 mmol/L時,由于生物量和油脂含量都較低導致測量誤差較大,這會嚴重干擾代謝擾動分析結果。因此本研究最終選取了1 mmol/L作為后續擾動實驗中的FP濃度,因為在這一濃度下既可以顯示FP的抑制作用,也保證了分析結果的準確性。
2.2FP代謝擾動分析
2.2.1FP的利用由FP作為丙酮酸脫氫酶復合體競爭性抑制劑的作用機制可知,丙酮酸脫氫酶每消耗1摩爾FP就會減少1摩爾丙酮酸的利用,因而就會相應的減少1摩爾的乙酰輔酶A的合成。因此圖2的數據也反映了裂殖壺菌胞內乙酰輔酶A合成量降低的現象。由圖2可知,加入FP后的前8 h(發酵48 h),FP的平均消耗速率為0.831 μmol/L·g·h,隨著培養時間的延長,FP的消耗速率降低,加入44 h后(發酵84 h)FP的消耗速率為0.21 μmol/L·g·h。在培養過程中對細胞代謝進行擾動時,胞內代謝途徑會受到極大干擾,但是需要經過一定的代謝積累達到擾動穩態后,在擾動因子(此處是FP抑制劑)依然存在的情況下對細胞代謝水平做出評價會更加準確。
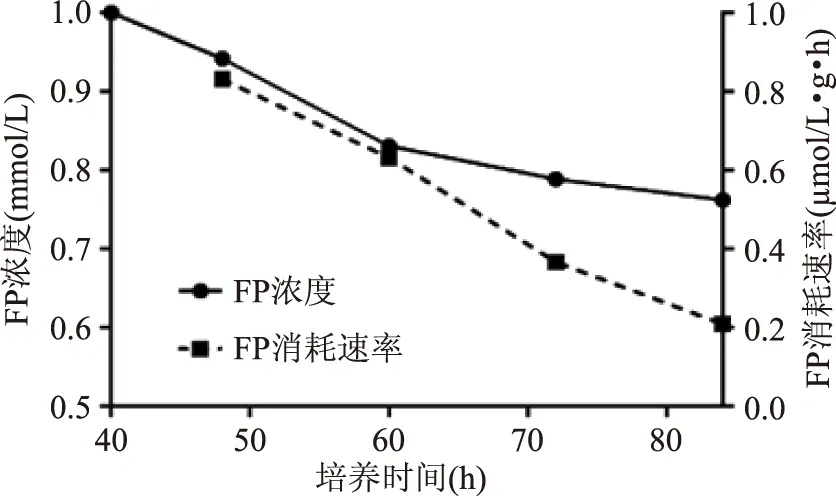
圖2 FP在胞內的代謝速率Fig.2 FP degradation rate in Aurantiochytrium cells

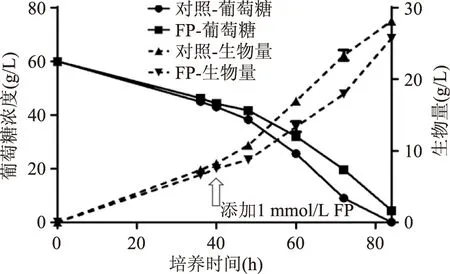
圖3 擬穩態下1 mmol/L FP對生長的影響Fig.3 Effects of 1 mmol/L FPto cell growth during homoeostasis state注:FP:FP擾動實驗組。
2.3油脂積累和脂肪酸成分變化
由圖4對照組結果可見,發酵初期(前40 h)在碳源和氮源充足的情況下細胞增殖占據了主導地位,油脂積累基本穩定在35%左右,發酵72~84 h后,細胞逐漸進入碳源、氮源缺乏的狀態,細胞進入油脂積累期,油脂含量可達45%以上。實驗組在加入FP之前,即前40 h和對照組的結果基本一致,油脂含量基本在35%左右,但是加入FP后,油脂含量出現明顯下降,84 h樣品細胞油脂含量為22%,僅為同時期對照組細胞油脂含量的40%。

圖4 裂殖壺菌含油率的變化Fig.4 Different ratio of total oil to dry cell weight
裂殖壺菌油脂的脂肪酸組成較為簡單,主要是由 FAS途徑合成的飽和脂肪酸——十六酸和十八酸以及PKS途徑合成的多不飽和脂肪酸——DHA和DPA組成。由圖5和圖6可知,加入FP后的8 h,脂肪酸分布并沒有顯著變化,這可能是因為胞內代謝途徑到代謝終產物受到影響的過程中有一個適應過程,當代謝擾動始終存在且對胞內代謝有較大影響的情況下,代謝終產物還是會體現出差異的。而后隨著培養時間的延長,對照組細胞油脂中FAS途徑生成的脂肪酸比率由40 h的58%下降到84 h的50%,PKS途徑合成的多不飽和脂肪酸比率則由40 h的42%上升為50%。FP處理組則呈現截然不同的變化趨勢,加入FP后,FAS途徑合成的脂肪酸比率卻呈上升趨勢,其比率從40 h的58%升至84 h的60%,而PKS途徑的占比從40 h的44%下降至84 h的40%。
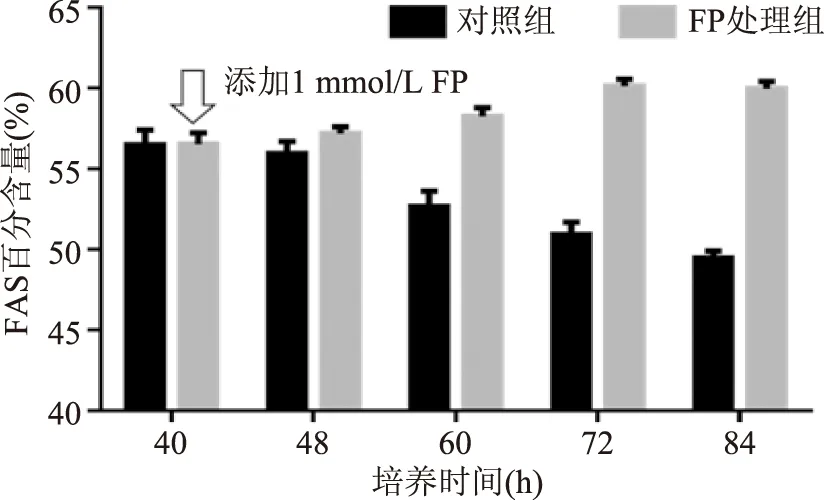
圖5 裂殖壺菌胞內油脂中飽和脂肪酸比率的變化Fig.5 Different percentage of saturated fatty acids注:FAS百分含量指油脂中飽和脂肪酸占總脂肪酸的比率。
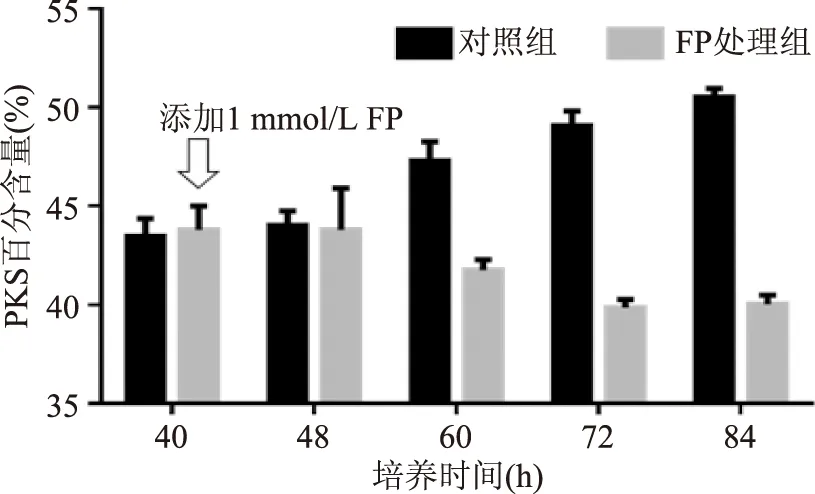
圖6 裂殖壺菌胞內油脂中不飽和脂肪酸比率的變化Fig.6 Different percentage of unsaturated fatty acid注:PKS百分含量指油脂中不飽和脂肪酸占總脂肪酸的比率。
利用圖4數據計算可知,加入FP后裂殖壺菌的含油率明顯下降,合成油脂的FAS和PKS途徑均受到抑制。在油脂合成受到抑制的前提下,不同油脂合成途徑受抑制的程度有顯著差別,FAS途徑的抑制率為54%,而PKS途徑的抑制率高達68%。因此可以說FP擾動降低乙酰輔酶A合成量對PKS的影響大于FAS。
胞內乙酰輔酶A的去向包括三羧酸循環、氨基酸合成和脂肪酸合成,由于已有裂殖壺菌的低溫擾動實驗說明乙酰輔酶A在FAS途徑和PKS途徑的分配比例與脂肪酸組成密切相關[14]。因此,首先由測定的脂肪酸組成和脂肪酸含量可以計算出用于合成脂肪酸的乙酰輔酶A總量,再根據脂肪酸的組成計算出分別由FAS途徑和PKS途徑消耗的乙酰輔酶A量,具體結果如表1所示。綜合了前述生物量積累、葡萄糖消耗、元素平衡分析、油脂組成等諸多參數,設定對照組和FP處理組用于合成脂肪酸的乙酰輔酶A的總量分別為100%,進而計算出乙酰輔酶A在FAS和PKS途徑中的分配比例變化,最終乙酰輔酶A在兩個脂肪酸合成途徑中的通量分布如圖7所示。由計算結果可知添加FP后用于合成脂肪酸的乙酰輔酶A量由對照組的8.62 mmol降低為4.38 mmol,正常培養時乙酰輔酶A在FAS和PKS途徑中的分配比例為幾乎1∶1,但添加FP后其分配比例變為3∶2,即通過1 mmol/L FP處理來降低乙酰輔酶A的供給量會擴大乙酰輔酶A在FAS途徑的分配比例。
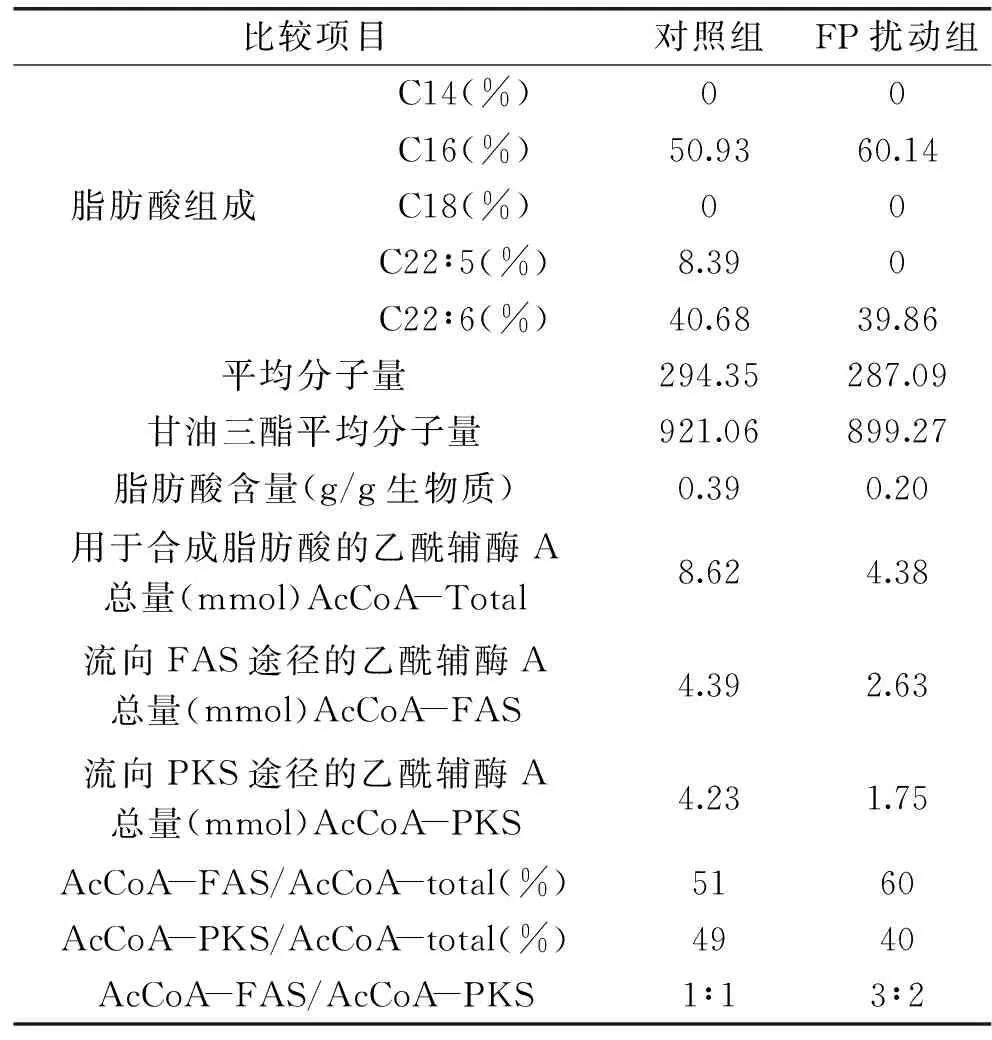
表1 FP對裂殖壺菌油脂積累及乙酰輔酶A代謝的影響
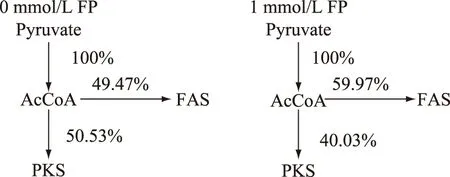
圖7 裂殖壺菌胞內乙酰輔酶A分支位點的分配比率Fig.7 Flux ratio of AcCoA metabolic branch point in cytoplasm注:乙酰輔酶A用于合成脂肪酸的量設定為100%。
由表1和圖7的結果可知,加入FP后,PDC合成乙酰輔酶A的量降低,也就導致脂肪酸合成的碳源前體供給量減少,從而一方面降低了總油脂的合成,另一方面也顯著影響了乙酰輔酶A在FAS和PKS之間的分配。FAS途徑和PKS途徑可以類似的看作兩種酶體系,對底物乙酰輔酶A具有不同的Km值,即對底物乙酰輔酶A具有不同的親和力。兩種酶體系競爭性與同一種底物結合,Km值較小的酶體系容易與底物結合。由實驗結果可知,在降低乙酰輔酶A 供給的情況下FAS占有競爭優勢,因此推測FAS途徑與乙酰輔酶A的親和性高于PKS。因此為了保證PKS途徑更多地合成DHA、DPA等不飽和脂肪酸,保證充足的乙酰輔酶A供給是十分有必要的。已有研究表明,通過在裂殖壺菌發酵過程中添加適當濃度的乙酸可以提高乙酰輔酶A的供給,并提高不飽和脂肪酸的合成[15],與本結果互為補充證明。
2.4碳分配變化

經計算對照組和實驗組碳原子分配結果:葡萄糖中有52.42%的碳原子流向生物質合成途徑;FP處理后這一比率降低為45.12%,而二氧化碳得率則相應地從對照組的47.59%上升至54.88%。以上結果表明抑制PDC降低了底物碳利用效率。
FP降低了丙酮酸脫氫酶復合體將丙酮酸轉化成為乙酰輔酶A的效率,造成了胞內的丙酮酸積累以及乙酰輔酶A和NADH的減少。由于NADH是細胞代謝的能量來源之一[16],細胞可能將線粒體中的乙酰輔酶A優先供給三羧酸循環的中心代謝途徑,造成了CO2的生成速率升高。
在實際生產過程中為了提高DHA的產量,通常利用代謝調控的方法將底物葡萄糖更高效地轉化成為DHA,因此提高細胞內的碳轉化效率是十分必要的。在裂殖壺菌中油脂合成機制的研究過程中,提高和降低碳轉化率都有利于對合成機理的進一步解析。在后期研究中,可以通過13C標記代謝通量分析實驗對中心代謝途徑的分配比率進行模擬計算,以利于深入研究乙酰輔酶A供給對PKS途徑的影響[17]。在生產應用中,應該保證充足的乙酰輔酶A的供給,提高丙酮酸脫氫酶復合體的活性,利于細胞積累更多的DPA、DHA,進一步接近理論產率。
3 結論
通過降低乙酰輔酶A供給可知丙酮酸脫氫酶復合體抑制劑FP可抑制裂殖壺菌的生長和油脂合成,同時FP會隨之代謝消耗。同時,在裂殖壺菌生長擬穩態下(對數生長期),1 mmol/L FP可顯著改變乙酰輔酶A在合成飽和脂肪酸的FAS途徑和合成不飽和脂肪酸的PKS途徑分配比率,從而導致總油脂中飽和脂肪酸含量上升而不飽和脂肪酸含量下降。經過物料平衡分析可知在降低了生物質合成途徑碳通量比率的同時,應用FP來抑制PDC活性也顯著增加了二氧化碳生成途徑的碳通量比率。裂殖壺菌生物質降低的同時二氧化碳生成量增加。
[1]宋曉金. 富含DHA的裂殖壺菌的工業化生產實驗、脂肪酸提取及應用研究[D]. 青島:中國海洋大學,2008.
[2]DYALL S C. Long-chain omega-3 fatty acids and the brain:a review of the independent and shared effects of EPA,DPA and DHA[J]. Front Aging Neurosci,2015,7.
[3]NESTEL P,CLIFTON P,COLQUHOUN D,et al. Indications for Omega-3 Long Chain Polyunsaturated Fatty Acid in the Prevention and Treatment of Cardiovascular Disease[J]. Heart Lung Circ,2015,24(8):769-779.
[4]MA Z X,TAN Y Z,CUI G Z,et al. Transcriptome and gene expression analysis of DHA producer Aurantiochytrium under low temperature conditions[J]. Sci Rep-Uk,2015,5.
[5]DE SWAAF M E,PRONK J T,SIJTSMA L. Fed-batch cultivation of the docosahexaenoic-acid-producing marine alga Crypthecodinium cohnii on ethanol[J]. Appl Microbiol Biot,2003,61(1):40-43.
[6]RATLEDGE C. Fatty acid biosynthesis in microorganisms being used for Single Cell Oil production[J]. Biochimie,2004,86(11):807-815.
[7]SHTAIDA N,KHOZIN-GOLDBERG I,BOUSSIBA S. The role of pyruvate hub enzymes in supplying carbon precursors for fatty acid synthesis in photosynthetic microalgae[J]. Photosynth Res,2015,125(3):407-422.
[8]ZOU J T,QI Q G,KATAVIC V,et al. Effects of antisense repression of an Arabidopsis thaliana pyruvate dehydrogenase kinase cDNA on plant development[J]. Plant Mol Biol,1999,41(6):837-849.
[9]QIU X. Biosynthesis of docosahexaenoic acid(DHA,22:6-4,7,10,13,16,19):two distinct pathways[J]. Prostag Leukotr Ess,2003,68(2):181-186.
[10]METZ J G,ROESSLER P,FACCIOTTI D,et al. Production of polyunsaturated fatty acids by polyketide synthases in both prokaryotes and eukaryotes[J]. Science,2001,293(5528):290-293.
[11]SONG X J,TAN Y Z,LIU Y J,et al. Different Impacts of Short-Chain Fatty Acids on Saturated and Polyunsaturated Fatty Acid Biosynthesis in Aurantiochytrium sp SD116[J]. J Agr Food Chem,2013,61(41):9876-9881.
[12]GAO M,SONG X J,FENG Y G,et al. Isolation and characterization of Aurantiochytrium species:high docosahexaenoic acid(DHA)production by the newly isolated microalga,Aurantiochytrium sp SD116[J]. J Oleo Sci,2013,62(3):143-151.
[13]BISSWANGER H. Substrate-Specificity of the Pyruvate-Dehydrogenase Complex from Escherichia-Coli[J]. J Biol Chem,1981,256(2):815-822.
[14]FLOURNOY D S,FREY P A. Inactivation of the Pyruvate-Dehydrogenase Complex of Escherichia-Coli by Fluoropyruvate[J]. Biochemistry-Us,1989,28(25):9594-9602.
[15]魏萍,任路靜,紀曉俊,等. 強化乙酰輔酶A供應對裂殖壺菌合成二十二碳六烯酸的影響[J]. 中國生物工程雜志,2011(4):87-91.
[16]崔家濤,譚延振,崔球,等. 海洋真菌SD116在產物合成中的輔因子譜分析[J]. 中國海洋藥物,2013(6):27-32.
[17]HE L,XIAO Y,GEBRESELASSIE N,et al. Central Metabolic Responses to the Overproduction of Fatty Acids in Escherichia coli Based on C-13-Metabolic Flux Analysis[J]. Biotechnol Bioeng,2014,111(3):575-585.
Research of a specific competitive inhibitor of pyruvate dehydrogenase complex onAurantiochytriumsynthesizing fatty acids
CHENG Yu-rong1,2,3,SUN Zhi-jie1,*,CUI Qiu1,2,4,*
(1.Shandong Provincial Key Laboratory of Energy Genetics,Qingdao Institute of Bioenergy and BioprocessTechnology,Chinese Academy of Sciences,Qingdao 266100,China;2.Qingdao Engineering Laboratory of Single Cell Oil,Qingdao 266100,China;3.University of Chinese Academy of Sciences,Beijing 100040,China;4.Key Laboratory of Biofuels,Qingdao Institute of Bioenergy and Bioprocess Technology,Chinese Academy of Sciences,Qingdao 266100,China)
Aurantiochytriumsynthesizes polyunsaturated fatty acid(docosahexenoic acid(DHA)and docosapentaenoic acid(DPA))through polyketide synthase(PKS)pathway,and saturated fatty acid(mainly palmic acid and oleic acid)through fatty acid synthase(FAS)pathway. Both pathways competitively used acetyl-CoA as carbon precursor. Understanding the mechanism to regulate the carbon partition between FAS pathway and PKS pathway was helpful for designation of high-DHA-yield strains and optimization of industrial fermentation process. In this research,the pyruvate dehydrogenase complex,which catalyzing the synthesis of acetyl-CoA,was treated by fluoropyruvate(FP)-a specific substrate-competitive inhibitor. Based on determination of carbon consumption,biomass,total oil accumulation and the distribution ratio of acetyl-CoA between FAS and PKS pathways were investigated. The results showed that FP could be assimilated and metabolized byAurantiochytriumand FP could inhibit lipid synthesis and significantly change the partition ratioof acetyl-CoA between FAS and PKS pathways. Production of carbon-dioxide was enhanced by FP,but the accumulation of biomass was inhibited. These results hinted that the affinity of FAS pathway to acetyl-CoA was higher than that of PKS pathway and the content of polyunsaturated fatty acid(DHA and DPA)in total oil could not be increased by reducing supply of acetyl-CoA.
fluoropyruvate;docosahexenoic acid;pyruvate dehydrogenase complex;acyl-CoA;Aurantiochytrium
2016-03-08
程鈺蓉(1991-),女,碩士研究生,研究方向:代謝通量分析,E-mail:chengyr@qibebt.ac.cn。
孫志杰(1978-),男,副研究員,研究方向:代謝通量分析,E-mail:sunzj@qibebt.ac.cn。
崔球(1975-),男,研究員,研究方向:微生物代謝工程及蛋白質工程,E-mail:cuiqiu@qibebt.ac.cn。
國家高技術研究發展計劃(863計劃)(2014AA021701);國家自然科學基金(41306132;3150078)。
TS201.3
A
1002-0306(2016)16-0161-06
10.13386/j.issn1002-0306.2016.16.024

