受體相互作用蛋白激酶1在食管鱗狀細胞癌中的表達及臨床意義
崔 凱,耿慧武,姬 強,朱克超,盧 晨,夏 杰,劉曉穎,于在誠
受體相互作用蛋白激酶1在食管鱗狀細胞癌中的表達及臨床意義
崔 凱1,耿慧武2,姬 強2,朱克超1,盧 晨1,夏 杰3,劉曉穎2,于在誠1
目的 探討受體相互作用蛋白激酶1(RIP1)蛋白在食管鱗癌中的表達情況及臨床意義。方法 應用Western blot法和免疫組織化學法檢測并且分析100例食管鱗癌患者的癌組織、相應癌旁組織和對應正常黏膜組織中RIP1的表達情況。結果 71%食管鱗癌組織中RIP1蛋白的表達水平高于對應癌旁組織和正常黏膜組織,20%食管鱗癌癌旁組織RIP1蛋白的表達水平高于對應癌組織和正常食管黏膜組織,差異有統計學意義(P<0.05)。食管鱗癌組織中高表達的RIP1蛋白水平與其TNM分期、病理分級、有無淋巴結轉移有關(P<0.05),與性別、年齡無關。癌旁組織中高表達的RIP1蛋白水平與腫瘤浸潤深度、TNM分期有關(P<0.05),與性別、年齡、有無淋巴結轉移及病理分級無關。結論 RIP1蛋白在食管鱗癌中的高表達可能與腫瘤的病理分級、TNM分期及預后有關,對于食管鱗癌的發生發展有一定的預測作用。
食管腫瘤;鱗狀細胞;免疫組織化學;受體相互作用蛋白激酶1
食管癌是人類常見的惡性腫瘤之一,其發病率居我國惡性腫瘤的第四位,食管癌絕大部分是鱗狀細胞癌,原發腺癌較少見。其早期無明顯典型癥狀,偶有下咽異物感、胸骨后疼痛等。手術是治療食管癌的首選方法,但手術切除率僅為58%~92%,且術后5年生存率仍不到40%[1],食管惡性腫瘤的早期發現與治療能夠大大提高患者的手術切除率和5年生存率。受體相互作用蛋白1(receptor interacting protein kinase 1)是一類絲氨酸/蘇氨酸蛋白激酶,其可以通過激活NF-κB、活化Caspase-8、參與活性氧的產生等方式,在細胞凋亡、細胞存活及細胞程序性壞死等信號傳導中起關鍵作用[2]。另外其功能受泛素化、鋅指蛋白等的調節[3]。目前關于RIP1在食管癌發生發展中的作用研究較少。該研究旨在通過檢測100例食管鱗癌患者的癌組織、相應癌旁及正常食管黏膜組織中RIP1的表達情況,分析RIP1在食管鱗癌的早期診斷、分化程度及預后中的相關意義。
1 材料與方法
1.1 病例資料 收集安徽醫科大學第一附屬醫院胸外科2014年10月~2015年7月手術切除的食管鱗癌標本100例,術前均經胃鏡活檢病理診斷明確,術前均未經放療、化療。男73例,女27例;年齡36~84(60.34±10.42)歲。手術切除標本后分別于病灶中心、癌旁(距病灶2 cm以內)及距病灶5 cm外正常食管黏膜切取少許組織兩份,一份立即放入-80℃保存,用Western blot法檢測RIP1的表達;另一份立即用4%中性甲醛溶液固定,常規脫水、石蠟包埋備用,其余大體標本立即置10%福爾馬林固定送入病理科,常規石蠟包埋、切片、HE染色,行病理學診斷。所有病例按《食管癌的國際TNM分期標準(2009年第7版)》進行分期。
1.2 主要試劑與儀器 Western IP細胞裂解液、BCA定量試劑盒和一抗、二抗稀釋液均購自上海碧云天公司;辣根過氧化物酶標記的山羊抗兔IgG、SP 9000通用型免疫組化試劑盒、DAB染色試劑盒購自北京中杉金橋生物技術有限公司;ECL顯色試劑盒購自美國Pierce公司;兔抗人RIP1單克隆抗體購自美國Sigma公司;Tissue lyser組織破碎儀購自德國QIAGEN公司。
1.3 方法
1.3.1 Western blot法檢測RIP1的表達 每個病例的食管癌組織、癌旁組織及相應癌旁正常食管黏膜組織作為自身對照。盡量剪碎組織,加入細胞裂解液,于Tissue lyser組織破碎儀上破碎,4℃、14 000 r/min離心10 min,收集上清液,蛋白定量30 μg,取出相應上清液與等量2×SDS上樣緩沖液混合,沸水浴5 min、冰浴2 min后進行SDS-PAGE電泳2 h,轉移至聚偏二氟乙烯膜(PVDF膜),100 V恒壓電轉1 h,用含5%脫脂奶粉的TBST溶液封閉2 h,用含0.05%Tween-20的TBST洗滌PVDF膜3次,RIP1抗體(1∶500,用一抗稀釋液稀釋)4℃過夜孵育,用TBST洗膜后與辣根過氧化物酶標記的山羊抗兔IgG(1∶5 000,用含5%脫脂奶粉的TBST溶液稀釋)室溫作用2 h,TBST洗膜后用ECL試劑盒顯色,在暗室中用X線片曝光并顯影和定影,X線片晾干后掃描(以GAPDH作為上樣內參照),運用Image J和Graphpad Prism 5.0軟件進行蛋白顯影后圖像分析,運用t檢驗進行數據處理。
1.3.2 免疫組化法檢測RIP1的表達 采用免疫組化SP法,嚴格按照說明書進行操作:每步用PBS工作液洗3次,每次3 min,3%過氧化氫20 min阻斷內源性過氧化物酶,非免疫血清作用20 min,RIP1一抗1∶200稀釋,4℃孵育過夜;生物素標記的二抗(1∶500稀釋)孵育30 min,鏈霉素抗生物素蛋白-過氧化物酶孵育30 min,DAB顯色,然后常規HE復染、脫水、封片在顯微鏡下觀察。
1.3.3 免疫組化結果判定 采用光學顯微鏡觀察RIP1的表達情況,取高倍視野(×400)進行觀察,細胞膜及細胞質呈棕色、棕褐色為陽性表達細胞。取3個不同的視野進行觀察,計數每個視野下100個細胞的染色情況,取平均值。按陽性表達細胞數及染色強度進行評分:陽性表達細胞數(0:陽性細胞數0~10%,1:陽性細胞數11%~25%,2:陽性細胞數26%~50%,3:陽性細胞數51%~75%,4:陽性細胞數76%~100%);染色強度(0:無黃染,1:淺黃色,2:深黃色,3:棕褐色)。總分=陽性細胞表達數+染色強度,>4分者為陽性(+),≤4分者為陰性(-)。
1.4 統計學處理 采用SPSS 17.0軟件進行分析。運用t檢驗進行數據處理。組間差異比較采用χ2檢驗及Fisher's確切概率法。
2 結果
2.1 Western blot法檢測RIP1蛋白的表達情況
應用Western blot法檢測部分病例食管鱗癌患者癌組織與癌旁組織及正常黏膜組織中RIP1的表達情況,結果顯示71%樣本中RIP1在食管鱗癌組織中的表達高于癌旁組織和正常黏膜組織(P<0.05),見圖1。20%樣本中RIP1在食管鱗癌患者癌旁組織中的表達高于鱗癌組織和正常黏膜組織(P<0.05),見圖2。
2.2 免疫組化法檢測RIP1蛋白的表達情況
RIP1陽性染色主要定位于細胞膜和細胞質中,為不均勻的棕黃色顆粒,無規律地散在分布于癌組織中。71%樣本中RIP1在食管鱗癌組織中的表達高于癌旁組織和正常黏膜組織,見圖3。20%樣本中RIP1在食管鱗癌患者癌旁組織中的表達高于鱗癌組織和正常黏膜組織,見圖4。
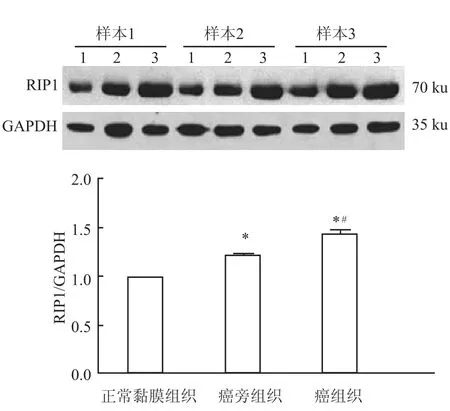
圖1 Western blot法檢測RIP1蛋白的表達情況
2.3 RIP1在食管鱗癌中的表達與臨床病理指標的關系 100例食管鱗癌組織中RIP1陽性表達且高于癌旁組織及相應正常食管黏膜組織71例,占71%,癌旁組織陽性表達且高于癌組織20例,占20%;癌組織中高表達的RIP1蛋白的表達水平與其TNM分期、病理分級、有無淋巴結轉移有關(P<0.05),與患者的性別、年齡無關,見表1。癌旁組織中高表達的RIP1蛋白的表達水平與腫瘤浸潤深度、TNM分期有關(P<0.05),與患者的性別、年齡、有無淋巴結轉移及病理分級無關,見表2。
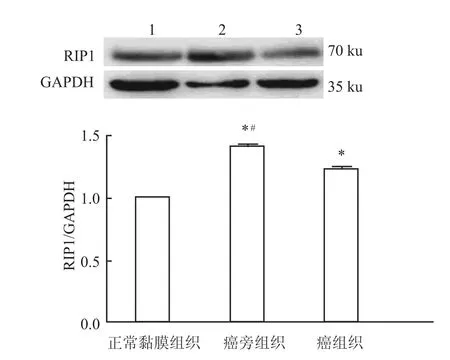
圖2 Western blot法檢測RIP1蛋白的表達情況
3 討論

圖3 免疫組化法檢測RIP1蛋白的表達情況 SP×400

圖4 免疫組化法檢測RIP1蛋白的表達情況 SP×400
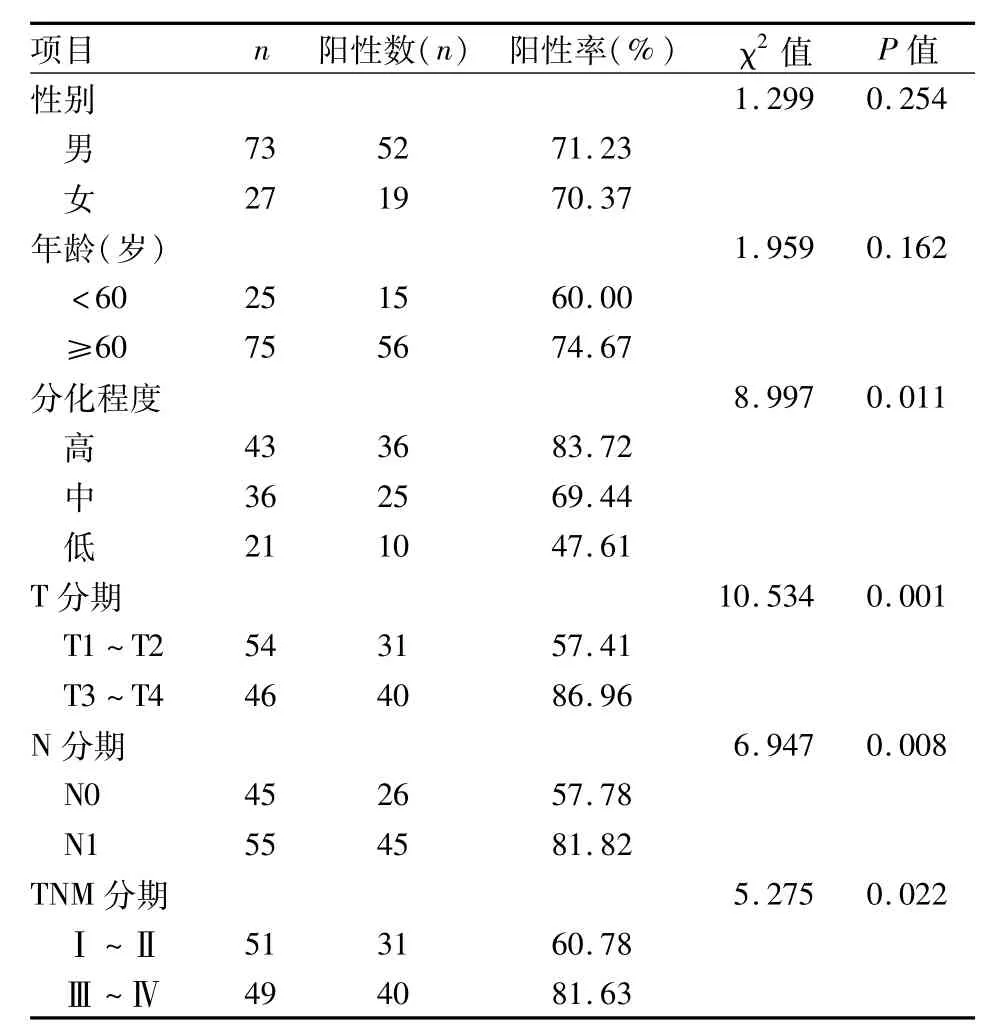
表1 癌組織中高表達的RIP1與臨床病理指標的關系
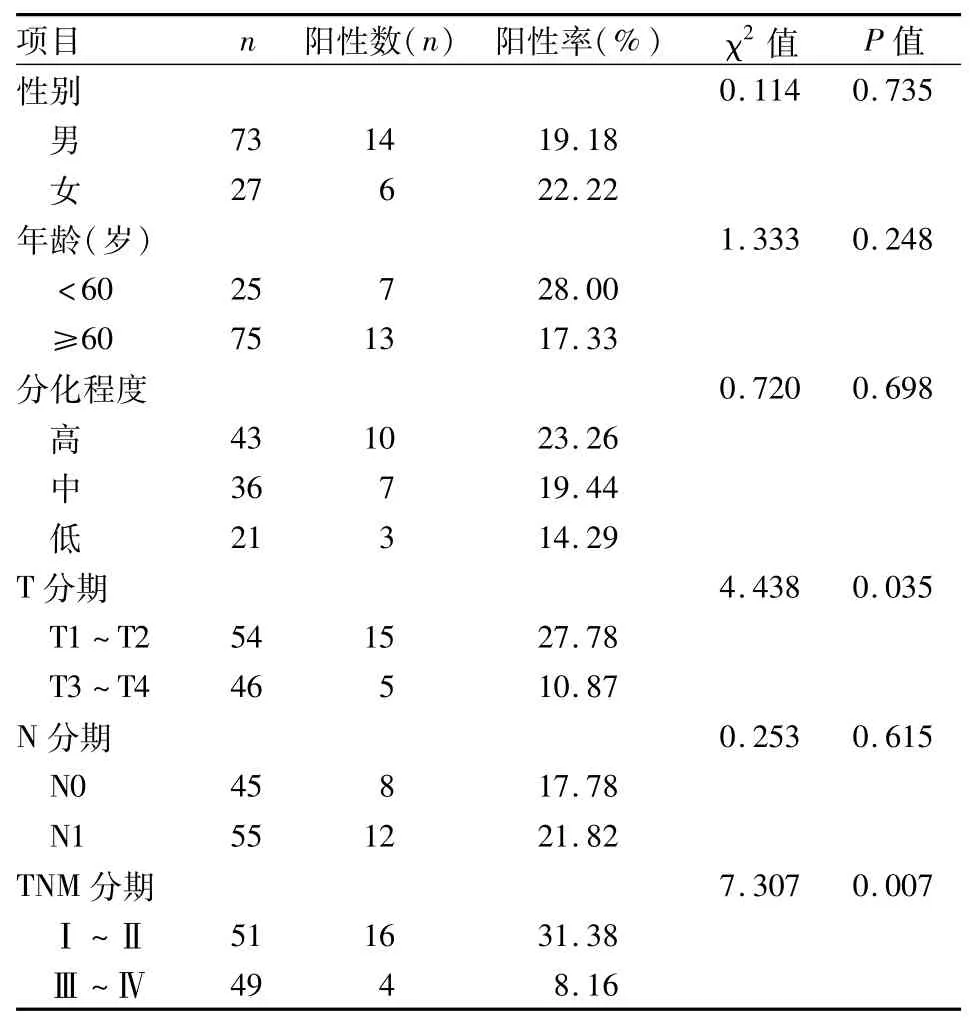
表2 癌旁組織中高表達的RIP1與臨床病理指標的關系
惡性腫瘤的發生發展與癌細胞的存活增殖密切相關,RIP1的泛素鏈的錨定位置決定了其作為一個存活的基礎架構或是細胞凋亡信號的功能。賴氨酸63連接泛素鏈的RIP1參與調控NF-κB通路[4]以此促細胞增殖,RIP1轉變泛素鏈錨定位置[5]后可與FADD和Caspase-8結合形成復合體Ⅱa[6],執行細胞凋亡。另外RIP1與RIP3通過RHIM結構域相互作用形成的淀粉樣沉積物在執行細胞程序性壞死過程中必不可少[7]。說明RIP1在腫瘤細胞的存活增殖、凋亡及程序性壞死等信號傳導中起著中樞調控的作用。
對人類黑色素瘤中RIP1的研究[8]表明沉默RIP1可以一定程度抑制黑色素瘤細胞的增殖,小鼠動物實驗也證實RIP1的沉默可以一定程度上延緩腫瘤細胞的生長。另外,乳腺癌、神經膠質瘤的發生發展與過表達的RIP1相關[9]。劉復興等[10]在評估RIP1在食管鱗癌的表達狀況中,發現RIP1在癌組織的表達顯著高于對應正常食管組織,且其表達水平與腫瘤的分期、分級、有無淋巴結轉移、浸潤深度呈正相關性。本研究中,食管癌組織RIP1的陽性表達率為71%,主要定位于腫瘤細胞的細胞質。中晚期患者癌組織中的表達情況明顯高于對應癌旁及正常食管黏膜組織,提示RIP1可能與食管鱗癌TNM分期及食管鱗癌細胞增殖有關。這與以往研究結果一致,提示在食管鱗癌中RIP1促進癌細胞增殖。章余妹等[11]發現在順氯氨鉑(cisplatin)誘導食管癌細胞凋亡過程中,DDP處理后的食管癌細胞株RIP1表達水平增高,聯合RIP1特異性抑制劑后,較敏感的KYSE510細胞株凋亡率明顯減少,推測DDP可能通過轉變RIP1上泛素化鏈錨定位置[12]進而導致腫瘤細胞程序性凋亡。關于RIP1泛素化鏈錨定位置對食管鱗狀癌細胞生存、增殖的影響需進一步研究來證實。
本研究還表明部分病例癌旁組織中RIP1的表達水平高于相應癌組織及正常食管黏膜組織,占早中期病例的31%。此種情況下,食管鱗癌癌旁組織中RIP1表達水平高于癌組織且與腫瘤TNM分期呈負相關性,推測部分早中期食管鱗癌組織中RIP1可以通過形成復合體Ⅱ執行細胞凋亡的方式抑制早期惡性腫瘤細胞的存活增殖。食管鱗癌患者癌旁RIP1的表達水平對診斷腫瘤的TNM分期有一定參考意義。
另外,癌旁組織中該蛋白的表達水平與腫瘤病理分級無關,結合癌組織中該蛋白表達與腫瘤病理分級的關系,考慮RIP1表達水平可能與腫瘤組織的惡性程度相關,從而能夠作為食管鱗癌患者判斷預后的一個參考指標。由于RIP1具備多個結構域,在細胞信號轉導中的作用更為復雜,其泛素化、磷酸化等修飾作用異常所導致的結果與食管鱗癌的關系等仍需要進一步的研究。
[1] Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277-300.
[2] Christofferson D E,Li Y,Yuan J.Control of life-or-death decisions by RIP1 kinase[J].Annu Rev Physiol,2014,76:129-50.
[3] Ofengeim D,Yuan J.Regulation of RIP1 kinase signalling at the crossroadsof inflammation and cell death[J].Nat Rev Mol CellBiol,2013,14(11):727-36.
[4] Jain M V,Paczulla A M,Klonisch T,et al.Interconnections between apoptotic,autophagic and necrotic pathways:implications for cancer therapy development[J].J Cell Mol Med,2013,17(1):12-29.
[5] Kovalenko A,Chable-Bessia C,Cantarella G,et al.The tumour suppressor CYLD negatively regulates NF-κB signalling by deubiquitination[J].Nature,2003,424(6950):801-5.
[6] Declercq W,Vanden Berghe T,Vandenabeele P.RIP kinases at the crossroads of cell death and survival[J].Cell,2009,138(2):229-32.
[7] Li J,McQuade T,Siemer A B,et al.The RIP1/RIP3 necrosome forms a functional amyloid signaling complex required for programmed necrosis[J].Cell,2012,150(2):339-50.
[8] Liu X Y,Lai F,Yan X G,et al.RIP1 kinase is an oncogenic driver in melanoma[J].Cancer Res,2015,75(8):1736-48.
[9] Habib A A,Chatterjee S,Park S K,et al.The epidermal growth factor receptor engages receptor interacting protein and nuclear factor-kappa B(NF-kappaB)-inducing kinase to activate NF-kappa B.Identification of a novel receptor-tyrosine kinase signalosome[J].J Biol Chem,2001,276(12):8865-74.
[10]劉復興,龐 洪,武 倩,等.受體相互作用蛋白1 RIP1在食管鱗癌的表達及意義[J].解剖學研究,2013,35(3):183-5.
[11]章余妹,吳 萍,張林杰,等.RIP1增強順鉑誘導食管癌細胞的凋亡[J].安徽醫科大學學報,2015,50(2):172-6.
[12]Wertz I E,O'Rourke K M,Zhou H,et al.De-ubiquitination and ubiquitinligase domains of A20 downregulate NF-κB signalling[J].Nature,2004,430(7000):694-9.
Receptor interacting protein kinase 1 expression in esophageal squamous carcinoma and clinical significance
Cui Kai1,Geng Huiwu2,Ji Qiang2,et al
(1Dept of Thoracic Surgery,The First Affiliated Hospital of Anhui Medical University,Hefei 230022;
2Faculty of Biology,Anhui Medical University,Hefei 230032)
Objective The investigation of the expression and clinical significance of receptor interacting protein kinase 1(RIP1)in esophageal squamous cell carcinoma.Methods Immunohistochemistry and Western blot analysis were applied to detect and analyze the expression of RIP1 in cancer tissue and the relevant pericarcinomatous tissue,as well as in the corresponding normal esophageal mucosa in 100 cases of ESCC patients.Results RIP1 expression levels in 71%of cases were demonstrated to be the highest in cancer tissue,then in pericarcinomatous tissue and normal esophageal mucosa in sequence,with statistical significance(P<0.05).20%of cases indicated that expression of RIP1 in pericarcinomatous tissue relating to esophageal squamous carcinoma was higher than that in cancer tissue and normal esophageal mucosa orderly(P<0.05).The investigated up-regulated expression of RIP1 in cancer tissue was proved to be relevant with TNM stage,pathologic grade and lymph node metastasis(P<0.05),while it was not associated with sex and age.The up-regulated expression of RIP1 in pericarcinomatous tissue was suggested to be corresponding to invasion depth and TNM stage(P<0.05),but not to sex,age lymph node metastasis or pathological grading.Conclusion The up-regulated expression of RIP1 in esophageal squamous carcinoma is supposed to be relevant to pathological grading,TNM stage and prognosis,which also is effective in the genesis and development of esophageal squamous carcinoma.
esophageal neoplasms;squamous cell;immunohistochemistry;receptor interacting protein kinase 1
R 735.1;R 341
A
1000-1492(2016)08-1175-05
時間:2016-6-22 14:44:58
http://www.cnki.net/kcms/detail/34.1065.R.20160622.1444.046.html
2016-04-19 接收
國家自然科學基金青年基金(編號:81201368)
1安徽醫科大學第一附屬醫院胸外科,合肥 230022
2安徽醫科大學生命科學學院生物學系,合肥 230032
3安徽醫科大學第四附屬醫院急診外科,合肥 230011作者簡介:崔 凱,男,碩士研究生;
于在誠,男,主任醫師,教授,碩士生導師,責任作者,E-mail:yuzaicheng@vip.sina.com

