單側肺精確滴注法制作小鼠單側急性肺損傷模型的研究
姜寶珍,劉澤玉,劉 星,張志紅
單側肺精確滴注法制作小鼠單側急性肺損傷模型的研究
姜寶珍1,2,劉澤玉1,2,劉 星3,張志紅1,2
經導管氣管內滴注方法制作一種操作簡捷可靠、劑量精確的小鼠單側肺損傷模型。經導管分別滴注生理鹽水(NS組)、0.05%伊文斯蘭(EB組)、脂多糖(LPS組)至小鼠左肺,6 h測呼吸功能(Pehn),24 h取肺臟進行病理分析,插管成功率為100%。解剖顯示EB組小鼠左肺均勻分布EB,右肺無明顯異常;NS組和EB組小鼠Pehn差異無統計學意義,LPS組Pehn與NS組、EB組比較差異有統計學意義(P<0.001);NS組和EB組小鼠雙肺病理HE染色均無明顯病理學改變,LPS組小鼠肺出現嚴重肺損傷。
單側氣管滴注;伊文斯蘭;脂多糖
近年來隨著實用性醫學研究的深入,各種疾病的動物模型更能夠接近人類疾病臨床表現。急性肺損傷是創傷、急救醫學不可避免的研究問題,不同類型急性肺損傷的動物模型也應運而生。小鼠易得且廉價,其基因背景99%與人類共享[1],因此科學家多用小鼠來制作各種疾病模型。同樣地,小鼠急性肺損傷模型也被廣泛應用。而如何精準地制作小鼠急性肺損傷模型是關鍵。氣管滴注方法是建立急性肺損傷模型時經常使用的手術方法之一。而現有的國內外氣管滴注方法操作[2-7]誤差較大,造成造模顯著的不穩定性和病變的不確定性。該研究在總結既往氣管滴注方法的基礎上,對導管、滴注手法加以改進,并引入指示劑,建立及完善一種更高效、精確、便捷、重復性高的小鼠單側肺導管滴注方法。為今后呼吸道暴露方法能夠更好地應用到臨床醫學、毒理學和環境醫學等相關領域研究提供參考。
1 材料與方法
1.1 材料 18只清潔級雄性C57BL/6J小鼠,18~22 g,購自北京華阜康生物科技股份有限公司。伊文斯蘭(E2129,美國Sigma Aldrich公司);脂多糖(LPS 055:B5,美國Sigma Aldrich公司);動脈導管(427401,美國BD公司,圖1A);手術器械高壓蒸汽滅菌(121℃、20 min)使用、冷光源(ULP-150,蘇州ULANP公司);實驗動物呼吸功能檢測儀(gyd-003,法國EMKA-wbp公司)。實驗中涉及動物的操作程序已經得到中國醫學科學院醫學實驗動物研究所實驗動物使用與管理委員會的批準(批準號:ILAS-PG-2015-017)。各組小鼠體重差異無統計學意義。
1.2 方法 18只小鼠按體重隨機分為3組:正常對照(normal saline,NS)組6只,氣管滴注無菌醫用生理鹽水(1 μl/g體重);伊文斯蘭(evans blue,EB)組6只,氣管滴管無菌0.05%伊文斯蘭-生理鹽水溶液(1 μl/g體重);脂多糖(lipopolysaccharide,LPS)組6只,氣管滴注無菌LPS-生理鹽水溶液(3.5 mg/kg體重)。操作步驟:①戊巴比妥鈉溶液腹腔注射(50 mg/kg體重)麻醉小鼠,固定四肢于小動物加熱板上,絲線固定門牙,使頸部充分暴露;②全部手術造模過程于潔凈工作臺內完成,小鼠頸前部備皮處理,按手術常規消毒頸前部皮膚,于小鼠氣管正前方做5 mm縱行切口并鈍性分離氣管前肌肉、筋膜,暴露氣管(圖1B);③將小鼠固定于傾斜60°的小動物固定板上,術者位于小鼠頭端,將冷光源對向小鼠的喉咽部,利用器械充分暴露喉部以及聲門,清楚可見到光源由聲門處透射出并隨聲門開合呈現閃爍感(圖2A);右手持導絲置入后的導管,于聲門張開瞬間向前上方平穩插入氣管,可有輕微突破感,拔出導絲;于頸部切口處可見插入氣管的導管(圖2B);調整導管向左側彎曲,再緩慢向氣管深處插入,深至距小鼠上門牙約2.8 cm以確保導管末端置于左主支氣管內,末端連接胰島素注射器,向導管內緩慢推注藥物,推注過程大于10 s,再補推注入約30倍液體體積的空氣;④輕柔拔出導管并豎直放置小鼠5 min,術后小鼠給予保溫措施等待蘇醒;⑤6 h后檢測小鼠呼吸功能,24 h后麻醉處死分離肺臟,肺組織經固定、脫水、包埋、切片及HE染色后于光學顯微鏡下觀察兩組小鼠肺臟組織的病理表現。
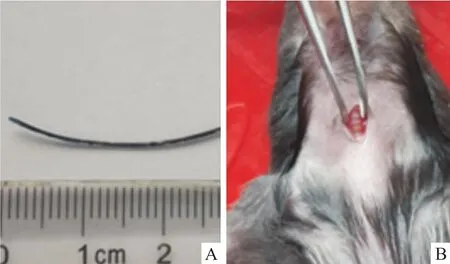
圖1 操作準備
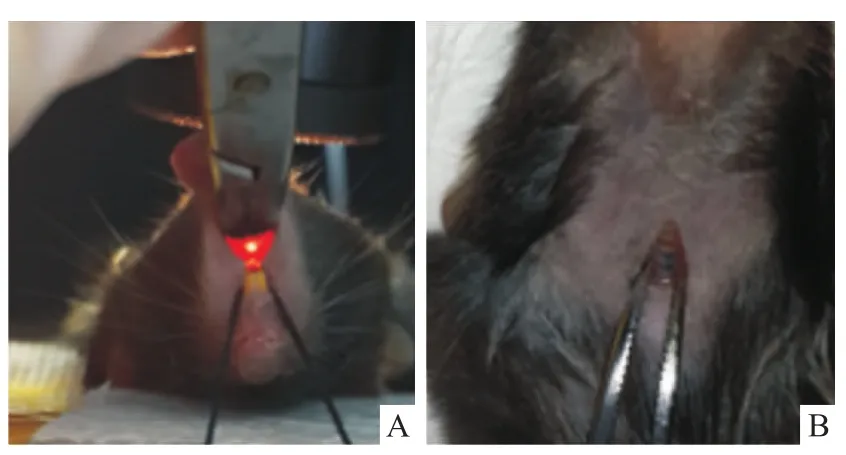
圖2 操作過程
1.3 統計學處理 采用SPSS 17.0軟件進行分析,數據以±s表示;經檢驗計量資料均符合正態分布及方差齊性,多組比較采用單因素方差分析和兩樣本均數t檢驗。
2 結果
2.1 狀態觀察 NS組和EB組小鼠在經導管單側肺滴注藥物過程中保持較平穩呼吸,沒有出現窒息或死亡,術后觀察咽部無明顯充血、紅腫,聲門無明顯損傷;小鼠蘇醒后,活動、進食水等無明顯異常表現。LPS組小鼠出現活動量及進食、飲水次數減少,呼吸急促、精神萎靡等表現。
2.2 大體觀察 EB組小鼠氣管滴注24 h后,解剖離體肺臟呈現左肺均勻分布藍色EB生物指示劑,而右肺為淡粉色。見圖3。
2.3 呼吸功能(Pehn) 3組小鼠的呼吸功能(Pehn)程度的方差分析比較差異有統計學意義(NS組:=0.429,σ=0.041;EB組:=0.464,σ= 0.019;LPS組:=5.59,σ=0.349;F=211.480,P =0.000 1);而NS組與EB組小鼠呼吸功能表現無明顯差異(t=1.250,P=0.252),表明0.05%伊文斯蘭-生理鹽水溶液氣管滴注對小鼠呼吸功能無明顯影響;LPS組呼吸功能分別與NS組、EB組比較明顯升高,差異有統計學意義(t=10.699,P= 0.000 1;t=10.794,P=0.000 1)。見圖4。
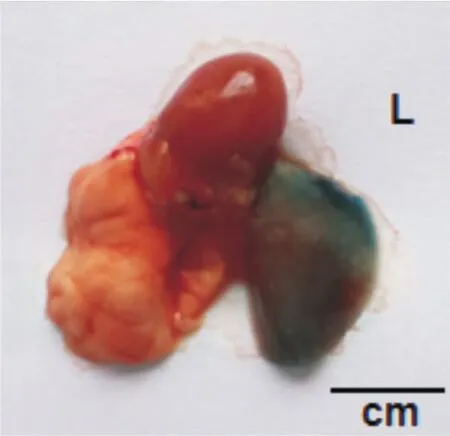
圖3 EB組離體肺
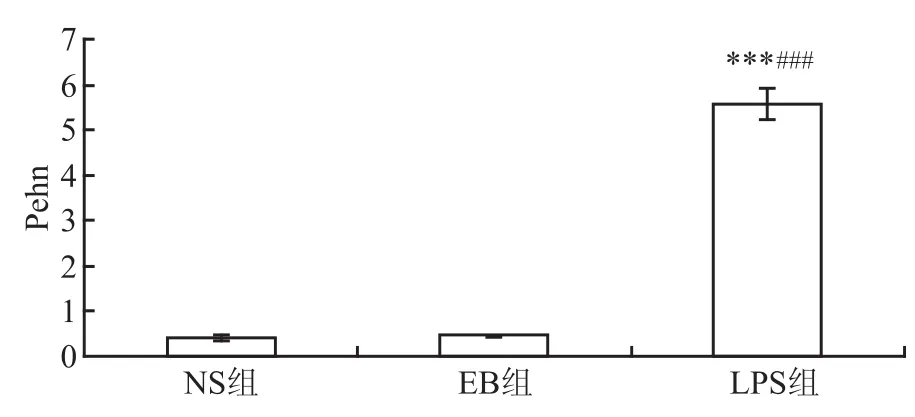
圖4 小鼠的呼吸功能(Pehn)
2.4 肺組織病理學 NS組與EB組雙肺肺組織均無明顯組織病理損傷;LPS組右肺未見明顯損傷或輕微損傷,肺泡結構完整,左肺肺組織可見彌漫性的出血水腫,肺泡壁增厚、結構紊亂,部分肺泡萎陷不張。見圖5。

圖5 小鼠肺組織病理學改變 HE×400
3 討論
氣管滴注方法是近年來實驗人員探索開發出的一種呼吸道給藥和染毒方法,如何簡單易行、準確和可重復一直是困擾該方法的瓶頸。本研究分別在手術方法和器械等方面進行了相應的改進,手術后的小鼠均狀態良好,能正常存活,插管成功率達100%。本實驗還采用該研究方法成功地建立了LPS導致小鼠急性肺損傷動物模型。
現有的國內外氣管滴注方法主要包括非暴露式和暴露式氣管滴注,非暴露式是指滴鼻吸入[2]、咽后壁滴注或導管經咽喉插入氣管內滴注[3-4];而暴露式氣管滴注法是指經有創操作暴露動物氣管,注射器直接刺入氣管進行滴注[5]。兩種滴注方法仍存在一些不足之處:①無法精確控制給藥量及藥物的肺內分布;②人為操作誤差大,造成造模顯著的不穩定性和病變的不確定性。國外也有少數研究者開始探索導管單側肺滴注[6-7],但還存在如下問題:①實驗者大多使用一次性靜脈留置針或穿刺針進行氣管插管,材料的性質導致導管插入部位隨機性較大;②插管接口僅與普通注射器相匹配,給藥量精確度控制欠佳[8];③操作無法實時確定導管插入成功與否,導致實驗的盲目性,同時增加了實驗損耗。
經過改良的氣管滴注方法主要有以下優點:方法的改進更便于操作,采用暴露小鼠氣管的方式,能直觀地明確導管的插入位置;給藥范圍更明確,由于傳統氣管滴注方法可導致藥物在不同肺葉分布不均,使實驗結果具有較大的隨機性,本實驗方法由導管直接將藥物滴注到左主支氣管,使藥物均勻分布于左肺,減小了個體間藥物分布誤差,實驗結果顯示,加入了指示劑組小鼠左肺EB均勻分布,右肺無明顯指示劑分布。改良后的手術器械增加了安全性和精準度,實驗選用動脈導管替代一次性靜脈留置針或穿刺針,并且在導管內加入金屬絲既保證了安全性又增加了硬度,最大限度上減小了手術操作對動物可能造成的損傷,可重復操作;相比原有方法所使用的普通醫用注射器,給藥量控制誤差較大[8]的問題,本實驗改用胰島素注射器進行給藥,其精確性顯著提高[9],給藥量更精確。除此之外,改良后的方法操作簡捷、高效,僅需一人,每只小鼠約10 min即可完成滴注,極大地提高了滴注手術的效率和成功率。
肺組織病理學和呼吸功能檢查在臨床診療過程中應用廣泛,在呼吸系統疾病的診斷、疾病程度和療效的評估等方面都有十分重要的意義。EB是一種臨床常用的測定血漿和血容量的指示劑,本實驗表明,EB對小鼠呼吸功能無明顯損傷作用,肺組織病理學檢查未見明顯病理改變,因此EB可作為氣管滴注給藥的一種指示劑。本研究采用改良后的氣管滴注方法制作LPS導致小鼠急性肺損傷動物模型,LPS導致小鼠呼吸功能損傷嚴重程度較正常對照組明顯加重;肺組織病理學顯示左肺直接滴注LPS后,出現肺組織彌漫性出血水腫,肺泡壁增厚、結構紊亂,部分肺泡萎陷不張,而右肺僅有輕微損傷。研究表明氣管滴注LPS能夠嚴重損傷直接暴露的肺組織,非直接暴露肺組織損傷程度較輕,因此,藥物在肺組織內的分布以及局部肺組織的藥物濃度直接影響肺部病變。
本實驗通過對細節的把握,針對定位不準確的問題通過引入EB指示劑加以完善,規范導管及微量注射器等裝置降低實驗誤差,增加了氣管滴注實驗操作的可重復性和規范性,避免了造模效果不穩定、造模結果差異顯著等問題的發生,并成功應用于LPS導致小鼠急性肺損傷模型建立,為將來進一步實施精準給藥、定點染毒奠定了基礎。綜上所述,本方法是一種簡捷可靠、劑量精確、可重復性高的小鼠單側導管肺滴注方法,將來可廣泛應用于小鼠經呼吸道給藥、染毒等各項肺損傷相關模型的制作和研究中。
[1] Mouse Genome Sequencing Consortium,Waterston R H,Lindblad-Toh K,et al.Initial sequencing and comparative analysis of the mouse genome[J].Nature,2002,420(6915):520-62.
[2] Yu P J,Li J R,Zhu Z G,et al.Praeruptorin D and E attenuate lipopolysaccharide/hydrochloric acid induced acute lung injury in mice[J].Eur J Pharmacol,2013,710(1-3):39-48.
[3] Kardara M,Hatziantoniou S,Sfika A,et al.Caveolar uptake and endothelial-protective effects of nanostructured lipid carriers in acid aspiration murine acute lung injury[J].Pharm Res,2013,30(7):1836-47.
[4] Zhang Y,Wen Z,Guan L,et al.Extracellular histones play an inflammatoryrole in acid aspiration-induced acute respiratory distress syndrome[J].Anesthesiology,2015,122(1):127-39.
[5] Zhang Y,Zhao Z,Guan L,et al.N-acetyl-heparin attenuates acute lung injurycaused by acid aspiration mainly by antagonizing histones in mice[J].PLoS One,2014,9(5):e97074.
[6] Eickmeier O,Kim S Y,Herrmann E,et al.Altered mucosal immune response after acute lung injury in a murine model of Ataxia Telangiectasia[J].BMC Pulm Med,2014,14:93.
[7] Cornélio Favarin D,Martins Teixeira M,Lemos de Andrade E,et al.Anti-inflammatory effects of ellagic acid on acute lung injury induced by acid in mice[J].Mediators Inflamm,2013,2013:164202.
[8] 彭康琳,周玉慶,周正適.劑量精確的大鼠無創氣管滴注方法[J].中國比較醫學雜志,2013,23(9):61-3.
[9] 李 琨,王 濤,海 潔,等.注射器類型對胰島素注射劑量的影響[J].實用醫學雜志,2012,28(15):2614-6.
Explore an accurate approach for setting up acute single lung inflammation in mice through intratracheally instillation
Jiang Baozhen1,2,Liu Zeyu1,2,Liu Xing3,et al
(1Dept of Eldery Respiratory Medicine,The First Affiliated Hospital
of Anhui Medical University,Hefei 230022;2Institute of Respiratory Disease,Anhui Medical
University,Hefei 230022;3Institute of Laboratory Animal Science,PUMC&CAMS,Beijing 100021)
To establish a simple,efficient and accurate approach for setting upacute lung inflammation in left lung in mice through intratracheally instillation.3 groups were intratracheally instilled with normal saline(NS group),0.05%Evans Blue(EB group)and lipopolysaccharide(LPS group)into the left lung with a catheter respectively. Mice respiratory functions(Pehn)were measured at 6 hours after administration of the above reagents.Distribution of EB was observed by pathological analysis after mice were sacrificed at 24 hours after instillation.100%of the flexible tube was intubated in the exact site of the left main trachea and EB was distributed evenly in the left lung of all the EB group mice.No differences of the Pehn and histopathological changes were found between the NS and EB groups,however,significantly decreased Pehn and sever acute lung injury under microscope were observed in LPS group(P<0.001).
intratracheal instillation;Evans Blue;lipopolysaccharide
R 563.9
A
1000-1492(2016)08-1221-04
時間:2016-6-22 14:44:59
http://www.cnki.net/kcms/detail/34.1065.R.20160622.1444.070.html
2016-05-12 接收
安徽省學術技術帶頭人后備人選基金(編號:皖人社秘[2013]228號);安徽省衛生廳青年領軍人才項目(編號:皖衛計委[2015]145號);中央級公益性科研院所基本科研業務費項目(編號:DWS201510)
1安徽醫科大學第一附屬醫院老年呼吸內科,合肥 230022
2安徽醫科大學呼吸病研究所,合肥 230022
3中國醫學科學院醫學動物實驗研究所,北京 100021作者簡介:姜寶珍,女,碩士研究生;
張志紅,女,主任醫師,碩士生導師,責任作者,E-mail:zhangzhihope@126.com;
劉 星,女,主管技師,責任作者,主管技師,E-mail:xingliu1976@163.com

