Meigs綜合征合并左腎嫌色細胞癌1例病例報道
張雪,佟曉光,張金磊,張頤
(中國醫科大學附屬第一醫院婦科,沈陽 110001)
·短篇論著·
Meigs綜合征合并左腎嫌色細胞癌1例病例報道
Meigs Syndrome Combined with Left Chromophobe Renal Cell Carcinoma:Report of One Case
張雪,佟曉光,張金磊,張頤
(中國醫科大學附屬第一醫院婦科,沈陽 110001)
對我院收治的1例Meigs綜合征合并左腎嫌色細胞癌患者的臨床特點、診斷思路進行分析。
Meigs綜合征;腎嫌色細胞癌
Meigs綜合征是一種少見的婦科合并癥,有文獻報道,Meigs綜合征的高發年齡為50~60歲,在年輕女性中尤為罕見,30歲以下發病者不足10%[1,2]。確診Meigs綜合征需要滿足3個條件:(1)原發腫瘤為卵巢良性纖維瘤或纖維瘤樣腫瘤;(2)合并胸水及腹水;(3)腫瘤切除后胸腹水消失且不復發。因腫瘤組織病理檢查是確診該病的關鍵,故術前診斷較難,易誤診。腎嫌色細胞癌是起源于腎集合小管細胞的腫瘤,是腎細胞癌的一種少見類型,約占腎細胞癌的3.2%[3],無明顯年齡和性別差異。該腫瘤生長緩慢,侵襲性低。相對于其他亞型同期腎細胞癌,腎嫌色細胞癌的預后最好。Meigs綜合征合并腎嫌色細胞癌罕見,迄今為止國內外未見報道。我院于2014年10月10日收治1例Meigs綜合征合并左腎嫌色細胞癌的中年女性患者,現報道如下:
1 臨床資料
患者,女,48歲,因咳嗽1個月、呼吸困難20余天入院。患者1個月前著涼后出現咳嗽,無咳痰及咯血,無發熱,伴有流涕及咽痛,咳嗽時自覺胸部不適,無胸痛,自服咽炎片等藥物治療,咽痛好轉,但仍有咳嗽。20余天前開始出現勞動后呼吸困難,癥狀逐漸加重,稍有活動即感呼吸費力,于當地醫院行肺CT檢查,提示右側大量胸腔積液。為求進一步診治,入我院呼吸內科住院治療。
查體:右肺叩診實音,右肺下葉未聞及呼吸音,右肺上葉呼吸音較弱,左肺聽診呼吸音清,未聞及干濕啰音。左下腹及臍下可觸及實性包塊,境界不清,無壓痛。化驗血清腫瘤標志物:CA125為788.40 U/mL。入院當日床頭超聲檢查提示:右側胸腔可見無回聲區,深度約11.5 cm。泌尿系及盆腔超聲提示:盆腹腔可見液性暗區,最大深度約6.0 cm;左腎中下部可見高回聲,大小約7.1 cm×7.0 cm×8.0 cm,外突,輪廓清,周邊及內部可見彩色血流。盆腔內(子宮前上方)見團塊樣低回聲,范圍約13.2 cm× 9.5 cm×12.7 cm,邊界較清晰,深部回聲略衰減,未見明顯彩色血流。網膜及腹膜超聲高頻掃描未見明顯結節。全腹增強3D-CT提示:左腎可見團塊影,大小約為7.4 cm×6.7 cm,平掃CT值約為39 HU,增強后病灶可見強化,CT值約為67 HU,病灶邊界尚清,其內可見小片狀弱強化影,盆腔內可見巨大腫塊影,范圍約為12.7 cm×10.6 cm,平掃CT值約為50 HU,增強后CT值約為63 HU,其內密度不均勻,可見不規則片狀低密度影。腹膜后未見確切腫大淋巴結。腎臟MR平掃+增強提示:左腎占位性病變,腎癌不除外。PET-CT提示:(1)左腎實質軟組織腫塊影,代謝同周圍腎臟組織,高分化惡性病變不除外;(2)盆腔巨大軟組織腫塊影,內見密度減低影,代謝彌漫不均增高。初步診斷:右側胸腔積液性質待定;左腎占位;盆腔占位。
入院當日(2014年10月10日)即行胸腔閉式引流術放胸水以緩解癥狀,住院期間共放出胸水約16 350 mL,同時查胸水腫瘤標記物,CA125為433.90 U/mL,胸水中未見典型瘤細胞;胸水涂片查抗酸桿菌為陰性。全院會診后,遵泌尿外科醫囑于2014年10月29日行腎穿刺活檢,病理提示惡性瘤,免疫組化結果支持腎細胞癌(傾向嫌色細胞癌)。考慮患者胸腹水可能與盆腔包塊導致Meigs綜合征相關,故轉入我科先行手術治療。
我科于2014年11月11日在雙阻滯麻醉下行右側附件切除,左側卵巢冠囊腫核除術。術中見盆腹腔內游離淡黃色液體約1 000 mL,右側卵巢生發超新生兒頭大實性腫瘤,表面灰白色,質硬,包膜完整,可見子宮大小正常,光滑,左側卵巢大小正常,可見左側卵巢冠囊腫約鵝卵大,表面光滑。送術中病理提示為卵泡膜細胞瘤或纖維瘤,遂行右側附件切除術,手術過程順利。術后病理證實為卵泡膜細胞瘤(圖1)。術后第6天復查胸水超聲提示:右側胸腔游離液性暗區最大前后徑約3.10 cm,較術前(2014年11月10日)超聲提示的最大深度6.7 cm明顯減少。2014年12月3日于我院復查肺CT,未見胸腔積液。患者于2014年12月9日在我院泌尿外科行經腰左腎根治性切除術,術中見腫瘤位于左腎中下部,實性,大小約7 cm。病理標本切開后切面呈腐肉樣改變伴壞死,切除腎臟及大部分輸尿管、腎周脂肪組織及腎周筋膜。術后病理(圖2)提示:左腎嫌色細胞癌,腎組織、脂肪組織、輸尿管末端未見癌。術后3個月于門診復查肝膽脾泌尿系超聲、盆腔超聲及胸部CT,未見異常。隨訪至今,胸腹水未見復發。
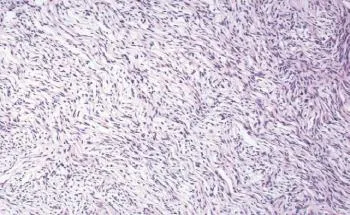
圖1 卵泡膜細胞瘤組織病理學圖片 ×100
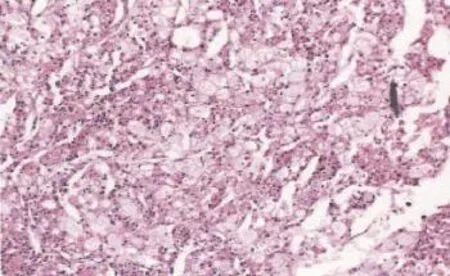
圖2 腎嫌色細胞癌組織病理學圖片 ×100
2 討論
Meigs綜合征由Meigs于1937年首次對其進行了正式的描述,后來發現其他盆腔良性病變也出現類似癥狀,故進一步將Meigs綜合征分為真、假兩性。真性Meigs綜合征主要包括卵巢纖維瘤、纖維上皮瘤、顆粒細胞瘤及卵泡膜細胞瘤等合并胸、腹水(多為漏出液,也有滲出液)癥狀;假性Meigs綜合征主要包括良性畸胎瘤、子宮平滑肌瘤、輸卵管乳頭狀瘤及盆腔血管瘤等合并胸腹水(多為滲出液)癥狀[4]。胸腹水產生的機制尚無統一認識,目前認為腫瘤本身是產生腹水的主要來源,而胸水是腹水通過橫膈淋巴管或橫膈上先天裂孔進入胸腔。Meigs綜合征的患者常因胸腹水就診于內科,易被誤診為結核、肝炎和胸腹腔惡性腫瘤等;部分患者自行捫及盆腔包塊就診。腫塊多在附件區,單側多見,腫物大小不一,表面光滑,球形或結節狀,質地堅硬,活動度較好。可伴有CA125升高,可作為診斷的參考。對于真性Meigs綜合征和假性Meigs綜合征的區分僅具有學術意義,但不涉及治療上的差異。Meigs綜合征屬良性病變,治療上應以手術治療為主,真性Meigs綜合征胸腹水在術后迅速消失。本例患者術后呼吸困難癥狀緩解,術中及術后病理均證實為卵泡膜細胞瘤,術后12 d復查肺CT胸腔積液消失,隨訪至今未見復發,符合Meigs綜合征的診斷。
腎嫌色細胞癌是由Thoenes等[5]在1985年首先提出的一類獨立的腎細胞癌亞型,是以染色體的普遍缺失為遺傳學的顯著特征,通常以1、2、6、10、13、17、21號染色體缺失為主[6]。腎嫌色細胞癌患者多無癥狀,絕大多數的患者是體檢時B超或CT發現。腰痛是最常見的臨床表現,具備典型的血尿、腰痛及腹部腫塊三聯癥的患者為極少數。目前B超是體檢時最常用的無創性檢查方法。術前可在超聲或CT定位下行腎臟穿刺活檢,以明確診斷。外科手術仍是腎嫌色細胞癌首選的治療方法。以2010年的AJCC癌癥分期為標準,腎嫌色細胞癌發現時多在Ⅰ或者Ⅱ期,對于局限性的腎腫瘤可采用根治性腎切除術或行保留腎單位手術。而對于預后不良、腫瘤為進展期的患者,術后需要嚴格的隨訪和輔助治療,如靶向治療[7]。腎嫌色細胞癌是一種預后相對較好的腎臟腫瘤,Cheville等[8]和Beck等[9]報道5年癌癥相關生存率和無病生存率分別為89%和80.1%。腎嫌色細胞癌總體上預后較好,但Zini等[10]發現仍有約5%的患者腫瘤侵犯下腔靜脈,6%~7%的患者發生遠處轉移,最常見的轉移部位是肝(39%)和肺(36%)。本例患者經腎穿刺活檢后病理示:惡性瘤,免疫組化結果支持腎細胞癌(傾向嫌色細胞癌)。行經腰左腎根治性切除術,術后病理提示左腎嫌色細胞癌,無轉移,診斷T1N0M0,為早期病變,預后較好,該患術后未行生物免疫治療。隨訪至今未見復發。
本例Meigs綜合征合并左腎嫌色細胞癌罕見,迄今為止國內外未見報道。兩者的確定診斷均需組織病理學檢查。本例患者行腎穿刺病理活檢后提示左腎嫌色細胞癌可能性大,該腫瘤預后好,轉移少見,患者胸水檢查未見典型瘤細胞,影像學檢查提示腫瘤基本位于腎周筋膜內,腎門未見明確腫大淋巴結,腎靜脈未見明顯瘤栓,且PET-CT未見其他部位轉移病灶,可基本排除左腎嫌色細胞癌轉移至胸膜的可能。本例患者盆腔包塊病史較長,超聲見腫塊大小約13.2 cm×9.5 cm×12.7 cm,邊界較清晰,深部回聲略衰減,未見明顯彩色血流,網膜及腹膜未見明顯結節。全腹增強3D-CT平掃CT值約為50 HU,增強后CT值約為63 HU,強化不明顯,臨床及影像學改變均不符合卵巢惡性腫瘤。雖然CA125升高達788.40 U/mL,但其對于卵巢惡性腫瘤診斷的特異性有限。對于因不明原因胸腹水就診的中年女性,經抗感染及對癥治療后病情無明顯變化者,應積極行盆腔影像學檢查,避免Meigs綜合征的漏診及誤診。腎嫌色細胞癌臨床癥狀多不典型,在完善影像學檢查的基礎上應積極行腎穿刺活檢術,以提高疾病的診斷率。
[1]Riker D,Goba D.Ovarian mass,pleural effusion,and ascites:revisiting Meigs syndrome[J].J Bronchol Intery Pulmonol,2013,20(1):48-51.
[2]Mui MP,Tam KF,Tam FK,et al.Coexistence of struma ovarii with marked ascites and elevated CA125 levels:case report and literature review[J].Arch Gynecol Obstet,2009,279(5):753-757.
[3]Cheville JC,Lohse CM,Sukov WR,et al.Chromophobe renal cell carcinoma:the impact of tumor grade on outcome[J].Am J Surg Pathol,2012,36(6):851-856.
[4]Nadia P,Piero C.Ovarian malignancies with cytologically negative pleural and peritoneal effusions:Demons’or Meigs’pseudo-syndromes?[J].Int J Surg Pathol,2009,17(5):396-397.
[5]Thoenes W,St?rkel S,Rumpelt HJ.Human chromophobe cell renal carcinoma[J].Virchows Arch B Cell Pathol Incl Mol Pathol,1985,48(3):207-217.
[6]Mazal PR,Exner M,Haitel A,et al.Expression of kidney-specific cadherin distinguishes chromophobe renal cell carcinoma from renal oncocytoma[J].Hum Pathol,2005,36(1):22-28.
[7]Volpe A,Novara G,Antonelli A,et al.Chromophobe renal cell carcinoma(RCC):oncological outcomes and prognostic factors in a large multicentre series[J].BJU Int,2012,110(1):76-83.
[8]Cheville JC,Lohse CM,Sukov WR,et al.Chromophobe renal cell carcinoma:the impact of tumor grade on outcome[J].Am J Surg Pathol,2012,36(6):851-856.
[9]Beck SD,Patel MI,Snyder ME,et al.Effect of papillary and chromophobe cell type on disease-free survival after nephrectomy for renal cell carcinoma[J].Ann Surg Oncol,2004,11(1):71-77.
[10]Zini L,Leroy X,Lemaitre L,et al.Tumour necrosis in chromophobe renal cell carcinoma:clinical data to distinguish aggressive variants[J].Eur J Surg Oncol,2008,34(6):687-691.
(編輯 陳 姜)
R737.31
A
0258-4646(2016)02-0177-03
10.12007/j.issn.0258-4646.2016.02.021
遼寧省自然科學基金(2014021021)
張雪(1990-),女,碩士研究生.
張頤,E-mail:syzi@163.com
2015-05-19
網絡出版時間:

