CaMKIIδ在破骨細胞分化不同階段表達規律的研究*
陸大壯, 劉娟娟, 戚孟春△, 溫黎明, 李 任, 孫 紅
(華北理工大學 1口腔醫學院口腔頜面外科教研室, 2基礎醫學院病理教研室, 河北 唐山 063000)
?
CaMKIIδ在破骨細胞分化不同階段表達規律的研究*
陸大壯1, 劉娟娟1, 戚孟春1△, 溫黎明1, 李 任1, 孫 紅2
(華北理工大學1口腔醫學院口腔頜面外科教研室,2基礎醫學院病理教研室, 河北 唐山 063000)
目的: 研究鈣離子/鈣調蛋白依賴性蛋白激酶II(CaMKII)δ在破骨細胞分化不同階段的表達規律,以揭示其在破骨細胞分化中的作用。方法: 應用50 μg/L核因子κB受體激活因子配體(RANKL)誘導小鼠RAW264.7細胞向破骨細胞分化;通過抗酒石酸酸性磷酸酶(TRAP)染色及骨磨片吸收陷窩檢測評價破骨細胞生成情況;同時于誘導第0、1、3、5 天末通過免疫熒光細胞化學、RT-qPCR和Western blot法檢測CaMKIIδ的mRNA及蛋白表達水平。結果: TRAP染色及骨吸收陷窩檢測顯示于誘導第5 天有多核破骨細胞生成。第0、1、3、5天 CaMKIIδ的mRNA表達水平分別為 1.028±0.041、2.478±0.087、10.524±1.284和42.914±2.667,蛋白相對水平分別為0.762、0.963、1.802和3.136,免疫熒光細胞化學檢測顯示CaMKIIδ的熒光6強度呈時間依賴性遞增。結論: CaMKIIδ的表達隨破骨細胞分化逐步增高,提示CaMKIIδ在破骨細胞分化中可能起著關鍵調控作用。
鈣離子/鈣調蛋白依賴性蛋白激酶IIδ; 破骨細胞; 核因子κB受體激活因子配體; 抗酒石酸酸性磷酸酶
破骨細胞(osteoclast,OC)是體內唯一具有骨吸收功能的細胞,在骨質疏松、Paget’s 病、多發性骨髓瘤、原發性/轉移性骨腫瘤、牙周炎、風濕性關節炎等許多骨過度吸收性疾病中發揮重要作用[1-3]。對上述疾病治療的一個重要策略是抑制破骨細胞介導的骨吸收;因而破骨細胞分化調控的研究顯得尤為重要。已知鈣離子/鈣調蛋白(Ca2+/calmodulin)信號通路對破骨細胞分化至關重要;而鈣離子/鈣調蛋白依賴性蛋白激酶II (Ca2+/calmodulin-dependent protein kinase II,CaMKII)是其中的關鍵信號分子[ 4-6]。CaMKII有α、β、γ和δ 四個異構體[7]。國外學者及我們前期對研究均顯示,異構體δ對破骨細胞分化的調控作用可能最為關鍵[8-9 ],但其在破骨細胞分化中的表達規律及可能的信號調節機制目前尚不清楚。本實驗通過檢測CaMKIIδ在破骨細胞分化不同階段mRNA及蛋白的表達水平,以揭示其表達規律,為后期破骨細胞分化信號調控的研究提供實驗依據。
材 料 和 方 法
1 實驗材料
核因子κB受體激活因子配體(receptor activator of nuclear factor kappa B ligand, RANKL)購自Biovision;小鼠RAW264.7細胞株(北京軍事醫學科學院);α-MEM培養基、甲苯胺藍和胎牛血清(中國四季青公司);兔抗鼠CaMKIIδ多克隆抗體(Santa Cruz);抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase, TRAP)染色試劑盒和碘化丙啶(propi-dium iodide,PI)購自Sigma;PCR引物(Invitrogen)。激光聚焦顯微鏡(Olympus);PCR擴增儀(PERKIN ELMER)。
2 實驗方法
2.1 破骨細胞的培養 RAW264.7細胞傳代后在含有1×105U/L 青霉素、100 mg/L 鏈霉素和10%胎牛血清的完全培養基中37 ℃、5% CO2條件下培養,每2 d換液。用終濃度為50 μg/L的RANKL進行誘導,促使細胞向破骨細胞分化;并于誘導前(第0 天)及誘導第1、3、5 天末收獲細胞,進行相關檢測。
2.2 TRAP染色檢測破骨細胞的生成 將RAW264.7細胞按5×103/cm2接種于蓋玻片上,制備細胞爬片。待細胞貼壁24 h后用RANKL誘導,于第5 天末收獲細胞,2.5%多聚甲醛固定,按試劑盒說明進行染色。
2.3 骨吸收陷窩檢測破骨細胞的功能 用新鮮離體制備牙本質磨片,直徑約5 mm,厚度0.4 mm,共10片,高溫高壓滅菌;細胞接種密度為1×107/L。細胞收獲后進行掃描電鏡觀察,500倍下每個磨片上選取6個視野,測量吸收陷窩總數目及總面積,取平均值,作為該磨片的吸收陷窩數目及面積;每組檢測5個牙本質磨片。
2.4 免疫熒光化學檢測CaMKIIδ的表達 同方法2.2在蓋玻片上接種細胞爬片。實驗結束后用2.5%多聚甲醛固定,兔抗鼠CaMKIIδ多克隆抗體4 ℃孵育過夜;II 抗為異硫氰酸熒光素(fluorescein isothiocyanate,FITC)標記的羊抗兔IgG,37 ℃雜交2 h, PI復染細胞核,封片;激光共聚焦顯微鏡觀察。
2.5 RT-qPCR 檢測CaMKIIδ的mRNA表達 TRI-zol提取細胞總RNA,逆轉錄合成cDNA;在Rotor-Gene 3000熒光定量PCR儀上進行變性、退火、延伸,引物見表1。反應條件為95 ℃ 30 s;95 ℃ 15 s,55 ℃ 20 s,72 ℃ 20 s,40個循環。分析軟件Rotor-Gene處理后得到數據,計算目的基因mRNA相對表達量,每組設3個復孔,實驗重復3次。

表1 RT-qPCR引物序列
F: forward; R: reverse.
2.6 Western blot法檢測CaMKIIδ蛋白的表達 提取細胞總蛋白,測定蛋白濃度。加入5×上樣緩沖液,煮沸變性,凝膠電泳并轉膜,5% BSA室溫封閉5 h,兔抗鼠 I 抗4 ℃孵育過夜; II 抗37 ℃孵育2 h,TBST洗3次,ECL顯色儀上顯色1 min。用ImageJ分析軟件檢測膜上每個條帶的灰度值;每組設3個復孔,實驗重復3次。
3 統計學處理
應用SPSS 17.0軟件進行數據分析,結果以均數±標準差(mean±SD)表示。多組間比較用單因素方差分析,各組均數間的兩兩比較采用SNK-q檢驗,以P<0.05為差異有統計學意義。
結 果
1 TRAP染色及骨磨片吸收陷窩檢測
細胞經TRAP染色,可見有許多體積較大的多核(≥3個)破骨細胞形成。掃描電鏡觀察顯示,可見在牙本質磨片上形成不同程度的吸收陷窩,邊界清晰,呈圓形、橢圓形及不規則形,見圖1。上述結果顯示,RAW264.7細胞在RANKL誘導下形成了有骨吸收功能的多核破骨細胞。
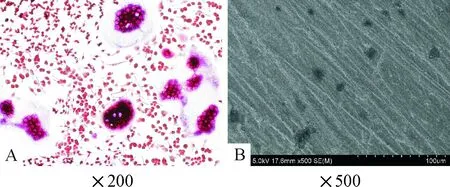
Figure 1. Detection of osteoclast formation by TRAP staining under light microscope (A), and dentin resorption lacunae by scanning electronic microscopy (B).
圖1 TRAP染色檢測破骨細胞生成及掃描電鏡檢測骨吸收陷窩
2 免疫熒光細胞化學檢測
在誘導第0、1 天,細胞為單個核細胞,尚無多核破骨細胞形成,CaMKIIδ呈弱陽性表達,熒光較弱;誘導第3、5 天,可觀察到多核破骨細胞形成,且細胞數目及體積逐漸增加;CaMKIIδ在第5 天的熒光強度明顯強于第3 天,見圖2。定量分析表明,CaMKIIδ熒光強度在第0、1、3、5 天分別為4.475±0.274、7.031±0.217、36.750±0.246和51.000±0.255,見圖3。該結果提示,CaMKIIδ蛋白的表達量隨破骨細胞分化持續增高。
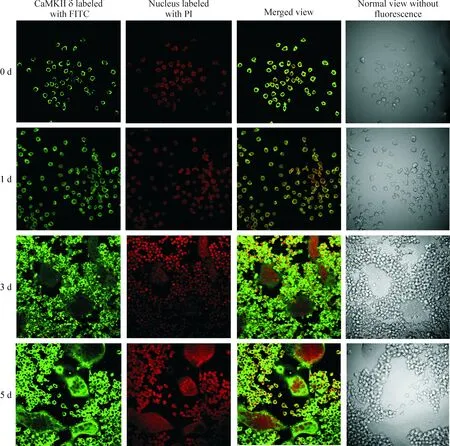
Figure 2. Detection of CaMKIIδ expression during osteoclast differentiation by immunofluorescence cytochemistry (×200).
圖2 免疫熒光細胞化學檢測CaMKIIδ在破骨細胞分化中的表達
3 RT-qPCR 檢測CaMKIIδ的mRNA水平
以第0 天 CaMKIIδ的mRNA相對表達量為參照,第1、3、5 天的mRNA相對表達量呈時間依賴性增高,見圖4。
4 Western blot法檢測CaMKIIδ的蛋白水平
CaMKIIδ蛋白水平在破骨細胞分化中隨時間亦呈遞增趨勢;其蛋白表達相對水平(與β-actin的比值)在第0、1、3、5 天分別為0.762、0.963、1.802和3.136,見圖5。
討 論
破骨細胞是多核巨細胞,來源于單核/巨噬細胞系前體細胞并通過單核前體細胞融合成多核巨細胞而成熟。骨組織正常的代謝基于破骨細胞與成骨細胞的動態平衡[4],一旦這種平衡被打破,將導致骨質疏松、轉移性骨腫瘤、Paget’s病、類風濕性關節炎以及其它骨代謝疾病的發生。研究表明,在RANKL誘導的破骨細胞分化中,NFATc1信號通路對破骨細胞分化及骨吸收功能發揮著極其重要的調控作用[3-5, 10]。
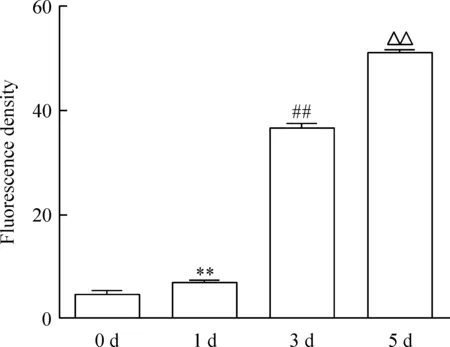
Figure 3. Quantitative analysis of CaMKIIδ expression during osteoclastogenesis by immunofluorescence cytochemistry. Mean±SD.n=3.**P<0.01vs0 d;##P<0.01vs1 d;△△P<0.01vs3 d.
圖3 CaMKIIδ在破骨細胞分化中蛋白表達的免疫熒光細胞化學定量分析
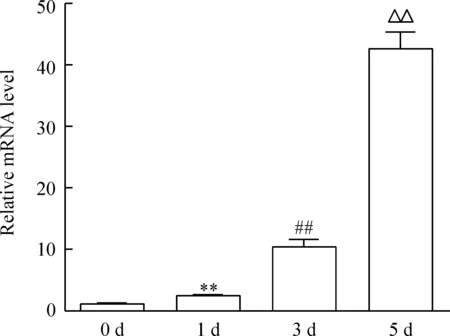
Figure 4. Quantitative analysis of the mRNA level of CaMKIIδ at different time points by RT-qPCR. Mean±SD.n=3.**P<0.01vs0 d;##P<0.01vs1 d;△△P<0.01vs3 d.
圖4 RT-qPCR定量分析各時點CaMKIIδ的mRNA表達水平
研究發現,在Ca2+信號傳遞中,CaMKII與Ca2+/calmodulin 結合后,獲得2個特性[5]:(1)對calmodulin 的親和力提高1 000 倍,發生calmodulin 分子捕獲;(2) 在calmodulin 解離后,仍保持部分酶活性,在較長時間內調節細胞功能,擁有分子記憶功能。因而,CaMKII對Ca2+信號傳遞及破骨細胞分化的調控可能極為關鍵。本課題前期研究發現,Ca2+/calmodulin/NFATc1 是雙膦酸鹽抑制破骨細胞分化的重要信號通路;唑來膦酸可以時間依賴性抑制破骨細胞內Ca2+振蕩,并下調CaMKII mRNA表達及蛋白活性[11]。
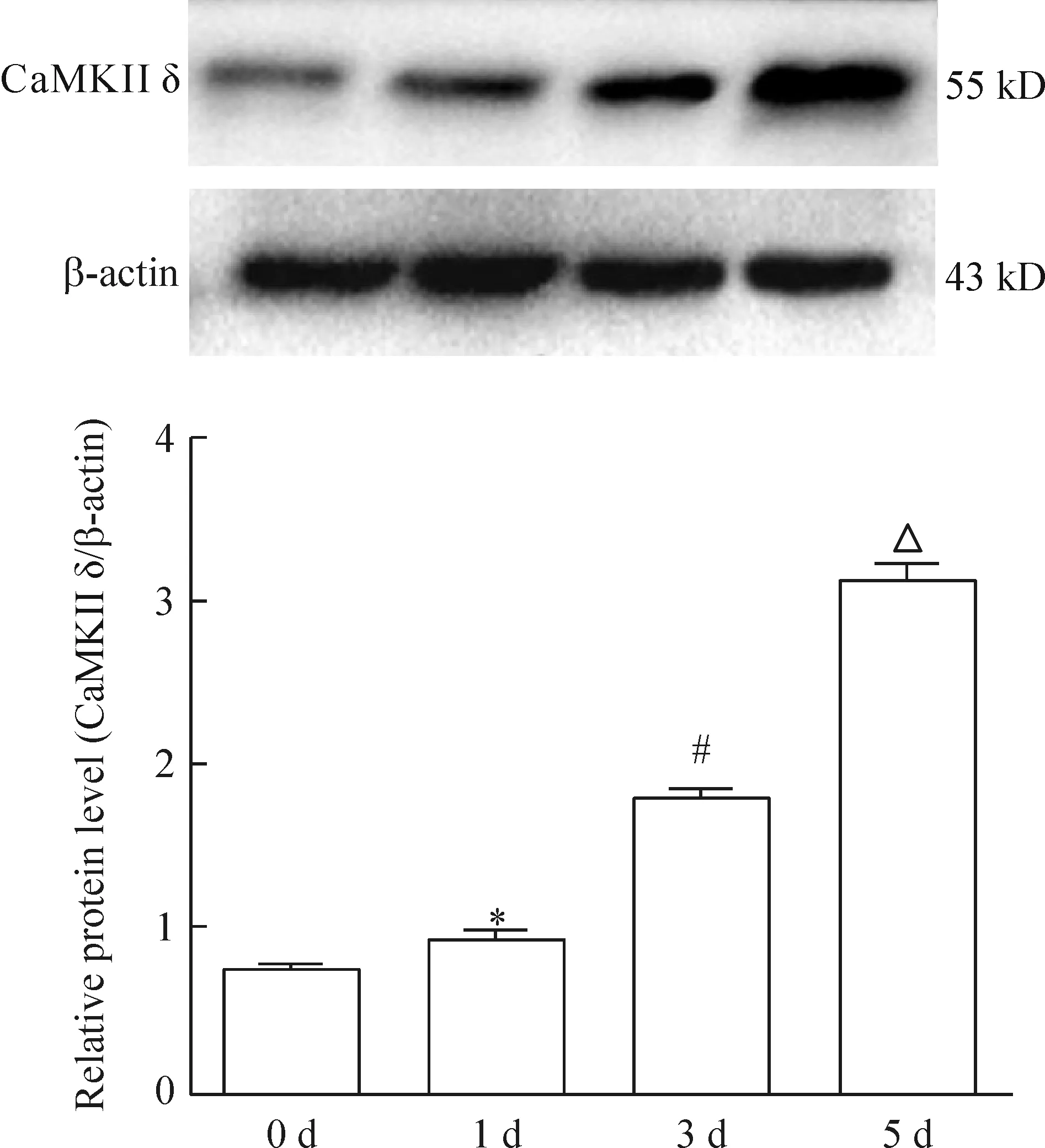
Figure 5. Detection of CaMKIIδ protein levels at different time points by Western blot. Mean±SD.n=3.*P<0.05vs0 d;#P<0.05vs1 d;△P<0.05vs3 d.
圖5 Western blot法檢測CaMKIIδ蛋白的表達
CaMKII有α、β、γ和δ 四個異構體[7], 其在大腦組織中大量表達并發揮重要功能[12-14];而CaMKIIγ和δ也廣泛存在于非神經的外圍組織中[15]。4個異構體在破骨細胞分化中的表達水平及作用目前還知之甚少。相關研究發現,在破骨細胞分化第0~3 天,CaMKIIβ的mRNA表達較弱,但蛋白無表達;CaMKIIα則幾乎不表達,CaMKIIδ、γ均有表達;在多核化階段(分化第2~3 天),CaMKIIα、β基本不表達;γ雖然表達,但mRNA及蛋白水平均較低且隨破骨細胞分化成熟而下降;CaMKIIδ的mRNA 及蛋白表達水平最高,并隨破骨細胞分化呈遞增趨勢[6]。Chang等[8]研究則表明,在破骨細胞分化初期,CaMKIIδ表達上升,其特異性siRNA可顯著抑制破骨細胞生成,提示CaMKIIδ在破骨細胞分化中發揮重要作用。Yao等[9]研究也表明,在CaMKII的4個異構體中,只有CaMKIIδ在破骨細胞分化中呈高水平表達,且mRNA的變化和蛋白相一致,因而認為CaMKIIδ在破骨細胞分化中可能起著關鍵調控作用。而Ang等[16]研究結果顯示在RAW264.7細胞和小鼠骨髓單核細胞均沒有檢測到CaMKIIδ的mRNA。
雖然國內外學者對 CaMKIIδ 在破骨細胞分化中的作用開展了研究,但大多數只局限到破骨細胞分化的某些階段,因而研究結論或是比較局限,或是相互矛盾[6, 8-9]。而這些問題的解決將更好地弄清楚CaMKIIδ在破骨細胞分化中的調控機制以及有助于發現對骨過度吸收性疾病治療的有效方法。
由于骨髓單核細胞(bone marrow monocyte,BMM)向破骨細胞分化,大致經歷前破骨細胞、單核破骨細胞、多核破骨細胞、成熟破骨細胞4個階段,分別對應RANKL誘導的第0、1、2~3和5天,因此本實驗的觀察時點設為0 d、1 d、3 d和5 d。RT-qPCR的檢測結果表明,CaMKIIδ的mRNA在破骨細胞形成不同階段均有表達,且呈持續性高表達;Western blot的檢測結果也表明,CaMKIIδ蛋白水平隨時間呈遞增趨勢,統計學分析各組間差異均有統計學顯著性。免疫熒光細胞化學檢測也表明,CaMKIIδ熒光強度隨破骨細胞分化逐漸增強,到第5天達到最高水平。因此推斷CaMKIIδ可能在破骨細胞分化及相關信號調控中發揮著重要作用。開展進一步研究,以揭示CaMKIIδ對破骨細胞分化調控的分子機制,將有助于對破骨細胞介導的骨過度吸收性疾病發病機制的了解。
[1] Cho YA, Jue SS, Bae WJ, et al. PIN1 inhibition suppresses osteoclast differentiation and inflammatory responses[J]. J Dent Res, 2015, 94(2):371-380.
[2] Colombo M, Thümmler K, Mirandola L, et al. Notch signaling drives multiple myeloma induced osteoclastogenesis[J]. Oncotarget, 2014, 5(21):10393-10406.
[3] Yavropoulou MP, Yovos JG. Osteoclastogenesis: current knowledge and future perspectives[J]. J Musculoskelet Neuronal Interact, 2008, 8(3):204-216.
[4] Negishi-Koga T, Takayanagi H. Ca2+-NFATc1 signaling is an essential axis of osteoclast differentiation[J]. Immunol Rev, 2009, 231(1):241-256.
[5] Zhang L, McKenna MA, Said-Al-Naief N, et al. Osteoclastogenesis: the role of calcium and calmodulin[J]. Crit Rev Eukaryot Gene Expr, 2005, 15(1):1-13.
[6] Sato K, Suematsu A, Nakashima T, et al. Regulation of osteoclast differentiation and function by the CaMK-CREB pathway[J]. Nat Med, 2006, 12(12):1410-1416.
[7] Colbran RJ. Targeting of calcium/calmodulin-dependent protein kinase II[J]. Biochem J, 2004, 378(Pt 1):1-16.
[8] Chang EJ, Ha J, Huang H, et al. The JNK-dependent CaMK pathway restrains the reversion of committed cells during osteoclast differentiation[J]. J Cell Sci, 2008, 121(Pt 15):2555-2564.
[9] Yao CH, Zhang P, Zhang L. Differential protein and mRNA expression of CaMKs during osteoclastogenesis and its functional implications[J]. Biochem Cell Biol, 2012, 90(4):532-539.
[10]Seales EC, Micoli KJ, McDonald JM. Calmodulin is a critical regulator of osteoclastic differentiatio, function and survival[J]. J Cell Biochem, 2006, 97(1):45-55.
[11]李 鵬, 林玨杉, 張 鵬, 等. 唑來膦酸對破骨細胞分化中鈣調蛋白和鈣調蛋白依賴性激酶Ⅱ基因表達的影響[J]. 中華口腔醫學雜志, 2013, 48(11):694-698.
[12]Erondu NE, Kennedy MB. Regional distribution of type II Ca2+/calmodulin-dependent protein kinase in rat brain[J]. J Neurosci, 1985, 5(12):3270-3277.
[13]Hudmon A, Schulman H. Ca2+/calmodulin-dependent protein kinase II: the role of structure and autoregulation in cellular function[J]. Annu Rev Biochem, 2002, 71:473-510.
[14]Hudmon A, Schulman H. Structure-function of the multifunctional Ca2+/calmodulin-dependent protein kinase II[J]. Biochem J, 2002, 364(Pt 3):593-611.
[15]Caran N, Johnson LD, Jenkins KJ, et al. Cytosolic targeting domains of gamma and delta calmodulin-dependent protein kinase II[J]. J Biol Chem, 2001, 276(45):42514-42519.
[16]Ang ES, Zhang P, Steer JH, et al. Calcium/calmodulin-dependent kinase activity is required for efficient induction of osteoclast differentiation and bone resorption by receptor activator of nuclear factor kappa B ligand (RANKL)[J]. J Cell Physiol, 2007, 212(3):787-795.
(責任編輯: 陳妙玲, 羅 森)
Expression profiles of CaMKIIδ at different stages of osteoclast differentiationLU Da-zhuang1, LIU Juan-juan1, QI Meng-chun1, WEN Li-ming1, LI Ren1, SUN Hong2
AIM: To study the expression profiles and the role of Ca2+/calmodulin-dependent kinase II delta (CaMKIIδ) during osteoclast differentiation. METHODS: Mouse RAW264.7 cells were induced by receptor activator of nuclear factor κB ligand (RANKL) at 50 μg/L for osteoclastogenesis. Tartrate-resistant acid phosphatase (TRAP) staining and bone resorption lacunae examination were performed to verify osteoclast formation. The expression of CaMKIIδ at mRNA and protein levels was also determined by immunofluorescent cytochemistry, RT-qPCR and Western blot at days 0, 1, 3 and 5. RESULTS: TRAP positive multinuclear cells with bone resorption function were formed after 5 d of induction. The mRNA levels of CaMKIIδ detected by RT-qPCR were 1.028±0.041, 2.478±0.087, 10.524±1.284 and 42.914±2.667 at days 0, 1, 3 and 5, respectively, while the protein levels of CaMKIIδ detected by Western blot were 0.762, 0.963, 1.802 and 3.136, respectively. The changes of protein level were also verified by immunofluorescence cytochemistry, in which the fluorescence intensity increased in a time-dependent manner (P<0.05). CONCLUSION: The expression of CaMKIIδ increases with the differentiation of osteoclasts. CaMKIIδ may play a key role in the osteoclastogenesis.
Ca2+/calmodulin-dependent protein kinase II delta; Osteoclasts; Receptor activator of nuclear factor κB ligand; Tartrate-resistant acid phosphatase
1000- 4718(2016)10- 1870- 05
2016- 04- 06
2016- 09- 09
國家自然科學基金資助項目(No. 81270965)
△通訊作者 Tel: 0315-3721508; E-mail: qimengchun@163.com
R363
A
10.3969/j.issn.1000- 4718.2016.10.021
雜志網址: http://www.cjpp.net
(1DepartmentofOralandMaxillofacialSurgery,SchoolofStomatology,2DepartmentofPathology,CollegeofBasicMedicine,NorthChinaUniversityofScienceandTechnology,Tangshan063000,China.E-mail:qimengchun@163.com)

