海水養殖魚類病毒性神經壞死病防控技術研究進展
黃 文,陳 償,趙 哲,李璐璐,羅 鵬,王艷紅,任春華,胡超群*,方 哲,王冬梅,詹鐘仁
(1.中國科學院南海海洋研究所熱帶海洋生物資源與生態重點實驗室,廣東省應用海洋生物學重點實驗室,廣東 廣州510301;2.南海資源開發與保護協同創新中心,廣東 珠海 519082;3.利津縣海洋與漁業局,山東 東營 257400;4.中國熱帶農業科學院熱帶生物技術研究所,海南 海口 571101;5.三亞福聯水產發展有限公司,海南 三亞 572026)
?
海水養殖魚類病毒性神經壞死病防控技術研究進展
黃 文1,2,陳 償1,2,趙 哲1,2,李璐璐3,羅 鵬1,2,王艷紅1,2,任春華1,2,胡超群1,2*,方 哲4,王冬梅4,詹鐘仁5
(1.中國科學院南海海洋研究所熱帶海洋生物資源與生態重點實驗室,廣東省應用海洋生物學重點實驗室,廣東 廣州510301;2.南海資源開發與保護協同創新中心,廣東 珠海 519082;3.利津縣海洋與漁業局,山東 東營 257400;4.中國熱帶農業科學院熱帶生物技術研究所,海南 海口 571101;5.三亞福聯水產發展有限公司,海南 三亞 572026)
神經壞死病毒(Nervous necrosis virus,NNV)是一種能導致海水魚腦、中樞神經及視網膜等神經系統壞死的病毒,該病毒引發的魚類病毒性神經壞死病主要發生在稚魚和幼魚期,較強的致病力及高致死率給海水魚養殖業帶來了沉重的打擊,成為海水魚類養殖產業可持續發展最重要的限制因素之一。文章主要綜述了NNV的基本特征、診斷技術、病毒傳播、疫苗免疫學等研究進展,介紹了NNV的防控技術及策略,為海水養殖魚類NNV的防控工作提供參考。
海水魚類;病毒性神經壞死病;綜述;乙型野田村病毒;病害防控
神經壞死病毒(Nervous necrosis virus,NNV)隸屬于乙型野田村病毒屬(又稱β諾達病毒屬,Betanodavirus)[1-2],能導致海水魚腦、神經及視網膜組織壞死,因此,由該病毒感染而引發的疾病又被稱為病毒性神經壞死病(Virial nervous necrosis,VNN)或病毒性腦及視網膜病(Viral encephalopathy and retinopathy,VER)。
有關NNV的報道最早見于1990年,日本科學家Yoshikoshi和Inoue在大量死亡的條石鯛(Oplegnathusfasciatus)幼苗中發現患病魚神經元及神經膠質細胞質中有大量不具外套膜、直徑約為34 nm且具有二十面體結構的病毒顆粒,并將該病稱為神經壞死病(Nervous necrosis)[3];同年,澳大利亞科學家Glazebrook等在大批量死亡的尖吻鱸(Latescalcarifer)幼苗中也發現了類似的病毒顆粒[4]。NNV具有較強的傳染性,且患病死亡率接近100%[1-2],到目前為止,已在多種石斑魚(Epinephelusakaara、Epinephelusseptemfasciatus、Epinephelusfuscogutatus)[5-7]、歐洲海鱸(Lateolabraxjaponicus)[8]、大菱鲆(Scophthalmusmaximus)[9]、黃帶擬鲹(Pseudocaranxdentex)[10]等40多種海水魚類的報道中出現過該病毒感染[11],給海水魚養殖產業造成了較大的經濟損失。
本文主要綜述了NNV的基本特征、診斷技術、病毒傳播、疫苗免疫學等的研究進展,并介紹了NNV的防控技術及策略,為海水養殖魚類NNV的防控工作提供參考。
1 病毒的基本特征
NNV由外殼和基因組兩部分組成,病毒大小約為25~30 nm,不具外套膜;病毒外殼由180個蛋白亞單位組成,病毒基因組大小約4.5 kb,主要由RNA1和RNA2兩條正義單鏈RNA組成;RNA1(3.1 kb)負責編碼復制酶(110 kDa),RNA2(1.4 kb)則負責編碼外殼蛋白(42 kDa)[11]。其中,RNA2編碼的外殼蛋白具有物種識別的功能。通過浸泡感染回接實驗發現,一定來源的NNV只感染相似種類的幼苗并出現感染死亡的現象[12];Iwamoto等利用重組不同種類RNA1和RNA2病毒的方法也證明了RNA2負責識別宿主[13]。
根據病毒RNA2序列的同源性,可將魚類NNV歸為4種血清型,分別為:紅鰭東方鲀(Takifugurubripes)神經壞死病病毒(Tiger puffer nervous necrosis virus,TPNNV)、黃帶擬鲹(Pseudocaranxdentex)神經壞死病病毒(Striped jack nervous necrosis virus,SJNNV)、條斑星鰈(Veraspermoseri)神經壞死病病毒(Barfin flounder nervous necrosis virus,BFNNV)和赤點石斑魚神經壞死病病毒(Redspotted grouper nervous necrosis virus,RGNNV)[11,14-15]。
NNV對外界環境具有很強的耐受性。Arimoto等研究發現,在0.05 mg/L的次氯酸鈉、次氯酸鈣、苯扎氯銨或者碘的作用下才能將SJNNV完全滅活,需要10 mL/L以上濃度的甲酚才能滅活SJNNV,而乙醇和甲醇以及氯仿、高堿度等對SJNNV不起作用[16]。Frerichs等在不同pH、溫度的培養液中評估NNV的活力,發現SBNNV(Sea bass nervous necrosis virus)在5%胎牛血清中15℃條件下保存1年以上仍然具有感染力,在pH 2~11的蒸餾水中可以耐受24 h以上而不會影響病毒活力[17]。NNV較強的耐受性可能是該病毒在海水魚類中廣為傳播的原因。
2 診斷技術
病毒性神經壞死病的病癥表現為體色黑化、趴底側躺、不進食、游泳異常等特征(圖1),感染NNV后,利用光學和電子顯微鏡,在腦和視網膜組織中會出現典型的空泡化病變,并可在腦和視網膜組織中觀察到病毒顆粒(圖2)[18-19]。精確的診斷方法有細胞培養、ELISA、免疫熒光和PCR技術等[20-21]。
利用病毒敏感的細胞系或細胞株進行體外培養是鑒定、分離及確診病原的重要方法。病毒感染細胞后,通過電鏡切片可以觀察到與病變組織相同的病毒顆粒,利用培養的病毒細胞對個體進行回接感染后會出現相同的病癥。如Gomez等利用E-11細胞系分離出了餌料雜魚中的NNV,并對健康的七帶石斑魚(E.septemfasciatus)進行回接感染,2周后,發現健康個體的腦及神經中出現了同樣的病毒顆粒,并造成90%~100%的死亡率,從而確認了餌料雜魚中的病毒是潛在的感染源[22]。
酶聯免疫吸附測定(Enzyme linked immunosorbent assay,ELISA)及免疫熒光技術都是利用抗原抗體結合專一性進行免疫反應的檢測方法,具有靈敏度高、特異性強的優點[1-2]。ELISA及免疫熒光技術作為經典的免疫檢測方法,已經被應用于NNV檢測及防控研究。利用ELISA檢測的報道,如:Breuil等利用ELISA技術有效地檢測出海鱸親魚中是否含有諾達病毒,從而篩選出具有陰性檢測結果的親魚進行繁殖[20];Watanabe等通過ELISA方法檢測條斑星鰈親魚,結果發現當ELISA抗體檢測滴度小于40時,該方法能夠成功篩選出不帶病毒的親魚,篩選出來的親魚繁殖后,其子代不易發生病毒性神經壞死病[21]。利用免疫熒光技術檢測的報道,如Iwamoto等利用免疫熒光技術檢測宿主細胞中重組的NNV與正常的病毒,證明了重組的NNV同樣具備侵染宿主細胞的能力[13]。
PCR檢測技術是針對病毒基因組進行擴增檢測的方法。最早應用PCR技術檢測病毒性神經壞死病的魚類是黃帶擬鰺,Nishizawa等利用設計的引物確認得到的序列是SJNNV的RNA2 cDNA序列[23]。隨著技術的發展,已經發展出RT-PCR、RT-qPCR、RT-nest PCR等多種PCR檢測方法。陳信忠等利用RT-PCR成功地在5種養殖石斑魚中擴增出421 bp的NNV RNA2條帶[24];Mu等檢測到25%~40%的正常斜帶石斑仔魚中攜帶了NNV[25];Kuo等通過RT-qPCR的方法檢測到了魚鰭中攜帶了NNV,推測諾達病毒可能通過魚鰭互相接觸的方式進行水平傳播[26]。巢式PCR(Nested PCR)能夠顯著提高檢測靈敏度和準確度,其靈敏度比普通PCR高10~100倍,比細胞培養高1萬倍左右[27],Gomez等發現普通PCR能檢測出30個陽性樣品,而巢式PCR能檢測出116個陽性樣品,巢式PCR技術的靈敏度優勢顯而易見[28]。較高的靈敏度能夠提前發現病毒,如Thiery等發現巢式PCR技術能夠檢測發病前1個月的幼苗中是否攜帶病毒[29]。環介導等溫擴增技術(Loop-mediated isothermal amplification,LAMP)是一種先進的核酸擴增方法,具有簡單、快速、特異性強的特點,通過恒溫1~2 h孵育便可完成PCR反應,Xu等在赤點石斑魚的研究中,發現LAMP的檢測靈敏度比巢式PCR高100倍左右[30]。在LAMP中添加熒光染料,能夠將檢測結果可視化(圖3),在養殖現場進行病害監測方面具有較大的技術優勢。
綜上可知,PCR技術耗時短、技術難度低,是最簡便、快速、有效的檢測方法,特別是LAMP檢測方法,能夠在1~2 h內完成擴增反應且無需特殊設備,目前已被廣泛地應用于病毒現場檢疫領域。細胞培養、ELISA、免疫熒光等檢測方法由于技術難度大、耗時長,不適宜養殖現場檢測,然而卻是細胞學、免疫學等研究不可或缺的技術方法。

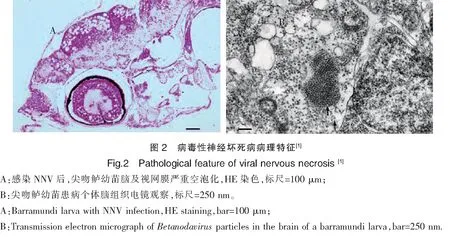
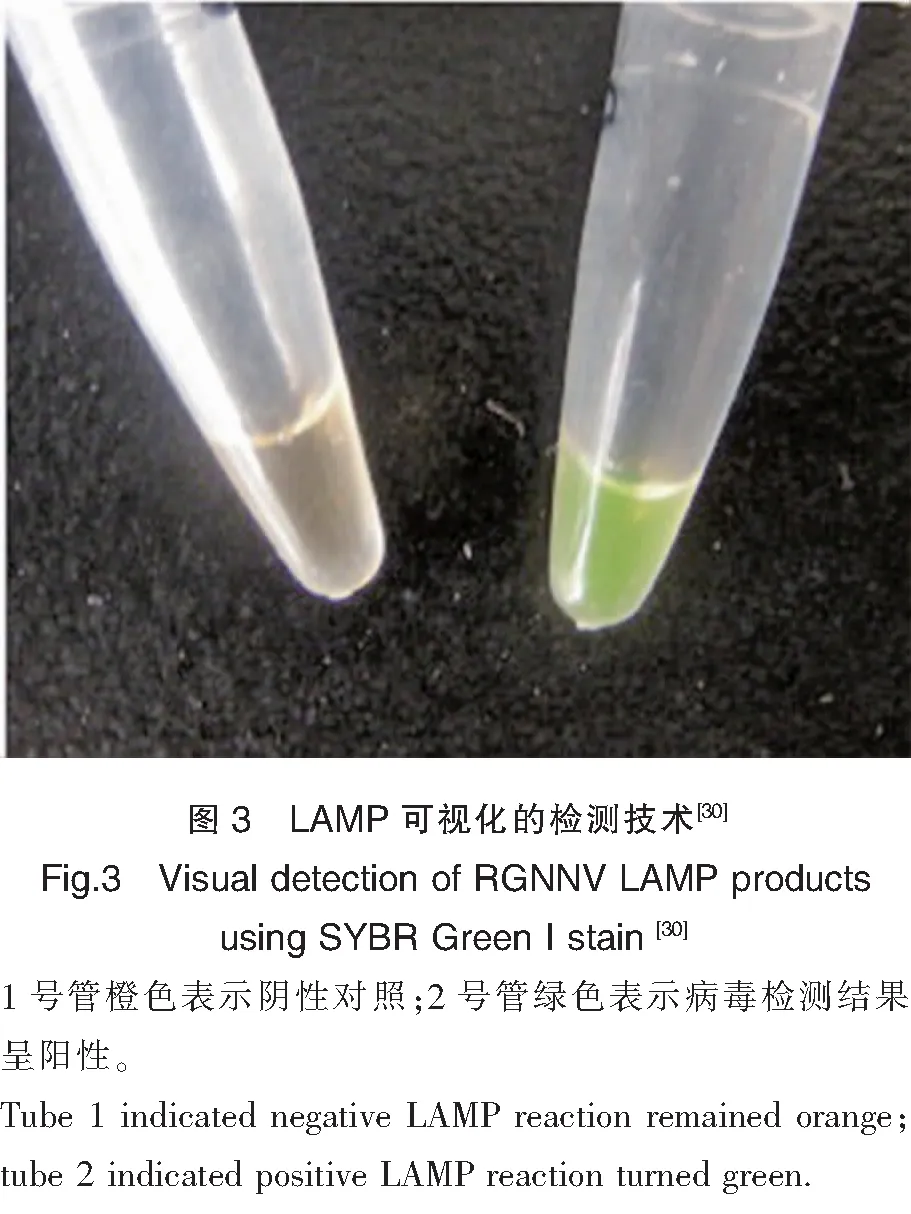
3 病毒傳播途徑
阻斷傳播是防控病毒病害大規模流行重要的手段。NNV的傳播途徑有兩種:一種是通過親魚的垂直傳播,另一種是通過養殖水體、互相接觸、餌料等形成的水平傳播[2,11]。
通過篩選不攜帶NNV的親魚進行繁殖,阻斷病毒的垂直傳播是防控病毒病害的重要研究方向。在海水魚類病毒性神經壞死病的研究中已有成功的報道,如Watanabe等利用ELISA和PCR技術相結合的方法,檢測條斑星鰈親魚是否攜帶NNV,并篩選出不帶病毒的親魚進行繁殖,結果發現其子代不容易發生病毒性神經壞死病,因此認為通過剔除帶病毒親魚進行繁殖的方法能夠有效地阻斷病毒的傳播[21];相似的報道還見于海鱸及黃帶擬鰺的相關研究[20,31]。由以上研究可知,篩選不攜帶NNV的親魚進行繁殖,是有效防控NNV傳播的途徑之一[31]。
水平傳播也是NNV擴散另一種重要的途徑。海水魚類NNV的水平傳播途徑已經被多次證明,如Manin和Ransangan將鱸魚和褐點石斑魚的幼魚與病魚的勻漿液浸泡后,在全部幼魚個體中都檢測到了NNV,表明NNV可以通過水平傳播的方式進行傳播[32];Kuo等通過熒光定量PCR的方法,揭示了NNV可能通過魚鰭互相接觸的方式進行水平傳播[26];Gomez等通過反轉錄PCR的方法在餌料魚中檢測出了NNV,利用從餌料魚中分離出的NNV對七帶石斑魚進行回接感染,發現餌料魚中的NNV能對七帶石斑魚幼苗造成90%~100%的死亡率,揭示了NNV的潛在傳播途徑[22]。有的學者甚至認為,NNV的垂直傳播并不是病害暴發的主要因素,養殖水體惡化或者未經消毒等水平傳播的方式才是導致NNV病害暴發的主要原因,Hick等利用反轉錄PCR技術檢測尖吻鱸的受精卵和仔魚,發現在所有批次的親魚、受精卵和仔魚中均未檢測到NNV,但是卻在2/6批次的幼魚中卻發生了NNV并造成了最高100%的死亡率,由此認為水平傳播才是造成病害大規模流行的主要原因[33]。
以上的研究表明,垂直傳播和水平傳播都是NNV重要的傳播方式,因此需要加強親魚、餌料、水體等各環節的檢疫,進行綜合防控才能有效阻斷病毒的傳播。
4 免疫防控
疫苗免疫是重要和有效的病毒防治手段之一。在海水魚病毒性神經壞死病的研究中已有較多成功的報道,如在褐點石斑魚和七帶石斑魚幼魚中,通過注射疫苗的方式,證明了NNV疫苗能夠提高約67%的成活率[34-35];Kai等通過疫苗浸泡的方式對褐點石斑魚進行病毒免疫,10 d后檢測到了病毒抗體,攻毒后免疫組存活率高達87%,對照組全部死亡[36];Lin等通過口服疫苗的方法對斜帶石斑魚幼魚進行免疫,7 d之后發現了病毒抗體,免疫組成活率達到69.5%[37]。
對親魚進行疫苗免疫,可以直接將病毒抗體傳遞給后代,在源頭上解決石斑魚稚、幼苗的病害問題,如Kai等分別對斜帶石斑魚和黑斑石斑魚親魚注射NNV疫苗,結果發現在免疫組親魚的受精卵中有病毒抗體存在,對照組未免疫親魚的受精卵中則無抗體[38]。
除了滅活病毒疫苗之外,其他類型的疫苗也可取得較好的免疫保護效果,如Lu等將NNV的外殼蛋白基因ORF框構建到了質粒上,并通過大腸桿菌表達出類病毒外殼的蛋白顆粒,這些重組的類病毒顆粒與NNV在神經細胞表面競爭結合位點,大大減少了病毒侵入石斑魚神經細胞的效率,對宿主起到了保護作用[39];Sommerset等利用重組的病毒外殼蛋白進行免疫,發現10 μg重組蛋白劑量具有較好的免疫保護效果[40];Coeurdacier等證明了人工合成的外殼蛋白多肽可對海鱸產生免疫保護效果[41]。
以上的研究表明,不同類型的神經壞死病毒疫苗(如滅活病毒、重組病毒外殼蛋白及人工合成病毒外殼蛋白多肽)及不同的免疫方式(如注射、浸泡及口服)都能夠對海水魚類產生免疫保護效果。然而在生產實踐中,稚魚或幼魚的特異性免疫系統還未充分發育,免疫后,稚魚或幼魚經常在未產生免疫保護之前即開始大規模發病死亡[15];通過免疫親魚遺傳獲得的抗體是否能持續地對稚魚或幼魚產生免疫保護作用也不得而知。有效的海水魚類免疫防控技術仍需深入研究。
5 展望
從1990年第一次被報道開始,病毒性神經壞死病就一直危害著海水魚養殖產業,給該產業帶來了持續的經濟損失[3-4]。NNV對海水魚幼苗的成活率威脅巨大,研究NNV的防控技術及策略是該產業發展不可回避的重要課題。
疫苗免疫通常是防治病毒病的最有效方法之一。滅活疫苗或者重組的疫苗蛋白能夠對石斑魚產生較好的免疫保護效果[34],然而,NNV主要作用于稚魚、幼魚,該階段幼苗的免疫系統可能未充分發育,使得疫苗的保護效果非常有限[15]。對繁殖親魚進行疫苗免疫,使得子代獲得病毒免疫力[38],該方法能夠阻斷病毒的垂直傳播,并使后代獲得先天的病毒免疫能力,相關技術具有較高的潛在應用價值,值得進一步開發。
加強病毒檢測,提前排除病毒媒介或攜帶者,阻斷病毒傳播,也是實現病毒防控的重要方法。隨著生物技術的發展,病毒的檢測技術已較為成熟,可對養殖過程中的各個環節進行檢測。然而,海水魚養殖產業的病毒檢疫防控工作仍不全面。Gomez等發現無脊椎動物(雙斑蟳Charybdisbimaculata、長額蝦Pandalushypsinotus、紫貽貝Mytilusgalloprovincialis)中也攜帶了NNV[42]。在海水魚類稚魚養殖過程中,輪蟲、豐年蟲等低等浮游生物餌料必不可少,該環節的病毒檢測工作至關重要,相應的研究仍需得到重視并加強。
現階段需要繼續加強病毒免疫學研究,開發出商業化的疫苗及合理的免疫方法。同時,需要加強病毒檢疫,制定出阻斷病毒傳播的綜合防治方案,最終為海水魚養殖業的快速發展提供助力。
[1]MUNDAY B,KWANG J,MOODY N,et al.Betanodavirus infections of teleost fish:a review[J].J Fish Dis,2002,25(3):127-142.
[2]NAKAI T,MORI K,SUGAYA T,et al.Current knowledge on Viral nervous necrosis(VNN)and its causative betanodaviruses[J].Isr J Aquacult-Bamid,2009,61(3):198-207.
[3]YOSHIKOSHI K,INOUE K.Viral nervous necrosis in hatchery-reared larvae and juveniles of Japanese parrotfish,Oplegnathusfasciatus[J].J Fish Dis,1990,13(13):69-77.
[4]GLAZEBROOK J,HEASMAN M,BEER S,et al.Picorna-like viral particles associated with mass mortalities in larval barrmundi,Latesclcarifer(Bloch)[J].J Fish Dis,1990,13(3):245-249.
[5]MORI K,NAKAI T,NAGAHARA M,et al.A viral disease in hatchery-reared larvae and juveniles of redspotted grouper[J].Fish Pathol,1991,26(4):209-210.
[6]FUKUDA Y,NGUYEN H,FURUHASHI M,et al.Mass mortality of cultured sevenband grouper,Epinephelusseptemfasciatus,associated with viral nervous necrosis[J].Fish Pathol,1996,31(3):165-170.
[7]CHI S,LO C,KOU G,et al.Mass mortalities associated with viral nervous necrosis(VNN)disease in two species of hatchery-reared grouper,EpinephelusfuscogutatusandEpinephelusakaara[J].J Fish Dis,1997,20(3):185-193.
[8]BREUIL G,BONAMI J,PEPIN J,et al.Viral infection(picorna-like virus)associated with mass mortalities in hatchery-reared sea-bass(Dicentrarchuslabrax)larvae and juveniles[J].Aquaculture,1991,97(2-3):109-116.
[9]BLOCH B,GRAVNINGEN K,LARSEN J,et al.Encephalomyelitis among turbot associated with a picornavirus-like agent[J].Dis Aquat Organ,1991,10(1):65-70.
[10]MORI K,NAKAI T,MUROGA K,et al.Properties of a new virus belonging to nodaviridae found in larval striped jack(Pseudocaranxdentex)with nervous necrosis[J].Virology,1992,187(1):368-371.
[11]陳信忠.石斑魚病毒性神經壞死病研究[D].廈門:廈門大學,2005:1-122.
[12]TANAKA S,KURIYAMA I,NAKAI T,et al.Susceptibility of cultured juveniles of several marine fish to the sevenband grouper nervous necrosis virus[J].J Fish Dis,2003,26(2):109-115.
[13]IWAMOTO T,YASUSHI O,KAZUYUKI M,et al.Identification of host-specificity determinants in betanodaviruses by using reassortants between striped jack nervous necrosis virus and sevenband grouper nervous necrosis virus[J].J Virol,2004,78(3):1256-1262.
[14]NISHIZAWA T,FURUHASHI M,NAGAI T,et al.Genomicclassification of fish nodaviruses by molecular phylogenetic analysis of the coat protein gene[J].Appl Environ Microb,1997,63(4):1633-1636.
[15]陳文捷,劉曉丹,胡先勤,等.魚類神經壞死病毒研究進展與發展趨勢[J].水產學報,2014,38(9):1666-1672.
[16]ARIMOTO M,SATO J,MARUYAMA K,et al.Effect of chemical and physical treatments on the inactivation of striped jack nervous necrosis virus(SJNNV)[J].Aquaculture,1996,143(1):15-22.
[17]FRERICHS G,TWEEDIE A,STARKEY W,et al.Temperature,pH,and electrolyte sensitivity,and heat,UV and disinfectant inactivation of sea bass(Dicentrarchuslabrax)neuropathy nodavirus[J].Aquaculture,2000,185(1-2):13-24.
[18]BRETON A,GRISEZ L,SWEETMAN J,et al.Viral nervous necrosis(VNN)associated with mass mortalities in cage-reared sea bass,Dicentrarchuslabrax(L.)[J].J Fish Dis,1997,20(2):145-151.
[19]GROTMOL S,BERGH O,TOTLAND G,et al.Transmission of viral encephalopathy and retinopathy(VER)to yolk-sac larvae of the Atlantic halibutHippoglossushippoglossus:occurrence of nodavirus in various organs and a possible route of infection[J].Dis Aquat Organ,1999,36(2):95-106.
[20]BREUIL G,PEPIN J,CASTRIC J,et al.Detection of serum antibodies against nodavirus in wild and farmed adult sea bass:application to the screening of broodstock in sea bass hatcheries[J].B Eur Assoc Fish Pat,2000,20(3):95-100.
[21]WATANABE K,NISHIZAWA T,YOSHIMIZU M,et al.Selection of broodstock candidates of barfin flounder using an ELISA system with recombinant protein of barfin flounder nervous necrosis virus[J].Dis Aquat Organ,2000,41(3):219-223.
[22]GOMEZ D,MORI K,OKINAKA Y,et al.Trash fish can be a source of betanodaviruses for cultured marine fish[J].Aquaculture,2010,302(3):158-163.
[23]NISHIZAWA T,MORI K,NAKAI T,et al.Polymerase chain reaction(PCR)amplification of RNA of striped jack nervous necrosis virus(SJNNV)[J].Dis Aquat Organ,1994,18(2):103-107.
[24]陳信忠,蘇亞玲,龔艷清,等.逆轉錄聚合酶鏈式反應(RT-PCR)檢測5種養殖石斑魚的神經壞死病毒[J].中國水產科學,2004,11(3):202-207.
[25]MU Y,LIN K,CHEN X,et al.Diagnosis of nervous necrosis virus in orange-spotted grouper,Epinepheluscoioides,by a rapid and convenient RT-PCR method[J].Acta Oceanol Sin,2013,32(10):88-92.
[26]KUO H,WANG T,CHEN P,et al.Real-time quantitative PCR assay for monitoring of nervous necrosis virus infection in grouper aquaculture[J].J Clin Microbiol,2011,49(3):1090-1096.
[27]DALLA V,ZANELLA L,PATARNELLO P,et al.Development of a sensitive diagnostic assay for fish nervous necrosis virus based on RT-PCR plus nested PCR[J].J Fish Dis,2000,23(5):321-327.
[28]GOMEZ D,SATO J,MUSHIAKE K,et al.PCR-based detection of betanodaviruses from cultured and wild marine fish with no clinical signs[J].J Fish Dis,2004,27(10):603-608.
[29]THIERY R,RAYMOND J,CASTRIC J,et al.Natural outbreak of viral encephalopathy and retinopathy in juvenile sea bass,Dicentrarchuslabrax:study by nested reverse transcriptase-polymerase chain reaction[J].Virus Res,1999,63(1-2):11-17.
[30]XU H,FENG J,GUO Z,et al.Detection of red-spotted grouper nervous necrosis virus by loop-mediated isothermal amplification[J].J Virol Methods,2010,163(1):123-128.
[31]MUSHIAKE K,NISHIZAWA T,NAKAI T,et al.Control of VNN in striped jack-selection of spawners based on the detection of SJNNV gene by polymerase chain-reaction(PCR)[J].Fish Pathol,1994,29(3):177-82.
[32]MANIN B,RANSANGAN J.Experimental evidence of horizontal transmission of betanodavirus in hatchery-produced Asian seabass,Latescalcariferand brown-marbled grouper,Epinephelusfuscoguttatusfingerling[J].Aquaculture,2011,321(1-2):157-165.
[33]HICK P,SCHIPP G,BOSMANS J,et al.Recurrent outbreaks of viral nervous necrosis in intensively cultured barramundi(Latescalcarifer)due to horizontal transmission of betanodavirus and recommendations for disease control[J].Aquaculture,2011,319(1-2):41-52.
[34]YAMASHITA H,NAKAI T.The efficacy of inactivated virus vaccine against viral nervous necrosis(VNN)[J].Fish Pathol,2005,40(1):15-21.
[35]PAKINGKING R,NORWELL-BRIAN B,EVELYN-GRACE J,et al.Protective immunity against viral nervous necrosis(VNN)in brown-marbled grouper(Epinephelusfuscogutattus)following vaccination with inactivated betanodavirus[J].Fish Shellfish Immun,2010,28(4):525-533.
[36]KAI Y,CHI S.Efficacies of inactivated vaccines against betanodavirus in grouper larvae(Epinepheluscoioides)by bath immunization[J].Vaccine,2008,26(11):1450-1457.
[37]LIN C,LIN J,CHEN M,et al.An oral nervous necrosis virus vaccine that induces protective immunity in larvae of grouper(Epinepheluscoioides)[J].Aquaculture,2007,268(1-4):265-273.
[38]KAI Y,SU H,TAI K,et al.Vaccination of grouper broodfish(Epinephelustukula)reduces the risk of vertical transmission by nervous necrosis virus[J].Vaccine,2010,28(4):996-1001.
[39]LU M,LIU W,LIN C,et al.Infection competition against grouper nervous necrosis virus by virus-like particles produced inEscherichiacoli[J].J Gen Virol,2003,84(Pt 6):1577-1582.
[40]SOMMERSET I,SKERN R,BIERING E,et al.Protection against Atlantic halibut nodavirus in turbot is induced by recombinant capsid protein vaccination but not following DNA vaccination[J].Fish Shellfish Immun,2005,18(1):13-29.
[41]COEURDACIER J,LAPORTE F,PEPIN J,et al.Preliminary approach to find synthetic peptides from nodavirus capsid potentially protective against sea bass viral encephalopathy and retinopathy[J].Fish Shellfish Immun,2003,14(5):435-447.
[42]GOMEZ D,BAECK G,KIM J,et al.Molecular detection of betanodaviruses from apparently healthy wild marine invertebrates[J].J Invertebr Pathol,2008,97(3):197-202.
Review on disease control researches of marine fish NNV
HUANG Wen1,2,CHEN Chang1,2,ZHAO Zhe1,2,LI Lulu3,LUO Peng1,2,WANG Yanhong1,2,REN Chunhua1,2,HU Chaoqun1,2*,FANG Zhe4,WANG Dongmei4,ZHAN Zhongren5
(1.Key Laboratory of Tropical Marine Bio-resources and Ecology(LMB)/Key Laboratory of Applied Marine Biology of Guangdong Province(LAMB),South China Sea Institute of Oceanology,Chinese Academy of Sciences,Guangzhou 510301,China;2.South China Sea Bio-Resource Exploitation and Utilization Collaborative Innovation Center,Zhuhai 519082,China;3.Oceanic and Fishery Administration of Lijin County,Dongying 257400,China;4.Institute of Tropical Bioscience and Biotechnology,Chinese Academy of Tropical Agricultural Sciences,Haikou 571101,China;5.Sanya Fulian Aquatic Development Limited Company, Sanya 572026,China)
Nervous necrosis virus(NNV)can lead to nervous,encephalopathy or retinopathy necrosis in marine fishes.The virus causing the nervous necrosis disease in marine fishes mostly infects the grouper fries and fingerlings,the strong pathogenicity and high mortality rate is a hammer blow to the marine fish culture,which had become one of the most important restrictions of marine culture industry.The study mainly reviews on the research progresses of basic characteristics,diagnostic techniques,transmission,vaccine immunology and controlling strategies of NNV.This paper will provide the
for preventing and controlling the NNV disease of marine fish culture industry.
marine fish;viral nervous necrosis;review;Betanodavirus;disease control
2016-07-20 基金項目:海南省產學研一體化專項資金項目資助(編號:cxy20150038);廣東省省級科技計劃項目資助(編號:2014B030301064).
黃 文(1987-),男,江西省井岡山人,助理研究員,博士,主要從事海洋生物技術與病害研究.Tel:020-89023216.E-mail:huangwen@scsio.ac.cn
胡超群(1962-),研究員,主要從事海洋生物技術與病害研究.E-mail:hucq@scsio.ac.cn
S942.2
A
1006-5601(2016)05-0419-08
黃 文,陳 償,趙 哲,等.海水養殖魚類病毒性神經壞死病防控技術研究進展[J].漁業研究,2016,38(5):419-426.

