木質纖維素高效降解的動物源機制
葉美瀛, 陳 雪, 劉研萍
(1.北京化工大學 環境科學與工程系, 北京 100029; 2.北京國能中電節能環保技術有限責任公司, 北京 100020)
?
木質纖維素高效降解的動物源機制
葉美瀛1, 陳 雪2, 劉研萍1
(1.北京化工大學 環境科學與工程系, 北京 100029; 2.北京國能中電節能環保技術有限責任公司, 北京 100020)
生物質資源在解決能源短缺和環境污染方面有著巨大的潛力,但生物質的低成本高效轉化利用機制仍需進行深入研究。在動物源木質纖維素降解體系中,選取低等白蟻進行了系統分析,由于其體內具有高效轉化木質纖維素系統,其腸道消化體系是一個非常高效的“生物反應器”。白蟻體內含豐富的木質纖維素降解酶系和高效微生物資源,在白蟻-共生微生物雙重作用下,纖維素和半纖維素能夠被高效降解。通過分子生物技術,可對纖維素酶和半纖維素酶進行異源表達,表達產物活性高。文章闡述了低等白蟻的木質纖維素降解酶系統,共生微生物的多樣性及功能和高效降解木質纖維素機制,以及木質纖維素酶異源表達情況,為生物質低成本、系統的高效轉化利用提供新的方向和思路。
低等白蟻; 木質纖維素降解酶; 共生微生物; 異源表達
木質纖維素主要是由纖維素,半纖維素和木質素組成,是地球上最豐富的可再生資源,具有生物燃料和生物材料生產的潛力[1]。木質纖維素由于結構復雜,纖維素晶體高度有序,與半纖維素交雜在一起,被性質穩定的木質素包裹起來,而難以被酶和微生物降解,導致其降解率一直不高。在自然界中,存在許多生物能夠以木質纖維素為食來獲取營養物質和能量,白蟻就是一類最具代表性的動物,大約2600種白蟻廣泛分布在世界范圍[2]。據估計,白蟻每年大約可消耗3~7億噸的木質纖維素,能高效消化79%~99%的纖維素,對熱帶和亞熱帶地區生態系統的碳循環起著非常重要作用[3]。
低等白蟻占總白蟻種類的25%,共有6個科,分別為草白蟻科、原白蟻科、澳白蟻科、木白蟻科、齒白蟻科和鼻白蟻科[4],在我國長江以南城市廣泛分布存在,典型的有家白蟻、散白蟻、木白蟻和原白蟻等[5]。與高等白蟻相比,低等白蟻進化不完全,取食范圍略窄,它們喜歡取食富含木質纖維素的食物,包括一些草本植物和樹木等活植物及干枯植物。白蟻能高效降解木質纖維素主要原因是其腸道消化系統是一個高效的“生物反應器”,其體內含有大量能表達木質纖維素酶的基因,以及大量微生物在后腸共生存在,在白蟻自身及共生體的雙重作用,木質纖維素被充分分解利用[6]。低等白蟻既是害蟲,也是資源型昆蟲,其體內相關木質纖維素降解酶及微生物具有重大的研究價值,對木質纖維素降解工藝的設計具有啟發意義。文章系統的分析了低等白蟻的木質纖維素降解酶體系、木質纖維素酶的異源表達、腸道微生物的多樣性以及木質纖維素的體內轉化過程。
1 低等白蟻的木質纖維素降解酶體系
低等白蟻能高效降解木質纖維素,主要原因是其體內具有豐富的降解木質纖維素相關酶種類,包括內切葡聚糖酶(EC 3.2.1.4,簡稱EG酶)、外切葡聚糖酶(EC3.2.1.91,也稱CBH酶)和葡聚糖苷酶(EC 3.2.1.21,簡稱BG酶)3種纖維素酶,以及木聚糖酶、甘露聚糖酶等半纖維素酶[7]。酶系來源包括白蟻自身產生的內源性纖維素酶和共生微生物產生的木質纖維素降解酶。
1.1 白蟻自身產生的內源性纖維素酶
低等白蟻自身能產生的內源性纖維素酶—EG酶和BG酶,主要是在唾液腺表達分布。Inoue[8]等人研究北美散白蟻體內纖維素酶時發現77.8%的EG酶和23.9%的BG酶分布在唾液腺中。80%的EG酶活性分布在臺灣乳白蟻的唾液腺中,而在中腸也分布相對較少的EG酶活性[9][10]。關于BG酶,Zhang[11]等人用基因轉錄檢測證實了唾液腺是BG酶主要表達場所。在恒春新白蟻的唾液腺中檢測到75%BG酶活性分布,15% BG酶活分布在共生著大量鞭毛蟲的后腸部位[12]。在低等白蟻前腸及中腸都能檢測到少量的纖維素酶,一種可能原因是部分由唾液腺產生的纖維素酶隨木質纖維素轉移到前腸和中腸部位。在GenBank收錄的纖維素酶基因中,根據肽序列相似性對白蟻內源性纖維素酶進行分類,所有的EG酶屬于GHF9,而內源性BG酶屬于GHF1[13]。
1.2 共生微生物產生的木質纖維素降解酶
1.2.1 纖維素酶
與內源性纖維素酶相比,低等白蟻后腸的共生原生動物能產生更復雜的纖維素酶。EG梅,BG梅和CBH梅3種纖維素酶均能在白蟻后腸檢測到。眾多學者利用生物學技術,在原生動物體內發現了大量的纖維素酶的基因,不同白蟻后腸的原生動物能夠克隆出的纖維素酶基因種類具有差異。臺灣乳白蟻后腸存在3種鞭毛蟲S.leidyi,H.mirabile和P.grassii,能夠從中克隆到不同的纖維素酶基因,分別有GHF5EG[13],GHF7EG[14]和GHF7CBH[15]。杜蕾蕾[16]通過RT-PCR和RACE技術克隆了黑胸散白蟻后腸鞭毛蟲的纖維素酶基因,經分析該基因屬于糖基水解酶家族7(GHF7)。近年來宏轉錄組學技術廣泛運用生物學研究,從低等白蟻后腸微生物獲得了眾多纖維素酶基因序列信息。Todaka[17]等人對臺灣乳白蟻、達爾文澳白蟻、恒春新白蟻和H.sjostedti原白蟻四種低等白蟻后腸共生原生動物建立了cDNA文庫并進行EST分析,可以得知GHF5EGs,GHF7EGs,GHF7CBHs和GHF45EGs是共生體纖維素酶系統的主要作用酶;其中GHF45EGs是達爾文澳白蟻共生原生動物的核心纖維素酶,而在恒春新白蟻后腸未檢測到其序列(見表1)。
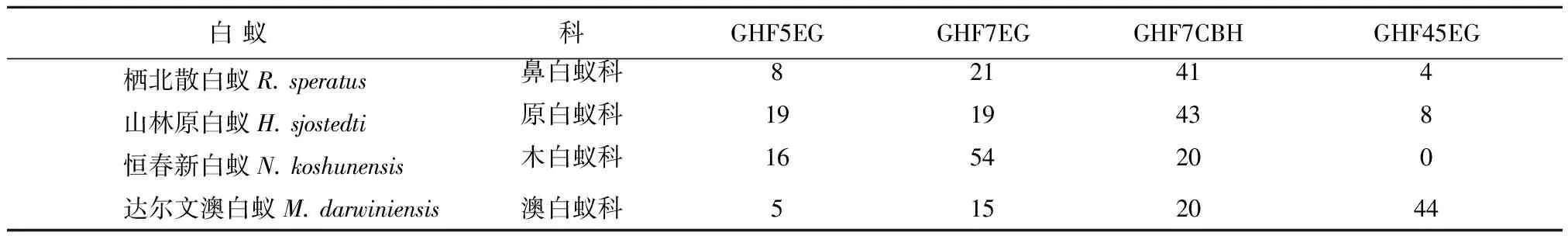
表1 低等白蟻共生原生動物已知功能的纖維酶基因
1.2.2 半纖維素酶
白蟻能高效消化半纖維素,主要是由其后腸共生微生物產生的木聚糖酶等半纖維素酶在起作用。Azuma[18]等人喂食黃胸散白蟻工蟻,在喂食木聚糖21天后,顯示白蟻后腸的一些原生動物仍能存活并保持著木聚糖酶活性,表明了木聚糖酶活性與后腸原生動物息息相關。Smith和Koehler[19]研究木聚糖含量不同的食物對白蟻體內木聚糖酶的影響,發現食物的木聚糖含量越高,測得的木聚糖酶越高,其中超過92%的木聚糖酶活性位于后腸,證明了木聚糖的消化主要由后腸共生微生物在起作用。Arakawa[20]等人第一次從臺灣乳白蟻提純到三種具有相同功能的木聚糖酶,克隆相應的cDNAs顯示這些木聚糖酶隸屬于GHF11,運用反轉錄-PCR技術證實相應的表達基因源自后腸全鞭毛蟲。由于木聚糖體外提純困難,提供信息不足,無法全面了解白蟻體內半纖維酶基因。近年來廣泛運用宏轉錄組學技術來發現并分析白蟻體內半纖維素酶基因,對常見的低等白蟻進行檢測,發現木聚糖酶基因主要是由白蟻后腸細菌及原生動物產生的,而白蟻能否自身分泌尚未得知(見表2),檢測到的半纖維素酶主要屬于GHF10和GHF11。在鼻白蟻科中,GHF10木聚糖酶相對含量較少,起主要作用的是GHF11木聚糖酶[21]。
1.3 低等白蟻木質纖維素酶的異源表達
白蟻體內的木質纖維素酶要實現工業應用,進行異源表達大量生產重組酶是非常有必要的。在國外,有關白蟻自身及其體內共生體的木質纖維素酶基因體外表達的研究報道很多,EGs,BGs和木聚糖酶異源高效表達,而國內鮮有報道。

表2 從低等白蟻共生微生物純化的木聚糖酶或測序基因
白蟻自身及其體內共生原生動物存在大量的纖維素酶基因,異源表達獲得的重組纖維素酶活性高。Zhang[28]等人從臺灣乳白蟻自身腸道克隆到cfEG5(GHF9)并在大腸桿菌表達,結果顯示重組EG酶的比活力達到325 U·mg-1。從棲北散白蟻R.speratus后腸共生原生動物克隆到一個GHF7 EG基因并在米曲霉表達,重組EG酶具有高比活力(603 U·mg-1),在pH值6.5和溫度45℃條件下,酶活性最高;以CMC底物重組EG酶的米氏常數Km和Vmax分別為1.97 mg·mL-1和769.6 U·mg-1[29]。Ni[30]等人將從恒春新白蟻的唾液腺中獲得的NkBG基因第一次在大腸桿菌異源表達,其重組BG酶的性質基本與白蟻體內BG酶一致,作用于纖維二糖的Km和Vmax分別為3.8 mM和220 U·mg-1,最適pH值和溫度分別為5.0和45℃,比活力達到156.7 U·mg-1。
對于重組木聚糖酶,Matteotti[31]等人根據功能活性篩選從散白蟻R.santonensis的革蘭氏陽性細菌克隆了一個木聚糖酶基因(XylB8),XylB8(GHF11)在大腸桿菌異源表達,獲得的重組木聚糖酶作用于山毛櫸材木聚糖,在pH值5.0和55℃下有最大酶活性,Km和Vmax分別為9 mg·mL和3333 U·mg-1。Tsukagoshi[32]等人第一次從棲北散白蟻R.speratus的共生原生動物克隆到GHF26甘露聚糖酶RsMan26H并在酵母菌表達,經過184 h培養后,蛋白質濃度最終達到0.67 g·L-1,對于底物可溶豆膠半乳甘露聚糖,最適pH值和溫度分別為5.0和40℃,該酶能夠作用于低聚糖或多糖產生甘露二糖。
2 腸道微生物的多樣性及功能
低等白蟻體內共生著大量的原生動物和古細菌、螺旋體等原核生物,對白蟻代謝活動和物質循環起著重要的作用。在以下對低等白蟻腸道內的原生動物和原核生物的多樣性及功能進行分析。
2.1 白蟻后腸原生動物的多樣性及功能
低等白蟻后腸定居著大量的共生鞭毛蟲,在木質纖維素消化降解過程起著重要的作用。白蟻共生的鞭毛蟲均屬于超鞭毛蟲目、毛滴蟲目和銳滴蟲目[33]。鞭毛蟲可達到白蟻總體重的1/7至1/3,在后腸腸液占有相對較大的體積空間,低等白蟻種類不同,其腸道內的鞭毛蟲種類具有差異,臺灣乳白蟻腸道內共生著3種鞭毛蟲,而棲北散白蟻至少存在11種[34]。
鞭毛蟲是低等白蟻不可或缺的存在,一方面鞭毛蟲與白蟻存在共生關系;另一方面,鞭毛蟲與細菌或古生菌存在內(外)共生關系。低等白蟻一旦缺失鞭毛蟲就無法存活,鞭毛蟲群落的改變會影響白蟻體內木質纖維素酶的活性,引起共生原核生物群落發生變化[35]。毛滴蟲目和超鞭蟲目的鞭毛蟲含有氫化酶體(Hydrogenosomes),以底物水平磷酸化的形式產生ATP并釋放乙酸,供白蟻代謝需要的能量。同種白蟻腸道的3種鞭毛蟲在消化木質纖維素過程起不同的作用,最大的鞭毛蟲(P.grassii)主要消化高度聚合的纖維素,而較小的鞭毛蟲Holomastigotoideshartmanni和Spirotrichonymphaleidyi則降解低分子量的纖維素[36]。在近年來,廣泛運用宏轉錄組學技術研究低等白蟻共生微生物,其中,鞭毛蟲來源的SSU rRNA占了77.9%,從鞭毛蟲克隆出了許多纖維素酶基因,如GHF5EGs,GHF7CBHs和GHF45EG等,證實了鞭毛蟲能夠降解木質纖維素[23]。
2.2 白蟻體內共生原核生物的多樣性及功能
低等白蟻后腸腸液及鞭毛蟲細胞液存在著大量的細菌和古生菌等原核生物。從低等白蟻腸道已分離到多種好氧菌及兼性厭氧菌,但細菌菌落的難培養性,只有少部分原核生物被認知。現在主要是依靠非培養式分子技術如對16S rRNA基因測序來研究原核生物的多樣性,經系統發育分析發現低等白蟻共生細菌的主要類群有螺旋體、變形菌、厚壁菌、擬桿菌、放線菌和白蟻菌群1[37]。優勢菌群因白蟻種類而有所差異,散白蟻屬最占優勢的是螺旋體,而在乳白蟻的最優勢菌是擬桿菌[38]。原核生物在低等白蟻腸道中的分布是不均勻的,有的與鞭毛蟲共生,有的游離生活于腸腔,還有的密布于后腸腸壁。
螺旋體在白蟻后腸腸道游離或粘附在鞭毛蟲表面,分離純化得到的螺旋體具有還原產乙酸作用,能夠消耗H2/CO2還原合成乙酸[39]。產甲烷古菌在低等白蟻后腸腸道含量相對較少,與螺旋體競爭利用二氧化碳和氫氣,還原反應生成甲烷[40]。同時,低等白蟻后腸還存在著固氮菌、硫酸鹽還原細菌、尿酸分解菌等,參與白蟻代謝活動和物質循環[41]。在國內外,盡管分離純化得到了許多能降解木質纖維素的原核生物,或通過宏轉錄組學和PCR-DGGE等技術了解了其多樣性,但它們在白蟻體內所起的具體作用仍未明確,相互作用關系有待進一步研究。
3 低等白蟻體內的木質纖維素的降解
3.1 低等白蟻腸道及內環境
白蟻腸道是結構化不斷變化的微環境系,生理狀態和微生物群落結構具有明顯差異,是木質纖維素降解的主要場所。白蟻腸道通常由前腸,中腸和后腸組成(見圖1)。前腸起源于外胚層,包含一段食道,膨大的前段(“嗉囊”)和后段(“砂囊”),主要作用是機械研磨白蟻攝入的木質碎片;中腸呈柱狀,起源于內胚層,是消化酶分泌和營養吸收的主要場所;中腸和后腸的連接處是馬氏管,具有排泄代謝廢物的功能;經過部分消化的木質纖維素進入到白蟻腸道最大的部分—后腸,其長度和結構復雜多變,細分可以分為P1,P2,P3,P4和P5五部分,是新陳代謝的主要場所[42]。后腸P3部分顯著膨大,生存著大量的細菌、古生菌和原生動物。膨大的腸道區域減緩了物質在腸道的運輸,延長了消化物與腸道微生物的接觸時間,這也是白蟻能高效降解木質纖維素的一種原因。
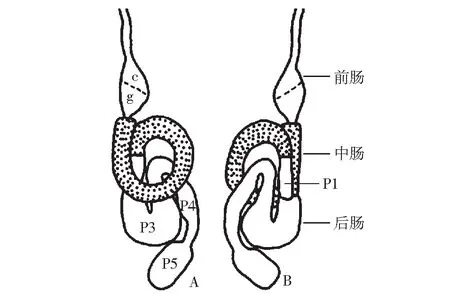
A. 背面觀; B. 腹面觀; c. 嗉囊; g. 砂囊; P1. 回腸; P3. 囊形胃; P4. 結腸; P5. 直腸圖1 臺灣乳白蟻工蟻消化道[43]
起初白蟻的后腸被認為是一個厭氧環境,后來嚴格好氧菌及兼性厭氧菌的發現否定了這觀點,微電極技術的應用證實了白蟻腸道是一個漸變的系統,氫氧分壓在白蟻腸道空間上分布呈明顯的梯度變化,氧分壓在腸壁部位高而中心部位很低,而氫分壓而相反[38]。這樣的漸變系統影響微生物群落及其活性在微尺度下呈現多樣性的分布變化。低等白蟻腸道pH值呈弱酸性,有利酶類和微生物作用木質纖維素。
3.2 木質纖維素在低等白蟻體內的轉化過程
低等白蟻消化降解木質纖維素的過程可以看作機械預處理、酶水解和微生物綜合處理的過程。
白蟻上顎和前胃能夠剪切或擠壓攝入的食物,降低物質粒徑,能使木質顆粒在前腸和后腸尾部區間達到20~100 μm不等長度,是一個機械預處理的過程[10]。
白蟻唾液腺能分泌內源性纖維素酶,這些酶與木質物質充分混合,在轉移到前腸和中腸的過程中進行酶水解產生纖維素碳水化合物和一些可溶性糖類(葡萄糖和纖維二糖),部分可溶性糖類在中腸被白蟻吸收[44]。
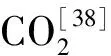

圖2 低等木食性散白蟻R. santonensis后腸主要的代謝途徑[38]
4 展望
我國具有豐富的生物質資源,但一直面臨轉化效率不高的問題。白蟻是一座值得挖掘開發的寶庫,其腸道消化系統是個非常高效的“生物反應器”,對木質纖維素具有非凡轉化利用能力,遠超現有任何技術。白蟻的“機械預處理-復合酶水解-微生物降解”高效轉化木質纖維素機制,對攻克生物質利用的關鍵技術和理論方面具有極大的科學借鑒價值。白蟻體內高效木質纖維素降解酶系統資源值得挖掘及其工程化利用,對高效微生物資源進行篩選、改造與利用。白蟻獨特的高效生物質轉化的能力及其背后的生物作用機制、理化作用原理及其物態演變的規律被揭開,人們就能夠通過現代生物技術與工程技術相結合,對這一機制和過程進行模擬,構建一個仿生集成系統,實現生物質高效轉化的過程化利用。
[1] Himmel M E, Ding S Y, Johnson D K, et al. Biomass recalcitrance: engineering plants and enzymes for biofuels production[J]. science, 2007, 315(5813): 804-807.
[2] Eggleton P. An introduction to termites: biology, taxonomy and functional morphology[M] .Biology of termites: a modern synthesis. Springer Netherlands, 2011: 1-26.
[3] Breznak J A, Brune A. Role of microorganisms in the digestion of lignocellulose by termites[J]. Annual review of entomology, 1994, 39(1): 453-487.
[4] Lo N, Eggleton P. Termite phylogenetics and co-cladogenesis with symbionts[M] .Springer Netherlands,Biology of termites: a modern synthesis,2011: 27-50.
[5] 蔡邦華, 陳寧生. 中國白蟻分類和區系問題[J]. 昆蟲學報, 1964, 1: 25-37.
[6] Nakashima K, Watanabe H, Saitoh H, et al. Dual cellulose-digesting system of the wood-feeding termite, Coptotermes formosanus Shiraki[J]. Insect Biochemistry and Molecular Biology, 2002, 32(7): 777-784.
[7] Ni J, Tokuda G. Lignocellulose-degrading enzymes from termites and their symbiotic microbiota[J]. Biotechnology advances, 2013, 31(6): 838-850.
[8] Inoue T, Murashima K, Azuma J I, et al. Cellulose and Xylan Utilisation in the Lower Termite Reticulitermes speratus [J]. Journal of insect physiology, 1997, 43(3): 235-242.
[9] Nakashima K, Azuma J. Distribution and properties of endo-β-1, 4-glucanase from a lower termite, Coptotermes formosanus (Shiraki)[J]. Bioscience biotechnology and biochemistry, 2000, 64(7): 1500-1506.
[10] Fujita A, Hojo M, Aoyagi T, et al. Details of the digestive system in the midgut of Coptotermes formosanus Shiraki[J]. Journal of wood science, 2010, 56(3): 222-226.
[11] Zhang D, Allen A B, Lax A R. Functional analyses of the digestive β-glucosidase of Formosan subterranean termites (Coptotermes formosanus)[J]. Journal of insect physiology, 2012, 58(1): 205-210.
[12] Tokuda G, Saito H, Watanabe H. A digestive β-glucosidase from the salivary glands of the termite, Neotermes koshunensis (Shiraki): distribution, characterization and isolation of its precursor cDNA by 5′-and 3′-RACE amplifications with degenerate primers[J]. Insect biochemistry and molecular biology, 2002, 32(12): 1681-1689.
[13] Inoue T, Moriya S, Ohkuma M, et al. Molecular cloning and characterization of a cellulase gene from a symbiotic protist of the lower termite, Coptotermes formosanus [J]. Gene, 2005, 349: 67-75.
[14] Watanabe H, Nakashima K, Saito H, et al. New endo-β-1, 4-glucanases from the parabasalian symbionts, Pseudotrichonympha grassii and Holomastigotoides mirabile of Coptotermes termites[J]. Cellular and Molecular Life Sciences CMLS, 2002, 59(11): 1983-1992.
[15] Nakashima K, Watanabe H, Azuma J I. Cellulase genes from the parabasalian symbiont Pseudotrichonympha grassii in the hindgut of the wood-feeding termite Coptotermes formosanus[J]. Cellular and Molecular Life Sciences CMLS, 2002, 59(9): 1554-1560.
[16] 杜蕾蕾. 黑胸散白蟻(Reticulitermes chinese Snyder)腸道纖維素酶GHF7基因的克隆與分析[D]. 武漢:華中師范大學, 2008.
[17] Todaka N, Inoue T, Saita K, et al. Phylogenetic analysis of cellulolytic enzyme genes from representative lineages of termites and a related cockroach[J]. PloS one, 2010, 5(1): 8636.
[18] Azuma J, Kanai K, Murshima K, et al. < Original> Studies on Digestive System of Termites III.: Digestibility of Xylan by Termite Reticulitermes speratus (Kolbe)[J]. Wood research: bulletin of the Wood Research Institute Kyoto University, 1993, 79: 41-51.
[19] Smith J A, Koehler P G. Changes in Reticulitermes flavipes (Isoptera: Rhinotermitidae) gut xylanolytic activities in response to dietary xylan content[J]. Annals of the Entomological Society of America, 2007, 100(4): 568-573.
[20] Arakawa G, Watanabe H, Yamasaki H, et al. Purification and molecular cloning of xylanases from the wood-feeding termite, Coptotermes formosanus Shiraki[J]. Bioscience biotechnology and biochemistry, 2009, 73(3): 710-718.
[21] Ni J, Tokuda G. Lignocellulose-degrading enzymes from termites and their symbiotic microbiota[J]. Biotechnology advances, 2013, 31(6): 838-850.
[22] Mattéotti C, Bauwens J, Brasseur C, et al. Identification and characterization of a new xylanase from Gram-positive bacteria isolated from termite gut (Reticulitermes santonensis)[J]. Protein expression and purification, 2012, 83(2): 117-127.
[23] Xie L, Zhang L, Zhong Y, et al. Profiling the metatranscriptome of the protistan community in Coptotermes formosanus with emphasis on the lignocellulolytic system[J]. Genomics, 2012, 99(4): 246-255.
[24] Todaka N, Moriya S, Saita K, et al. Environmental cDNA analysis of the genes involved in lignocellulose digestion in the symbiotic protist community of Reticulitermes speratus[J]. FEMS microbiology ecology, 2007, 59(3): 592-599.
[25] Tartar A, Wheeler M M, Zhou X, et al. Parallel metatranscriptome analyses of host and symbiont gene expression in the gut of the termite Reticulitermes flavipes[J]. Biotechnol Biofuels, 2009, 2(1): 25.
[26] Cairo J, Leonardo F C, Alvarez T M, et al. Functional characterization and target discovery of glycoside hydrolases from the digestome of the lower termite Coptotermes gestroi[J]. Biotechnology for Biofuels, 2011, 4(1): 1-11.
[27] Zhang D, Lax A R, Henrissat B, et al. Carbohydrate-active enzymes revealed in Coptotermes formosanus (Isoptera: Rhinotermitidae) transcriptome[J]. Insect molecular biology, 2012, 21(2): 235-245.
[28] Zhang D, Lax A R, Bland J M, et al. Characterization of a new endogenous endo-β-1, 4-glucanase of Formosan subterranean termite (Coptotermes formosanus)[J]. Insect biochemistry and molecular biology, 2011, 41(4): 211-218.
[29] Todaka N, Lopez C M, Inoue T, et al. Heterologous expression and characterization of an endoglucanase from a symbiotic protist of the lower termite, Reticulitermes speratus[J]. Applied biochemistry and biotechnology, 2010, 160(4): 1168-1178.
[30] Ni J, Tokuda G, Takehara M, et al. Heterologous expression and enzymatic characterization of. BETA.-glucosidase from the drywood-eating termite, Neotermes koshunensis[J]. Applied entomology and zoology, 2007, 42(3): 457-463.
[31] Mattéotti C, Bauwens J, Brasseur C, et al. Identification and characterization of a new xylanase from Gram-positive bacteria isolated from termite gut (Reticulitermes santonensis)[J]. Protein expression and purification, 2012, 83(2): 117-127.
[32] Tsukagoshi H, Nakamura A, Ishida T, et al. The GH26 β-mannanase RsMan26H from a symbiotic protist of the termite Reticulitermes speratus is an endo-processive mannobiohydrolase: Heterologous expression and characterization[J]. Biochemical and biophysical research communications, 2014, 452(3): 520-525.
[33] Radek R. Flagellates, bacteria, and fungi associated with termites: diversity and function in nutrition-a review[J]. Ecotropica, 1999, 5(1): 183-196.
[34] 楊 紅.木食性散白蟻腸道共生細菌的區系結構和多樣性[D]. 武漢:華中師范大學, 2004.
[35] Tanaka H, Aoyagi H, Shina S, et al. Influence of the diet components on the symbiotic microorganisms community in hindgut of Coptotermes formosanus Shiraki[J]. Applied microbiology and biotechnology, 2006, 71(6): 907-917.
[36] Abe T, Bignell D E, Higashi M. Termites: Evolution, Sociality, Symbioses[J]. Ecology, 2000, 466.
[37] 陳 娟. 兩種木食性白蟻腸道內共生細菌多樣性的比較研究[D]. 武漢:華中師范大學, 2011.
[38] Biology of Termites: a Modern Synthesis: A Modern Synthesis[M]. Springer, 2010.
[39] 蘇麗娟, 李 琰, 王鳳芹, 等. 白蟻腸道內的共生微生物區系[J]. 江西農業學報, 2011, 23(1): 164-167.
[40] Pester M, Brune A. Hydrogen is the central free intermediate during lignocellulose degradation by termite gut symbionts[J]. The ISME journal, 2007, 1(6): 551-565.
[41] 陳 虹, 梅建鳳, 閔 航. 白蟻腸道微生物[J]. 微生物學雜志, 2005, 25(2): 75-79.
[42] Watanabe H, Tokuda G. Cellulolytic systems in insects[J]. Annual review of entomology, 2010, 55: 609-632.
[43] 高 超, 吳 捷, 尚素琴. 八種白蟻的兵蟻和工蟻消化道形態比較研究 (等翅目)[J]. 昆蟲分類學報, 2011, 33(3): 176-187.
[44] Tokuda G, Tsuboi Y, Kihara K, et al. Metabolomic profiling of 13C-labelled cellulose digestion in a lower termite: insights into gut symbiont function[J]. Proceedings of the Royal Society of London B: Biological Sciences, 2014, 281(1789): 20140990.
The Mechanism of Degrading Lignocelluloses Effectively in Lower-animal Termites /
YE Mei-ying1, CHEN Xue2, LIU Yan-ping1/
(1.Department of Environmental Science & Engineering,Beijing University of Chemical Technology, Beijing 100029, China; 2.China Power Conservation & Environment Protection Co Ltd, Beijing 100020, China)
The low cost and high efficient degradation of lignocelluloses are needing more intensive studies for its resource utilization. Some lower level animals as termite have efficient “bio-reactor” in the body, which contains rich lignocellulose degradation enzyme and high efficient microbial resources, under their dual action the cellulose and hemicellulose could be efficiently degraded. In this paper, the degradation system of animal sourced lignocelluloses in termites was analyzed. The enzyme system of lignocelluloses degradation, the symbiotic microorganisms, their functions, the degradation mechanisms in termites, and the heterogonous expression of enzyme, were stated. Using molecular biological techniques, cellulase and hemicellulase could be expressed heterologously, and the expression products had high activity.
lower level animal; termite; lignocellulos-degrading enzymes; symbiotic microorganism; heterologous expression
2016-01-11
項目來源: “十二五”科技支撐項目(2015BAD21B03, 2014BAC24B01)
葉美瀛(1990-),男,在讀碩士,研究方向為固體廢棄物資源化利用,E-mail:ymgau@sina.com
劉研萍,E-mail:liushuihan@163.com
S216.4;TQ35
A
1000-1166(2016)02-0018-06

