人PD-L1基因啟動子克隆及其熒光素酶報告基因載體的構建
豐江舟,楊夢夢,朱彬彬,曹文清,鄭立春,周興路,王 潞,吳志浩
(1.皖南醫學院第一附屬醫院 弋磯山醫院 腫瘤內科,安徽 蕪湖 241001;2.皖南醫學院 麻醉學院,安徽 蕪湖 241002;3.皖南醫學院 法醫學院,安徽 蕪湖 241002;4.皖南醫學院 醫學影像與檢驗學院,安徽 蕪湖 241002;5.皖南醫學院 醫學生物學教研室,安徽 蕪湖 241002)
?
·基礎醫學·
人PD-L1基因啟動子克隆及其熒光素酶報告基因載體的構建
豐江舟1,楊夢夢2,朱彬彬3,曹文清2,鄭立春4,周興路4,王 潞1,吳志浩5
(1.皖南醫學院第一附屬醫院 弋磯山醫院 腫瘤內科,安徽 蕪湖 241001;2.皖南醫學院 麻醉學院,安徽 蕪湖 241002;3.皖南醫學院 法醫學院,安徽 蕪湖 241002;4.皖南醫學院 醫學影像與檢驗學院,安徽 蕪湖 241002;5.皖南醫學院 醫學生物學教研室,安徽 蕪湖 241002)
目的:對人源PD-L1基因啟動子進行PCR擴增,構建PD-L1熒光素酶報告基因。 方法:用PCR擴增方法獲得PD-L1基因啟動子;PD-L1啟動子和載體行KpnⅠ、XhoⅠ酶切、連接和轉化,然后行菌落PCR以及測序等。構建成功后轉染至A549細胞中并檢測PD-L1啟動子活性。 結果:經PCR方法擴增出PD-L1基因啟動子片段,;菌落PCR鑒定各重組體構建正確并經生工測序成功;瞬時轉染A549細胞后經報告基因檢測得知所克隆的不同片段序列具有啟動子活性。 結論:成功克隆PD-L1基因啟動子,構建出不同片段基因啟動子熒光素酶報告基因,為進一步研究其分子機制提供詳實基礎。
PD-L1;啟動子克隆;雙熒光素酶報告基因
【DOI】10.3969/j.issn.1002-0217.2016.06.004
程序性細胞死亡蛋白1(programmed death-1,PD-1)為PDCD1基因編碼的Ⅰ型跨膜糖蛋白[1],PD-1表達于活化的免疫細胞表面,如CD4+T細胞、B細胞等[2]。PD-L1(programmed death-1-ligand 1,程序性死亡配體-1)是程序性細胞死亡蛋白1的配體之一,同屬CD28/B7家族。PD-L1多表達于腫瘤細胞表面,如PD-L1在乳腺癌[3]、非小細胞肺癌[4]、黑色素瘤[5]等癌細胞表面都呈過表達。腫瘤細胞表面的PD-L1與免疫細胞表面的PD-1結合后可抑制免疫細胞的增殖與活性并可誘導免疫細胞凋亡,從而對機體免疫應答過程起負性調節作用[6-7]。PD-1/PD-L1通路在腫瘤細胞的免疫逃逸中具有重大意義,近年來越來越多與此相關的實驗得以開展,并且PD-1單克隆抗體、PD-L1單克隆抗體在晚期腫瘤病人身上發揮驚人的療效。 目前關于調控PD-L1的分子機制尚未明了,為了深入研究其調控機制,我們克隆了PD-L1基因啟動子,并構建到報告基因載體PGL3-Basic上,然后對其啟動因子活性進行初步檢測。
1 材料與方法
1.1 材料 DMEM培養基,購自Gibco公司;Lipofectamine2000,購自invitrogen 公司;E.coli DH5α Competent Cells為TaKaRa公司產品; pGL3-Basic質粒、質粒小量提取試劑盒,購自 Promega公司; KpnⅠ、XhoⅠ,購自NEW ENGLAND BioLabs; T4 DNA連接酶,Takara公司;A549細胞,本室凍存。
1.2 方法
1.2.1 PD-L1基因系列啟動子的擴增
1.2.1.1 引物設計 在NCBI網站中根據PD-L1基因序列,選擇啟動子區域。設計5對引物,其中1987 bp片段的擴增引物如下,上游5′-TCTCCGGGTAGTTGATCAATTGTATGG-3′;1375 bp的擴增引物為:上游5′-TCCTAGAGGTCACAGTCACCAAAGTTG-3′;1011 bp的擴增引物為:上游5′-AGAAGGAAAGGCAAACAACGAAGAGTC-3′;632 bp的擴增引物為:上游5′-TCATTATGTCGAGGAACTTTGAGGAAG-3′; 145 bp的擴增引物為:上游5′-TCACCGAAGGTCAGGAAAGTCCAACGC-3′;下游引物共為:5′-GGAGCCTCGGGAAGCTGCGCAGAACTG-3′。
1.2.1.2 PCR擴增 對A549細胞運用細胞基因組提取試劑盒提取基因組,提取的基因組DNA為PCR擴增的模板,PCR反應條件:預變性94℃、3 min;變性94℃、30 s,退火61℃、30 s,延伸72℃、60 s,共30 個循環,延伸72℃、5 min。擴增的PCR產物經1%的瓊脂糖凝膠電泳分析。
1.2.2 PD-L1熒光素酶報告基因重組質粒的構建與鑒定 將上述克隆的系列PD-L1啟動子和PGL3-Basic載體分別經KpnⅠ、XhoⅠ雙酶切、連接,然后進行轉化。挑取單克隆菌落做菌落PCR鑒定其陽性的克隆,然后陽性的克隆再次進行搖菌,保種后行質粒提取并送往上海生工生物工程有限公司測序。
1.2.3 PD-L1基因啟動子報告基因載體轉染A549細胞與活性檢測 將上述構建的質粒進行轉染,質粒轉染操作按轉染試劑說明書嚴格進行。在細胞轉染質粒兩天后,進行收樣等處理,利用雙螢光檢測試劑盒在螢光檢測儀GloMax20/20(Promega 公司)上檢測螢火蟲和海腎螢光素酶活力。實驗重復3次,每次平行做3個復孔。
1.2.4 統計學分析 應用GraphPad Prism 5 軟件的t-test方法進行統計學分析,P<0.05為差異有統計學意義。
2 結果
2.1 PD-L1不同片段啟動子的克隆 以A549細胞基因組DNA為模板,克隆出5段啟動子,分別命名為F1:1987 bp,F2:1375 bp,F3:1011 bp,F4:632 bp,F5:145 bp。將克隆出的目的片段進行1%瓊脂糖電泳分析,其結果與所設計的PD-L1片段大小一致,表明PD-L1不同片段啟動子的克隆成功(圖1)。
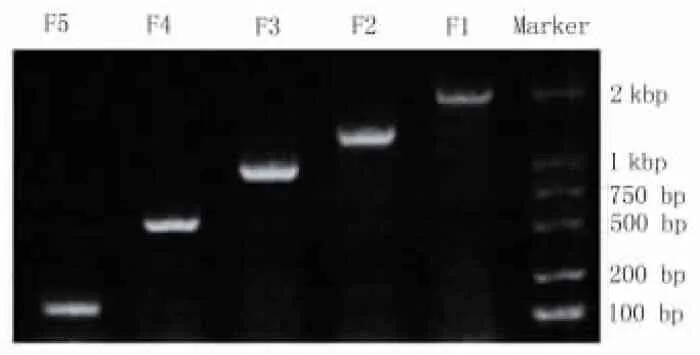
圖1 PCR產物瓊脂糖凝膠電泳圖
2.2 PD-L1啟動子報告基因載體的PCR鑒定 根據實驗需求,選取1011 bp、632 bp和145 bp的PD-L1啟動子及選取熒光素酶報告基因載體pGL3-Basic進行酶切、連接和轉化。挑取單個菌落作模板加入相應上下游引物等進行菌落PCR,初步證實重組體構建成功。圖2中圖A、B 和C分別為構建的不同片段的PD-L1熒光素酶報告基因載體熒光素酶報告基因菌落PCR結果。

圖2 PD-L1啟動子熒光素酶報告基因質粒菌落PCR鑒定結果
2.3 啟動子活性的檢測 在12孔板A549細胞中,轉染與螢光素酶基因融合的PD-L1 promoter,并且與海腎螢光素酶基因以1000∶1的比例共轉。轉染空載pGL3-Basic質粒為對照,pGL3-Basic-PDL1 Promoter F3、pGL3-Basic-PDL1 Promoter F4和pGL3-Basic-PDL1 Promoter F5重組體為3個實驗組。轉染48 h后利用Promega 公司的Dual-Luciferase Reporter Assay Systerm(雙螢光素酶報告基因檢測系統)檢測顯示,pGL3-Basic-PDL1 Promoter F3、pGL3-Basic-PDL1 Promoter F4和pGL3-Basic-PDL1 Promoter F5與對照PGL3-Basic相比顯著升高,結果具有顯著的統計學差異(P<0.01),由此可見所克隆的報告基因具有啟動子活性(圖3)。

**P<0.01,***P<0.01。
圖3 雙熒光素酶報告基因法檢測PD-L1啟動子活性
3 討論
兩種新的PD-1/PD-L1 抗體被批準用于不能手術或者轉移性黑色素瘤的治療[8]。除了惡性黑色素瘤,PD-1/PD-L1 抗體在肺癌病人中也顯示出令人驚喜的療效。我們運用PCR擴增、酶切、連接等實驗方法克隆出不同片段的PD-L1啟動子,然后經過菌落PCR鑒定和測序驗證,證實成功構建PD-L1基因啟動子報告基因。在此基礎上,經熒光素酶報告基因檢測發現與空載體對照組相比所構建的PD-L1啟動子報告基因具有明顯的啟動子活性。
據相關研究報道,PD-L1在人體多種腫瘤細胞表面均有表達,促進腫瘤細胞表面高表達PD-L1的相關因素大體可分為腫瘤細胞外在因素和內在因素。腫瘤微環境中外在刺激促進PD-L1表達主要通過激活TLRs和IFN-γ受體,進而激活下游信號通路,如NF-kB[9]、MAPK[10]、PI3K[11]和JAK/STAT[12]信號轉導通路等;腫瘤細胞內在因素促進PD-L1表達,主要是通過抑癌基因LKB1和Pten[13]缺失來激活PI3K/Akt/mTOR通路,核增殖抗原Ki-67的活化[14],EGFR通路的激活[15]等途徑來促進腫瘤細胞表面高表達PD-L1。目前報道的腫瘤細胞中調控PD-L1表達的相關信號通路主要有Akt信號通路和MAPK信號通路。為了研究腫瘤細胞在轉錄水平上對PD-L1的調控機制,我們運用PCR擴增、酶切和連接等實驗技術構建了人PD-L1基因啟動子熒光素酶報告基因,并根據相關信號通路的轉錄因子在PD-L1啟動子區域的潛在結合位點構建出不同片段的PD-L1基因熒光素酶報告基因,以明確該信號通路在轉錄水平這方面促進PD-L1的轉錄,以及根據不同片段的PD-L1報告基因來明確促進PD-L1轉錄的具體轉錄因子。我們可明確該信號通路的轉錄因子可促進PD-L1的轉錄從而促進PD-L1的表達,阻斷該信號轉導通路腫瘤細胞表達的PD-L1將明顯下調,從而阻斷腫瘤細胞發生免疫逃逸等惡性事件的發生,同時為臨床抗PD-L1的靶點藥物的研發提供詳實的分子基礎。
[1] CEERAZ S,NOWAK E,NOELLE RJ,etal. B7 family checkpoint regulators in immune regulation and disease[J].Trends Immunol,2013,14: 556-563.
[2] KEIR M,BUTTE,M,FREEMAN GJ,etal. PD-1 and its ligands in tolerance and immunity[J]. J. Annu Rev Immunol,2008,26: 677-704.
[3] SOLIMAN H,KHALIL F,ANTONIA S. PD-L1 Expression is increased in a subset of basal type breast cancer cells[J]. PLoS One,2014,9(2): e88557.
[4] VELCHETI V,SCHALPER KA,CARVAJAL DE,etal. Programmed death ligand-1expression in non-small cell lung cancer[J]. Lab Invest,2014,94(1):107-116.
[5] SPRANGER S,SPAAPEN RM,ZHA Y,etal. Up-regulation of PD-L1,IDO,and Tregs in the melanoma tumor microenvironment is driven by CD8(+)T cells[J]. Transl Med,2013,5(200):2418-2419.
[6] LUSSIER DM,?NEILL L,NIEVES LM,etal. Enhanced T-Cell Immunity to Osteosarcoma Through Antibody Blockade of PD-1/PD-L1 Interactions[J]. J Immunother,2015,38(3):96-106.
[7] BLAKE SJ,CHING AL,KENNA TJ,etal. Blockade of PD-1/PD-L1 promotes adoptive T-Cell immunotherapy in a tolerogenic environment[J]. PLoS One,2015,10(3):e0119483.
[8] OTT PA,HODI FS,ROBERT C. CTLA-4 and PD-1/PD-L1 blockade:new immunotherapeutic modalities with durable clinical benefit in melanoma patients[J]. Clin Cancer Res,2013,19(19):5300-5309.
[9] KONDO A,YAMASHITA T,TAMURA H,etal. Interferongamma and tumor necrosis factor-alpha induce an immunoinhibitory molecule,B7-H1,via nuclear factor-kappaB activation in blasts in myelodysplastic syndromes[J]. Blood,2010,116:1124-1131.
[10]QIAN Y,DENG J,GENG L,etal. TLR4 signaling induces B7-H1 expression through MAPK pathways in bladder cancer cells[J]. Cancer Invest,2008,26:816-821.
[11]CHEN J,FENG Y,LU L,etal. Interferon-gamma-induced PDL1 surface expression on human oral squamous carcinoma via PKD2 signal pathway[J]. Immunobiology,2012,217:385-393.
[12]LEE SJ,JANG BC,LEE SW,etal. Interferon regulatory factor-1 is prerequisite to the constitutive expression and IFN-gamma-induced upregulation of B7-H1 (CD274)[J]. FEBS Lett,2006,580:755-762.
[13]XU C,FILLMORE C,KOYAMA S,etal. Loss of Lkb1 and Pten Leads to Lung Squamous Cell Carcinoma with Elevated PD-L1 Expression[J]. Cancer Cell,2014,25(5):590-604.
[14]GHEBEH H,TULBAH A,MOHAMMED S,etal.Expression of B7-H1 in breast cancer patients is strongly associated with high proliferative Ki-67-expressing tumor cells[J]. Int J Cancer,2007,121:751-758.
[15]AZUMA K,OTA K,KAWAHARA A,etal. Association of PD-L1 overexpression with activating EGFR mutations in surgically resected nonsmall-cell lung cancer[J]. Ann Oncol,2014,25:1935-1940.
Construction of human PD-L1 gene promoter luciferase reporter gene vectors
FENG Jiangzhou,YANG Mengmeng,ZHU Binbin,CAO Wenqing,ZHENG Lichun,ZHOU Xinglu,WANG Lu,WU Zhihao
Department of Medical Oncology,The First Affiliated Hospital of Wannan Medical College,Wuhu 241001,China
Objective:To clone PD-L1 gene promoter for constructing the luciferase reporter gene vectors.Methods:PD-L1 gene promoter was obtained via PCR amplification,and then sub-cloned into luciferase reporter gene vector to construct three different recombinant plasmids that were transfected into A549 cell lines after digestion with enzyme KpnI and Xho I. Then the transcription activation of these promoters was determined.Results:Segments of PD-L1 gene promoter was amplified by PCR. Recombined plasmids were identified by colony PCR and verified through contracted sequencing by Biotechnology (Shanghai,China),which indicated successful construction of the vectors. Transient transfection of the A549 cells showed activation of different sequences of reporter gene.Conclusion:Human PD-L1 gene promoter luciferase reporter gene vector was successfully constructed,which may lay a foundation for following research of the molecular mechanisms of PD-L1.
PD-L1; promoter cloning; dual luciferase reporter gene
1002-0217(2016)06-0524-03
2016-09-09
豐江舟( 1989-) ,男,2014 級碩士研究生,(電話)18315361831,(電子信箱) feng421937821@ 163.com; 王 潞,女,主任醫師,(電子信箱) lucyyjs@163.com 通信作者; 吳志浩,男,教授,(電子信箱)zwu2ster@163.com,通信作者.
R 346
A

