雷公藤甲素對U251細胞自噬活性的影響及機制研究*
惠 雙,郭宏強,王 博,王 媛,張成輝
(1.河南省南陽市中心醫院腫瘤內科 473000;2.鄭州大學附屬腫瘤醫院腫瘤內科,鄭州 450000)
?
雷公藤甲素對U251細胞自噬活性的影響及機制研究*
惠 雙1,郭宏強2,王 博1,王 媛1,張成輝1
(1.河南省南陽市中心醫院腫瘤內科 473000;2.鄭州大學附屬腫瘤醫院腫瘤內科,鄭州 450000)
目的 探討雷公藤甲素對U251細胞自噬活性的影響及機制。方法 采用四甲基偶氮唑藍(MTT)法檢測雷公藤甲素對U251細胞的增殖抑制率、半數抑制濃度(IC50);免疫熒光化學法測定細胞中LC3-Ⅱ表達,Westernblot法測定LC3-Ⅱ/LC3-Ⅰ、Beclin-1、磷酸化P70、磷酸化Erk、磷酸化AKT蛋白的表達。結果 雷公藤甲素作用于U251細胞后,細胞增殖受抑制,24h的IC50為0.73μmol/L,48h的IC50為0.27μmol/L。免疫熒光法測定6、12、24h后LC3-Ⅱ水平增高;Westernblot法測定LC3-Ⅱ水平、LC3-Ⅱ/LC3-Ⅰ比值隨時間增高;Beclin-1水平增高,磷酸化P70、磷酸化Erk表達降低、磷酸化AKT無明顯變化。結論 雷公藤甲素可抑制U251細胞增殖并促進自噬,并可通過上調Beclin-1表達和抑制mTOR的活性來促進自噬。
雷公藤內酯;自噬;膠質母細胞瘤;U251細胞
膠質瘤是源于神經外胚層間質細胞的顱內惡性腫瘤,約占顱腦腫瘤的50%。其中多形膠質母細胞瘤是較常見的一種病理類型,標準治療為手術和術后放射治療。其惡性程度高,治療效果差,接受標準治療患者的中位生存期僅為9個月[1]。近年來,對該病治療進展主要在替莫唑胺同步放化療并聯合化療或靶向治療,但仍未能明顯提高其療效[2]。因此,尋求有效的治療藥物對于多形膠質母細胞瘤的治療有著重要意義。雷公藤甲素是中藥材雷公藤的一種提取成分,具有抗炎、免疫抑制、抗腫瘤、抗生育等多種作用[3-6]。有文獻表明雷公藤甲素可影響膠質瘤細胞周期調控和促進凋亡[7-8]。雷公藤甲素作用于多形膠質母細胞瘤細胞系U251細胞,發現其能促進細胞自噬和抑制細胞增殖,本研究初步研究其發生機制,現報道如下。
1 材料與方法
1.1 材料 U251細胞系由鄭州大學附屬腫瘤醫院中心實驗室提供;雷公藤甲素標準品由福建漢堂生物制藥公司提供;四甲基偶氮唑藍(MTT)、免疫熒光試劑盒、細胞總蛋白提取試劑盒為上海生物工程有限公司產品;鼠抗人單克隆抗體、兔抗鼠酶標二抗為上海碧云天生物公司產品;PE標記單抗、流式細胞儀(FACSCanto Ⅱ型)為美國BD公司產品;酶聯免疫吸附實驗(ELISA)比色儀:Metertech.∑960型,蛋白電泳儀:A131154型。
1.2 方法
1.2.1 細胞培養 實驗選用含有10%滅活小牛血清,青霉素和鏈霉素各100 KU/L的RPMI-1640培養液,將U251細胞加入該培養液置于37 ℃、5%CO2孵箱內懸浮培養。
1.2.2 細胞增殖抑制的檢測 將處于對數生長期U251細胞以3×108/L濃度接種于96孔培養板,加入終濃度為0、0.01、0.10、0.30、0.50 μmol/L的雷公藤甲素,對照組加入等量的RPMI-1640培養液,各孵育60 h。每12 h收集各組U251細胞,使用MTT法在ELISA比色儀570 nm處記錄吸光度(A)值,并計算出不同濃度組雷公藤甲素在各時間點對U251細胞的增殖抑制率及半數抑制濃度(IC50)。每濃度組設5個平行副孔測均值。增殖抑制率=(對照孔A值-各濃度孔A值)/對照孔A值×100%,IC50由線性回歸方程求得。
1.2.3 免疫熒光法測定U251細胞LC3-Ⅱ蛋白的表達 將加入0.20 μmol/L雷公藤甲素培養的U251細胞組設為實驗組,加入等量生理鹽水的U251細胞設為對照組。培養6、12、24 h后收集各組細胞,上離心機以3 000 r/min 分離細胞,用磷酸鹽緩沖液(PBS)洗滌后于多聚賴氨酸玻片上進行細胞涂片;使用4%多聚甲醛固定30 min后,用PBS洗滌3次后晾干。置于37 ℃用山羊血清封閉20 min,加入鼠抗人LC3-Ⅱ一抗置4 ℃冰箱過夜。再次用PBS洗滌3次后,加入熒光素標記兔抗鼠二抗,置于37 ℃孵育15 min后,封片劑封片。熒光顯微鏡下觀察并攝像。
1.2.4 Western blot法測細胞自噬相關蛋白的表達 分組及培養方法同免疫熒光法。各組收集細胞2×107,用細胞總蛋白提取試劑盒,裂解細胞,4 ℃離心機以12 000 g分離蛋白。加入PBS液煮沸5 min后上樣,12%聚丙烯酰胺凝膠進行電泳。電轉法轉膜后,用2%牛血清清蛋白-磷酸鹽緩沖液(BSA-PBS)封閉過夜,次日加鼠抗人單抗于37 ℃孵育4 h,PBS依次沖洗3次,加辣根過氧化物酶(HRP)標記的二抗置37 ℃孵育1 h,PBS再次沖洗3次,加電化學發光(ECL)發光液顯色,置暗室曝光顯影,用圖像分析軟件記錄圖片數據帶灰度分析,用該法測定實驗組和對照組LC3-Ⅰ、LC3-Ⅱ、Beclin-1、磷酸化P70、磷酸化Erk、磷酸化AKT蛋白的表達。

2 結 果
2.1 雷公藤甲素對U251細胞的增殖抑制 不同濃度雷公藤甲素對U251細胞均存在增殖抑制作用,見表1、圖1。24、48h的雷公藤甲素對U251細胞的IC50為0.73μmol/L和0.27μmol/L。

圖1 不同濃度雷公藤甲素對U251細胞增殖抑制率曲線
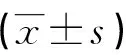
表1 不同濃度雷公藤甲素對U251細胞的增殖抑制作用

圖2 免疫熒光法測定U251細胞中LC3-Ⅱ蛋白的表達

圖3 Western blot法測定LC3-Ⅰ和LC3-Ⅱ蛋白的表達
2.2 免疫熒光顯微鏡下觀察細胞 將實驗組和對照組細胞置于熒光顯微鏡下發現,對照組細胞質中LC3-Ⅱ熒光信號極低且隨時間無明顯變化,實驗組細胞質LC3-Ⅱ熒光信號隨時間而明顯增強,見圖2。
2.3Westernblot法測定LC3-Ⅰ和LC3-Ⅱ蛋白的表達 隨時間延長,實驗組LC3-Ⅱ蛋白表達明顯增加,LC3-Ⅱ/LC3-Ⅰ比值也逐漸增高。對照組LC3-Ⅱ表達較低,隨時間無明顯變化,見圖3。實驗組與對照組相比,在6、12、24h后,LC3-Ⅰ相對表達度、LC3-Ⅱ相對表達度、LC3-Ⅱ/LC3-Ⅰ比值差異有統計學意義(P<0.05)。
2.4Westernblot法測定Beclin-1、磷酸化P70、磷酸化Erk、磷酸化AKT蛋白的表達 用Westernblot法測定第24h的實驗及對照組各蛋白表達差異,發現實驗組Beclin-1組較對照組明顯增高,而實驗組磷酸化P70、磷酸化Erk較對照組明顯降低,磷酸化AKT兩組無明顯差異,見圖4。實驗組與對照組相比,Beclin-1、磷酸化P70、磷酸化Erk蛋白相對表達度差異有統計學意義(P<0.05),磷酸化-AKT蛋白相對表達度差異無統計學意義(P>0.05)。

圖4 Western blot法測定Beclin-1、磷酸化-P70、磷酸化-Erk、磷酸化-AKT蛋白的表達
3 討 論
細胞自噬是真核生物細胞內溶酶體依賴性的蛋白質或細胞器降解過程,是細胞應激的一種表現。自噬與腫瘤的增殖調控,能量代謝,凋亡調控,免疫逃逸,轉移浸潤,微環境改變等諸多生物學行為密切相關[9-13],研究腫瘤細胞的自噬屬性對于腫瘤的防治有著重要的意義。
微管相關輕鏈蛋白3 (LC3)在自噬體的輸送和與溶酶體的融合過程起重要作用,其活性體LC3-Ⅱ定位于自噬體外膜,LC3-Ⅱ/LC3-Ⅰ比值是反映自噬強度的一個重要指標[13-14]。Beclin-1在自噬體隔膜隔離和囊泡封閉過程中起重要作用,其可與P53蛋白、B細胞淋巴瘤2(Bcl-2)蛋白家族等多種蛋白相互作用而影響自噬[15]。雷帕霉素靶蛋白(mTOR)是自噬信號轉導通路的一個樞紐,活化型mTOR復合體通過抑制ULK1-FIP200-Atg13復合體激活從而抑制自噬,P70是mTOR一個重要底物,實驗常以P70數量反映mTOR活性[9,16],Ras/MAPK/Erk/mTOR通路和PI3KI/AKT/mTOR通路是mTOR上游2個重要通路,由多種生長因子信號介導,通過激活mTOR實現對自噬的抑制[16-17]。本實驗發現雷公藤甲素可誘導U251細胞自噬而抑制其生長,并明確了此作用的部分機制:(1)增強Beclin-1表達;(2)下調Erk表達,從Ras/MAPK/Erk/mTOR通路抑制mTOR活性。
本研究為臨床應用雷公藤甲素治療膠質母細胞瘤提供了理論依據和實驗室數據。雷公藤甲素誘導U251細胞自噬的其他機制,本課題組正在研究中并將陸續發表研究成果。
[1]StewartLA.Chemotherapyinadulthigh-gradeglioma:asystematicreviewandmeta-analysisofindividualpatientdatafrom12randomisedtrials[J].Lancet,2002,359(9311):1011-1018.
[2]StuppR,HegiME,MasonWP,etal.EffectsofradiotherapywithconcomitantandadjuvanttemozolomideversusradiotherapyaloneonsurvivalinglioblastomainarandomisedphaseⅢstudy:5-yearanalysisoftheEORTC-NCICtrial[J].LancetOncol,2009,10(5):459-466.
[3]居星耀.雷公藤甲素誘導H22細胞凋亡作用研究[J].現代中西醫結合雜志,2007,16(5):586-587,597.
[4]于艷秋,張義俠,金玉楠,等.雷公藤多甙對急性移植物抗宿主病小鼠的作用[J].中國實驗血液學雜志,2006,14(5):928-933.
[5]PhillipsPA,DudejaV,MccarrollJA,etal.Triptolideinducespancreaticcancercelldeathviainhibitionofheatshockprotein70[J].CancerRes,2007,67(19):9407-9416.
[6]AntonoffMB,ChughR,Borja-CachoD,etal.Triptolidetherapyforneuroblastomadecreasescellviabilityinvitroandinhibitstumorgrowthinvivo[J].Surgery,2009,146(2):282-290.
[7]ZhangHP,ZhuWB,SuXW,etal.Triptolideinhibitsproliferationandinvasionofmalignantgliomacells[J].JNeurooncol,2012,109(1):53-62.
[8]LinJ,ChenL,LinZ,etal.Inhibitoryeffectoftriptolideonglioblastomamultiformeinvitro[J].JIntMedRes,2007,35(4):490-496.
[9]RabinowitzJD,WhiteE.Autophagyandmetabolism[J].Science,2010,330(6009):1344-1348.
[10]SuiX,ChenR,WangZ,etal.Autophagyandchemotherapyresistance:apromisingtherapeutictargetforcancertreatment[J].CellDeathDis,2013(4):e838.
[11]WhiteE.Deconvolutingthecontext-dependentroleforautophagyincancer[J].NatRevCancer,2012,12(6):401-410.
[12]MathewR,WhiteE.Autophagyintumorigenesisandenergymetabolism:friendbyday,foebynight[J].CurrOpinGenetDev,2011,21(1):113-119.
[13]TanidaI,UenoT,KominamiE.LC3andAutophagy[J].MethodsMolBiol,2008,445(1):77-88.
[14]KumaA,MatsuiM,MizushimaN.Aggregatesindependentofautophagy:cautionintheinterpretationofLC3localization[J].Autophagy,2007,3(4):323-328.
[15]BlanderJM.Along-awaitedmergerofthepathwaysmediatinghostdefenceandprogrammedcelldeath[J].NatRevImmunol,2014,14(9):601-618.
[16]YangZF,KlionskyDJ.Mammalianautophagy:coremolecularmachineryandsignalingregulation[J].CurrOpinCellBiol,2010,22(2):124-131.
[17]BaehreckeEH.Autophagy:dualrolesinlifeanddeath?[J].NatRevMolCellBiol,2005,6(6):505-510.
The influence and mechanism of Triptolide on autophagy in human glioma cell line U251*
HuiShuang1,GuoHongqiang2,WangBo1,WangYuan1,ZhangChenghui1
(1.DepartmentofOncology,CentralHospitalofNanyangCity,Nanyang,Henan473000,China;2.DepartmentofOncology,AffiliatedTumorHospitalofZhengzhouUniversity,Zhengzhou,Henan450000,China)
Objective To explore the variation of autophagic activity in U251 cells after treatment with Triptolide and its mechanisms.Methods We measured the proliferation inhibition rate,half inhibitory concentration (IC50) by MTT assay;LC3-Ⅱ protein expression were tested by immunofluorescence assay;protein expression of LC3-Ⅱ/LC3-Ⅰ,Beclin-1,Phospho-P70,Phospho-Erk and Phospho-AKT were measures by Western blot.Results After treatment with Triptolide,the proliferation of U251 cells was inhibited,with theIC50of 0.73 μmol/L at 24 h and theIC50of 0.27 μmol/L at 48 h;the expression of LC3-Ⅱ were increased at 6,12,24 h;the expression of LC3-Ⅱ,LC3-Ⅱ/LC3-Ⅰ and Beclin-1 increased,the expression of Phospho-P70 and Phospho-Erk decreased and the expression of Phospho-AKT had no obvious change.Conclusion Triptolide could inhibit the proliferation of U251 cells and induce cell autophagy;Triptolide could increase the autophagy by upregulating Beclin-1 expression and inhibiting the activity of mTOR.
Triptolide;autophagy;glioblastoma;U251 cells
國家自然科學基金青年基金(81101797)。 作者簡介:惠雙(1976-),副主任醫師,碩士,主要從事腫瘤的內科治療及腫瘤的分子病理學方面研究。
論著·基礎研究
10.3969/j.issn.1671-8348.2016.23.004
R
A
1671-8348(2016)23-3179-03
2016-04-16
2016-06-21)

