胰腺癌細胞中TGF-β1對Foxp3表達的影響
曹亞峰,衣 昕
(1.同濟大學附屬楊浦區中心醫院血液科,上海 200090;2.南通大學醫學院人體解剖學系,江蘇南通 226001)
?
·經驗交流·
胰腺癌細胞中TGF-β1對Foxp3表達的影響
曹亞峰1,衣 昕2△
(1.同濟大學附屬楊浦區中心醫院血液科,上海 200090;2.南通大學醫學院人體解剖學系,江蘇南通 226001)
目的 探討胰腺癌細胞分泌的轉化生長因子β1(TGF-β1)對正常人外周血單個核細胞(PBMC)轉錄因子Foxp3表達的影響。方法 利用Transwell小室建立胰腺癌細胞CF-PAC1與PBMC的共培養體系,分為A組(PBMC),B組(PBMC-CF-PAC1),C組[PBMC-CF-PAC1+TGF-β1抗體(1 μL)],D組[PBMC-CF-PAC1+TGF-β1抗體(2 μL)],E組[PBMC-CF-PAC1+TGF-β1抗體(4 μL)],F組[PBMC-CF-PAC1+TGF-β1抗體(8 μL)],G組[PBMC-CF-PAC1+TGF-β1抗體(16 μL)]。采用酶聯免疫吸附法檢測共培養體系中加入TGF-β1抗體前、后細胞培養液中TGF-β1的水平。采用Western blot法、免疫熒光方法檢測共培養體系中加入TGF-β1抗體前、后PBMC中Foxp3的表達量。結果 A組TGF-β1平均濃度為(12.44±2.08)ng/mL,B組TGF-β1平均濃度為(14.12±1.25)ng/mL,兩組比較差異有統計學意義(P<0.05)。隨著加入TGF-β1抗體濃度的增加,各組TGF-β1水平呈遞減趨勢(P<0.05)。B組PBMC中Foxp3蛋白相對表達量明顯高于A組(P<0.05),其余6組PBMC細胞中Foxp3蛋白的表達量隨著加入TGF-β1抗體濃度的增加,呈遞減趨勢(P<0.05)。結論 胰腺癌細胞可通過調整腫瘤微環境中TGF-β1影響PBMC細胞中Foxp3蛋白的表達。
胰腺腫瘤;受體,轉化生長因子β;外周血單個核細胞;轉化生長因子β1;Foxp3
Sakaguchi等[1]學者研究證實天然CD4+CD25+調節性T細胞(regulatory T cell,Treg)具有免疫抑制作用,此類細胞以“主動”的方式調控機體免疫應答及免疫耐受,在移植免疫、腫瘤免疫中發揮著重要的作用。當機體逐漸形成惡性腫瘤時,Treg細胞會產生大量包括轉化生長因子-β1(TGF-β1)在內的免疫抑制因子,顯著抑制抗腫瘤免疫。Foxp3在構建Treg體系中起主導作用,對Treg的形成和功能發揮具有重要的作用,是叉頭樣轉錄因子家族中的一員,被認為是Treg細胞標志性分子[2-3]。本研究采用正常人外周血中分離出正常人外周血中單個核細胞(PBMC),體外培養胰腺癌細胞CF-PAC1、利用Transwell小室建立胰腺癌細胞CF-PAC1與PBMC的共培養體系,采用酶聯免疫吸附試驗(ELISA)法檢測共培養體系中加入TGF-β1抗體前、后細胞培養液中TGF-β1水平。采用Western blot法、免疫熒光方法檢測共培養體系中加入TGF-β1抗體前、后PBMC細胞中Foxp3的表達量。本研究欲了解TGF-β1與Foxp3之間的關系,以期通過調控TGF-β1來影響Treg功能和數量以便進一步發揮機體的免疫調節作用。
1 資料與方法
1.1 一般資料 收集2012年9月1日至2013年5月31日期間體檢無特殊的健康人外周血,提取PBMC。
1.2 方法
1.2.1 PBMC的提取 提取健康人PBMC。適量淋巴細胞分離液加入離心管中,肝素抗凝靜脈血與等量磷酸鹽緩沖液(PBS)充分混勻,用滴管沿管壁緩慢滴混勻液于分層液面上,注意保持清楚的界面。水平離心2 000 r/min 20 min后,管內可見3層,PBMC為主的白色云霧層狹窄帶位于上、中層界面處,用毛細吸管插到云霧層吸取PBMC,置入另一短中管中,加入5倍體積的PBS液,水平離心1 500 r/min 10 min,洗滌細胞2次。末次離心后,棄上清液,加入含有10%小牛血清的DMEM,調整PBMC濃度為2×105/mL。
1.2.2 Transwell小室建立共培養體系 將胰腺癌細胞CF-PAC1(上海中科院細胞庫購買)調整細胞數約為2×106/孔,加入2.6 mL DMEM培養液于6孔板中培養,調整細胞狀態;將0.4 μm Transwell小室放入6孔板中,小室內置入1.5 mL提取得到的PBMC細胞懸液。試驗分組如下。(1)A組:即PBMC組,共培養下層6孔板中,加入調整PBMC細胞數為2×106的DMEM培養液2.6 mL,放入0.4 μm Transwell小室后,小室內加入PBMC細胞數為2×105的DMEM培養液1.5 mL;(2)B組:即PBMC-CF-PAC1組。共培養下層6孔板中,加入胰腺癌細胞CF-PAC1,調整細胞數為2×106,DMEM培養液2.6 mL,放入0.4 μm Transwell小室后,小室內加入PBMC細胞數為2×105的DMEM培養液1.5 mL;(3)C組:即PBMC-CF-PAC1+抗TGF-β1抗體(1 μL)組,共培養下層6孔板中,加入胰腺癌細胞CF-PAC1,調整細胞數為2×106,DMEM培養液2.6 mL,同時加入抗TGF-β1抗體1 μL,放入0.4 μm Transwell小室后,小室內加入PBMC細胞數為2×105的DMEM培養液1.5 mL;(4)D組:即PBMC-CF-PAC1+抗TGF-β1抗體(2 μL)組。共培養下層6孔板中,加入胰腺癌細胞CF-PAC1,調整細胞數為2×106,DMEM培養液2.6 mL,同時加入抗TGF-β1抗體2 μL,放入0.4 μm Transwell小室后,小室內加入PBMC細胞數為2×105的DMEM培養液1.5 mL;(5)E組:即PBMC-CF-PAC1+抗TGF-β1抗體(4 μL)組。共培養下層6孔板中,加入胰腺癌細胞CF-PAC1,調整細胞數為2×106,DMEM培養液2.6 mL,同時加入抗TGF-β1抗體4 μL,放入0.4 μm Transwell小室后,小室內加入PBMC細胞數為2×105的DMEM培養液1.5 mL;(6)F組:即PBMC-CF-PAC1+抗TGF-β1抗體(8 μL)組,共培養下層6孔板中,加入胰腺癌細胞CF-PAC1,調整細胞數為2×106,DMEM培養液2.6 mL,同時加入抗TGF-β1抗體8 μL,放入0.4 μm Transwell小室后,小室內加入PBMC細胞數為2×105的DMEM培養液1.5 mL。(7)G組,即PBMC-CF-PAC1+抗TGF-β1抗體(16 μL)組,共培養下層6孔板中,加入胰腺癌細胞CF-PAC1,調整細胞數為2×106,DMEM培養液2.6 mL,同時加入抗TGF-β1抗體16 μL,放入0.4 μm Transwell小室后,小室內加入PBMC細胞數為2×105的DMEM培養液1.5 mL。
1.2.3 利用ELISA法檢測TGF-β1水平 按照TGF-β1 ELISA試劑盒(BD公司)說明書步驟,檢測培養液中TGF-β1的水平。
1.2.4 Western blot法檢測PBMC中Foxp3的蛋白水平 提取Transwell小室中PBMC細胞總蛋白,按Bradford法進行蛋白總量測定,凍存于-70 ℃冰箱待用。蛋白樣品與6×上樣緩沖液混合,100 ℃水浴5 min,置冰上冷卻,采用10%十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)電泳垂直電泳進行分離,每組上樣量45 μg,電壓120 V,溴酚藍到底后停止。Bio-Rad半干轉印系統轉膜15 V,1 h用TBST緩沖液洗膜3次,并用5%脫脂奶粉封閉1.5 h,再用兔抗Foxp3(1∶1 000,proteintech公司),鼠抗β-actin(1∶1 500,Sigma公司)孵育,4 ℃過夜,TBST緩沖液洗滌3次后分別加入辣根過氧化物酶結合的抗兔免疫球蛋白G(IgG,北京中山金橋公司)和抗鼠IgG(北京中山金橋公司)室溫孵育4 h。 TBST緩沖液洗滌3次后加入電化學發光(ECL)發光液(Pierce公司),膠片曝光l min后顯影、定影、晾干。
1.2.5 Foxp3免疫熒光方法檢測 在EP管中加入適量0.01 mol/L PBS洗滌收集的細胞3次,0.2% Triton X-100破膜15 min,0.01 mol/L PBS洗滌10 min×3次,5%牛血清清蛋白(BSA)封閉1 h。加入鼠抗Foxp3單克隆抗體(北京中山金橋公司)4 ℃孵育過夜,0.01 mol/L PBS洗滌10 min×3次,FITC標記的山羊抗小鼠IgG室溫避光孵育2 h,0.01 mol/L PBS洗滌10 min×3次,Hoechst室溫避光孵育5 min,染細胞核,雙蒸水(ddH2O)洗滌10 min×3次,甘油-Tris封片,激光共聚焦顯微鏡下觀察結果,激發波長為488 nm和380 nm。

2 結 果
2.1ELISA法檢測細胞培養液中TGF-β1水平。
2.1.1A、B組細胞培養液中TGF-β1水平的比較A組TGF-β1平均濃度為(12.44±2.08)ng/mL,B組TGF-β1平均濃度為(14.12±1.25)ng/mL,兩組比較差異有統計學意義(P<0.05)。
2.1.2B、C、D、E、F和G組細胞培養液中TGF-β1水平的比較 隨著加入TGF-β1抗體濃度的增加,各組TGF-β1水平呈遞減趨勢,差異有統計學意義(P<0.05),見表1。
2.2Westernblot法檢測各組PBMC中Foxp3蛋白表達量
2.2.1A、B組PBMC中Foxp3蛋白表達量比較Westernblot法檢測結果顯示B組PBMC中Foxp3蛋白相對表達量明顯高于A組,差異有統計學意義(P<0.05),見圖1。
2.2.2B、C、D、E、F和G組PBMC中Foxp3蛋白表達量比較Westernblot法檢測結果顯示,6組PBMC細胞中Foxp3蛋白的表達量隨著加入TGF-β1抗體濃度的增加,呈遞減趨勢,差異有統計學意義(P<0.05),見圖2。
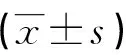
表1 6組細胞培養液中TGF-β1水平比較

圖1 Western blot檢測A、B組PBMC中Foxp3蛋白表達量

圖2 Western blot檢測6組PBMC中Foxp3蛋白表達量
2.3Foxp3免疫熒光方法檢測
2.3.1A、B組Foxp3熒光檢測結果B組Foxp3陽性細胞數量明顯多于A組,差異有統計學意義(P<0.05),見圖3。

圖3 A、B組Foxp3免疫熒光方法檢測結果
2.3.2B、C、D、E、F和G組Foxp3熒光檢測結果 6組Foxp3陽性細胞數量隨著加入TGF-β1抗體濃度的增加,呈遞減趨勢,差異有統計學意義(P<0.05),見圖4。

圖4 6組Foxp3免疫熒光檢測結果
3 討 論
有研究表明,Treg細胞在腫瘤微環境中升高,Treg細胞能夠抑制惡性腫瘤組織中CD8+T、CD4+T淋巴細胞及自然殺傷細胞(naturekillercells,NK)等表達,并且抑制其遷移到腫瘤局部,發揮抑制抗腫瘤免疫效應的作用[1],但是Treg細胞在腫瘤微環境中升高的機制尚不明確。
Valzasina等[4]學者在研究腫瘤負荷小鼠時觀察到,小鼠體內CD4+CD25+T細胞向Treg細胞轉化是Treg增殖的主要來源之一。有研究觀察到,TGF-β1可以促進CD4+CD25+T細胞向CD4+CD25+Foxp3+Treg轉化,參與了體內Treg細胞增殖過程,進一步促進免疫負調節效應[5]。CD4+CD25+Treg細胞特異標志性分子Foxp3蛋白是其生長、分化和功能發揮的關鍵基因。有關試驗動物研究發現,Foxp3mRNA的表達量對外周血Treg細胞數量及功能的影響有著至關重要的意義。scurfy小鼠Foxp3基因缺失,表現出的是CD4+CD25+Treg細胞的缺失,這表明Foxp3基因是CD4+CD25+Treg細胞生長和分化過程中不可缺失的促進因子[6-7]。由此推測,上調Foxp3基因的表達可能會促進腫瘤組織中CD4+T細胞向Treg細胞轉變,促進Treg細胞增殖使得腫瘤組織產生抑制免疫效應。
本研究用Transwell培養體系模擬腫瘤微環境,腫瘤細胞與淋巴細胞互相作用,試驗結果顯示,胰腺癌細胞CF-PAC1可分泌一定濃度的TGF-β1。有關文獻報道,5 000pg/mL的TGF-β1可將活化的CD4+T細胞誘導轉化為Treg細胞[8]。本試驗還觀察胰腺癌細胞CF-PAC1分泌的TGF-β1的水平與Foxp3的表達存在關系,胰腺癌細胞CF-PAC1能夠顯著上調正常人PBMC中Foxp3蛋白的表達,而且該作用能被TGF-β1抗體所拮抗。本研究結果表明,胰腺癌細胞可分泌產生TGF-β1,從而促進了PBMC中Foxp3蛋白的表達,進一步推斷胰腺癌細胞分泌的TGF-β1可促進Treg細胞的分化和自身增殖,可對機體的免疫功能起進一步的抑制作用。
Moo-Young等[8]也發現,高表達TGF-β1的胰腺癌細胞pan02可誘導小鼠大量CD4+T細胞轉化為CD4+FOXP3+Treg細胞,而低表達TGF-β的胰腺癌細胞未觀察到此現象。本研究結果也發現類似的現象。這些證據表明腫瘤來源的TGF-β1可促進CD4+Foxp3+Treg細胞的增殖,這也是腫瘤免疫抑制的重要機制之一。
綜上所述,可以通過TGF-β1對Foxp3的表達量進行調控,且進一步調控Treg細胞的數目及功能活性,從而影響腫瘤免疫抑制功能的發揮。
[1]SakaguchiS,MiyaraM,CostantinoCM,etal.Foxp3+regulatoryTcellsinthehumanimmunesystem[J].NatRevImmunol,2010,10(7):490-500.
[2]SakaguchiS.NaturallyarisingFoxp3-expressingCD25+CD4+regulatoryTcellsinimmunologicaltolerancetoselfandnon-self[J].NatureImmunol,2005,6(4):345-352.
[3]ZhouX,Bailey-BucktroutS,JekerLT,etal.PlasticityofCD4+Foxp3+Tcells[J].CurOpinImmunol,2009,21(3):281.
[4]ValzasinaB,PiconeseS,GuiducciC,etal.Tumor-inducedexpansionofregulatoryTcellsbyconversionofCD4+CD25lymphocytesisthymusandproliferationindependent[J].CancerRes,2006,66(8):4488-4495.
[5]AttisanoL,WranaJL.SignaltransductionbytheTGF-βsuperfamily[J].Science,2002,296(5573):1646-1647.
[6]PetersenRP,CampaMJ,SperlazzaJ,etal.TumorinfiltratingFoxp3+regulatoryT-cellsareassociatedwithrecurrenceinpathologicstageⅠNSCLCpatients[J].Cancer,2006,107(12):2866-2872.
[7]PerroneG,RuffiniPA,CatalanoV,etal.IntratumouralFoxp3-positiveregulatoryTcellsareassociatedwithadverseprognosisinradicallyresectedgastriccancer[J].EurJCancer,2008,44(13):1875-1882.
[8]Moo-YoungTA,LarsonJW,BeltBA,etal.TumorderivedTGF-ΒmediatesconversionofCD4+Foxp3+regulatoryTcellsinamurinemodelofpancreascancer[J].JImmunoth,2009,32(1):12-21.
曹亞峰(1990-),住院醫師,碩士,主要從事消化內科研究。△
10.3969/j.issn.1671-8348.2016.23.045
R576
B
1671-8348(2016)23-3290-03
2016-01-17
2016-03-24)

