機械牽張調控LRP6磷酸化介導心臟側群干細胞增殖
陳志丹 龔 惠,△ 葉 勇 張國平 李 洋 楊春杰 賈劍國 鄒云增,
(1復旦大學附屬中山醫院上海市心血管病研究所 上海 200032; 2復旦大學生物醫學研究院 上海 200032)
?
機械牽張調控LRP6磷酸化介導心臟側群干細胞增殖
陳志丹1龔 惠1,2△葉 勇1張國平2李 洋2楊春杰1賈劍國1鄒云增1,2
(1復旦大學附屬中山醫院上海市心血管病研究所 上海 200032;2復旦大學生物醫學研究院 上海 200032)
目的 研究機械牽張對心臟側群干細胞(cardiac side population cell,CSP)增殖的作用及機制。方法 通過流式細胞儀分選并培養大鼠乳鼠CSP,牽張后觀察細胞的增殖。并通過胸主動脈縮窄(transverse aorta constriction,TAC)建立壓力負荷小鼠模型,流式細胞儀分選后觀察CSP的比例。進一步通過熒光染色以及Western blot檢測CSP的LRP6磷酸化水平。結果 成功分離及培養CSP,機械牽張可促進CSP增殖。體內實驗表明,壓力負荷可明顯促進CSP比例的升高。免疫熒光及Western blot實驗表明,機械牽張可明顯促進CSP的LPR6磷酸化。CSP過表達LRP6可明顯增強機械牽張介導的促增殖效應。結論 機械牽張可促進LRP6磷酸化,從而促進CSP增殖,有利于機體對病理性刺激產生適應性反應以維持心功能。
機械牽張; 壓力負荷; 心臟側群干細胞; LRP6; 增殖
缺血或高血壓等引起的心肌損傷是心肌細胞不可逆地死亡或凋亡導致心力衰竭的重要因素。出生后心肌細胞即失去有絲分裂特性是心肌修復困難的關鍵原因。越來越多的證據表明,心臟中存在原位干細胞,其表達干細胞的標志物c-kit等。側群(side population,SP)細胞是近年來備受關注的一群成體干細胞。由Goodell等[1]在1996年首次從小鼠骨髓造血干細胞中分離獲得。隨后陸續在心臟、骨骼肌及腦組織等分離出SP細胞[2-3]。體內外研究表明,心臟側群干細胞(cardiac side population cell,CSP)具有向心肌細胞、內皮細胞以及平滑肌細胞分化的能力[4-5],這些研究結果提示來源于心臟的SP細胞很有可能成為修復損傷心肌的理想細胞。然而,生理情況下CSP在心臟中的比例非常低,僅占心臟細胞的1%~3%。急性心梗后,CSP的比例上調3倍以上[3],提示它可能在心梗的心肌修復中發揮一定的作用。高血壓是常見的病癥,主要引起心臟的壓力負荷升高,長期的心臟超負荷導致心肌肥大,血管新生相對不足引起心肌缺氧等損傷,最終導致心臟失代償而發生心力衰竭[6]。在這種壓力負荷介導心肌慢性缺氧的情況下,CSP是否發生增殖,其具體機制是什么,目前還未見相關報道。這方面的研究有助于探索CSP增殖的新機制,對于如何促進病理狀態下CSP增殖從而更好地發揮修復心肌的作用有一定的臨床應用價值。
材 料 和 方 法
試驗動物 野生型C57BL/6雄性小鼠,8周齡,體質量18~22 g,購于上海斯萊克實驗動物有限責任公司,于復旦大學實驗動物部飼養。SD大鼠乳鼠購于上海斯萊克實驗動物有限責任公司。
小鼠升主動脈縮窄模型的建立 選取8周齡的野生型C57BL/6雄性小鼠實施小鼠升主動脈縮窄(transverse aorta constriction,TAC)手術以構建壓力超負荷心肌肥厚模型。具體步驟如下:術前稱重,氯胺酮麻醉(100 mg/kg,腹腔注射),氣管插管,接呼吸機,剔除小鼠胸前毛發,碘伏局部消毒。沿胸骨左緣剪開小鼠皮膚,逐層分離皮下組織,沿胸骨左緣的第二肋骨處剪斷第二肋骨,用胸廓撐開器撐開暴露出手術視野,剝離白色的胸腺,暴露出跳動的升主動脈。在主動脈凸側分支的第一和第二分支之間,用自制的穿線器將5-0絲線穿過主動脈弓,將剪去針尖后折彎的27 G針頭沿主動脈方向與分離的主動脈弓一起結扎,小心拔除針頭,造成升主動脈環行縮窄,之后逐層縫合胸壁,再次用碘伏局部消毒。待小鼠出現抵抗行為時脫呼吸機,拔出氣管插管。假手術組只穿線不結扎。術后連續3天腹腔內注射青霉素10000 U,以預防感染,常規飲食飲水照明。
成年小鼠CSP細胞分離和分選 酒精消毒小鼠皮膚,剪取成年小鼠心臟后轉移至無菌超凈臺內的玻璃皿內。PBS漂洗心臟2~3次,洗凈殘留血液,將心臟剪碎,PBS洗后放入裝有5 mL消化酶溶液的50 mL離心管中,置于37 ℃水浴搖床振蕩20 min,轉速為165 r/min。加入10 mL含3%FBS的PBS終止消化,400×g離心5 min。去除上清,加入11 mL含3% FBS的PBS,重懸細胞沉淀,制成細胞懸液。5 mL離心管中加入1 mL心肌細胞懸液,先加入維拉帕米(Verapamil,美國Sigma公司)至終濃度為50 μmol/L,37 ℃孵育10 min,然后加Hoechst 33342染料(美國Sigma公司),終濃度為1 μg/mL;其余心肌細胞懸液只加入終濃度為1 μg/mL的Hoechst 33342染料。兩組均置于37 ℃ 避光孵育60 min,每隔15 min混勻1次。孵育結束后,4 ℃下400×g離心5 min,棄上清;用預冷的含3%FBS 的PBS充分混勻清洗細胞,4 ℃下400×g離心5 min。棄上清,再次洗滌細胞,離心條件同前,將細胞沉淀重懸于預冷的含3%FBS的PBS中,加入PI(美國Sigma公司)至終濃度為2 μg/mL。置細胞懸液于冰上,待上機分選。流式細胞儀(美國貝克曼公司)分選CSP細胞:Hoechst 33342的激發光為350 nm紫外光,450 nm濾光片收集藍光,675 nm濾光片收集紅光。PI的激發光為488 nm藍光,用620 nm濾光片收集紅光。用Hoechst 33342檢測管和維拉帕米抑制管確定CSP細胞的分選條件,收集CSP細胞。一般1只成年小鼠可得20 000~30 000個CSP細胞。
新生大鼠CSP細胞分離、分選、培養和傳代 取1~3日齡健康的SD大鼠乳鼠10~20只,75%酒精消毒后取心臟,用眼科剪將組織剪碎至約1 mm3大小的組織塊,常規用0.1%胰酶分次消化成細胞懸液,室溫下200×g離心5 min后用含3%FBS的PBS以1×106/mL濃度重懸細胞。染色和流式細胞儀分選步驟同成年小鼠SP細胞。將收集到的CSP細胞在4 ℃下400×g離心5 min,去除上清,再用冰浴的含3%FBS的PBS混懸、清洗細胞。用IMDM(含10%FBS及1%雙抗)培養基重懸細胞后進行培養。每次分選獲取的CSP細胞數約(3~15)×104個,將得到的CSP細胞按(1~5)×104/mL的密度接種到6孔板中,每孔1 mL。置于37 ℃、5%CO2培養箱內培養。48 h后首次換液,采用半量換液法,以后每3天換液1次。待集落樣生長細胞達一定數量或至80%融合時,進行傳代培養。傳代方法如下:吸去6孔板內培養基,PBS洗滌3次,吸盡PBS。加入1 mL 0.1%胰蛋白酶,室溫下消化3~5 min,同時在倒置光學顯微鏡下觀察。等細胞變圓,即向培養瓶中加含10% FBS的IMDM培養基終止消化。用一次性吸管反復吹打,洗脫未完全脫壁的細胞。并將細胞懸液轉移到15 mL離心管中,4 ℃下200×g離心10 min,棄上清。用含10%FBS及1%雙抗的IMDM培養基重懸細胞,根據細胞數量按1∶3~1∶6的比例傳代,其中部分接種至硅膠皿中,置于37 ℃、5%CO2培養箱中培養。
機械牽張CSP細胞 將CSP接種于具有彈性的硅膠皿中(長4 cm、寬2 cm,兩邊有小孔可插在機械牽張板上),細胞接種前硅膠皿經鋪鼠尾膠、風干、紫外照射滅菌處理。機械牽張時,將硅膠皿插在機械牽張板上,使其長度拉伸為5 cm,寬度不變,故其表面積增大20%。
新生大鼠CSP細胞增殖實驗 使用Promega 公司的CellTiter-Glo?發光法細胞活力檢測試劑盒檢測CSP細胞增殖情況,根據說明書進行以下操作:使用前,融化CellTiter-Glo?緩沖液并平衡至室溫,將凍干的CellTiter-Glo?基質平衡至室溫,將CellTiter-Glo?緩沖液加入裝有凍干CellTiter-Glo?基質的棕色瓶中即成CellTiter-Glo?試劑,輕輕翻轉以混勻溶液。制備只含培養基不含細胞的對照皿,以獲得背景熒光值。加入與細胞培養液等體積的檢測試劑至硅膠皿內,在搖床上混合2 min以促進細胞充分裂解。室溫下放置10 min以穩定熒光信號。將硅膠皿中的液體轉移至不透光的檢測板內,用化學發光儀(美國Berthold公司)檢測。
細胞免疫熒光染色 按照以下步驟進行細胞免疫熒光染色:吸棄細胞培養基,用PBS輕輕洗滌細胞3次。室溫下4%多聚甲醛固定細胞10 min。PBS洗滌3次,每次5 min。加入0.1%Triton X-100室溫下透化5 min。PBS清洗3次,每次5 min。2%BSA(用PBS配制)室溫封閉1 h。吸去封閉液,加入兔抗p-LRP6(Ser1490)多抗(美國CST公司,1∶100),或兔抗Bcrp1多克隆抗體(英國Abcam公司,1∶100),或抗α肌球蛋白重鏈(alpha myosin heavy chain,α-MHC)抗體(英國Abcam公司,1∶100),或抗α平滑肌肌動蛋白(alpha smooth muscle actin,α-SMA)抗體(丹麥DAKO公司,1∶200),或抗血管性血友病因子(von Willebrand factor,vWF)抗體(丹麥DAKO公司,1∶200)。4 ℃孵育過夜,吸去一抗,用PBS清洗3次,每次10 min。分別加入FITC(美國Invitrogen公司,1∶1 000),Cy3及Cy5標記的二抗(美國Jackson公司,1∶200),37 ℃避光孵育1 h。吸去二抗,用PBS洗滌3次,每次10 min。加入DAPI(美國Sigma公司),室溫放置5 min。用PBS洗滌細胞3次,每次5 min。加入少量PBS,覆蓋細胞表面,激光共聚焦顯微鏡(德國Zeiss公司)下觀察。
Western blot檢測 用RIPA裂解液裂解細胞提取細胞總蛋白,BCA法測定蛋白質濃度,在蛋白樣品中加入5×蛋白上樣緩沖液,并加入β-巰基乙醇,100 ℃水浴中加熱變性5 min。取等量蛋白進行SDS聚丙烯酰胺凝膠電泳,結束后使用Bio-Rad濕式轉膜裝置將蛋白轉至PVDF膜,5%BSA室溫封閉1 h,加入用5%BSA稀釋的一抗(1∶1 000),放置在4 ℃冰箱內的水平搖床上孵育過夜。一抗孵育結束后,用TBST漂洗3次,每次10 min。加入辣根過氧化物酶(horse radish peroxidase,HRP)標記的二抗孵育液(上海康成生物公司,1∶5 000),室溫下孵育1 h。用TBST漂洗3次,每次5 min。使用SuperSignal化學發光底物(美國Pierce公司)在LAS-3000成像系統(日本Fujifilm公司)上曝光顯影。蛋白灰度測定使用Image Pro Plus 5.0軟件。
質粒轉染 LRP6-PCS2質粒由美國哈佛醫學院波士頓兒童醫院F.M.kirby神經生物中心的Xi He博士惠贈。PCS2對照質粒為本實驗凍存。當細胞融合度達到約80%時進行質粒轉染。使用前,將FuGENE?HD 轉染試劑平衡至室溫,顛倒混勻,用Opti-MEM?I培養基將質粒稀釋至0.02 μg/μL,按FuGENE?HD 轉染試劑(μL)∶DNA(μg)為3∶1的比例將FuGENE?HD直接加入稀釋后的質粒中,注意勿將未稀釋的FuGENE?HD接觸塑料管壁。將FuGENE?HD轉染試劑/DNA 混合物在室溫孵育約15 min后加入細胞中并輕柔混勻,再將細胞放回到培養箱中繼續培養。6孔板一個孔或一個硅膠皿轉染質粒2 μg。
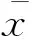
結 果
分選和培養CSP細胞 在乳鼠的心臟細胞懸液中,CSP細胞比例通常為1%~3%(圖1A)。由于SP細胞主要通過細胞膜上高表達BCRP1受體而發揮泵出Hoechst33342的特性,因此我們將分離出的CSP細胞培養1天后,通過免疫熒光可觀察到其細胞膜上BCRP1受體的表達,進一步驗證分選獲得了CSP細胞(圖1B)。
將分選獲得的CSP細胞按2×104/mL接種培養,CSP細胞在培養24h后可觀察到細胞貼壁生長,呈小三角形、多角形或不規則形等。培養至第3天,細胞增殖開始活躍,呈圓形、半圓形或多角形等(圖1C)。培養3周后,CSP陸續表達心肌細胞標志蛋白α-MHC,內皮細胞標志物vWF及平滑肌細胞特征蛋白SMC等(圖1D)。提示CSP有向心肌細胞、內皮細胞和平滑肌細胞分化的潛能。
機械牽張促進CSP細胞增殖 當分離培養的CSP增殖到一定程度后,進行消化傳代。將細胞接種于硅膠皿上,培養2~3天后,給予機械牽張,以不牽張組作為對照。牽張24h后,檢測細胞的增殖能力。結果顯示,機械牽張組的CSP細胞增殖活躍,較對照組增加約2倍(圖2A)。進一步通過TAC建立壓力負荷小鼠模型,觀察小鼠CSP增殖能力是否增強。TAC術后2周的血流動力學結果顯示,小鼠心室收縮壓為(184±14)mmHg(1mmHg=0.133kPa,下同),與假手術組[(106±7)mmHg]比較明顯升高,說明壓力負荷模型建立成功(圖2B)。細胞增殖結果顯示,與假手術組比較(1.85%±0.33%),小鼠CSP比例升高4倍以上(8.08%±0.48%,圖2C)。因此,體內外實驗表明,機械牽張可促進CSP增殖。
機械牽張促進CSP的LRP6磷酸化LRP6磷酸化后可引起核內介導有絲分裂的因子明顯增加,從而促進細胞的增殖[8]。因此我們檢測了CSP的LRP6磷酸化水平。免疫熒光結果顯示,機械牽張3h后LRP6磷酸化水平明顯增加(圖3A)。Westernblot結果表明,在機械牽張后,LRP6水平變化不大,而p-LRP6水平明顯增加(圖3B)。這些結果提示,機械牽張介導的CSP增殖可能與p-LRP6水平升高有關。
LRP6過表達促進機械牽張介導的CSP細胞增殖效應 為了進一步說明LRP6磷酸化是否參與機械牽張介導的CSP增殖,對CSP轉染空載體pCS2以及LRP6過表達載體,并給予機械牽張。LRP6過表達后,磷酸化LRP6水平明顯增加(圖4A)。細胞增殖實驗進一步表明,機械牽張可促進CSP增殖,LRP6過表達組的細胞增殖進一步增加(圖4B)。這些結果表明,LRP6過表達促進了機械牽張介導的CSP細胞增殖效應。
討 論
長期以來成體心臟被認為是終末分化器官,沒有再生能力。然而,越來越多的證據表明成體心臟中存在表達干細胞標志的細胞,這些細胞具有分化成心肌細胞的能力[9-10]。CSP是心臟干細胞的一種類型,可以分化為心肌細胞、內皮細胞以及平滑肌細胞[4-5],因而被認為是在損傷心臟中具有再生能力的內源性心臟干細胞。然而在生理狀況下,CSP的比例非常低,僅為1%~3%。Martin等[3]發現,在急性心梗發生后的3天內,CSP的比例上升3倍以上,提示該細胞的大量增殖可能有助于在心梗急性期發揮修復心肌的作用。
A:Isolation of CSPs by FACS analysis; B:Immunostaining cultured CSPs with Bcrp1 antibody (bar=5 μm); C:Morphology of CSPs under optical microscopy (×100); D:Immunostaining cultured CSPs with α-MHC,vWF and SMC antibody,respectively,after cultured for 3 weeks(left:bar =100 μm,middle and right:bar=20μm).
圖1 CSP細胞的分選、培養和鑒定
Fig 1 Isolation,culturation and identification of CSPs
CSP的分選通常采用熒光激活細胞分選法(fluorescence-activated cell sorting,FACS)[5,7]。SP細胞膜上的乳腺癌耐藥蛋白(breast cancer resistance protein,BCRP) 1受體具備將熒光染料Hoechst 33342泵出細胞外的特性,因此在FACS分布圖上,該細胞群分布于左下側,所以稱為側群干細胞或側群細胞。當細胞懸液預先用維拉帕米孵育后,可明顯抑制該細胞群泵出Hoechst 33342特性。利用這一特性我們可通過FACS分選出CSP進行體外培養。
A:Cell Viability Assay of the proliferation of CSPs with or without MS;B:Left ventricular systolic pressure of mice subjected to sham operation or TAC was measured by hemodynamic analysis; C:FACS analysis of the ratio of CSPs per mouse subjected to sham operation or TAC.The ratio of CSPs in sham or TAC mice were determined by FACS analysis.vs.control or sham group,(1)P< 0.01.MS:Mechanical stretch.
圖2 機械牽張促進CSP細胞的增殖
Fig 2 Mechanical stretch promotes the proliferation of CSPs
A:Immunofluorescence analysis of p-LRP6 level in cultured CSPs without or with MS (bar=20μm).B:Western blot analysis of p-LRP6 level in cultured CSPs without or with.vs.control group,(1)P< 0.05.MS:Mechanical stretch.
圖3 機械牽張促進LRP6的磷酸化
Fig 3 Mechanical stretch promotes the phosphorylation of LRP6
我國高血壓患者眾多,高血壓引起心臟壓力負荷升高,心肌發生肥厚等改變,為了維持心功能,這時心臟處于代償期,然而長期的壓力負荷將導致心臟不可逆的受損及心功能不全[6]。在心臟壓力負荷代償期,CSP細胞是否發生增殖在維持心功能方面有一定的作用,但尚未見相關研究。我們通過壓力負荷的體外模型-機械牽張模型觀察到機械牽張介導CSP細胞增殖,進一步通過TAC建立小鼠的壓力負荷模型,觀察到TAC術后2周(此時處于代償期)CSP的比例升高約4倍。這些結果提示,CSP增殖可能參與壓力負荷介導的心臟代償作用。
目前有關CSP增殖的機制研究甚少。急性心梗后,氧化應激反應調控HIF-2α與CSP表面的Abcg2啟動子結合,介導Abcg2表達上調,從而引起CSP增殖[3]。本研究觀察到機械牽張促進了CSP的LRP6磷酸化。LRP6是Wnt/β-catenin通路的重要成員,該通路在細胞增殖中發揮重要作用。LRP6/5和Frz是WNT共同受體,它們介導的信號轉導通路參與器官的生長發育以及多種疾病(如腫瘤)的病理生理過程。LRP6是單次跨膜蛋白受體,其結構主要由胞外部分、跨膜區和胞內區域組成。正常情況下,當LRP6或Frz被WNT激活,部分PPPS/TP發生磷酸化,導致胞質內β-catenin增多而進入核內與Tcf/Lef結合,啟動一系列基因轉錄[11],包括cMyc和 Cyclin D1等,從而引起胚胎干細胞及祖細胞的增殖,這也在腫瘤發生發展中起重要作用[12]。但CSP增殖是否與LRP6通路有關,目前研究甚少。本研究觀察到機械牽張直接促進LRP6磷酸化,LRP6過表達明顯上調機械牽張對CSP的促增殖效應,提示LRP6磷酸化可能參與該過程。
A:Western blot analysis of p-LRP6 and LRP6 levels in control group and LRP6 overexpression group.B:Cell Viability Assay of the proliferation of CSPs subjected to mechanical stretch or not (control).(1)vs. pCS2 group,P< 0.05;(2)vs. pCS2 in control group,P< 0.05.
圖4 LRP6過表達促進機械牽張介導的CSP細胞增殖
Fig 4 Overexpression of LRP6 promotes the proliferation of CSPs induced by mechanical stretch
機械牽張激活LRP6的機制還有待進一步闡明。一方面,很有可能機械牽張刺激CSP或心臟其他細胞合成和分泌Wnt 等,后者與LRP6結合,促進其磷酸化。這也可能是我們觀察到壓力負荷小鼠心臟中CSP的比例升高超過4倍,而體外機械牽張模型中CSP增殖僅有2倍的原因之一。 另一方面,很多G蛋白偶聯受體激酶(如GSK3、GRK5和CK1c)可介導LRP6磷酸化[13-15]。研究表明MAPK (包括p38、ERK1/2及JNK等)是LRP6的PPPS/TP部位磷酸化的必要條件[16]。心臟負荷增加可明顯上調心肌組織GSK3及GRK5的水平[17],并激活MAPK[18]。機械牽張可明顯促進激活多種細胞的MAPK[19-20]。因此,在CSP細胞上機械牽張可能通過促進MAPK或上調GSK水平等直接介導LRP6磷酸化。本研究的局限性在于尚未具體闡明機械牽張介導CSP的LRP6磷酸化的機制。
本研究觀察到機械牽張介導CSP細胞增殖,該效應與機械牽張促進LRP6磷酸化有關,有助于理解壓力負荷狀態下CSP增殖的新機制,從而為在壓力負荷狀態下促進CSP增殖并改善心功能提供一定參考。
[1] GOODELL MA,BROSE K,PARADIS G,etal.Isolation and functional properties of murine hematopoietic stem cells that are replicatinginvivo[J].JExplMed,1996,183(4):1797-1806.
[2] ASAKURA A,RUDNICKI MA.Side population cells from diverse adult tissues are capable ofinvitrohematopoietic differentiation [J].ExpHematol,2002,30(11):1339-1345.
[3] MARTIN CM,MEESON AP,ROBERTSON SM,etal.Persistent expression of the ATP-binding cassette transporter Abcg2,identifies cardiac SP cells in the developing and adult heart [J].DevBio,2004,265(1):262-275.
[4] SANTINI MP,FORTE E,HARVEY RP,etal.Developmental origin and lineage plasticity of endogenous cardiac stem cells [J].Development,2016,143(8):1242-1258.
[5] QIU Y,BAYOMY AF,GOMEZ MV,etal.A role for matrix stiffness in the regulation of cardiac sidepopulation cell function [J].AmJPhysiolHeartCircPhysiol,2015,308(9):H990-997.
[6] YOU J,WU J,JIANG G,etal.Olmesartan attenuates cardiac remodeling through DLL4/Notch1 pathway activation in pressure overload mice [J].JCardiovascPharmacol,2013,61(2):142-151.
[7] GONG H,MA H,LIU M,etal.Urotensin II inhibits the proliferation but not the differentiation of cardiac side population cells [J].Peptides,2011,32(5):1035-1041.
[8] LIN SS,UENG SW,NIU CC,etal.Hyperbaric oxygen promotes osteogenic differentiation of bone marrow stromal cells by regulating Wnt3a/β-catenin signaling-aninvitroandinvivostudy [J].StemCellRes,2014,12(1):260-274.
[9] IAUCU CB,IANCU D,RENTEA I,etal.Molecular signatures of cardiac stem cells [J].RomJMorpholEmbryol,2015,56(4):1255-1262.
[10] DOYLE MJ,MAHER TJ,LI Q,etal.Abcg2-Labeled Cells Contribute to Different Cell Populations in the Embryonic and Adult Heart [J].StemCellsDev,2016,25(3):277-284.
[11] REINKE L,LAM AP,FLOZAK AS,etal.Adiponectin inhibits Wnt co-receptor,LRP6,phosphorylation and β-catenin signaling [J].BiochemBiophysResCommun,2016,470(3):606-612.
[12] CLEVERS H.Wnt/beta-catenin signaling in development and disease [J].Cell,2006,127(3):469-480.
[13] ZENG X,TAMAI K,DOBLE B,etal.A dual-kinase mechanism for Wnt co-receptor phosphorylation and activation [J].Nature,2005,438(7069):873-877.
[14] DAVIDSON G,SHEN J,HUANG YL,etal.Cell cycle control of wnt receptor activation [J].DevCell,2009,17(6):788-799.
[15] DAVIDSON G,WU W,SHEN J,etal.Casein kinase 1 gamma couples Wnt receptor activation to cytoplasmic signal transduction [J].Nature,2005,438(7069):867-872.
[16] CERVENKA I,WOLF J,MASEK J,etal.Mitogen-activated protein kinases promote WNT/beta-catenin signaling via phosphorylation of LRP6 [J].MolCellBiol,2011,31(1):179-189.
[17] GOLD JI,GAO E,SHANG X,etal.Determining the absolute requirement of G protein-coupled receptor kinase 5 for pathological cardiac hypertrophy:short communication [J].CircRes,2012,111(8):1048-1053.
[18] WEI WY,MA ZG,XU SC,etal.Pioglitazoneprotected against cardiac hypertrophy via inhibiting AKT/GSK3β and MAPK signaling pathways [J].PPARRes,2016,2016:9174190.
[19] MATSUI H,FUKUNO N,KANDA Y,etal.The expression of Fn14 via mechanical stress-activated JNK contributes to apoptosis induction in osteoblasts [J].JBiolChem,2014,289(10):6438-6450.
[20] SAITO T,NISHIDA K,FURUMATSU T,etal.Histone deacetylase inhibitors suppress mechanical stress-induced expression of RUNX-2 and ADAMTS-5 through the inhibition of the MAPK signaling pathway in cultured human chondrocytes [J].OsteoarthritisCartilage,2013,21(1):165-174.
Mechanical stretch promotes the proliferation of cardiac side population cells induced by the phosphorylation of LRP6
CHEN Zhi-dan1, GONG Hui1,2△, YE Yong1, ZHANG Guo-ping2, LI Yang2,YANG Chun-jie1, JIA Jian-guo1, ZOU Yun-zeng1,2
(1ShanghaiInstituteofCardiovascularDiseases,ZhongshanHospital,FudanUniversity,Shanghai200032,China;2InstitutesofBiomedicalSciences,FudanUniversity,Shanghai200032,China)
Objective To investigate the effect of mechanical stretch on the proliferation of cardiac side population cell (CSP) and to explore its potential mechanisms. Methods CSPs from neonatal rat were isolated by FACS analysis.The proliferation of cultured CSPs was examined with mechanical stretch.Transverse aorta constriction (TAC) was applied to mice to induce pressure overload.The ratio of CSPs was analyzed by FACS.The phosphorylation of LRP6 was determined by immunofluorescence staining and Western blot analysis. Results CSPs were isolated and cultured successfully.Mechanical stretch promotes the proliferation of CSPs.The ratio of CSPs in TAC mice was increased significantly compared to it in sham mice.Further analysis showed that mechanical stretch enhanced the phosphorylation of LRP6 by immunofluorescence staining and Western blot analysis.Overexpression of LRP6 greatly exaggerated the proliferation of CSPs induced by mechanical stretch. Conclusions Mechanical stretch promotes the proliferation of CSPs by the activation of LRP6.The finding provide an understanding on the mechanisms responsible for the proliferation of CSPs under pressure overload.
mechanical stretch; pressure overload; cardiac side population cell; LRP6;proliferation
國家自然科學基金(81570353);上海市科委基礎重點子課題(13JC1401703);復旦大學附屬中山醫院優秀骨干基金(2015ZSYXGG06)
Q253
A
10.3969/j.issn.1672-8467.2016.06.006
2016-02-22;編輯:段佳)
△Corresponding author E-mail:gonghui2005@fudan.edu.cn
*This work was supported by the National Natural Science Foundation of China (81570353),the Key Sub-project of Science and Technology Commission of Shanghai Municipality (13JC1401703) and the Outstanding Talent of Zhongshan Hospital,Fudan University (2015ZSYXGG06).

