基于HPLC的標準加入法同時測定小鼠血清中犬尿氨酸和色氨酸
陳 月 康宏艷 胡 楠 楊 青 郁韻秋△
(1復旦大學藥學院藥物分析教研室 上海 201203;2復旦大學生命科學學院生物化學與分子生物學系 上海 200438)
?
基于HPLC的標準加入法同時測定小鼠血清中犬尿氨酸和色氨酸
陳 月1康宏艷1胡 楠2楊 青2郁韻秋1△
(1復旦大學藥學院藥物分析教研室 上海 201203;2復旦大學生命科學學院生物化學與分子生物學系 上海 200438)
目的 建立一種同時測定小鼠血清中犬尿氨酸和色氨酸濃度的高效液相色譜(HPLC)法,用于評價小鼠給予IDO抑制劑后體內IDO活性。方法 血清用6%高氯酸沉淀蛋白法處理,離心后取上清進樣,采用標準加入法定量。選用ThermoHypersil GOLD色譜柱(250 mm×4.6 mm,5 μm)分離,流動相為乙腈-醋酸鈉(15 mmol/L,冰醋酸調pH至 4.0),流速1.1 mL/min,柱溫30 ℃,犬尿氨酸和色氨酸的紫外檢測波長分別為360 nm和280 nm。結果 犬尿氨酸保留時間為6.10 min,線性范圍為0.25~10 μmol/L,檢測限為0.09 μmol/L;色氨酸保留時間10.12 min,線性范圍為25~1 000 μmol/L,檢測限為0.25 μmol/L。精密度、回收率及穩定性等均符合生物樣品定量分析方法驗證指導原則的要求,并成功應用于62只小鼠血清犬尿氨酸和色氨酸濃度的測定。結論 建立了一種簡單、快速、準確的HPLC分析方法,采用標準加入定量方式,可同時測定小鼠血清中犬尿氨酸和色氨酸血藥濃度,并成功應用于實際生物樣本的測定。
犬尿氨酸; 色氨酸; HPLC; 血清; 標準加入法; 小鼠
色氨酸(tryptophan,Trp)是哺乳類動物合成必需的氨基酸之一,也是構成蛋白質的重要成分,還可以在肝、腎等組織中代謝成為生物活性分子。在哺乳類動物中其主要有兩條代謝途徑:一是在羥化酶的作用下生成5-羥色胺(5-hydroxytryptamine,5-HT),另一條是生成犬尿氨酸(kynurenine,Kyn)[1]。據估計,在哺乳類動物中經膳食攝入的Trp僅1%左右可被轉化成5-HT,剩下99%的Trp經Kyn途徑代謝[2],即Trp在色氨酸吲哚胺-2,3-雙加氧酶(indoleamine 2,3-dioxygenase,IDO)作用下生成甲酰犬尿氨酸,然后迅速代謝為Kyn[3]。研究表明,Kyn與Trp的比值可以靈敏地監測機體IDO激活狀態以及細胞免疫狀態,當IDO處于激活狀態,即Kyn與Trp的比值變大時,機體往往容易誘發各種疾病,例如病毒感染、自身免疫性疾病和惡性腫瘤等[4]。因此,定量測定機體中Kyn與Trp的含量以及它們的比值具有重要意義,可為相關疾病診斷治療提供重要依據。
目前,國內外主要采用高效液相色譜(HPLC)法檢測Kyn與Trp的含量[5-7],而在同時測定這兩種氨基酸時常采用熒光和紫外檢測器聯用的方式[8],因為Trp含有生色團還有較強的熒光特性,而Kyn只有紫外吸收,因此該方式對儀器設備有一定的要求。也有報道采用高效液相色譜-紫外檢測法同時測定Kyn與Trp[9],該報道直接采用水溶液標準曲線的方式定量血清中Kyn與Trp的濃度,即用超純水配制一系列濃度的Kyn與Trp標準工作液定量,但由于Kyn與Trp均是內源性物質,水溶液基質簡單、成分少,而實際測定的生物樣品血清基質復雜、成分多,含有大量的血漿蛋白、多肽、脂肪、碳水化合物、生長因子等物質,基質的不同會影響和干擾對Kyn與Trp的檢測,使其測得的結果產生偏差,所以在對Kyn與Trp定量時,應盡量采用相同或類似的基質。我們采用血清標準加入法進行測定,即先用若干份空白血清分析得到空白血清響應值,然后在空白的血清中分別加入已知不同濃度的Kyn和Trp,以加入后的響應值與空白血清響應值的差值來建立標準曲線,被測物的濃度便可在該標準曲線下計算得到。采用這樣的方式對Kyn和Trp進行定量誤差更小,也更為科學合理。為此,本文建立了一種簡單、快速、準確的HPLC法,可同時測定小鼠血清中Kyn和Trp血藥濃度。
材 料 和 方 法
儀器 Hitachi 2130型高效液相色譜儀(包括L-2130四元泵、L-2200自動進樣器、L-2455 UV檢測器),L-2300色譜柱恒溫箱,D-2000 Elite工作站,Direct-Q純化水系統(美國Millipore公司);TGL-16 g高速臺式冰凍離心機(湖南省湘儀集團);VORTEX-5渦旋混合器(海門市其林貝爾儀器制造公司);GB204型電子天平(瑞士Mettler Toledo公司);真空泵(美國GAST公司);pH計(上海理達儀器廠)等。
藥品和試劑 L-Kyn (美國Sigma公司);L-Trp (美國Sigma公司);乙腈(HPLC級,美國Dikma Technologies公司);醋酸鈉,冰醋酸,高氯酸(均為分析純,國藥集團化學試劑有限公司)。
試劑及其配制
儲備液 精密稱取L-Kyn標準品0.002 08 g,用體積百分比為2.5%的高氯酸溶解并于10 mL容量瓶中定容,配成1 mmol/L儲備液;精密稱取L-Trp標準品0.020 45 g,用體積百分比為2.5%的高氯酸溶解并于5 mL容量瓶中定容,配成20 mmol/L儲備液;均于4 ℃條件下儲存,臨用時稀釋至所需濃度。
標準曲線樣品 取一定體積的混合空白血清,加入Kyn和Trp儲備液適量,渦旋3 min,制得Kyn濃度范圍為0.25~10 μmol/L和Trp濃度范圍為25~1 000 μmol/L的混合標準曲線樣品,空白血清加入同體積的純水制得。
流動相 精密稱取醋酸鈉4.922 8 g,用純水溶解并于100 mL容量瓶中定容,配制成600 mmol/L儲備液。待用時,用10 mL量筒量取20 mL,加純水稀釋至800 mL,配制得15 mmol/L溶液,用冰醋酸調節pH 至4.0, 0.45 μm親水性微孔濾膜過濾制得。
樣品的收集及處理
Lewis肺癌荷瘤小鼠模型建立 健康雌性小鼠BALB/c小鼠80只,體質量為(20±1) g,SPF級實驗室喂養。用無菌生理鹽水將Lewis肺癌細胞制成濃度為1×107/mL的細胞懸液。無菌環境下在小鼠腋下皮下注射0.2 mL上述細胞懸液。
血清樣本的收集 小鼠接種后,隨機分為8組,每組10只。當腫瘤直徑達到5 mm時,首次給藥。對照組給予0.2 mL 0.5%CMC(羧甲基纖維素鈉),每天一次,灌胃給藥。其余7組分別給予相同體積不同種類和劑量的IDO抑制劑,每天一次,灌胃給藥,連續給藥21天。停藥后次日取血,置于干凈的促凝管內,采血后650×g離心15 min,分離血清,并于-20 ℃冰箱保存。
血清樣品的處理 取100 μL血清樣本于1.5 mL離心管中,加入60 μL 6%高氯酸,渦旋1 min,靜置5 min,10 000×g離心10 min,取上清進樣。
色譜條件 色譜柱:Thermo Hypersil GOLD (250 mm×4.6 mm,5 μm);預柱:Phenomenex C18 (40 mm×3.0 mm,5 μm);流動相:乙腈:醋酸鈉(15 mmol/L,冰醋酸調至pH 4.0,體積百分比為8∶92);流速:1.1 mL/min;柱溫:30 ℃;進樣體積:20 μL;犬尿氨酸紫外檢測波長:360 nm;色氨酸紫外檢測波長:280 nm。
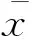
其中:Au為血清中Kyn的峰面積,As為標準曲線中Kyn總的峰面積,Ab為空白血清Kyn的峰面積,Cs為標準曲線中Kyn的濃度。
Trp采用相同方法進行計算。
結 果
方法學驗證
分析方法專屬性 在選定的色譜條件下運行Kyn和Trp的混合樣品,其中Kyn檢測波長為360 nm,Trp檢測波長為280 nm,由色譜圖(圖1~3)可見血清中內源性物質與待測定的物質完全分離,其中Kyn的保留時間為6.10 min,Trp的保留時間為10.12 min,峰形良好,且無其他內源性物質干擾。
標準曲線和線性范圍 取EP管(1.5 mL)若干只,各加入混合空白血清90 μL,加入Kyn和Trp對照品溶液10 μL,使血清中Kyn和Trp濃度分別為0.25、0.5、1、2.5、5、10 μmol/L和25、50、100、250、500、1 000 μmol/L,并按上述的血清樣本處理方式操作后進行HPLC處理分析。以Kyn和Trp的理論濃度為自變量X,Kyn和Trp的峰面積減空白血清平均值為因變量Y,用最小二乘法作線性回歸,得標準曲線方程:Kyn為Y=1 795.1X-17.221 (R2=1),Trp為Y=1 577.4X+8 281.3 (R2=0.999 8)。顯示本方法Kyn在0.25~10 μmol/L的濃度,Trp在25~1 000 μmol/L的濃度范圍內線性關系良好。
檢測限和定量限 按照信噪比3為檢測限,信噪比10為定量限。其中Kyn的檢測限為0.09 μmol/L,定量限0.25 μmol/L,Trp的檢測限為0.25 μmol/L,定量限0.75 μmol/L。
精密度試驗 配制高(Kyn 8 μmol/L、Trp 800 μmol/L)、中(Kyn 2.5 μmol/L、Trp 250 μmol/L)、低(Kyn 0.5 μmol/L、Trp 50 μmol/L)和定量下限(Kyn 0.25 μmol/L、Trp25 μmol/L) 4個濃度的標準血樣,同樣按照上述的血清樣本處理方式操作后進行HPLC分析,在同一天內對每一考察濃度平行配制5個樣品,進行日內和日間精密度考察,其相對標準偏差(RSD)均小于7%,結果見表1。
表1 Kyn和Trp的精密度


Concentration(μmol/L)Intra-dayInter-dayAssay(μmol/L)RSD(%)Assay(μmol/L)RSD(%)Kyn0.250.251±0.0156.140.239±0.0104.340.50.537±0.0264.770.494±0.0255.162.52.480±0.0893.592.503±0.0240.9887.999±0.0921.157.923±0.1071.34Trp2524.57±0.843.4124.57±0.843.415052.18±1.041.9853.05±1.232.32250255.54±5.272.06259.04±4.961.91800807.23±6.370.79801.77±7.720.96
回收率試驗 配制高(Kyn 8 μmol/L、Trp 800 μmol/L)、中(Kyn 2.5 μmol/L、Trp 250 μmol/L)和低(Kyn 0.5 μmol/L、Trp 50 μmol/L)3個濃度的標準血樣,同樣按照上述的血清樣本處理方式操作后進行HPLC分析,在同一天內對每一考察濃度平行配制3個樣品,進行回收率試驗,Kyn的回收率為95.40%~100.08%,Trp的回收率為99.54%~107.84%(表2)。
表2 Kyn和Trp的回收率


Concentration(μmol/L)Assay(μmol/L)Recovery(%)RSD(%)Kyn0.50.477±0.04695.409.662.52.502±0.078100.083.1487.848±0.17398.102.21Trp5053.92±2.63107.844.88250262.55±4.20105.021.60800796.31±20.1299.542.53
穩定性 分別對樣品在4 ℃、25 ℃以及自動進樣器條件下進行穩定性考察。具體條件如下:配制高(Kyn 8 μmol/L、Trp 800 μmol/L)和低(Kyn 0.5 μmol/L、Trp 50 μmol/L)兩個濃度的樣品各3份,分別放置于4 ℃和25 ℃下2 h及4 h、自動進樣器條件下4 h及8 h考察其穩定性。測得濃度與標示濃度相比較,偏差均在±10%之內,符合生物樣品定量分析方法驗證指導原則中穩定性的要求。
方法應用 用該方法同時測定了對照組和7組分別服用不同IDO抑制劑的小鼠血清中Kyn和Trp的濃度及其比值,其中有18例小鼠的血清由于量太少而無法測定,最終共得62例小鼠血清(表3)。t檢驗證實,只有IDO抑制組1與對照組的差異具有統計學意義(P<0.05),提示這7組分別服用不同種類和劑量IDO抑制劑的小鼠中,只有第1組IDO抑制劑對于抑制Kyn途徑具有明顯的抑制作用。

表3 實際生物樣品測定結果
討 論
Kyn和Trp均為內源性物質,對于它們的定量比較困難和復雜,目前國內外也沒有明確的關于內源性物質定量的指導性原則。在對小鼠血清Kyn和Trp的測定中,我們考慮到血清中成分多且基質復雜,為了減少基質不同給測定結果帶來的偏差,從而提高定量分析的準確性,所以采用了標準加入法對Kyn和Trp進行定量,該方法更為科學合理,并在相關的文獻中得到證實[10]。建立標準曲線時,混合空白血清來自于同一批在同樣環境下喂養的10只雌性小鼠。
在檢測器及波長的選擇方面,我們也進行了優化。鑒于Trp有較強的熒光特性,起初我們選擇了HPLC-熒光檢測法測定Trp,但由于有些實際生物樣品中Trp含量較高,測定時會出現超出量程的平頭峰而導致無法定量,若通過稀釋樣品進行分析又會因為Kyn含量較低,測定時低于檢測限而導致無法定量,綜合考慮2種被測組分的實際濃度后,我們最終選擇HPLC-紫外檢測法,采用兩個不同的波長分別測定Kyn和Trp,該法不需添加其他檢測器,更簡便易行。
[1] MANEGLIER B,ROGEZ-KREUZ C,CORDONNIER P,etal.Simultaneous measurement of kynurenine and tryptophan in human plasma and supernatants of cultured human cells by hplc with coulometric detection[J].ClinChem,2004,50(11):2166-2168.
[2] MANDI Y,VECSEI L.The kynurenine system and immunoregulation[J].JNeuralTransm(Vienna),2012,119(2):197-209.
[3] MORONI F.Tryptophan metabolism and brain function:focus on kynurenine and other indole metabolites[J].EurJPharmacol, 1999:87-100.
[4] LAICH ANG,WIDNER B,FUCHS D.More rapid method for simultaneous measurement of tryptophan and kynurenine by HPLC[J].ClinChem,2002,48(3):579-581.
[5] ZHAO J,CHEN H,NI P,etal. Simultaneous determination of urinary tryptophan,tryptophan-related metabolites and creatinine by high performance liquid chromatography with ultraviolet and fluorimetric detection[J].JChromatogrBAnalytTechnolBiomedLifeSci,2011,879(26):2720-2725.
[6] ZHAO J.Simultaneous determination of plasma creatinine,uric acid,kynurenine and tryptophan by high-performance liquid chromatography:method validation and in application to the assessment of renal function[J].BiomedChromatogr,2015,29(3):410-415.
[7] 甄乾娜,黃小蘭,張曉清,等.高效液相色譜-程序波長紫外檢測法同時測定血漿中的色氨酸及其代謝物[J].色譜,2011,29(5):435-438.
[8] VIGNAU J,JACQUEMONT MC,LEFORT A,etal. Simultaneous determination of tryptophan and kynurenine in serum by HPLC with UV and fluorescence detection[J].BiomedChromatogr,2004,18(10):872-874.
[9] 王瑞,唐愛國.高效液相色譜法同時測定血清中的犬尿氨酸和色氨酸[J].色譜,2006,24(20):140-143.
[10] 張煊,謝小青,劉婷立,等.內源性物質藥物的定量測定及生物等效性評價研究進展[J].中國新藥雜志,2011,20(22):2221-2228.
Simultaneous determination of kynurenine and tryptophan in serum of mice by standard addition method based on HPLC
CHEN Yue1, KANG Hong-yan1, HU Nan2, YANG Qing2, YU Yun-qiu1△
(1DepartmentofPharmaceuticalAnalysis,SchoolofPharmacy,FudanUniversity,Shanghai201203,China;2DepartmentofBiochemistryandMolecularBiology,SchoolofLifeSciences,FudanUniversity,Shanghai200438,China)
Objective A high performance liquid chromatography (HPLC) method has been developed for the simultaneous determination of kynurenine and tryptophan in the serum of mice,which was used to evaluate IDO activityinvivoin mice treated with IDO inhibitors. Methods Sample was precipitated with 6% perchloric acid to remove protein before centrifugation,then the clear layer was injected.Standard addition method was used for quantitative analysis.Separation was achieved by an Thermo Hypersil GOLD column (250 mm×4.6 mm,5 μm).The mobile phase composed of 15 mmol/L sodium acetate (acetic acid adjust pH to 4.0) and acetonitrile,with a constant flow rate of 1.1 mL/min at 30 ℃.Kynurenineand tryptophan were measured at UV detection wavelength of 360 nm and 280 nm,respectively. Results The retention time of kynurenine was 6.10 min,the linear range was from 0.25 to 10 μmol/L,and the detection limit was 0.09 μmol/L.The retention time of tryptophan was 10.12 min,the linear range was from 25 to 1 000 μmol/L,and the detection limit was 0.25 μmol/L. Precision,accuracy and stability all were accorded with guiding principles for quantitative analysis of biological samples.This method was applied to determinate kynurenine and tryptophan in serum of 62 mice successfully. Conclusions The HPLC method with standard addition quantitative analysis was a simple,rapid and accurate tool for simultaneous determination of kynurenine and tryptophan in serum of mice,which was applied to biological samples successfully.
kynurenine; tryptophan; HPLC; serum; standard addition method; mice
國家自然科學基金(81373396,81573310);高等學校博士學科點專項科研基金(20130071110037)
R917
A
10.3969/j.issn.1672-8467.2016.06.012
2016-05-30;編輯:王蔚)
△Corresponding author E-mail:yqyu@shum.edu.cn
* This work was supported by the National Natural Science Foundation of China (81373396,81573310) and the Research Fund of the Doctoral Program of Higher Education of China (20130071110037).

