二氫楊梅素抑制脂多糖誘導后BV2細胞HMGB1的核質轉位和釋放
劉 祎, 徐 運, 曹 翔
?
二氫楊梅素抑制脂多糖誘導后BV2細胞HMGB1的核質轉位和釋放
劉 祎, 徐 運, 曹 翔
目的 探索二氫楊梅素(Ampelopsin,AMP)對脂多糖(LPS)刺激的小膠質細胞BV2高遷移率族蛋白B1(HMGB1)核質轉位和釋放的影響。方法 不同濃度的二氫楊梅素(10 μmol/L,30 μmol/L,50 μmol/L)聯合LPS處理BV2細胞,用Elisa法檢測HMGB1的分泌水平;細胞核質分離方法檢測HMGB1核/質轉位;免疫共沉淀檢測HMGB1磷酸化的表達情況;免疫印跡檢測JAK2、STAT3磷酸化水平。結果 不同濃度的二氫楊梅素顯著抑制了LPS引起的BV2細胞HMGB1釋放,減少了LPS誘導的HMGB1由細胞核到細胞質的轉位。免疫共沉淀和免疫印跡結果表明:二氫楊梅素可減少HMGB1磷酸化水平,抑制LPS誘導的JAK2-STAT3信號通路激活。結論 二氫楊梅素可以抑制LPS介導的BV2細胞HMGB1的轉位和釋放,其主要機制可能是通過降低HMGB1的磷酸化以及抑制JAK2-STAT3信號途徑。
二氫楊梅素; 脂多糖; BV2細胞; 高遷移率族蛋白B1
小膠質細胞是中樞神經系統(central nervous system,CNS)固有的免疫效應細胞,在缺血性卒中后炎癥反應起著十分重要的作用[1,2]。病理條件下,小膠質細胞數量顯著增加并開始活化,激活的小膠質細胞通過釋放白細胞介素(interleukin,IL)、腫瘤壞死因子(tumor necrosis factor-α,TNF-α)、一氧化氮(nitric oxide,NO)、趨化因子(chemokine)和神經生長因子(nervegrowthfactor,NGF)等細胞因子發揮細胞毒性效應,導致繼發性腦損傷[3,4]。大量研究證實,抑制小膠質細胞的激活,可以減輕炎癥因子對神經組織的損傷,因此,抑制小膠質細胞的激活,將成為一種有效治療缺血性卒中的策略。高遷移率族蛋白B1(High mobility group protein box 1,HMGB1)是一種高度保守的細胞核內非組蛋白,具有廣泛的生物學效應。核內的HMGB1能穩定核小體,參與DNA修復、DNA重組等生命活動,然而分泌到胞外的HMGB1可通過激活其他炎癥介質,放大炎癥反應,加劇缺血性腦損傷。臨床研究發現,HMGB1在腦缺血后表達量明顯升高并持續數周,其升高程度與腦缺血程度呈正相關[5]。在大腦中動脈閉塞(middle cerebral artery occlusion,MCAO)動物模型和氧糖剝奪(oxygen glucose deprivation,OGD)細胞模型中,HMGB1表達水平也出現增高[6~8],并且與腦缺血程度有一定相關性。顱內注射HMGB1特異性抗體則顯著減少大鼠腦的梗死面積,降低血腦屏障損害[9]。因此,抑制HMGB1的激活可能成為缺血性卒中患者更為有效的治療手段。二氫楊梅素(Ampelopsin,AMP)是從蛇葡萄屬多年野生藤本植物莖葉中提取出來的有效成分,具有抗腫瘤、抗脂質過氧化、保肝護肝等作用[10,11]。目前,對二氫楊梅素的抗炎機制研究較少,有文獻報道了其對RAW264.7鼠巨噬細胞株早期炎癥因子的影響[12],然而對于二氫楊梅素是否可以減輕小膠質細胞介導的晚期炎癥因子HMGB1的釋放,尚未見文獻報道。在本研究中,我們利用BV2細胞,探究二氫楊梅素對脂多糖(Lipopolysaccharide,LPS)誘導HMGB1釋放的抑制作用,并探討其潛在作用機制,尋找缺血性卒中的潛在臨床治療手段。
1 材料和方法
1.1 試劑 二氫楊梅素(CAS號27200-12-0,純度98%)、LPS購自美國Sigma公司,BV2細胞株購買自中國科學院細胞庫。HMGB1和磷酸化絲氨酸(serine)抗體購于Abcam公司,JAK2、STAT3、p-JAK2和p-STAT3抗體均購自美國Cell Signaling公司,GAPDH、Lamin B、細胞核質分離試劑盒購于巴傲得生物科技有限公司。CCK-8試劑盒購自碧云天公司。HMGB1檢測Elisa試劑盒購于武漢華美生物試劑公司。蛋白A/G偶聯的瓊脂糖磁珠購自Millipore公司。
1.2 細胞培養 BV2細胞用含有10%胎牛血清、100 U/ml青霉素、100 μg/ml鏈霉素的高糖DMEM完全培養基,置于37 ℃、CO2體積分數為5%的培養箱中常規培養。每天換液,每2 d傳代1次,實驗使用均為對數生長期的細胞。
1.3 CCK-8法檢測細胞活性 將BV2細胞以每孔4×103個細胞的密度接種于96孔板,待細胞生長過夜貼壁后,與不同濃度二氫楊梅素(10 μmol/L,30 μmol/L,50 μmol/L)共孵育24 h,然后每孔加入10 μl CCK-8工作液,37 ℃孵育2 h,于450 nm波長下檢測光密度值。
1.4 酶聯免疫吸附(Elisa)法檢測HMGB1含量 將BV2細胞接種于12孔板中,待細胞生長過夜貼壁,用不同濃度的二氫楊梅素(10 μmol/L,30 μmol/L,50 μmol/L)預處理細胞2 h,繼而用LPS(500 ng/ml)刺激或不刺激細胞18 h,收取細胞培養液上清,3000 r/min離心10 min去除細胞碎片。釋放的HMGB1表達水平用雙抗夾心法測定,具體的操作步驟按照試劑盒說明書進行。最后根據標準品,確定樣品中HMGB1的含量。
1.5 細胞核質分離 將藥物處理的細胞用PBS(4 ℃)洗滌2遍,棄去PBS后加入細胞質裂解液(RLA),冰上孵育20 min,3000 r/min離心15 min,所得上清液為胞質蛋白。利用RLA洗滌沉淀,反復3次后,加入核裂解液(RIPA),冰上孵育20 min,每隔5 min渦旋振蕩30 s,12500 rpm/min離心15 min,上清液為核蛋白。
1.6 免疫印跡與免疫共沉淀 將藥物處理的細胞用預冷PBS(4 ℃)洗滌2遍,棄去PBS后加入細胞裂解液(含蛋白酶抑制劑)冰上裂解30 min,接著用細胞刮板將細胞完全刮下,4 ℃,12500 r/min離心15 min,吸取上清蛋白。500 mg總蛋白中加入5 μg HMGB1抗體進行免疫共沉淀分析,然后在旋轉混合器4 ℃過夜孵育,次日加入10%體積的預處理的蛋白 A/G 偶聯的瓊脂糖磁珠,旋轉混合器4 ℃孵育3 h,6000 r/min離心5 min,收集沉淀,利用細胞裂解液洗滌沉淀3次,最后利用上樣緩沖液打斷目的蛋白與磁珠之間的二硫鍵,得到上清蛋白。
每組樣品取等量蛋白上樣,進行SDS-聚丙烯酰胺凝膠電泳(SDS-PAGE)。電泳約2 h后100 V恒壓120 min轉膜,接著用5%脫脂奶粉封閉1 h,4 ℃一抗孵育過夜。次日用含0.05%Tween-20的TBS溶液洗膜3次,再用相應種屬來源的二抗室溫孵育1 h,TBST清洗3次,化學發光法顯影,用Image J圖像分析系統分析實驗結果。
2 結 果
2.1 低濃度的二氫楊梅素對BV2細胞活性無顯著影響 細胞活性的檢測結果如表1所示,與對照組相比,1~50 μmol/L的二氫楊梅素對BV2小膠質細胞活性影響無統計學差異(P>0.05),但是高濃度的二氫楊梅素(80 μmol/L和100 μmol/L)顯著降低了BV2細胞活性。因此,本實驗所用的劑量在50 μmol/L范圍內。
2.2 二氫楊梅素抑制LPS誘導的BV2細胞HMGB1的釋放 Elisa實驗結果表明,LPS能顯著引起BV2細胞HMGB1的釋放,而不同濃度二氫楊梅素預處理組HMGB1的釋放明顯低于LPS刺激組,并且抑制效應呈濃度依賴性(見圖1)。
2.3 二氫楊梅素抑制LPS誘導的BV2細胞HMGB1的核/質轉位 核質分離的實驗結果顯示(見圖2),LPS刺激BV2細胞12 h,大量的HMGB1蛋白由細胞核轉位至細胞質,而二氫楊梅素預處理組的BV2細胞,細胞核內的HMGB1蛋白含量明顯高于LPS組,而轉位至細胞質的HMGB1含量顯著低于LPS組,說明二氫楊梅素有效的抑制了LPS誘導的BV2細胞HMGB1的核/質轉位。
2.4 二氫楊梅素抑制LPS誘導的BV2細胞HMGB1的磷酸化 免疫共沉淀的結果發現,隨著LPS刺激時間的延長,HMGB1自身的磷酸化水平也隨之增高,4 h磷酸化水平達到最高點,而二氫楊梅素預處理顯著抑制了HMGB1的磷酸化(見圖3)。
2.5 二氫楊梅素抑制LPS誘導的BV2細胞JAK2-STAT3信號通路激活 LPS刺激BV2細胞后,JAK2、STAT3磷酸化增加,用二氫楊梅素預處理BV2細胞2 h,然后用LPS處理1 h,免疫印跡結果顯示,二氫楊梅素組細胞p-JAK2、p-STAT3水平明顯下調(見圖4)。
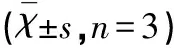
表1 二氫楊梅素對BV2細胞活性的影響
與對照組比較,*P<0.05 ,**P<0.01

與對照組比較,*P<0.05,**P<0.01
圖1 二氫楊梅素抑制LPS誘導的BV2細胞HMGB1釋放

與LPS組比較,**P<0.01
圖2 二氫楊梅素抑制LPS誘導的BV2細胞HMGB1的核/質轉位

圖3 二氫楊梅素抑制LPS誘導的BV2細胞HMGB1的磷酸化

與對照組比較,**P<0.01;與LPS組比較,##P<0.01
圖4 二氫楊梅素對LPS誘導的BV2細胞JAK2-STAT3信號通路激活的影響
3 討 論
從發現HMGB1至今已有30余年的歷史,因其分子質量小,在SDS-PAGE電泳時泳動速度快而得名。Wang等首次發現HMGB1是內毒素血癥的炎性介質,與IL-1β、TNF-α這些經典的早期炎癥因子相比,有表達高峰晚且持續時間長的特點[13]。近來的研究發現:HMGB1可以直接誘導細胞凋亡,擴大MCAO大鼠的梗死面積,并且加劇神經功能損傷[14,15]。臨床研究顯示,腦缺血患者血漿HMGB1水平顯著高于對照組,與缺血性卒中嚴重程度以及1年時功能轉歸密切相關[16]。利用HMGB1的單克隆抗體或者干擾RNA能顯著減少MCAO模型大鼠的腦損傷[9]。因此,充分了解HMGB1在腦缺血中的作用機制,尋找可靠有效的HMGB1抑制劑,有望為缺血性卒中的治療帶來新的方向。
小膠質細胞是介導神經炎癥最主要的細胞,同時也是中樞神經系統第一道免疫防線,過度激活的小膠質細胞會釋放包括HMGB1在內的大量炎性因子,導致神經元壞死與凋亡,引發嚴重的神經損傷[3,17]。體外OGD細胞模型研究中還發現,HMGB1能由神經元分泌,繼而通過識別小膠質細胞上的HMGB1受體激活小膠質細胞,進一步促進并加重缺血再灌注損傷[15]。BV2細胞經LPS刺激后能夠生成NO等炎癥因子,激活NF-κB信號通路,能與T細胞、神經元相互作用[18]。
二氫楊梅素是一種具有藥用價值的黃酮類物質,近年的研究發現其具有抗腫瘤、抗氧化、解酒護肝、抗病原微生物、抗炎等藥理作用,在LPS誘導RAW264.7細胞中,其通過抑制IκB磷酸化、NF-κB的核轉運抑制炎癥反應[12]。本研究主要探討了二氫楊梅素對LPS誘導后BV2細胞HMGB1核/質轉位及釋放的作用,并對其可能的機制進行了探究。結果發現,二氫楊梅素能抑制LPS誘導的HMGB1釋放,并且抑制效應呈現劑量依賴性。研究發現,HMGB1的核/質轉位是其由細胞釋放到胞外的前提,實驗中我們利用核質分離觀察二氫楊梅素對HMGB1轉位的影響,結果發現二氫楊梅素能夠抑制HMGB1從細胞核向細胞質的轉位。研究指出,HMGB1的轉位和釋放以自身磷酸化為前提[19],同時Youn等發現細胞質中磷酸化的HMGB1不能自由的入核[20]。我們進一步的實驗結果證實,二氫楊梅素的預處理能顯著減少LPS誘導后BV2細胞HMGB1的磷酸化水平。研究證實JAK2-STAT3信號途徑參與HMGB1的釋放,該通路的抑制劑AG490被證實具有減少HMGB1從巨噬細胞中釋放的能力[21,22],我們進一步檢測了JAK2-STAT3信號通路的變化。實驗結果發現二氫楊梅素可抑制LPS激活的JAK2-STAT3信號通路。這些結果說明,二氫楊梅素可以抑制LPS誘導后BV2細胞HMGB1核/質轉位和釋放,其潛在機制可能與HMGB1的磷酸化以及JAK2-STAT3信號通路有關。
本研究初步證實二氫楊梅素預處理能抑制LPS誘導的BV2細胞HMGB1的釋放,提示二氫楊梅素具有抗神經炎癥的作用。通過潛在機制的探究,為臨床治療缺血性卒中的神經炎性反應提供了一定的理論依據。本研究只涉及BV2細胞的體外研究,在動物模型上的進一步探討將是我們未來研究的重點。
[1]Graeber MB. Changing face of microglia[J]. Science,2010,330(6005):783-788.
[2]Griffiths M,Neal JW,Gasque P. Innate immunity and protective neuroinflammation:new emphasis on the role of neuroimmune regulatory proteins[J]. Inter Rev Neurobiol,2007,82:29-55.
[3]Lucas SM,Rothwell NJ,Gibson RM. The role of inflammation in CNS injury and disease[J]. Brit J Pharmacol,2006,147(Suppl 1):232-240.
[4]Block ML,Zecca L,Hong JS. Microglia-mediated neurotoxicity:uncovering the molecular mechanisms,Nature reviews[J]. Neuroscience,2007,8(1):57-69.
[5]Goldstein RS,Gallowitsch-Puerta M,Yang L,et al. Elevated high-mobility group box 1 levels in patients with cerebral and myocardial ischemia[J]. Shock,2006,25(6):571-574.
[6]Muhammad S,Barakat W,Stoyanov S,et al. The HMGB1 receptor RAGE mediates ischemic brain damage[J]. J Neurosci,2008,28(46):12023-12031.
[7]Xiong XX,Gu LJ,Shen J,et al. Probenecid protects against transient focal cerebral ischemic injury by inhibiting HMGB1 release and attenuating AQP4 expression in mice [J]. Neurochem Res,2014,39(1):216-224.
[8]Kim JB,Lim CM,Yu YM,et al. Induction and subcellular localization of high-mobility group box-1 (HMGB1) in the postischemic rat brain [J]. J Neurosci Res,2008,86(5):1125-1131.
[9]Kim JB,Sig Choi J,Yu YM,et al. HMGB1,a novel cytokine-like mediator linking acute neuronal death and delayed neuroinflammation in the postischemic brain [J]. J Neuroscie,2006,26(24):6413-6421.
[10]Ni F,Gong Y,Li L,et al. Flavonoid ampelopsin inhibits the growth and metastasis of prostate cancer in vitro and in mice [J]. PloS One,2012,7(6):e38802.
[11]Murakami T,Miyakoshi M,Araho D,et al. Hepatoprotective activity of tocha,the stems and leaves of Ampelopsis grossedentata,and ampelopsin [J]. Bio Factors,2004,21(1):175-178.
[12]Qi S,Xin Y,Guo Y,et al. Ampelopsin reduces endotoxic inflammation via repressing ROS-mediated activation of PI3K/Akt/NF-kappaB signaling pathways [J]. Inter Immunopharmacol,2012,12(1):278-287.
[13]Wang H,Bloom O,Zhang M,et al. HMG-1 as a late mediator of endotoxin lethality in mice [J]. Science,1999,285(5425):248-251.
[14]Liu K,Mori S,Takahashi HK,et al. Anti-high mobility group box 1 monoclonal antibody ameliorates brain infarction induced by transient ischemia in rats [J]. FASEB J,2007,21(14):3904-3916.
[15]Faraco G,Fossati S,Bianchi ME,et al. High mobility group box 1 protein is released by neural cells upon different stresses and worsens ischemic neurodegeneration in vitro and in vivo [J]. J Neurochem,2007,103(2):590-603.
[16]Huang JM,Hu J,Chen N,et al. Relationship between plasma high-mobility group box-1 levels and clinical outcomes of ischemic stroke [J]. J Critic Care,2013,28(5):792-797.
[17]Shin JH,Lee HK,Lee HB,et al. Ethyl pyruvate inhibits HMGB1 phosphorylation and secretion in activated microglia and in the postischemic brain [J]. Neurosci Let,2014,558:159-163.
[18]Henn A,Lund S,Hedtjarn M,et al. The suitability of BV2 cells as alternative model system for primary microglia cultures or for animal experiments examining brain inflammation [J]. Altex,2009,26(2):83-94.
[19]Oh YJ,Youn JH,Ji Y,et al. HMGB1 is phosphorylated by classical protein kinase C and is secreted by a calcium-dependent mechanism [J]. J Immunol,2009,182(9):5800-5809.
[20]Youn JH,Shin JS. Nucleocytoplasmic shuttling of HMGB1 is regulated by phosphorylation that redirects it toward secretion [J]. J Immunol,2006,177(11):7889-7897.
[22]Liu H,Yao YM,Yu Y,et al. Role of Janus kinase/signal transducer and activator of transcription pathway in regulation of expression and inflammation-promoting activity of high mobility group box protein 1 in rat peritoneal macrophages [J]. Shock,2007,27(1):55-60.
Inhibitory effects of ampelopsin on translocation and secretion of HMGB1 in BV2 microglial cells induced by LPS
LIU Yi,XU Yun,CAO Xiang.
(Department of Neurology,Drum Tower Hospital of Nanjing University Medical School,Nanjing,Jiangsu 210008,China)
Objective To investigate the effects of ampelopsin (AMP) on the nuclear/cytosolic translocation and secretion of high mobility group box1 (HMGB1) in BV2 cells induced by lipopolysaccharide (LPS). Methods Different concentrations of ampelopsin (10 μmol/L,30 μmol/L,50 μmol/L) were added to LPS-treated BV2 cells. The secretion level of HMGB1 was examined by specific Elisa assays. We further investigated whether ampelopsin could block HMGB1 translocation from nuclear to cytoplasm during LPS treatments. The effect of ampelopsin on HMGB1 phosphorylation was detected by co-immunoprecipitation. The expression of phosphorylated JAK2 and STAT3 were detected by Western blotting. Results Ampelopsin at the dose of 50 μmol/L markedly attenuated HMGB1 secretion after LPS treatment. The levels of nuclear HMGB1 were decreased and HMGB1 was accumulated in the cytoplasm after LPS. However,ampelopsin treatment obviously inhibited nucleus to cytoplasm translocation of HMGB1.Co-immunoprecipitation results showed that ampelopsin pretreatment blocked HMGB1 phosphorylation. Western blotting revealed that ampelopsin significantly down-regulated the phosphorylation of JAK2-STAT3 pathway in LPS-stimulated BV2 cells. Conclusion Pretreatment with ampelopsin before LPS suppressed HMGB1 secretion from activated microglia and its nuclear/cytosolic translocation through interfering with both JAK2/STAT3 signaling pathways and HMGB1 phosphorylation.
Ampelopsin; Lipopolysaccharide; BV2 cells; High mobility group box1
1003-2754(2016)11-0969-04
2016-09-15;
2016-10-04
國家自然科學基金(No. 81230026);南京大學中央高校基本科研項目(No. 021414380132);江蘇省博士后科研資助計劃(No. 1601009C)
(南京大學醫學院附屬鼓樓醫院神經內科,江蘇 南京 210008)
曹 翔,E-mail:xiangcao1988@163.com
R966
A

