慢性阻塞性肺疾病急性加重合并肺栓塞患者的臨床表現和輔助檢查特征分析
楊瓊芳 方雙燕 季巧英 馮蘭芳
慢性阻塞性肺疾病急性加重合并肺栓塞患者的臨床表現和輔助檢查特征分析
楊瓊芳 方雙燕 季巧英 馮蘭芳
慢性阻塞性肺疾病(COPD)急性加重期易合并肺栓塞,發生率高達17.5%[1],而肺栓塞一旦發生,心肺功能則進一步惡化,甚至危及生命,病死率顯著增加。因而,提高對慢性阻塞性肺疾病急性加重(AECOPD)合并肺栓塞臨床特征的認識尤為重要。本研究通過分析AECOPD合并肺栓塞患者的臨床特征,觀測抗凝治療前后血清D-二聚體、腦鈉肽前體(Pro-BNP)、肌鈣蛋白T及肺動脈壓力等指標的變化,評估這些臨床指標對AECOPD合并肺栓塞的診斷價值,從而為基層醫院臨床經驗性診斷和治療提供一定的依據,現報道如下。
1 對象和方法
1.1 對象 選擇2014年6月至2015年9月本院呼吸內科收治的經CT肺動脈造影(CTPA)檢查診斷為肺栓塞,合并COPD且處于急性加重期,同時COPD綜合評分為C、D級的51例住院患者作為觀察組;選取同期入住的COPD綜合分級為C、D級的AECOPD患者,經CTPA檢查排除肺栓塞的53例作為對照組。所有患者均符合2013年中華醫學會呼吸病學分會的AECOPD診治指南中的診斷標準[2]。肺栓塞的診斷標準依據2011年中華醫學會呼吸病學分會的肺血栓栓塞癥的診斷與治療(草案)提出的診斷標準,均行CTPA確診。兩組患者性別、年齡、基礎疾病等比較差異均無統計學意義(均P>0.05),詳見表1。
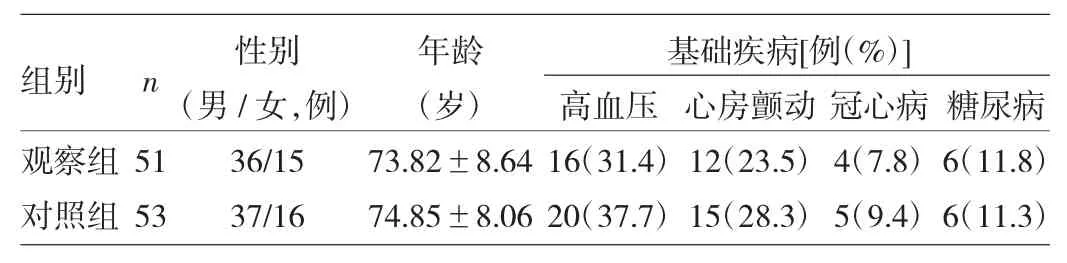
表1 兩組患者一般資料比較
1.2 方法
1.2.1 病史采集 入院24 h內對所有患者進行病史采集,包括:呼吸困難、胸痛、暈厥、咳嗽、咯血、心悸;發熱、單側或雙側胸腔積液、下肢不對稱浮腫。
1.2.2 檢測指標 入院24h內對所有患者抽取靜脈血10ml快速送檢。采用法國STA-COMPACT全自動血凝儀以快速酶聯免疫吸附法(ELISA)測定D-二聚體;采用美國BECKMAN公司DXI800型全自動化學發光儀以微粒子化學發光法測定Pro-BNP;采用瑞士羅氏Roche E170模塊型電化學發光免疫分析儀以電化學免疫發光法測定肌鈣蛋白T。采用美國PHILIPS IE33彩色多普勒超聲儀測定安靜狀態下肺動脈收縮壓(PASP),心臟彩超檢查均系同一人操作。采用德國西門子SOMATOM Definition AS 64排128層4D螺旋CT儀器行CTPA檢查。經CTPA確診為肺栓塞的患者給予依諾肝素鈉針0.1ml/10kg皮下注射,2次/d,并于注射第3天加用華法林3mg[此后每天依據國際標準化比值(INR)的變化調整華法林用量]抗凝治療2周,于第15天清晨再次采血檢測上述指標并行超聲心動圖評估肺動脈壓力情況。
1.3 統計學處理 采用SPSS18.0統計軟件,計量資料以表示,組間比較采用t檢驗;計數資料以百分比表示,組間比較采用χ2檢驗。
2 結果
2.1 兩組患者臨床癥狀及體征比較 見表2。
由表2可見,兩組患者呼吸困難、胸痛、暈厥、咳嗽、咯血、胸悶及發熱比較差異均無統計學意義(均P>0.05),而胸腔積液及下肢不對稱浮腫的發生率差異均有統計學意義(均P<0.05)。
2.2 兩組患者血清D-二聚體、肌鈣蛋白T、Pro-BNP及PASP比較 見表3。
由表3可見,觀察組血清D-二聚體、肌鈣蛋白T水平、Pro-BNP水平及PASP較對照組升高,差異均有統計學意義(均P<0.05)。
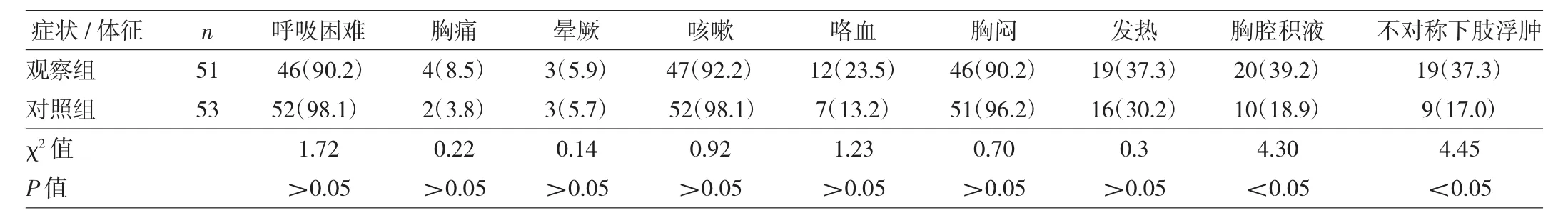
表2 兩組患者臨床癥狀及體征比較[例(%)]

表3 兩組患者血清D-二聚體、肌鈣蛋白T、Pro-BNP及PASP比較
2.3 觀察組抗凝治療后D-二聚體、肌鈣蛋白T、Pro-BNP及PASP比較 抗凝治療2周后觀察組血清D-二聚體、Pro-BNP水平及PASP分別為(1.05±0.76)pg/ml、(2 097.14±1 009.91)pg/ml、(39.42±9.05)mmHg,較抗凝治療前明顯下降,差異均有統計學意義(t=4.57、3.29、5.35,均P<0.01);肌鈣蛋白T水平為(0.023±0.010)ng/ ml,與抗凝治療前相比差異無統計學意義(t=0.76,P>0.05)。
3 討論
急性肺栓塞患者臨床表現多樣化且無特異性,與AECOPD患者臨床表現相似,導致AECOPD是否合并肺栓塞往往難于鑒別。本文資料顯示,觀察組呼吸困難、胸痛、暈厥、咳嗽、咯血、胸悶及發熱等臨床癥狀與對照組比較差異均無統計學意義,這與Tillie-Leblond[3],Lesser[4]的研究結果一致。本研究還發現觀察組胸腔積液及不對稱下肢浮腫的發生率明顯增多。觀察組約39.2%的患者出現胸腔積液,該比例大約是對照組的2.1倍。原因可能在于一方面肺栓塞引起肺動脈高壓與右心衰竭,導致壁層胸膜毛細血管靜脈壓升高,液體漏出產生胸腔積液[5];另一方面富含血小板的血栓中炎癥介質釋放,導致肺毛細血管滲透性增加,肺間質內過多滲出的液體穿透臟層胸膜聚集于胸膜腔形成胸腔積液[6]。AECOPD患者由于長時間臥床造成血液瘀滯及缺氧導致紅細胞代償性增多造成血液高凝狀態,從而誘發深靜脈血栓的形成。深靜脈血栓形成的典型癥狀正是不對稱下肢浮腫。因此本文進一步證明不對稱下肢浮腫可以作為AECOPD患者合并肺栓塞的危險因素,這亦再次證實了Gunen[7]的研究結果。因此臨床上對于AECOPD患者,若出現不明原因的胸腔積液及不對稱下肢浮腫,則需高度警惕合并肺栓塞可能,應及早進行進一步檢查。
急性肺栓塞后肺泡巨噬細胞Latexin表達顯著升高,導致內皮素-1濃度增加。內皮素-1可促進纖維蛋白的沉積,從而增強血小板的黏附反應,繼發纖溶亢進,并經纖溶酶水解交聯纖維蛋白,使血漿D-二聚體升高[8-10]。因此,D-二聚體作為交聯纖維蛋白的特異性降解產物,是反映體內高凝狀態和繼發纖溶活性的敏感標志物之一[11]。國內外學者研究發現,AECOPD患者合并急性肺栓塞時血清D-二聚體水平顯著升高[12-13],與本研究結果基本一致。本研究還發現,經正規抗凝治療后D-二聚體明顯下降,原因可能在于通過降低AECOPD患者血液黏稠性、避免患者處于高凝狀態和繼發性纖溶亢進,從而使D-二聚體下降。
Pro-BNP是由心室肌細胞合成和分泌的一類具有調節血壓、維持水和電解質平衡作用的內源性激素,在心室的容量負荷和壓力負荷增加時分泌增加。AECOPD時可因存在右心功能不全,導致Pro-BNP升高。AECOPD患者出現急性肺栓塞后,因血栓的機械阻塞、低氧及神經體液因素等機制引起肺動脈收縮,從而增加肺血管阻力,導致肺動脈壓力升高,進而增加右心室后負荷,引起Pro-BNP水平進一步上升。本研究發現觀察組肺動脈壓力與Pro-BNP水平較對照組明顯增高,這與理論相符。文獻亦指出Pro-BNP升高及肺動脈高壓均可預測肺栓塞相關的病死率,故可作為評估肺栓塞病情嚴重程度的指標[14-16]。本研究中,82.4%的患者合并血清Pro-BNP升高,62.7%的患者出現肺動脈高壓,明顯高于Gibson[17]的報道,原因可能與本研究入選者均為AECOPD綜合評分為C、D級的患者,而這部分患者病情相對較重,本身可能存在心肺功能不全,合并肺栓塞后導致心肺功能進一步惡化有關。本研究還發現,抗凝治療通過改善患者臨床癥狀、糾正缺氧,從而減少炎癥介質及神經體液因素和低氧血癥引起的肺動脈收縮,降低肺動脈壓力,減輕右心室后負荷,進一步導致Pro-BNP水平下降。
心肌肌鈣蛋白是反映心肌損傷的靈敏指標,在急性肺栓塞的早期即可檢測到,原因在于急性肺栓塞引起血流動力學障礙和氣體交換障礙,進一步影響心肌代謝,損傷心肌細胞。本研究發現觀察組血清肌鈣蛋白T水平較對照組有所升高,但91.6%的患者血清肌鈣蛋白T水平仍波動在正常范圍,只有8.4%的嚴重右心功能不全患者肌鈣蛋白T明顯高于正常范圍,基于右心功能是肺栓塞預后的確認指標,從而表明肌鈣蛋白T可以作為急性肺栓塞預后的一個指標,亦進一步證實了Janata[18]的觀點。
AECOPD作為肺栓塞的一項獨立危險因素,在肺栓塞的發生、發展過程中具有十分重要的作用。當AECOPD患者一旦出現不明原因的胸腔積液及不對稱下肢浮腫,需高度警惕肺栓塞可能。一旦疑診肺栓塞,則應及時行D-二聚體、肌鈣蛋白T、Pro-BNP檢測及心臟彩超檢查評估肺動脈壓力,若出現上述指標的明顯異常,在病情允許的前提下可及早進行CTPA或核素肺通氣/灌注掃描進行綜合性檢查以明確診斷,并及時進行溶栓及抗凝治療改善患者的預后。
[1]BahloulM,ChaariA,TounsiA,et al.Incidence and impact outcome ofpulmonary embolism in critically illpatients with severe exacerbation ofchronic obstructive pulmonary diseases[J].Clin Respir J, 2015,9(3):270-277.
[2]慢性阻塞性肺疾病急性加重(AECOPD)診治專家組.慢性阻塞性肺疾病急性加重(AECOPD)診治中國專家共識(2014年修訂版)[J].國際呼吸雜志,2014,34(1):1-11.
[3]Tillie-Leblond I,Marquette C H,Perez T,et al.Pulmonary embolism in patients with unexplained exacerbation of chronic obstructive pulmonary disease:Prevalence and risk factors[J].Ann Intern Med,2006,144:390-396.
[4]Lesser B A,Leeper K VJr,Stein P D,et al.The diagnosis of acute pulmonary embolism in patients with chronic obstructive pulmonary disease[J].Chest,1992,102:17-22.
[5]FindikS.pleuraleffusion in pulmonary embolism[J].Curr Opin Pulm Med,2012,18(4):347-354.
[6]PorcelJ W,Light R W.Pleuraleffusion due to pulmonary embolism [J].Curr Opin Pulm Med,2005,11:329-333.
[7]Gunen H,Gulbas G,In E,et al.Venous thromboemboliand exacerbations ofCOPD[J].Eur Respir J,2010,35:1243-1248.
[8]Gutte H.Neuroendocrine activation and diagnostics in pulmonary embolism:Translationalstudies[J].DanMed Bull,2011,58(3):B4258.
[9]Gutte H,Mortensen J,Jensen C V,et al.ANP,BNP and D-dimer predict right ventricular dysfunction in patients with acute pulmonary embolism [J].Clin Physiol Funct Imaging,2010,30(6): 466-472.
[10]AgterofMJ,van BladelER,Schutgens RE,et al.Risk stratification of patients with pulmonary embolism based on pulse rate and D-dimer concentration[J].Thromb Haemost,2009,102(4):683-687.
[11]Kearon C,Ginsberg J S,Douketis J,et al.An evaluation of D-dimer in the diagnosis of pulmonary embolism:a randomized trial[J].Ann Intern Med,2006,144(11):812-821.
[12]葉曉芳,劉雙,楊京華.血漿D-二聚體水平測定在不同肺部疾病中的臨床意義[J].心肺血管病雜志,2009,28(1):7-9.
[13]Hartmann I J,Hagen P J,Melissant C F,et al.Diagnosing acute pulmonary embolism:effect of chronic obstructive pulmonary disease on the performance of D-dimer testing,ventilation/perfusion scintigraphy,spiral computed tomographic angiography, and conventional angiography.ANTELOPE Study Group.Advances in New Technologies Evaluating the Localization of Pulmonary Embolism[J].Am J Respir Crit Care Med,2000,162(6): 2232-2237.
[14]Klok F A,Mos I C,Huisman M V.Brain-type natriuretic peptide levels in the prediction of adverse outcome in patients with pulmonary embolism:a systematic review and meta-analysis[J]. Am J Respir Crit Care Med,2008,178(4):425-430.
[15]Lega J C,Lacasse Y,Lakhal L,et al.Natriuretic peptides and troponins in pulmonary embolism:a meta-analysis[J].Thorax, 2009,64(10):869-875.
[16]Becattini C,Casazza F,Forgione C,et al.Acute pulmonary embolism:external validation of an integrated risk stratification model[J].Chest 2013,144(5):1539-1545.
[17]Gibson N S,Sohne M,Buller H R.Prognostic value of echocardiography and spiralcomputed tomography in patients with pulmonary embolism[J].Curr Opin Pulm Med,2005,11(5):380-384.
[18]Janata K,Holzer A,Laggner A N,et al.Cardiac troponin T in the severity assessment of patients with pulmonary embolism:cohort study[J].BMJ,2003,326(7384):312-313.
2015-12-03)
(本文編輯:馬雯娜)
金華市科學技術局資助項目(2014-3-113)
322100 溫州醫科大學附屬東陽醫院呼吸內科
楊瓊芳,E-mail:qfy195581@163.com

