T-CAM表面修飾n-HA/PA66復合骨修復材料修復兔橈骨骨缺損的實驗研究*
邱 皓,董 靖,盧公標,盧旻鵬△,曹春風,王群波,張銘華△
(1.重慶醫科大學附屬永川醫院骨科,重慶 402160;2.山東省濟寧市人民醫院骨科 272011)
?
T-CAM表面修飾n-HA/PA66復合骨修復材料修復兔橈骨骨缺損的實驗研究*
邱 皓1,董 靖1,盧公標2,盧旻鵬1△,曹春風1,王群波1,張銘華1△
(1.重慶醫科大學附屬永川醫院骨科,重慶 402160;2.山東省濟寧市人民醫院骨科 272011)
目的 探討T-CAM表面修飾納米羥基磷灰石/聚酰胺66(nano-hydroxyapatite/polyamide66,n-HA/PA66)復合骨修復材料修復兔橈骨中段骨缺損的療效。方法 選擇36只成年新西蘭大白兔,建立右橈骨中段1.5cm骨缺損模型后分為兩組:實驗組植入T-CAM表面修飾n-HA/PA66復合骨修復材料;對照組植入n-HA/PA66。觀察術前,術后2、4、8、12周靜脈血堿性磷酸酶(ALP)值;術后4、8、12周每個時間點處死6只兔子,進行X線片、大體標本觀察、組織學等觀察橈骨骨缺損愈合情況。結果 所有兔子術后切口均一期愈合,無死亡,無體內植入材料脫落。影像學及組織學結果表明實驗組在術后4周就有新生骨組織,隨著時間的延長,實驗組新骨生長速度和數量明顯優于對照組,術后12周Lane-Sandhu法X線片和組織學評分實驗組均高于對照組(P<0.05);術后2周實驗組ALP值開始升高,隨著時間的推移,兩組ALP值均升高,術后8周達最高峰,之后開始下降,在12周時接近于術前,靜脈血ALP值在術后第2、4、8周與對照組比較差異有統計學意義(P<0.05)。結論T-CAM表面修飾n-HA/PA66復合骨修復材料具有促進骨質愈合的作用,尤其在早期修復骨缺損的效果優于n-HA/PA66。
橈骨;堿性磷酸酶;骨折愈合;骨缺損;納米羥基磷灰石;聚酰胺66
骨缺損的修復是困擾骨科醫生的難題之一。納米羥基磷灰石/聚酰胺66(nano-hydroxyapatite/polyamide 66,n-HA/PA66)復合骨修復材料是本課題組前期開發的具有優良的生物學性能和類骨活性的骨修復材料[1]。T-CAM黏附分子(Tetra-cell adhesion molecule)是包含RGD(arginine-glycine-aspartic acid),PHSRN(proline-histidine-serine-arginine-asparagine),EPDIM(glutamic acid-proline-aspartic acid-isoleucine-methionine),YH(tyrosine-histidine)4個序列互補性修飾的黏附分子,能夠促進細胞的黏附與擴散,動物實驗表明復合T-CAM黏附分子的脫鈣骨有良好的修復骨缺損能力[2]。本研究將T-CAM黏附分子修飾于n-HA/PA66上,制備T-CAM表面修飾n-HA/PA66復合骨修復材料,觀察其對兔橈骨中段骨缺損的修復能力,并為其應用于臨床提供理論和實驗基礎。
1 材料與方法
1.1 材料 n-HA/PA66復合骨修復材料(材料規格: 4.0 mm×15.0 mm圓柱體)。
1.2 方法
1.2.1 T-CAM表面修飾nHA/PA66復合骨修復材料的制備 按文獻[3]制備T-CAM黏附分子。將n-HA/PA66復合骨修復材料置入溶有一定量T-CAM黏附分子的磷酸鹽緩沖液(PBS)中浸泡24 h后室溫下風干,然后在水提取器除去未被修飾的T-CAM,制得T-CAM表面修飾n-HA/PA66復合骨修復材料。
1.2.2 骨缺損動物模型制備及實驗分組 4~6月齡健康成年新西蘭大白兔(由重慶醫科大學實驗動物中心提供,雌雄不限)用速眠新(3 mL/kg)麻醉后,按孟純陽等[4]的方法制作節段性右側橈骨中段骨缺損模型,缺損長度1.5 cm。將36只造模成功的新西蘭大白兔分為兩組,每組18只。其中,實驗組植入T-CAM表面修飾n-HA/PA66復合骨修復材料(圖1);對照組植入n-HA/PA66復合材料。所有兔子術后均分籠飼養,每天每只肌內注射青霉素8×105U(分2次),稀碘伏消毒傷口(2次/天),連續3 d。

圖1 實驗組術中植入材料
1.2.3 觀察指標
1.2.3.1 一般情況觀察 術后觀察兔子的飲食、前肢功能、步態及傷口愈合情況。
1.2.3.2 血清堿性磷酸酶(ALP)測定 于術前,術后2、4、8、12 周分別抽取靜脈血檢測ALP值。觀察兩組兔子血清ALP的變化,進行統計學分析。
1.2.3.3 影像學觀察 術后4、8、12周行兔右橈骨X線片檢查,觀察骨折愈合情況;采用Lane-Sandhu X射線評分標準[5]評估骨-材料界面骨痂形成及骨愈合情況。
1.2.3.4 大體及組織學觀察 術后4、8、12周處死兔子,將植入材料連同兩端0.5 cm正常骨組織取出,觀察橈骨骨缺損修復情況。之后將標本置于10%福爾馬林中固定,經脫鈣,石蠟包埋,縱行切片后,行蘇木素-伊紅(HE)染色,光鏡下觀察新生骨組織長入材料內情況及材料周圍新生骨組織情況。并采用Lane-Sandhu 組織學評分標準[6]評估骨缺損修復情況。

2 結 果
2.1 一般情況 術后1h后兔子蘇醒,可自由活動,但進食稍差;術后3d內所有兔子飲食均稍差,活動少;1周后兔子飲食明顯增加;所有兔子術后切口均一期愈合。
2.2 血清ALP檢測結果 術后2、4、8 周時各組ALP均較術前顯著升高,術后2周實驗組ALP值開始升高,隨著時間的推移,兩組ALP值均升高,術后8周達最高峰,之后開始下降,在12周時接近于術前;靜脈血ALP值在術后第2、4、8周與對照組比較差異有統計學意義(P<0.05),見表1。
2.3 影像學結果 術后第4周,實驗組骨-材料界面界面模糊,可見骨痂形成,對照組材料與骨組織分界仍較清楚,有少量骨痂形成;術后第8周,實驗組材料周圍骨痂明顯增多,材料-骨組織界面模糊,分界不清,對照組相骨痂明顯較少;術后第12周,實驗組和對照組均可見新生骨痂包裹材料,材料-骨組織界面模糊,實驗組材料周圍大量骨痂形成,量較對照組多。術后第12周Lane-SandhuX線片評分結果顯示實驗組(10.24±0.37)分,對照組(8.41±0.77)分,二者比較差異有統計學意義(t=2.147,P=0.037),見表2。
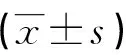
表1 各組血清ALP檢測結果
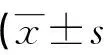
表2 各組Lane-Sandhu X線片評分結果,分)
2.4 組織學觀察結果 術后4周,實驗組材料-骨界面可見纖維骨痂、新生血管組織及骨組織,對照組在材料-骨界面可見大量纖維組織、軟骨細胞及少量新生骨組織,但未見明顯新生血管組織;術后8周,實驗組材料-骨界面可見大量新生骨組織、新鮮松質骨及新生血管組織,對照組在材料-骨界面可見纖維組織、新生血管、骨母細胞等;術后12周,實驗組可見大量板層骨形成,骨痂塑形完好,對照組在材料-骨界面可見大量新生骨組織、密質骨,見圖2。術后第12周 Lane-Sandhu組織學評分結果顯示實驗組(11.65±0.58)分,對照組(9.33±0.26)分,二者比較差異有統計學意義(t=2.438,P=0.031),見表3。

圖2 術后12周骨-材料界面HE染色(×100)
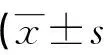
表3 各組Lane-Sandhu組織學評分結果,分)
3 討 論
骨缺損的修復和重建是目前骨科研究領域中的熱點課題,現階段臨床上應用較為廣泛的骨修復材料主要包括異體骨、自體骨和人工生物材料等。自體骨來源有限,異體骨移植可能使患者產生免疫排斥反應,也存在倫理問題和引入外源病菌、病毒的風險。這些問題與風險促使人們研制更加先進、有效的人工骨修復材料來實現骨組織缺損的再生與重建。n-HA/PA66復合骨修復材料因具有良好的生物力學性能、生物相容性及生物安全性,目前已廣泛用于骨缺損的填充及修復,并取得了不錯的臨床效果[1,5,7]。但該材料無骨誘導作用,早期成骨效果及材料-骨界面穩定性較差[5,8]。
近年來,有學者提出將生物活性分子固定在人工合成材料表面進行修飾,為種子細胞提供黏附、增殖和分化信號的生物界面[9]。目前,使用最廣泛的是含RGD序列的多肽,RGD是一類存在于多種黏附蛋白結構中的共有基序,因此將其修飾到材料表面可增強成骨細胞黏附、增殖和分化,促進hESCd-MSCs細胞黏附、增殖及骨礦物質的合成,促進植入物周邊新生骨形成,增強早期成骨標志-ALP活性[10-14]。然而由于缺乏附屬或調節性結構域,導致RGD肽生物活性及RGD序列的功能受限[15]。為提高生物利用度,部分學者提出在RGD序列周圍圈定足夠的功能位點,其中最重要的方法之一是核心基序RGD和輔助序列PHSRN的互補性修飾[16]。Lee等[3]發現EPDIM和YH互補性修飾能夠促進細胞的黏附與擴散,并在此基礎上進一步合成包含RGD,PHSRN,EPDIM,YH4個序列互補性修飾的T-CAM黏附分子,動物實驗表明復合T-CAM黏附分子的脫鈣骨有良好的修復骨缺損能力。為此,作者將T-CAM黏附分子復合到n-HA/PA66材料表面進行修飾,期望通過黏附分子表面修飾提高材料早期誘導成骨性能。
Park等[17]研究顯示T-CAM表面修飾的植入材料能明顯促進兔股骨植入物周邊新生骨的形成。本研究結果顯示,動物實驗中組織學和影像學結果表明術后實驗組新骨生長速度和數量明顯優于對照組,顯示n-HA/PA66材料經T-CAM黏附分子表面修飾后具有良好的誘導成骨效應。ALP的表達可反應軟骨及骨細胞的增生、活躍程度,ALP結果提示術后2周時實驗組ALP水平是術前的1.6倍,對照組ALP接近術前水平,說明實驗組從術后2周開始即有成骨;4周時實驗組和對照組分別是術前的2.0和1.7倍,術后8周達最高峰,實驗組和對照組分別是術前的3.4和2.6倍,之后開始下降,在12周時ALP水平接近于術前。這提示材料植入后4周骨及軟骨細胞增生活躍,8周時達最高峰,而T-CAM表面修飾n-HA/PA66復合骨修復材料的成骨效果優于n-HA/PA66復合材料。
綜上所述,本實驗結果表明,從X線片、大體標本及組織學觀察,相對于n-HA/PA66復合材料,T-CAM表面修飾nHA/PA66復合骨修復材料體內具有更好的成骨特性,尤其是在愈合早期,可滿足局部骨缺損的修復,具有良好的臨床應用前景。
[1]溫從游,孟純陽,蔣電明.納米羥基磷灰石/聚酰胺66復合材料的研究及應用[J].中國組織工程研究,2014,18(3):464-469.
[2]ParkJW,LeeSG,ChoiBJ,etal.EffectsofacelladhesionmoleculecoatingontheblastedsurfaceofTitaniumimplantsonbonehealingintherabbitfemur[J].IntJOralMaxillofacImplants,2007,22(4):533-541.
[3]LeeJH,ParkJW,ChoiBJ,etal.Anorganicbonemineralcoatedwithtetra-celladhesionmoleculeenhancesboneformationinrabbitcalvarialdefects[J].KeyEngineMateri,2006(309):981-984.
[4]孟純陽,安洪,蔣電明,等.網孔納米羥基磷灰石/聚酰胺人工骨修復兔橈骨缺損[J].中華創傷雜志,2005,21(3):31-35.
[5]盧旻鵬,王群波,董靖,等.納米羥基磷灰石/聚酰胺66/富血小板血漿復合物修復兔股骨中段骨缺損的實驗研究[J].重慶醫學,2015,44(7):885-887.
[6]LaneJM,SandhuHS.Currentapproachestoexperimentalbonegrafting[J].OrthopClinNorthAm,1987,18(2):213-225.
[7]YangX,ChenQ,LiuL,etal.ComparisonofanteriorcervicalfusionbyTitaniummeshcageversusnano-hydroxyapatite/polyamidecagefollowingsingle-levelcorpectomy[J].IntOrthop,2013,37(12):2421-2427.
[8]梁勇.納米羥基磷灰石/聚酰胺 66椎間融合器的實驗研究[D].重慶:重慶醫科大學,2007.
[9]WangF,LiY,ShenY,etal.ThefunctionsandapplicationsofRGDintumortherapyandtissueengineering[J].IntJMolSci,2013,14(7):13447-13462.
[10]DettinM,ZamunerA,RosoM,etal.FacileandselectivecovalentgraftingofanRGD-peptidetoelectrospunscaffoldsimprovesHUVECadhesion[J].JPeptSci,2015,21(10):786-795.
[11]ChienCY,LiuTY,KuoWH,etal.Dopamine-assistedimmobilizationofhydroxyapatitenanoparticlesandRGDpeptidestoimprovetheosteoconductivityofTitanium[J].JBiomedMaterResA,2013,101(3):740-747.
[12]ChenW,ZhouH,WeirMD,etal.Humanembryonicstemcell-derivedmesenchymalstemcellseedingonCalciumphosphatecement-chitosan-RGDscaffoldforbonerepair[J].TissueEng(PartA),2013,19(7/8):915-927.
[13]ThomaDS,SubramaniK,WeberFE,etal.Biodegradation,softandhardtissueintegrationofvariouspolyethyleneglycolhydrogels:ahistomorphometricstudyinrabbits[J].ClinOralImplantsRes,2011,22(11):1247-1254.
[14]李長文,鄭啟新,郭曉東,等.RGD多肽修飾的改性PLGA仿生支架材料對骨髓間充質干細胞黏附、增殖及分化影響的研究[J].中國生物醫學工程學報,2006,25(2):142-146,157.
[15]MuthiahM,ParkIK,ChoCS.SurfacemodificationofIronoxidenanoparticlesbybiocompatiblepolymersfortissueimagingandtargeting[J].BiotechnolAdv,2013,31(8):1224-1236.
[16]GaertnerFC,KesslerH,WesterHJ,etal.RadiolabelledRGDpeptidesforimagingandtherapy[J].EurJNuclMedMolImaging,2012,39(Suppl1):S126-138.
[17]ParkJW,LeeSG,ChoiBJ,etal.Effectsofacelladhesionmoleculecoatingontheblastedsurfaceoftitaniumimplantsonbonehealingintherabbitfemur[J].IntJOralMaxillofacImplants,2007,22(4):533-541.
The experimental research of T-CAM surface modification nano-hydroxyapatite/polyamide 66 composite materials repair of rabbit radius bone defect*
QiuHao1,DongJing1,LuGongbiao2,LuMinpeng1△,CaoChunfeng1,WangQunbo1,ZhangMinghua1
(1.DepartmentofOrthopedics,YongchuanHospitalofChongqingMedicalUniversity,Chongqing402160,China;2.DepartmentofOrthopedics,JiningFirstPeople′sHospital,Jining,Shandong272011,China)
Objective To discuss the efficacy of T-CAM surface modification nano-hydroxyapatite/polyamide 66 (T-CAM/n-HA/PA66) composite materials on the recovery of rabbit radius bone defect.Methods A total of 36 New Zealand rabbits were artificially made to be bone defect by resecting the 1.5 cm substantia ossea with periosteum of radius,and were divided into two groups averagely depending on implanted materials:experimental group (T-CAM/n-HA/PA66),control group (n-HA/PA66).The alkaline phosphatase (ALP) of venous blood was observed at preoperative and week 2,4,8,12 postoperative.Every 6 rabbits were sacrificed on week 2,4,8,12,and the radius healing status was observed by X-ray,histology.Results No rabbit was infected or died,no implant material was dropped.Gross observation,X-ray results and histology results demonstrated that the experimental group began to have a new bone tissue at 4 weeks after the operation;with the extension of time,the experimental group′s new bone growth speed and the quantity were better than the those of control group.The Lane -Sandhu method X-ray score showed that there were significant differences between two groups (P<0.05),as well as the Lane-Sandhu method histological score.The ALP value of experimental group began to rise at two weeks postoperative;with the extension of time,ALP value of both groups increased,peaked at 8 weeks,then began to decline,lastly close to the preoperative at 12 weeks,The ALP value at 2,4 and 8 weeks were significant between two groups (P<0.01).Conclusion T-CAM/n-HA/PA66 composite materials could accelerate the healing of bone defect.the effect of repair of bone defect is better than that of n-HA/PA66 artificial bone in the early.
radius;alkaline phosphatase;fracture healing;bone defect;T-CAM nano-hydroxyapatite;polyamide 66
重慶市科委自然科學基金資助項目(cstc2012jjA10029);重慶市永川區科委基金資助項目(YCSTC,2011BE5018)。 作者簡介:邱皓(1991-),在讀碩士,主要從事骨科生物材料、脊柱外科方面研究。△
E-mail:luminpeng@126.com。
論著·基礎研究
10.3969/j.issn.1671-8348.2016.23.006
R
A
1671-8348(2016)23-3185-03
2016-04-02
2016-06-23)

