甲狀腺功能亢進對大鼠肝脾鐵含量及血紅素加氧酶1表達的影響*
彭丁晉,李艷偉,黃作良,黃澤智,馬新華,趙晉英
(邵陽市分子生物學診斷重點實驗室/邵陽醫學高等專科學校檢驗系,湖南邵陽 422000)
?
甲狀腺功能亢進對大鼠肝脾鐵含量及血紅素加氧酶1表達的影響*
彭丁晉,李艷偉,黃作良,黃澤智,馬新華,趙晉英△
(邵陽市分子生物學診斷重點實驗室/邵陽醫學高等專科學校檢驗系,湖南邵陽 422000)
目的 通過檢測甲狀腺功能亢進(簡稱甲亢)時大鼠肝、脾組織鐵含量和血紅素加氧酶1(HO-1)的表達,探討甲亢對大鼠機體鐵代謝的影響。方法 將18只雌性SD大鼠分為甲亢4周組、甲亢8周組和對照組,每組6只。甲亢組灌胃給藥優甲樂,對照組灌胃生理鹽水。造模結束分別取各組大鼠肝、脾臟,用二氨基聯苯胺增強的Perl′s鐵染色法檢測肝、脾組織鐵含量,用逆轉錄PCR技術檢測大鼠肝、脾組織HO-1mRNA的表達;利用Westernblot和免疫組織化學染色法對大鼠肝、脾臟HO-1表達進行分析。結果 甲亢模型4周、8周組大鼠的肝、脾組織鐵染色均明顯強于對照組,且甲亢8周組強于甲亢4組(P<0.01); 甲亢4周、8周組大鼠的肝、脾臟的HO-1mRNA、蛋白表達均高于對照組,且甲亢8周組明顯高于4周組,差異具有統計學意義(P<0.01)。結論 甲亢可引起肝、脾組織鐵含量增加,HO-1表達增強。
甲狀腺素;血紅素加氧酶-1;肝;甲狀腺功能亢進;脾臟;鐵含量
甲狀腺功能亢進(后簡稱甲亢) 是甲狀腺激素分泌增多導致的一種常見內分泌疾病。臨床上,甲亢患者易發生貧血[1-2]。研究資料顯示缺鐵、鐵利用障礙與甲亢性貧血的發生有關[3]。肝、脾臟是機體最主要的儲鐵器官,而且是衰老紅細胞內鐵再循環利用的主要場所,而血紅素加氧酶1(heme oxygenase 1,HO-1)作為血紅素鐵再利用的限速酶,在肝脾鐵穩態調節中發揮著非常重要的作用[4-5]。然而,目前甲亢對肝脾鐵代謝及HO-1影響相關的研究鮮見報道。因此,本實驗通過檢測甲亢模型大鼠肝脾鐵含量及HO-1的表達,進一步探討甲亢對肝脾鐵代謝的影響,現報道如下。
1 材料與方法
1.1 材料
1.1.1 實驗藥物 優甲樂片即左旋甲狀腺素鈉購自德國默克公司(批號:169818)。
1.1.2 實驗動物 SPF級健康雌性SD大鼠18只,由南華大學實驗動物中心提供,體質量(200±10)g,在室溫18~25 ℃,50%~70%相對濕度條件飼養。
1.1.3 實驗試劑及儀器 Trizol、 逆轉錄PCR(RT-PCR)試劑盒購自碧云天生物公司;辣根酶標記羊抗兔免疫球蛋白G(IgG)、羊抗小鼠IgG、兔抗大鼠HO-1抗體、羊抗兔鏈霉親和素-生物素復合物(strept avidin-biotin complex,SABC)檢測試劑盒均購自武漢博士德生物公司;β-actin抗體購自Abcam公司;內參甘油醛-3-磷酸脫氫酶(GAPDH)和HO-1引物購于上海生物工程公司;PCR儀購自美國Bio-Rad公司。
1.2 方法
1.2.1 實驗甲亢模型分組、造模及取材 18只雌性SD大鼠分為甲亢4周組、甲亢8周組和對照組,每組6只。參照張彬等[6]的方法造模:研磨優甲樂片,用生理鹽水混懸,灌胃給藥(60 μg/100 g,1次/天);對照組灌服生理鹽水。兩個甲亢組大鼠分別于第4周和第8周末處死,對照組于實驗末處死。取大鼠肝脾組織,部分石蠟包埋切片(4 μm厚),其余新鮮肝脾組織經提取總RNA,行RT-PCR實驗;經提取總蛋白,行Western blot 實驗。
1.2.2 二氨基聯苯胺(DAB)增強的Perl′s鐵染色 肝、脾組織切片脫蠟復水,置于現配的5%氯化氫(HCl)-5%亞鐵氰化鉀1∶1混合液中30 min;磷酸鹽緩沖液(PBS)沖洗后,3%H2O2去除內源性過氧化物酶;DAB顯色,蘇木素復染細胞核以利于鏡下觀察,封片鏡檢。同行做陰性對照染色,除了不加HCl-亞鐵氰化鉀混合液外,其余步驟相同。組織鐵陽性染色呈棕黃色顆粒狀。
1.2.3 RT-PCR檢測 用Trizol提取肝、脾組織總RNA。以GAPDH為內參,采用RT-PCR 兩步法檢測大鼠HO-1 mRNA的表達,大鼠HO-1上游引物序列為5′-CAG AAC CCA GTC TAT GCC-3′,下游序列為 5′-GCT CGG GAA GGT GAA AA-3′,擴增長度306 bp;大鼠GAPDH上游序列為5′-TCC CTC AAG ATT GTC AGC AA-3′,下游序列為5′-AGA TCC ACA ACG GAT ACA TT-3′,擴增長度 308 bp。PCR反應條件:第1步95 ℃ 4 min,1個循環;第2步94 ℃ 30 s, 58 ℃ 30 s (50 ℃ for GAPDH),72 ℃ 30 s,共30 個循環;第3步72 ℃延伸10 min。擴增產物經1.0% 瓊脂糖凝膠電泳約1 h(電壓150 V),經 Photoshop 軟件測定條帶亮度值,將擴增目標產物與內參相比進行相對定量。
1.2.4 Western blot檢測 用Western blot檢測大鼠肝、脾臟HO-1的表達情況。大鼠新鮮肝、脾組織經勻漿裂解后, 4 ℃ 12 000 r/min離心5 min,取上清液,采用蛋白質定量試劑盒(BCA)測定實驗樣品蛋白濃度。取含有30 μg蛋白量的上樣體積進行十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)電泳分離,將膠上蛋白轉移至聚偏二氟乙烯(PVDF)膜。5%牛血清清蛋白(BSA)封閉2 h,加入兔抗大鼠HO-1抗體(1∶100), 4 ℃過夜孵育后,辣根過氧化物酶標記羊抗兔IgG(1∶1 000)37 ℃孵育2 h,最后滴加超敏電化學發光(ECL)發光液孵育,X膠片曝光,每步反應期間用磷酸鹽緩沖液(PBST)充分洗滌3次,每次5 min。以β-actin為內參,一抗為小鼠抗大鼠β-actin抗體(1∶1 000),二抗為辣根酶標記的羊抗小鼠IgG(1∶1 000)。曝光膠片分別分析條帶灰度值,以HO-1及β-actin灰度值之比進行相對定量。
1.2.5 免疫組織化學染色 采用免疫組織化學SABC法對肝、脾HO-1進行定位。一抗為兔抗大鼠HO-1抗體(1∶100),操作嚴格按照SABC檢測試劑盒說明書進行,陰性對照用PBS代替一抗。結果判斷:HO-1定位于細胞質內,染色呈棕黃色部位。

2 結 果
2.1 甲亢對大鼠肝、脾鐵含量的影響 經DAB增強的Perl′s染色法,組織鐵鏡下呈棕黃色染色,分布于細胞質和(或)細胞間質。對照組大鼠肝細胞和肝巨噬細胞鐵染色明顯,在中央靜脈周圍染色更甚(圖1A),而門管區染色較淺。對照組脾組織鐵染色顆粒主要位于紅髓,白髓無明顯鐵染色顆粒(圖1D)。而甲亢4周組和8周組大鼠肝、脾組織鐵染色均明顯強于對照組,且甲亢8周組肝、脾組織鐵染色強于甲亢4周組,見圖1B、C、E、F。
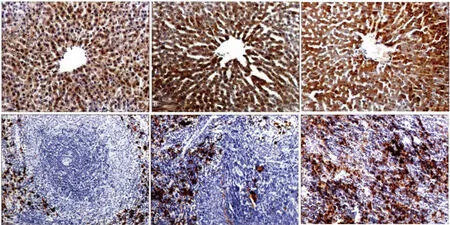
圖1 大鼠肝臟和脾臟DAB增強的Perl′s鐵染色(×100)
2.2 甲亢對肝、脾HO-1mRNA表達的影響RT-PCR顯示,大鼠肝、脾組織均表達HO-1mRNA。甲亢4周組和8周組肝、脾組織的HO-1mRNA表達均高于對照組,且甲亢8周組肝、脾組織的HO-1mRNA表達又明顯高于甲亢4周組,差異具有統計學意義(P<0.01),見圖2~3。

圖2 RT-PCR檢測肝臟HO-1 mRNA的表達
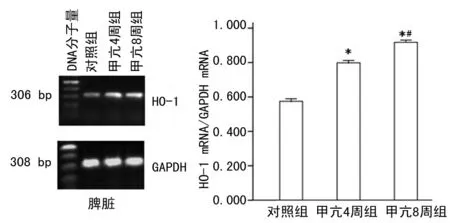
圖3 RT-PCR檢測脾臟HO-1 mRNA的表達
2.3 甲亢對肝、脾HO-1蛋白表達的影響 經Westernblot結果顯示,大鼠肝、脾組織均表達HO-1蛋白。甲亢4周組和8周組肝、脾組織HO-1蛋白表達均高于對照組,且甲亢8周組明顯高于甲亢4周組,差異具有統計學意義(P<0.01),見圖4~5。免疫組織化學染色結果顯示,對照組大鼠肝組織HO-1蛋白主要定位于肝巨噬細胞,肝細胞無明顯染色,脾組織HO-1蛋白主要定位紅髓,白髓無明顯染色。甲亢4周組和8周組肝、脾組織HO-1染色均強于對照組,且甲亢8周組明顯強于甲亢4周組,見圖6。
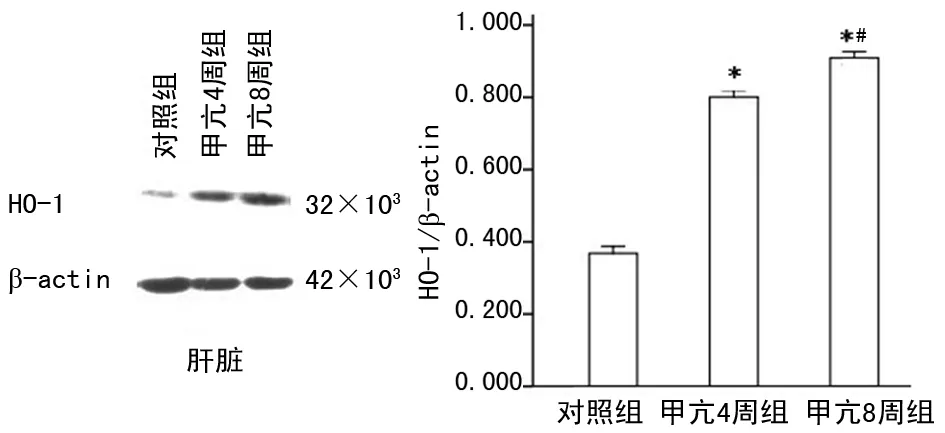
圖4 Western Blot檢測肝臟HO-1蛋白的表達
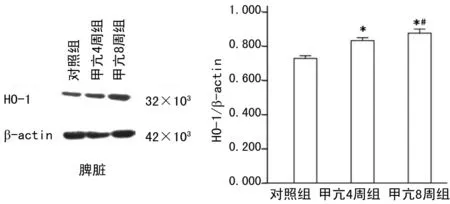
圖5 Western Blot檢測脾臟HO-1蛋白的表達

圖6 大鼠肝臟和脾臟HO-1免疫組織化學染色(×100)
3 討 論
臨床研究顯示甲亢患者發生貧血的發病率國外約為8%~57%,國內10~44%,甲亢性貧血與機體鐵代謝異常有關[3]。人體所需鐵除了部分來源于食物,大部分則來源于衰老紅細胞中血紅素鐵的再循環。肝、脾不僅是機體最主要的儲鐵器官,而且是衰老紅細胞內鐵再循環利用的主要場所,因此肝、脾在機體鐵穩態調節中處于重要的地位。本研究采用DAB增強的Perl′s鐵染色檢測了甲亢時肝、脾鐵染色的變化[7]。實驗發現大鼠肝組織鐵主要位于肝細胞和肝巨噬細胞,在近中央靜脈處染色明顯,而門管區染色較弱。脾組織鐵染色顆粒主要位于紅髓。而甲亢模型大鼠的肝、脾組織鐵染色均明顯強于對照組,且隨時間延長逐漸增強,提示機體在甲亢時肝、脾組織鐵儲量明顯高于正常狀態。
鐵在機體發揮重要的作用,但過多的鐵可誘導自由基的生成,通過氧化應激反應損害組織器官[8]。臨床報道甲亢伴有肝損害的并不少見[9],本實驗發現的甲亢大鼠肝組織鐵含量升高可能參與了甲亢性肝損害。當胞內鐵含量過多時,細胞一般通過增加鐵儲存蛋白,即鐵蛋白(Feritin,Fn)的表達來結合過多的鐵。有臨床資料顯示甲亢患者血清中Fn水平升高,動物實驗也證實甲亢可引起肝組織Fn表達升高[10]。可以這樣認為,甲亢引起了肝脾的鐵含量升高,同時誘導肝脾Fn表達結合過多的鐵,Fn的升高對器官起保護作用,而過多的Fn從細胞溢出血液引起了血液中Fn水平的升高。
甲亢大鼠肝、脾組織鐵含量升高,提示甲亢時單核巨噬細胞對衰老紅細胞的破壞有可能高于正常生理狀態,使得血紅素鐵的再循環增加。脾臟巨噬細胞吞噬衰老的紅細胞分解血紅蛋白釋放出血紅素,HO可催化血紅素降解產生膽綠素、CO和Fe2+。另外,10%~20%的衰老紅細胞也會在血管內發生破裂,釋放出的血紅蛋白與結合珠蛋白結合,然后被運輸到肝臟,在肝細胞形成內吞小體,分解出血紅素,血紅素再經HO作用釋放出Fe2+[11]。HO是血紅素分解代謝的限速酶,血紅素鐵的再循環與肝脾HO的表達量有關。
哺乳動物體內存在3種形式的HO:HO-1、HO-2和HO-3。在非應激狀態,肝細胞主要表達HO-2,HO-1只在Kupffer細胞中分布;在應激性傷害時,肝組織HO活性的主要成分是HO-1,不僅分布于Kupffer細胞,也可表達在肝實質細胞和間質細胞中[12]。在脾中HO-1的表達量是HO-2的5倍[13]。HO-1是誘導型HO,諸如重金屬、血紅素、缺氧、化學物質、細胞因子等均可誘導HO-1的表達增加[14]。而目前認為只有糖皮質激素能調節HO-2的表達,HO-3的表達量極少,其分解血紅素的活性亦最低。因此,本實驗僅檢測了甲亢模型大鼠肝、脾組織HO-1的表達。
RT-PCR和WesternBlot結果顯示,大鼠肝、脾組織均表達HO-1mRNA及蛋白。甲亢組HO-1mRNA及蛋白各時間點表達均高于對照組,且隨時間延長逐漸升高。免疫組織化學染色結果顯示,對照組大鼠肝臟HO-1蛋白主要定位在肝巨噬細胞,肝細胞無明顯染色。而脾臟HO-1蛋白主要定位紅髓,白髓無明顯染色。脾組織紅髓含有大量的巨噬細胞,這也提示脾臟中主要是巨噬細胞表達HO-1。本研究中甲亢模型鼠肝、脾HO-1表達增強的結果提示肝脾對血紅素的分解代謝活動增強,使得衰老紅細胞血紅素鐵再循環增強,這可能是甲亢肝、脾鐵儲量增加的原因。
另外,資料顯示HO-1也是機體內最易被誘導產生的抗氧化酶類,缺血再灌注等多種損害因素均可誘導肝組織HO-1活性增加[15],而HO-1對由氧化應激損害引起的細胞損傷也具有保護作用[16]。由于甲亢促進了機體新陳代謝,產熱增加,耗氧量增加,這可能引起器官氧自由基增加,氧化應激反應增強。甲亢時肝、脾組織HO-1表達增加也可能是機體應對高氧化應激反應的一種細胞保護反應。細胞中游離血紅素是一種促氧化劑,當血紅素與分子氧反應時,可催化產生活性氧簇(ROS),而HO-1可催化血紅素降解產生膽綠素、CO和Fe2+,避免對細胞的損傷;鐵離子亦能誘導Fn的表達,結合催化氧自由基形成所需要的游離鐵,從而減輕氧自由基對組織細胞的損傷;膽綠素和膽紅素不僅具有抗氧化特性,二者還能通過其他途徑發揮細胞保護作用[17-18]。
總之,本實驗發現甲亢可引起肝、脾組織鐵含量增加,HO-1表達增強。增加的鐵含量有可能是由于衰老紅細胞血紅素鐵再循環增加所致,而HO-1表達增強促進了血紅素鐵的釋放,增高的HO-1對肝、脾等重要臟器也可能具有保護作用。
雖然本實驗未探討甲亢時是否紅細胞破壞增加,但有資料顯示甲亢時心肌收縮力增強,心率加快,血液循環加快。高速血流可引起血管內紅細胞破壞增加,加快紅細胞衰老速度。另外,甲亢時骨髓紅細胞異常生成,幼紅細胞數量偏高,但由于存在某種鐵利用障礙,而形成一定程度的無效紅細胞生成。另外,亦有觀點認為血紅蛋白具有甲狀腺激素的結合位點,結合甲狀腺激素的多少可以反映血紅蛋白的壽命,甲亢患者高含量的甲狀腺激素也必然導致紅細胞的壽命縮短。同時動物實驗也發現甲亢大鼠紅細胞的滲透脆性明顯下降[19]。總之,這些因素均有可能增加了肝脾內巨噬細胞對紅細胞的過濾,加快血紅素鐵在肝脾的再循環,促進肝脾鐵儲量的增加。因此,本研究結果提示臨床上治療甲亢性貧血時,須慎用補鐵療法,以免加重機體鐵超載負擔,增加肝臟等重要器官的氧化應激損傷。然而,由于動物實驗采用的甲亢造模方法與臨床上甲亢患病的機制有一定區別,本研究結果仍需在臨床上進一步研究證實。
[1]OmarS,HadjTaeibS,KanounF,etal.Erythrocyteabnormalitiesinthyroiddysfunction[J].TunisMed,2010,88(11):783-788.
[2]趙笑燕,王淑芳,于正翠.以貧血為主要表現的甲亢1例[J].實用醫學雜志,2010,26(3):376.
[3]趙晉英,王培培,黃作良,等.甲狀腺功能亢進性貧血與機體鐵代謝關系的研究進展[J].廣東醫學,2014,35(4):611-613.
[4]MeynardD,BabittJL,LinHY.Theliver:conductorofsystemicIronbalance[J].Blood,2014,123(2):168-176.
[5]KongWN,LeiYH,ChangYZ.TheregulationofIronmetabolisminthemononuclearphagocytesystem[J].ExpertRevHematol,2013,6(4):411-418.
[6]張彬,畢建玲,李金源,等.即刻負載微種植體在甲亢大鼠模型中支抗穩定性的研究[J].口腔醫學研究,2011,27(3):183-186.
[7]MeguroR,AsanoY,OdagiriS,etal.Nonheme-ironhistochemistryforlightandelectronmicroscopy:ahistorical,theoreticalandtechnicalreview[J].ArchHistolCytol,2007,70(1):1-19.
[8]Waldvogel-AbramowskiS,WaeberG,GassnerC,etal.PhysiologyofIronmetabolism[J].TransfusMedHemoth,2014,41(3):213-221.
[9]DeCamposMazoDF,DeVasconcelosGB,PereiraMA,etal.Clinicalspectrumandtherapeuticapproachtohepatocellularinjuryinpatientswithhyperthyroidism[J].ClinExpGastroenterol,2013(6):9-17.
[10]LiewCF,CheahJS.Thyrotoxicosis-inducedhyperferritinaemia[J].HospMed,2003,64(2):114.
[11]孔衛娜,段相林,常彥忠.單核巨噬細胞系統鐵代謝調控機制[J].自然科學進展,2008,18(6):615-621.
[12]ImmenschuhS,Baumgart-VogtE,TanM,etal.Differentialcellularandsubcellularlocalizationofheme-bindingprotein23/peroxiredoxinⅠandhemeoxygenase-1inratliver[J].JHistochemCytochem,2003,51(12):1621-1631.
[13]KnutsonM,Wessling-ResnickM.Ironmetabolisminthereticuloendothelialsystem[J].CritRevBiochemMolBiol,2003,38(1):61-88.
[14]WegielB,NemethZ,Correa-CostaM,etal.Hemeoxygenase-1:ametabolicnike[J].AntioxidRedoxSignal,2014,20(11):1709-1722.
[15]SassG,BarikbinR,TiegsG.Themultiplefunctionsofhemeoxygenase-1intheliver[J].ZGastroenterol,2012,50(1):34-40.
[16]FarombiEO,SurhYJ.Hemeoxygenase-1asapotentialtherapeutictargetforhepatoprotection[J].JBiochemMolBiol,2006,39(5):479-491.
[17]楊明,陳曉春.血紅素氧合酶與肝臟氧化應激[J].福建醫科大學學報,2008,42(4):380-383.
[18]OrigassaCS,CmaraNO.Cytoprotectiveroleofhemeoxygenase-1andhemedegradationderivedendproductsinliverinjury[J].WorldJHepatol,2013,5(10):541-549.
[19]YücelR,OzdemirS,Dar′yerliN,etal.Erythrocyteosmoticfragilityandlipidperoxidationinexperimentalhyperthyroidism[J].Endocrine,2009,36(3):498-502.
《重慶醫學》對臨床研究論文醫學倫理學要求
凡投本刊的臨床研究論文(主體是以人為研究對象),作者應說明其遵循的程序是否符合負責人體試驗的委員會(單位性的、地區性的或國家性的)所制訂的倫理學標準,并提供(上傳)該委員會的批準文件復印件及受試對象或其親屬的知情同意書復印件。
《重慶醫學》編輯部
The effects of hyperthyroidism on Iron content and heme oxygenase 1 expression of liver and spleen of rats*
PengDingjin,LiYanwei,HuangZuoliang,HuangZezhi,MaXinhua,ZhaoJinying△
(ShaoyangKeyLaboratoryofMolecularBiologyDiagnosis/theDepartmentofClinicalLaboratoryMedicine,ShaoyangMedicalCollege,Shaoyang,Hunan422000,China)
Objective To explore the effects of hyperthyroidism on Iron content and heme oxygenase 1(HO-1) expression of liver and spleen of rats.Methods A total of 18 female SD rats were divided into hyperthyroidism for 4 weeks group(n=6),hyperthyroidism for 8 weeks group(n=6) and control group(n=6).Hyperthyroidism rats were induced by intragastric administration of Euthyrox (Levothyroxine).And the control rats were given normal saline.The liver and spleen of rats were obtained after administration,respectively.Iron of liver and spleen were stained by DAB enhanced Perls′ method,and the expression of HO-1 mRNA was measured by reverse transcription polymerase chain reaction (RT-PCR).HO-1 protein was measured by Western blot and immunohistochemistry.Results Iron staining of liver and spleen of hyperthyroidism for 4 weeks group and 8 weeks group was significantly stronger than those of control group,respectively.And Iron staining of liver and spleen of hyperthyroidism for 8 weeks group was stronger than those of hyperthyroidism for 4 weeks group.The increase of HO-1 mRNA and protein expression was shown in liver and spleen of hyperthyroidism for 4 weeks group and 8 weeks group (P<0.01).Moreover,the expression of HO-1 mRNA and protein of liver and spleen of hyperthyroidism rats for 8 weeks group were higher than those of hyperthyroidism for 4 weeks group(P<0.01).Conclusion The hyperthyroidism induced increase of Iron content,HO-1 mRNA and protein expression of liver and spleen of rats.
thyroxine;heme oxygenase-1;liver;hyperthyroidism;spleen;Iron content
2013年湖南省教育廳科學研究優秀青年項目(13B157)。 作者簡介:彭丁晉(1981-),講師,碩士,主要從事甲狀腺功能亢進對機體鐵代謝的影響方面研究。△
E-mail:zhaojinying928@163.com。
論著·基礎研究
10.3969/j.issn.1671-8348.2016.23.010
R
A
1671-8348(2016)23-3196-05
2016-04-24
2016-06-23)

