以羊膜為載體體外培養大鼠角膜緣干細胞的實驗研究*
胡 蓉,高 杰,梁雅茹,黃 悅,李 紅,蘇 敏
(貴州醫科大學組織學與胚胎學教研室,貴陽 550004)
?
·技術與方法·
以羊膜為載體體外培養大鼠角膜緣干細胞的實驗研究*
胡 蓉,高 杰,梁雅茹,黃 悅,李 紅,蘇 敏△
(貴州醫科大學組織學與胚胎學教研室,貴陽 550004)
目的 比較角膜緣干細胞(LSCs)在不同羊膜上的生長情況,尋求LSCs體外培養的最佳載體。方法 取健康剖宮產孕婦胎盤的羊膜組織,分別制備保留上皮的新鮮羊膜、去除上皮的新鮮羊膜和冷凍羊膜。消化法分離大鼠LSCs后將其按相同濃度分別種植于3種事先準備好的羊膜載體和無載體孔中,分為4組。實驗1組:保留上皮的新鮮羊膜組;實驗2組:去除上皮的新鮮羊膜組;實驗3組:去除上皮的冷凍羊膜組;對照組:無羊膜載體組。4組細胞分別作細胞凋亡檢測,p63、PCNA免疫熒光檢測,檢測陽性細胞計數。結果 培養第3天,3個實驗組培養的細胞排列緊密,融合形成單層,其中可見大小不等的團塊狀集落,細胞大小基本一致,多呈圓球形或卵圓形。對照組培養的細胞排列相對稀疏,基本融合,形成單層,可見散在的、大小不等的桑葚樣細胞集落,集落細胞的生長特征及形態特點與實驗組相似。實驗組的細胞凋亡率均低于對照組,p63陽性率和PCNA陽性率均高于對照組(P<0.01),尤以實驗1組變化最為明顯(P<0.01)。結論 羊膜載體有利于體外培養大鼠LSCs的擴增,保留上皮的新鮮羊膜能更好地維持體外培養LSCs的特性,是體外角膜緣干細胞培養的理想載體。
角膜緣;干細胞;羊膜;染色與標記;角膜;細胞凋亡;p63;PCNA
正常角膜表面由角膜上皮細胞覆蓋,表層上皮細胞不斷脫落死亡,同時基底層的細胞不斷增殖以取代表層上皮細胞。角膜上皮的完整性依賴于這一動態平衡過程。體外培養的角膜緣干細胞(limbal stem cells,LSCs)移植被認為是目前針對眼表疾病最有前景的治療方法之一[1-3]。大量實驗表明羊膜是LSCs體外培養的良好底物,是干細胞體外培養和臨床移植研究的首選載體[4-6]。盧建民等[7]研究報道,將人羊膜上皮細胞移植到兔角膜緣干細胞缺乏性功能障礙(LSCD)模型眼上可抑制新生血管,減輕角膜混濁。以羊膜為載體的LSCs體外培養方法的建立,目前主要集中在新鮮羊膜或低溫冷凍保存羊膜的使用。對于何種羊膜載體在LSCs培養中更有利于LSCs的生長目前尚需進一步研究。故本研究擬探討用不同羊膜為載體體外培養LSCs的方法,比較LSCs在不同羊膜上的生長情況,以期尋求LSCs體外培養的最佳載體,為最終實現以體外培養的LSCs移植提供實驗依據。
1 材料與方法
1.1 材料
1.1.1 實驗材料 健康清潔級SD大鼠,體質量200~500 g,雌雄不限,由貴州醫科大學實驗動物中心提供,生產許可證:SCXK(黔)2012-0001。孕婦胎盤,產前進行母體血清學檢查,排除一切傳染性疾病的感染,由貴州醫科大學附屬醫院提供,并通過倫理委員會批準。
1.1.2 儀器與試劑 DMEM/F12培養基購自美國Gibco公司,胎牛血清購自杭州四季青生物工程公司,0.25%Trypsin-0.01%乙二胺四乙酸(EDTA)購自美國Hyclone公司,兔多克隆抗體p63購自北京博奧森生物技術公司,小鼠單克隆抗體PCNA、細胞凋亡檢測試劑盒、免疫熒光試劑盒購自武漢博士德生物工程有限公司,細胞培養板購自美國Costar公司,CO2培養箱購自美國Thermo公司,倒置相差顯微鏡購自日本Nikon公司。
1.2 方法
1.2.1 羊膜載體的制備 取行剖宮產的健康孕婦的胎盤,無菌條件下,鈍性分離獲取羊膜,浸泡在含青鏈霉混合液(1∶1)的磷酸鹽緩沖液(PBS)中20 min。上皮面向上貼附于無菌硝酸纖維素膜上,修剪成2.5 cm×2.5 cm的小塊。(1)羊膜保存:將部分羊膜置于5%胎牛血清的DMEM/F12細胞培養液中浸泡備用,4 ℃保存,于取材后12 h內使用。將剩余羊膜按培養基和甘油1∶1混合的溶液浸泡,4 ℃冰箱中放置20 min,轉-80 ℃冰箱保存2個月,待使用時取出迅速置于37 ℃ PBS中解凍1 min,沖去表面甘油,PBS水化30 min后去上皮。(2)羊膜去上皮:含0.25%胰蛋白酶、0.01%EDTA的消化液37 ℃消化45 min,細胞刮刀刮除上皮細胞,倒置鏡下確認上皮細胞全部清除,上皮面朝上置于24孔培養板內于37 ℃孵箱中干燥待用。
1.2.2 LSCs的分離與培養 取新鮮大鼠角膜緣組織,眼科剪將組織反復剪碎至1 mm2大小,消化液37 ℃消化20 min,加適量20%胎牛血清的DMEM/F12培養基反復吹打至單細胞懸液,離心去上清液。適量培養液重懸細胞,計數后以1.5×105/cm2的密度分別接種于平鋪24孔培養板中,分為4組:有新鮮的保留上皮的羊膜為實驗1組;新鮮的去除上皮的羊膜為實驗2組;經冷凍保存的去除上皮的羊膜及無羊膜載體的為實驗3組;無羊膜載體組為對照組。37 ℃ 5%CO2培養,培養液每2~3天更換1次,每日用倒置相差顯微鏡觀察細胞的生長狀況并拍照記錄。
1.2.3 細胞凋亡蘇木素-伊紅(HE)染色檢測 取分組培養第5天的LSCs,按照武漢博士德生物工程有限公司提供凋亡檢測試劑盒說明書操作。
1.2.4 免疫熒光細胞化學染色檢測 取分組培養第5天的LSCs,免疫熒光細胞化學染色檢測p63和PCNA的表達。實驗嚴格按照說明書操作,空白對照以PBS代替一抗。

2 結 果
2.1 羊膜載體的制備 倒置顯微鏡觀察,保留上皮的羊膜上皮細胞呈立方形,小而密,覆蓋整個表面(圖1A)。去除上皮的羊膜表面未見細胞成分,可見基底膜網狀纖維,縱橫交錯,見圖1B。
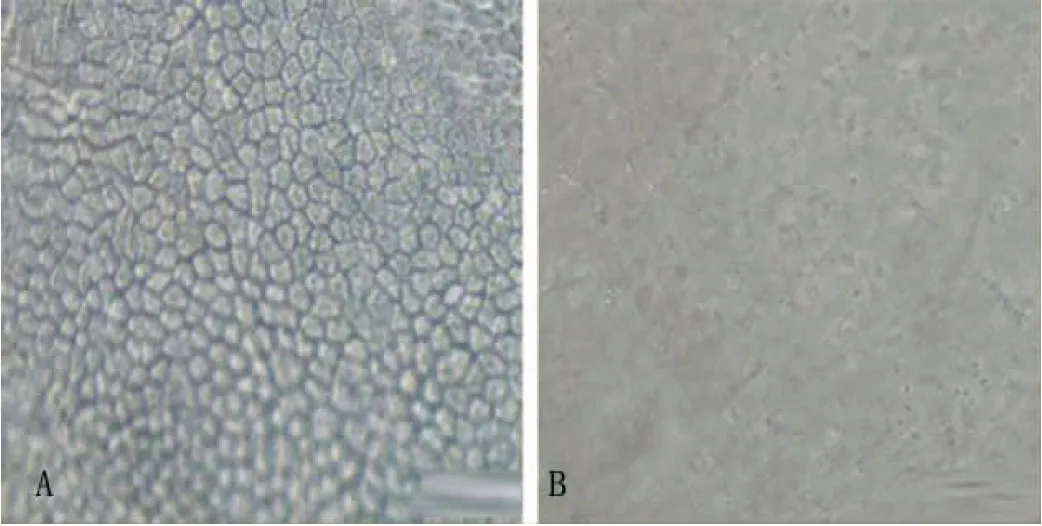
圖1 羊膜載體制備結果(×200)
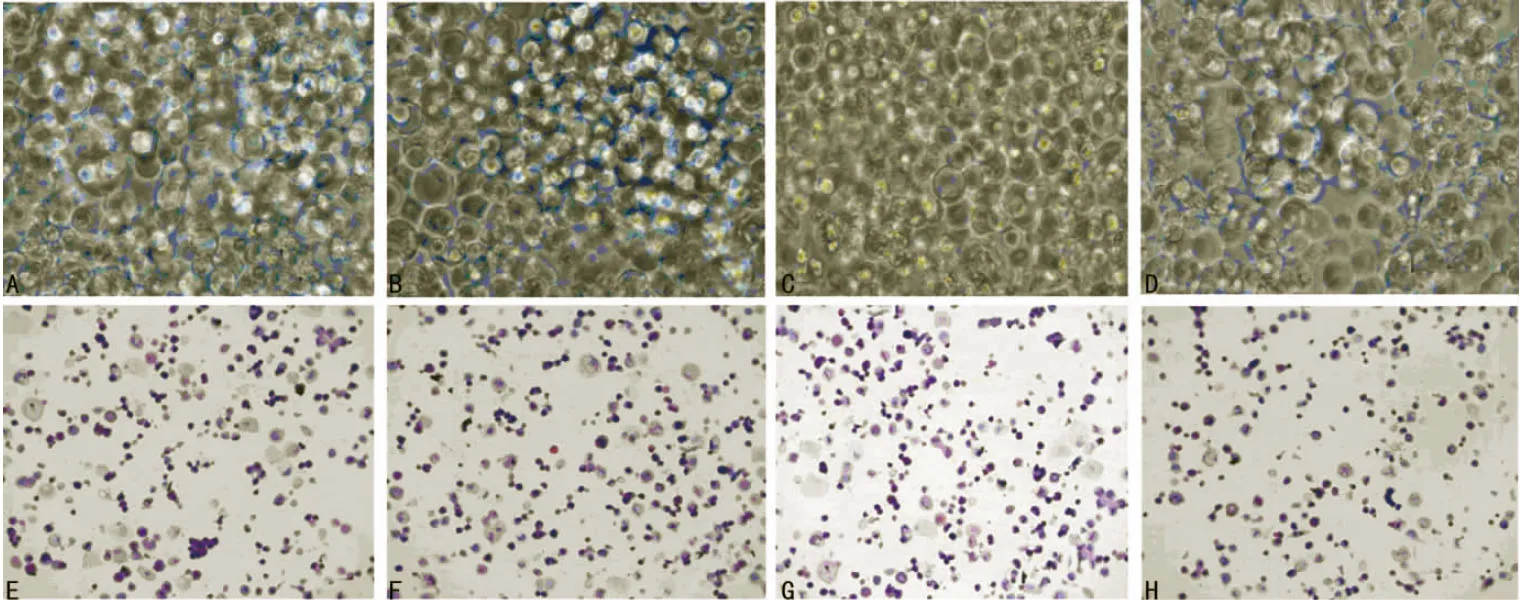
圖2 SD大鼠LSCs體外細胞培養結果(×400)
2.2 大鼠LSCs的培養體外生長特征 倒置鏡觀察,培養第3天,實驗1組(圖2A)、實驗2組(圖2B)、實驗3組(圖2C)3個實驗組培養細胞排列緊密,融合形成單層,單層之間可見大小不等的團塊狀集落,細胞大小基本一致,多呈圓球形或卵圓形,其中實驗2組和實驗3組的細胞集落均多于實驗1組的細胞集落,但二者的死細胞數比實驗1組多。對照組(圖2D)培養細胞排列相對稀疏,基本融合形成單層,可見散在的、大小不等的桑葚樣細胞集落,集落細胞生長特征及形態特點與實驗組相似,死細胞明顯比3個實驗組的死細胞多。HE染色觀察4組培養細胞的形態特征:實驗1組(圖2E)、實驗2組(圖2F)、實驗3組(圖2G)3個實驗組的LSCs數量均相對較多,對照組(圖2H)細胞數較少,4組培養細胞的形態基本相同,均呈橢圓形或不規則形。
2.3 免疫熒光細胞化學檢測各組p63蛋白及增殖細胞核抗原(PCNA)的表達 培養第5天,3個實驗組中均有大多數細胞呈p63陽性反應(細胞核發出橙黃色熒光的細胞則為p63陽性細胞),而p63陽性細胞則為LSCs。實驗1組、實驗2組、實驗3組的p63陽性率均高于對照組(圖3)。細胞核發出橙黃色熒光的細胞則為PCNA陽性細胞,3個實驗組中均有大多數細胞呈PCNA陽性反應。實驗1組、實驗2組、實驗3組的PCNA陽性率均高于對照組(圖4)。實驗1組與實驗2組的p63,PCNA陽性性表達率比較,差異有統計意義(P<0.01);實驗1組與實驗3組的p63,PCNA陽性性表達率比較,差異有統計意義(P<0.01);實驗2組與實驗3組的p63,PCNA陽性性表達率比較,差異無統計意義(P>0.05),見圖3、4。
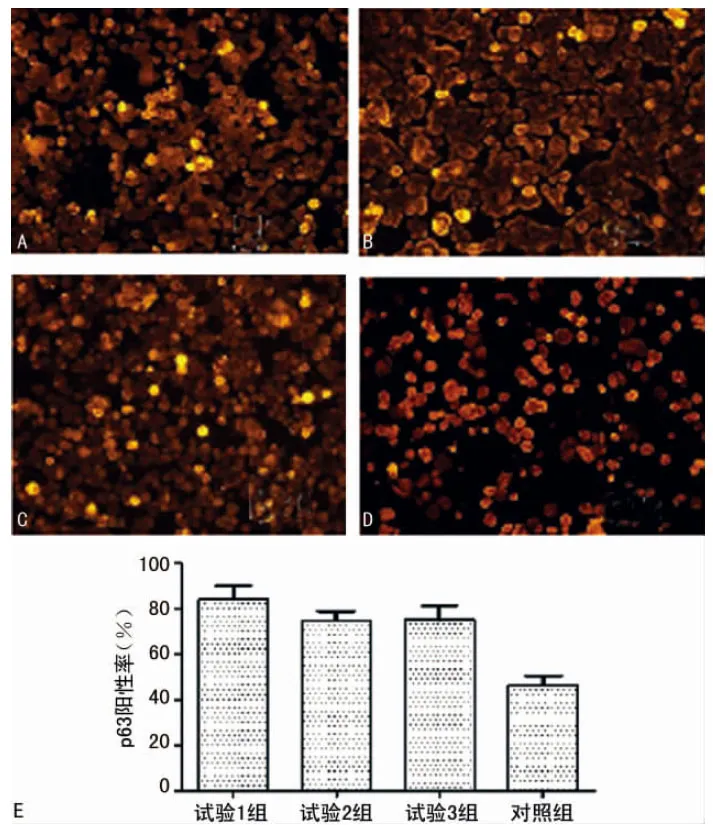
圖3 SD大鼠LSCs中p63免疫熒光染色結果
2.4 細胞凋亡檢測各組細胞的凋亡率 培養第5天,3個實驗組中均有少數細胞呈細胞凋亡陽性反應,細胞核中有棕黃色顆粒者為陽性,即發生凋亡的細胞。實驗1組細胞凋亡率為(21.63±2.76)%、實驗2組細胞凋亡率為(31.21±2.50)%、實驗3組細胞凋亡率為(30.49±4.01)%,而對照組細胞凋亡率為(54.60±5.21)%。與對照組比較,實驗1組、實驗2組、實驗3組均細胞凋亡數量減少(P<0.01)。實驗3組與實驗2組細胞凋亡率均高于實驗1組,差異有統計學意義(P<0.01),見圖5。
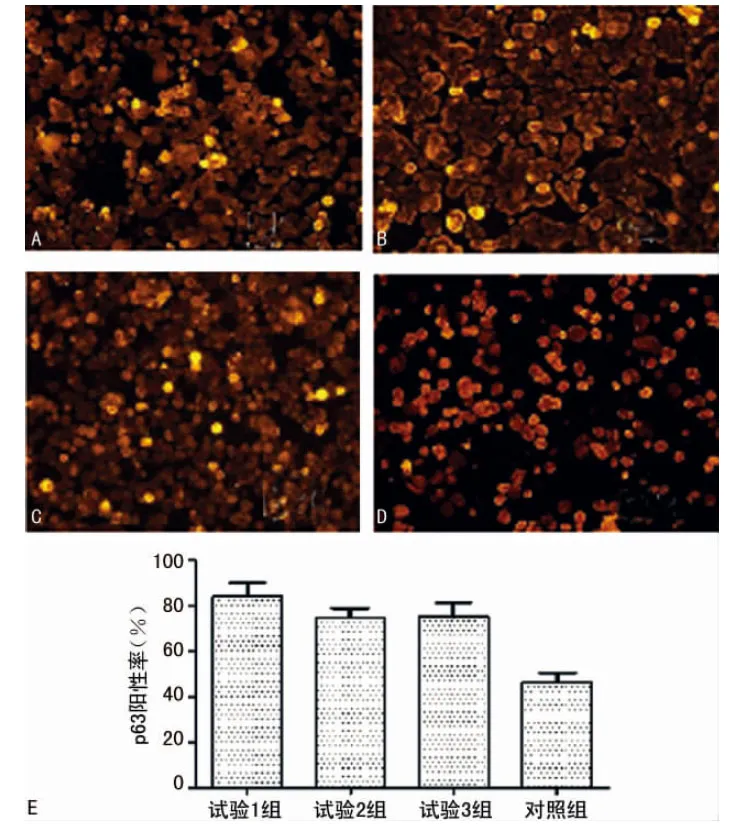
圖4 SD大鼠LSCs中PCNA免疫熒光染色結果
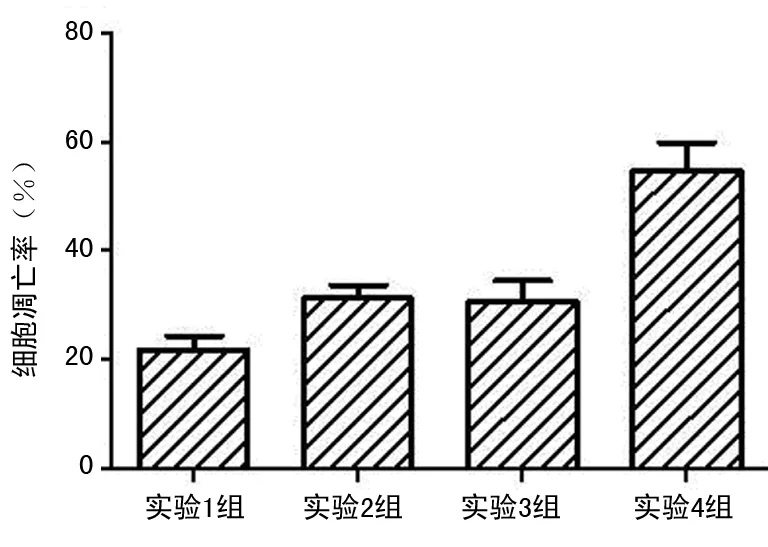
圖5 SD大鼠LSCs細胞凋亡結果
3 討 論
3.1 大鼠LSCs的體外培養及鑒定LSCs位于角膜緣上皮基底層中,其更新能夠保持角膜緣上皮細胞功能和結構的完整性,對于角膜通透性至關重要。因此LSCs體外培養及相關分子鑒定至關重要。直到目前為止,關于LSCs的鑒定都是間接的。Sudha等[8]發現,p63局限地位于角膜上皮邊緣的基底細胞,認為p63是LSCs的標志物。Parthasarathy等[9]研究發現p63在LSCs中高表達,而在由干細胞分化而來的短暫擴充細胞中不表達,認為p63可作為鑒定LSCs的標志。近年來,p63已被廣泛用作了LSCs的鑒定[10-13]。
PCNA是一種在增殖細胞中合成和表達的核內多肽,它的表達和合成與細胞周期有關,其作為DNA聚合酶的輔助蛋白直接參與了細胞的增殖能力,在含有增殖細胞的組織中,PCNA呈陽性表達,故PCNA可間接地反映細胞的增殖狀況[14]。PCNA陽性細胞僅局限于有增殖能力的組織,是評價細胞增殖能力的可靠指標,多用于細胞的體外培養[15]。故本研究對4組細胞進行了PCNA免疫熒光細胞化學染色,各組中均有不同數量的細胞染色呈陽性,證明了所培養的LSCs具有較強的增殖能力。
3.2 最佳羊膜載體的選擇 目前認為,羊膜是干細胞體外培養和臨床移植研究的首選載體[4]。Bourne將正常人羊膜組織自內向外分為5層:(1)上皮細胞層;(2)基底膜;(3)致密層;(4)纖維母細胞層;(5)海綿層。在制備羊膜載體時,將絨毛膜去掉,合格的羊膜載體只包括上皮細胞層和基底膜,無血管和基質成分(如成纖維細胞、膠原和其他非細胞成分)。本實驗制備的羊膜載體成分均符合體外培養載體的要求。
本研究在3種羊膜上培養的LSCs發現所得的克隆細胞團形態一致,有較高的核質比,說明3種培養方法均較好地保持了培養LSCs的干細胞特性。倒置鏡觀察到,羊膜載體上培養的細胞,3d的融合率可達到70%,5d可達100%,明顯高于無載體組(第5天左右方可達到70%的融合),說明在3種羊膜載體上培養的大鼠LSCs生長速度快,克隆形成率高,具有較強的增殖能力,均較無載體狀態更有利于LSCs的體外培養。
目前,關于新鮮羊膜和保存羊膜用于眼表疾病的治療中孰優孰劣的問題,眾說紛紜。LSCs在體內增殖分化受神經、內分泌、體液及微環境等各種因素的影響,其中各種細胞因子的作用尤為重要。許多研究表明,完整新鮮羊膜的上皮層細胞能夠分泌多種生物活性分子(表皮生長因子、轉化生長因子、成纖維細胞生長因子、神經生長因子等),在體外培養時,能刺激培養細胞的增殖、運動,增強黏附,并調節其分化狀態[16-20]。另外,神經生長因子還可誘導蛋白質合成、刺激免疫球蛋白M(IgM)分泌、調節膽堿乙酰基轉移酶的活性,對調節LSCs生存的微環境,促進其增殖具有重要作用。本研究用新鮮完整羊膜培養的LSCs數量最多,增殖能力最強,細胞凋亡率最低,在整個培養過程中,除培養基外,未使用其他任何促進細胞增殖的試劑,產生這一結果的原因可能與羊膜上皮細胞分泌各種細胞因子,最好地模擬了LSCs生長的微環境有關。
羊膜的基底膜是人體中最厚的基底膜,含有Ⅳ型膠原纖維網(ColⅣ)、層粘連蛋白(LN)和硫肝糖蛋白,可以為細胞黏附提供支架,引發細胞內信號轉導,促進細胞增生和移行[21]。說明去上皮的羊膜作為“移植的基底膜”,也可以為LSCs生長提供一種健康基質,起到增強LSCs的黏附,促進其移行和分化,以及防止凋亡等作用。故本研究用新鮮去上皮的羊膜作LSCs的體外培養,所獲細胞的數量、增殖能力、凋亡率均優于無載體,提示在羊膜去上皮的情況下,羊膜基質在LSCs體外培養過程中也在一定程度上發揮了正面的作用。
針對冷凍去上皮羊膜培養LSCs的情況,研究表明,冷凍保存的羊膜中上皮分泌的各種細胞因子效價顯著降低,但基底膜中含有的ColⅣ和LN并無明顯變化,故認為在冷凍保存羊膜中各種生物活性分子的作用很小,甚至沒有作用,而發揮主要作用的是基底膜[21]。這一觀點支持了本實驗冷凍去上皮羊膜組LSCs體外培養的結果,即由于沒有羊膜上皮所分泌的各種細胞因子的作用,所獲LSCs的數量、增殖能力均低于新鮮保留上皮的羊膜組,而凋亡率則相對增加;相關指標與新鮮去上皮羊膜組沒有明顯的區別,這也是沒有設置冷凍保留上皮羊膜組培養的原因。
綜上所述,本研究通過比較大鼠LSCs在保留上皮的新鮮羊膜、去除上皮的新鮮羊膜和去除上皮的冷凍羊膜上的生長情況和生物學特性發現,保留上皮的新鮮羊膜能更好地維持體外培養LSCs的干細胞的特性。因此,可認為保留上皮的新鮮羊膜載體更有利于大鼠LSCs的體外培養,是體外培養大鼠LSCs的理想載體,可為建立穩定的LSCs體外實驗細胞模型,和LSCs進一步用于角膜損傷修復的研究奠定理論基礎。
[1]FanJH,JiangH.Thesatusofrecentresearchoncornealpreservationandsomeexpectation[J].InternJOphth,2006(6):164-168.
[2]高平,劉慧霞,金偉,等.自體角膜緣干細胞移植聯合羊膜遮蓋治療眼表疾病31例[J].武警醫學,2014,25(4):387-388.
[3]茹香萍.角膜緣干細胞移植與羊膜移植治療翼狀胬肉[J].山西醫藥雜志,2010,39(4):337-338.
[4]Rendal-VázquezR,San-Luis-VerdesA,Yebra-Pimentel-VilarMT,etal.Cultureoflimbalstemcellsonhumanamnioticmembrane[J].CellTissueBank,2012,3(7):463-471.
[5]楊瑞青,崔巍,高偉.羊膜聯合角膜緣干細胞移植治療眼表疾病的研究[J].疾病監測與控制,2011,5(6):321-323.
[6]宋淑娟,馬彥秀,周翔宇.手術切除后局部應用絲裂霉素C聯合羊膜、角膜緣干細胞移植治療翼狀胬肉的臨床分析[J].中國社區醫師(醫學專業),2013,15(6):94-95.
[7]盧建民,呂秀麗,馬翔.兔骨髓間充質干細胞及人羊膜上皮細胞移植治療兔角膜緣干細胞缺損的研究[J].中華實驗眼科雜志,2011,29(9):786-792.
[8]SudhaB,SitalakshmiG,IyerGK,etal.Putativestemcellmarkersinlimbalepithelialcellsculturedonintact&denudedhumanamnioticmembrane[J].IndianJMedRes,2008,128(2):149-156.
[9]ParthasarathyArpithaNV,Muthu-KkaruppanV.HighexpressionofP63combinedwithalargeN/Cratiodefinesasubsetofhumanlimbalepithelialcells:implicationsonepithelialstemcells[J].InvestOphthalmolVisSci,2005,10(46):3631-3636.
[10]魏彤心,李冰,史靜華.人角膜緣干細胞的體外培養及鑒定[J].眼科研究,2010,28(5):432-435.
[11]齊飛,于佳欣,李若溪.人角膜緣干細胞提取方法的比較性研究[J].中國傷殘醫學,2015,23(8):31-33.
[12]李麗娜.白細胞介素-6和人角膜緣干細胞龕:上皮細胞和間質組織間相互作用的中介[J].中國病理生理雜志,2011(2):292.
[13]劉志平,沙翔垠,王智崇,等.胚胎干細胞微環境增強人角膜緣干細胞的干性和抑制凋亡的機制[J].中華實驗眼科雜志,2015,33(5):389-399.
[14]李紅,蘇敏,黃悅,等.PCNA在新西蘭大耳兔角膜及角膜緣的表達[J].局解手術學雜志,2009,18(5):297-299,303.
[15]StrzalkaW,ZiemienowiczA.Proliferatingcellnuclearantigen(PCNA):akeyfactorinDNAreplicationandcellcycleregulation[J].AnnBot,2011,107(7):1127-1140.
[16]TuliSS,LiuR,ChenC,etal.ImmunohistochemicallocalizationofEGF,TGF-alpha,TGF-beta,andtheirreceptorsinratcorneasduringhealingofexcimerlaserablation[J].CurrEyeRes,2006,31(9):709-719.
[17]WangZ,PeterS.DependenceofEGF-inducedincreasesincornealepithelialproliferationandmigrationonGSK-3inactivation[J].InvestOphthalmolVisSci,2009,10(50):4828-4835.
[18]YutakaTakeuchiKM,ChrisW.TherolesofFGFsignalingingermcellmigrationinthemouse[J].Development,2005,12(132):5399-5409.
[19]TandonA,ToveyJC,MohanRR.etal.RoleoftransforminggrowthfactorBetaincornealfunction,biologyandpathology[J].CurrMolMed,2010,10(6):565-578.
[20]HqiD,JonesDB.Identificationofneurotroph-icfactorsNGF,GDNFandtheircorrespondingreceptorsTrkA,GFRα-1aspotentialnewmarkersforhumancornealepithelialstemcells[J].InvestOphthalmolVisSci,2007,5(48):481-485.
[21]趙敏,魯靜,張琪,等.HGF、bFGF、ColⅣ、LN在保存羊膜中的表達[J].眼科研究,2006,24(5):514-517.
An experimental study of cultivating rat limbal stem cells in vitro on amniotic membrane*
HuRong,GaoJie,LiangYaru,HuangYue,LiHong,SuMin△
(DepartmentofHistologyandEmbryology,GuizhouMedicalUniversity,Guiyang,Guizhou550004,China)
Objective To search the optimal substrate of limbal stem cells(LSCs) cultured in vitro and provide experimental basis for LSCs transplantation.Methods The amniotic membranes of placenta from healthy pregnant women were obtained after caesarean section,the intact fresh amniotic membrane,the denuded fresh amniotic membrane and the denuded frozen amniotic membrane were prepared.There were 4 groups in the experiment:the experimental group 1 (the intact fresh amniotic membrane group),the experimental group 2 (the denuded fresh amniotic membrane group),the experimental group 3 (the denuded frozen amniotic membrane group) and the control group (the amniotic membrane free group).One hundred and twenty SD rats were used in this experiment.The cells of 4 groups were detected by cell apoptosis(TUNEL method),immunofluorescence of p63 and PCNA.The positive rates were analysed with the statistical methods.Results On the 3th day,the cultured cells of 3 experimental groups spreaded tightly and fused to a monolayer.There were many big clones clustered and the cells were spherical or oval with the same size.The cultured cells of the control group spreaded less tightly and fused to a monolayer as well.There were some small clones clustered and the cells were similar to the experimental groups.Experimental groups had less apoptosis positive cells and most cells were p63 and PCNA positive,while the control group had more apoptosis positive cells and less p63 and PCNA positive cells.The cell apoptosis rates of three experimental groups were lower than those of control group,the positive rates of their p63 and PCNA were higher than those of control group (P<0.01).The changes of the experimental group 1 were the most obvious (P<0.01).Conclusion Three different amniotic membranes are all helpful for rat LSCs culture in vitro.Moreover,the cells cultured on the intact fresh amniotic membrane were maintained with better characteristics.So the intact fresh amniotic membrane is considered to be the optimal substrate.
limbus corneae;stem cells;amnion;staining and labeling;corneae;cell apoptosis;p63;PCNA
貴州省優秀科技教育人才省長專項資金項目(黔省專合字[2012]41號);貴州省科技廳-貴陽醫學院聯合基金(黔科合LG字[2012]026號)。 作者簡介:胡蓉(1980-),副教授,博士,主要從事干細胞基礎與應用方面研究。△
10.3969/j.issn.1671-8348.2016.23.023
R329.2
A
1671-8348(2016)23-3233-04
2016-04-08
2016-07-21)

