姜黃素抑制HGF誘導血管內皮細胞遷移和VEGF表達的體內外研究*
宋 嘉, 王 劍, 李 玉, 胡慧珍, 嚴 杰, 吳麗君, 徐 煒, 陳清勇
(中國人民解放軍第一一七醫院, 浙江 杭州 310013)
?
姜黃素抑制HGF誘導血管內皮細胞遷移和VEGF表達的體內外研究*
宋 嘉▲, 王 劍▲, 李 玉, 胡慧珍, 嚴 杰, 吳麗君, 徐 煒, 陳清勇△
(中國人民解放軍第一一七醫院, 浙江 杭州 310013)
目的: 探索姜黃素抑制肝細胞生長因子(HGF)誘導血管生成的分子機制。方法:利用管腔形成實驗、劃痕實驗、Western blot實驗和動物實驗觀察姜黃素、c-Met抑制劑SU11274、磷脂酰肌醇3-激酶(PI3K)抑制劑LY294002和mTOR抑制劑rapamycin對HGF誘導的內皮細胞遷移、管腔形成能力、血管內皮生長因子(VEGF)表達、相關信號通路和瘤體內血管密度的影響。結果:姜黃素可顯著抑制HGF誘導內皮細胞發生遷移、小管形成及VEGF的表達,同時抑制c-Met/AKT/mTOR/S6通路的磷酸化,并可減少瘤體內VEGF的表達和微血管密度。使用c-Met抑制劑SU11274、PI3K抑制劑LY294002或mTOR抑制劑rapamycin能得到和姜黃素相似的效應。結論:姜黃素抑制HGF誘導的血管生成可能是通過抑制c-Met/AKT/mTOR/S6信號通路活化實現的。
姜黃素; 肝細胞生長因子; 血管內皮生長因子; 血管生成
血管生成是腫瘤生長和轉移的重要因素[1],血管內皮生長因子(vascular endothelial growth factor,VEGF)和肝細胞生長因子(hepatocyte growth factor,HGF)具有強烈的致腫瘤血管生成作用[2-3]。目前的研究均認為血管生成是腫瘤生長和轉移的重要途徑之一,血管網在腫瘤內增殖為腫瘤提供營養物質及氧氣,保證腫瘤生長,同時在腫瘤釋放的各種生長因子作用下,血管新生,進一步促進了腫瘤增殖及浸潤。盡管抗腫瘤藥物能有效殺滅腫瘤細胞,但由于周圍血管支持,殘存腫瘤細胞仍可繼續存活,導致腫瘤復發。此外,由于腫瘤血管結構的特殊性,使得藥物在向腫瘤內部輸送時遞減,也是導致抗腫瘤失敗的原因之一。因此,抗血管生成在腫瘤治療方面顯得尤為重要。姜黃素(curcumin, CUR)有廣泛的藥理作用,如抗炎、抗腫瘤、調節免疫等[4]。而當前關于姜黃素能否抑制HGF誘導的血管生成及相關分子機制尚無研究報道,本實驗將對姜黃素能否抑制HGF誘導的血管生成進行研究。
材 料 和 方 法
1 材料
1.1 細胞 人非小細胞肺癌細胞A549購自上海中科院細胞庫;人臍靜脈內皮細胞(HUVECs)由浙江中醫藥大學提供。
1.2 主要試劑 姜黃素購自Sigma;HGF 購自Peprotech;c-Met抑制劑SU11274、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)抑制劑LY294002和哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)抑制劑rapamycin購自Selleck Chemicals;抗p-Met(Y1234/35)、c-Met、p-Akt (S473)、p-mTOR (S2448)、AKT、mTOR、S6、p-S6、CD34、VEGF、GAPDH等抗體購自Cell Signaling Technology;羊抗兔IgG II抗購自Jackson。
1.3 實驗動物 12只雄性BALB/c小鼠,4~6周齡,購自上海實驗動物中心,飼養于浙江中醫藥大學動物房。
2 方法
2.1 細胞培養 細胞用含10%胎牛血清和青霉素、鏈霉素(終濃度為1×105U/L)的RPMI-1640(Gibco)培養液,常規置于37 ℃、5% CO2培養箱中培養,取對數生長期細胞實驗。
2.2 細胞分組 實驗分為對照(control)組、HGF組、HGF+SU11274組、HGF+LY294002組、HGF+rapamycin組、HGF+低、中、高濃度CUR組。其中HGF使用濃度為40 μg/L,SU11274使用濃度為5 μmol/L,LY294002使用濃度為20 μmol/L,rapamycin使用濃度為200 nmol/L,姜黃素低、中、高濃度分別為10、20、30 μmol/L。
2.3 劃痕修復實驗 接種3×105個HUVECs于6孔板,待細胞融合度為80%時,在板內進行劃痕、拍照。吸去培養基,加入含有2.5%血清培養基,或含有高、中、低濃度姜黃素及SU11274、LY294002和rapamycin的培養基,作用2 h后加入HGF,使終濃度為40 ng/L,繼續培養24 h。劃痕修復率=(0 h劃痕寬度-24 h劃痕寬度)/0 h劃痕寬度×100%。
2.4 管腔形成實驗 將1×104個(200 μL) HUVECs接種于預先鋪有Matrigel的96孔板內,并加入上述濃度藥物,培養6 h后用吖啶橙染色,PBS清洗3遍后在熒光倒置顯微鏡下拍照,并計算小管數量。
2.5 Western blot實驗 用RAPI 裂解液提取各組細胞總蛋白并進行蛋白定量,每個泳道上蛋白樣品10 μg,8% SDS-PAGE分離后,轉印(300 mA,120 min)到PVDF膜上。5%脫脂牛奶或牛血清白蛋白室溫封閉1 h。分別加入對應 I 抗,4 ℃孵育過夜,TBST洗滌3次,加入 II 抗孵育2 h后洗膜,加入電化學發光法發光液,凝膠成像系統拍照,分析條帶灰度值。
2.6 動物實驗 實驗方法、藥物劑量參考前期的一些研究報道[5-7]。將1×107個(100 μL) A549細胞注射于小鼠的右側前肢,在接種15 d后,將小鼠分為4組,每組3只,實驗分別為對照(control)組、HGF組、HGF聯合低濃度(100 mg/kg)CUR組,HGF聯合高濃度(300 mg/kg)CUR組。每只小鼠灌胃30 μL DMSO或姜黃素,同時每隔3 d瘤內注射濃度為30 μg/kg的HGF或同體積的PBS。30 d后處死小鼠,瘤體固定包埋、切片,行免疫組化染色后,觀察VEGF和CD34的表達量,計算微血管密度。
2.7 免疫組化染色及結果判定 切片常規脫蠟水化,56 ℃孵育2 h,浸泡在枸櫞酸鹽緩沖液中微波加熱修復抗原,3% H2O2/甲醇封閉內源性過氧化物酶10 min,羊血清中孵育封閉20 min;滴加 I 抗,4 ℃孵育過夜,滴加 II 抗室溫孵育30 min,滴加SABC液,室溫孵育30 min。PBS漂洗后滴加DAB顯色液,顯色5~10 min;蘇木素復染,梯度乙醇脫水,二甲苯透明,中性樹膠封片。VEGF和CD34以棕黃色顆粒為陽性,按細胞膜染色強度分為0(無色)、1(淡黃色)、2(中等黃色)、3(棕黃色)。每個樣本中選取2個視野計數胞質被標記的細胞百分數。結果分為2組,其中無任何標記、染色強度為1分的細胞比例小于25%、染色強度為2分的細胞比例小于5%被認為是陰性結果,其余則認為是陽性的結果。
3 統計學處理
以上實驗均至少重復3次,應用SPSS 13.0統計軟件進行統計分析,數據以均數±標準差(mean±SD)表示,多組間比較采用單因素方差分析(one-way ANOVA),多個樣本均數間的兩兩比較采用Bonferroni校正的t檢驗,以P<0.05為差異有統計學意義。
結 果
1 姜黃素對HUVECs細胞形態的影響
顯微鏡下觀察發現,HGF作用24 h后,內皮細胞的細胞形態為長梭形,而隨著姜黃素濃度增加,細胞形態逐漸變為卵圓形,見圖1。
2 姜黃素抑制HGF誘導內皮細胞發生遷移
與對照組相比,HGF可以顯著誘導內皮細胞發生遷移(P<0.05);與HGF組相比,姜黃素可抑制遷移的發生(P<0.05),見圖2。

Figure 1.The effect of curcumin on HGF-induced endothelial cell morphology (×200).
圖1 姜黃素對HGF誘導的內皮細胞形態的影響
Figure 2.The effect of curcumin on HGF-induced endothelial cell migration ability (×100). Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05,##P<0.01vsHGF group.
圖2 姜黃素對HGF誘導的內皮細胞遷移能力的影響
3 姜黃素抑制HGF誘導HUVECs管腔形成
與對照組相比,HGF可以顯著誘導內皮細胞小管形成(P<0.01);與HGF組相比,姜黃素可顯著抑制HGF誘導的小管形成(P<0.01),見圖3。
4 姜黃素抑制HGF誘導的VEGF表達
與對照組相比,HGF可誘導內皮細胞VEGF表達(P<0.01),姜黃素可呈濃度依賴性抑制HGF誘導的VEGF表達(P<0.01),見圖4。
5 姜黃素抑制HGF誘導的c-Met/AKT/mTOR/S6通路相關分子的磷酸化
與對照組相比,HGF可誘導內皮細胞c-Met、AKT、mTOR和S6的磷酸化(P<0.05),而姜黃素可呈濃度依賴性地抑制HGF誘導的c-Met、AKT、mTOR和S6的磷酸化(P<0.05),見圖5。
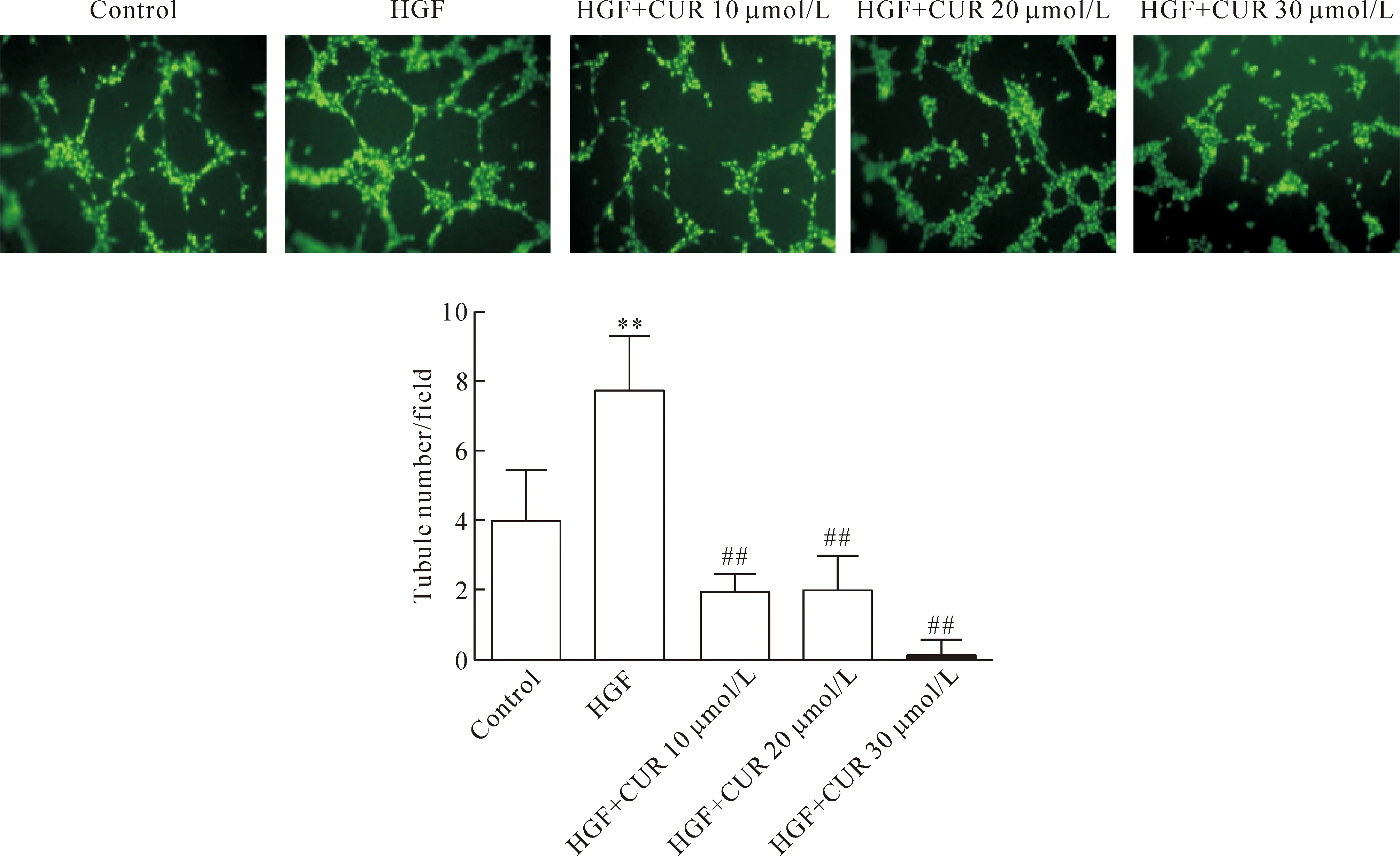
Figure 3.The effect curcumin on HGF-induced tubule formation of endothelial cells (×100). Mean±SD.n=4.**P<0.01vscontrol group;##P<0.01vsHGF group.
圖3 姜黃素對HGF誘導的內皮細胞管腔形成能力的影響
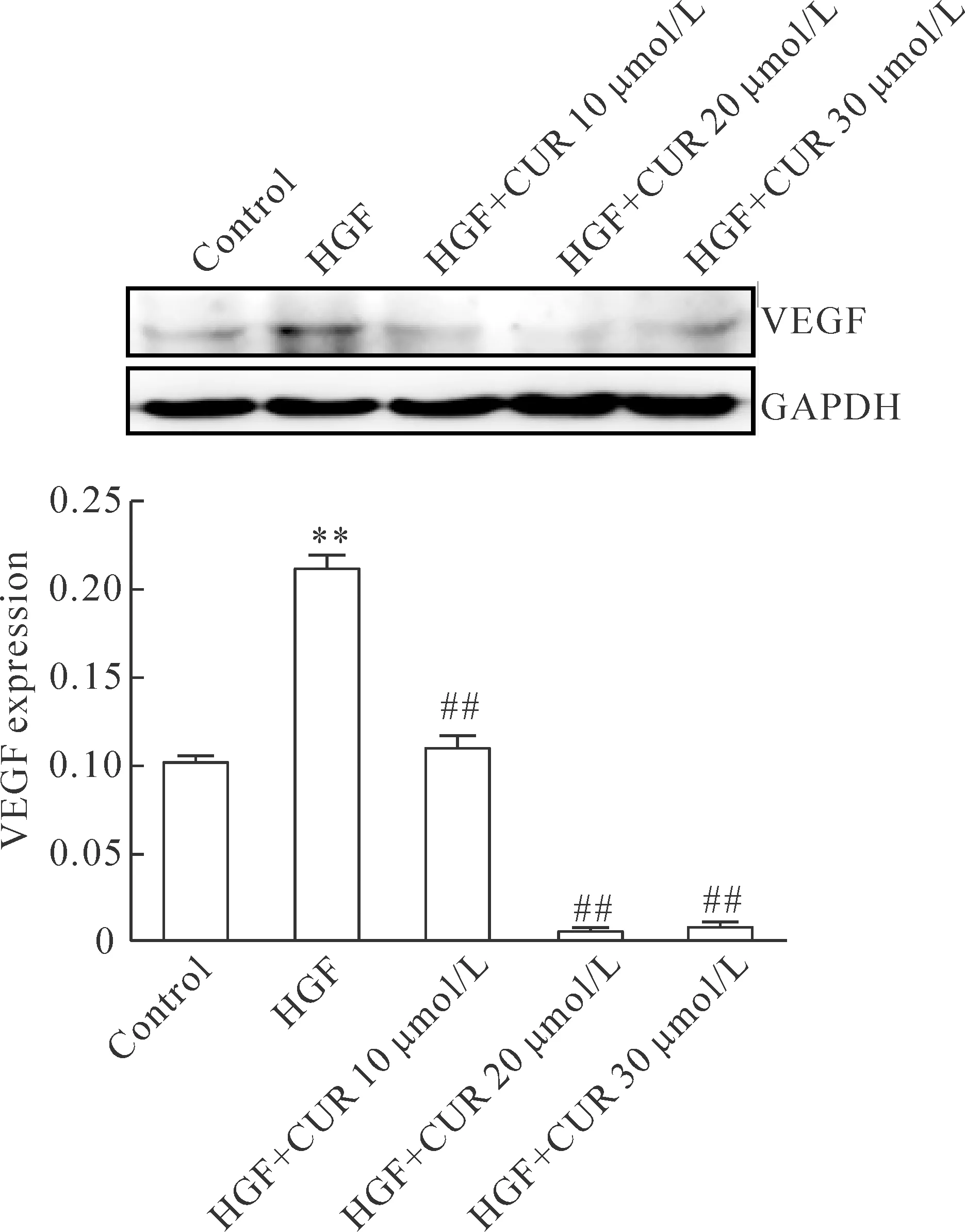
Figure 4.Curcumin inhibited VEGF expression induced by HGF. Mean±SD.n=4.**P<0.01vscontrol group;##P<0.01vsHGF group.
圖4 姜黃素抑制HGF誘導的VEGF表達
6 SU11274、LY294002和rapamycin對HUVECs細胞形態的影響
光鏡觀察發現,HGF刺激HUVECs后,細胞形態變成長梭形,加入SU11274、LY294002和rapamycin后,細胞則呈卵圓形,見圖6。
7 SU11274、LY294002和rapamycin抑制HGF誘導HUVECs細胞遷移
HGF可誘導HUVECs細胞發生遷移,與control組比較,差異有統計學顯著性(P<0.05)。加入SU11274、LY294002和rapamycin可顯著抑制HGF誘導的HUVECs發生遷移(P<0.01),見圖7。
8 SU11274、LY294002和rapamycin抑制HGF誘導的HUVECs管腔形成
HGF可誘導HUVECs細胞小管形成,與control組比較差異有統計學顯著性(P<0.05)。加入SU11274、LY294002和rapamycin可顯著抑制HGF誘導的HUVECs小管的形成(P<0.01),見圖8。
9 SU11274、LY294002、rapamycin抑制HGF誘導的VEGF表達
與對照組相比,HGF可誘導內皮細胞VEGF表達(P<0.01);與HGF組相比,SU11274、LY294002和rapamycin可抑制HGF誘導的VEGF表達(P<0.05),見圖9。
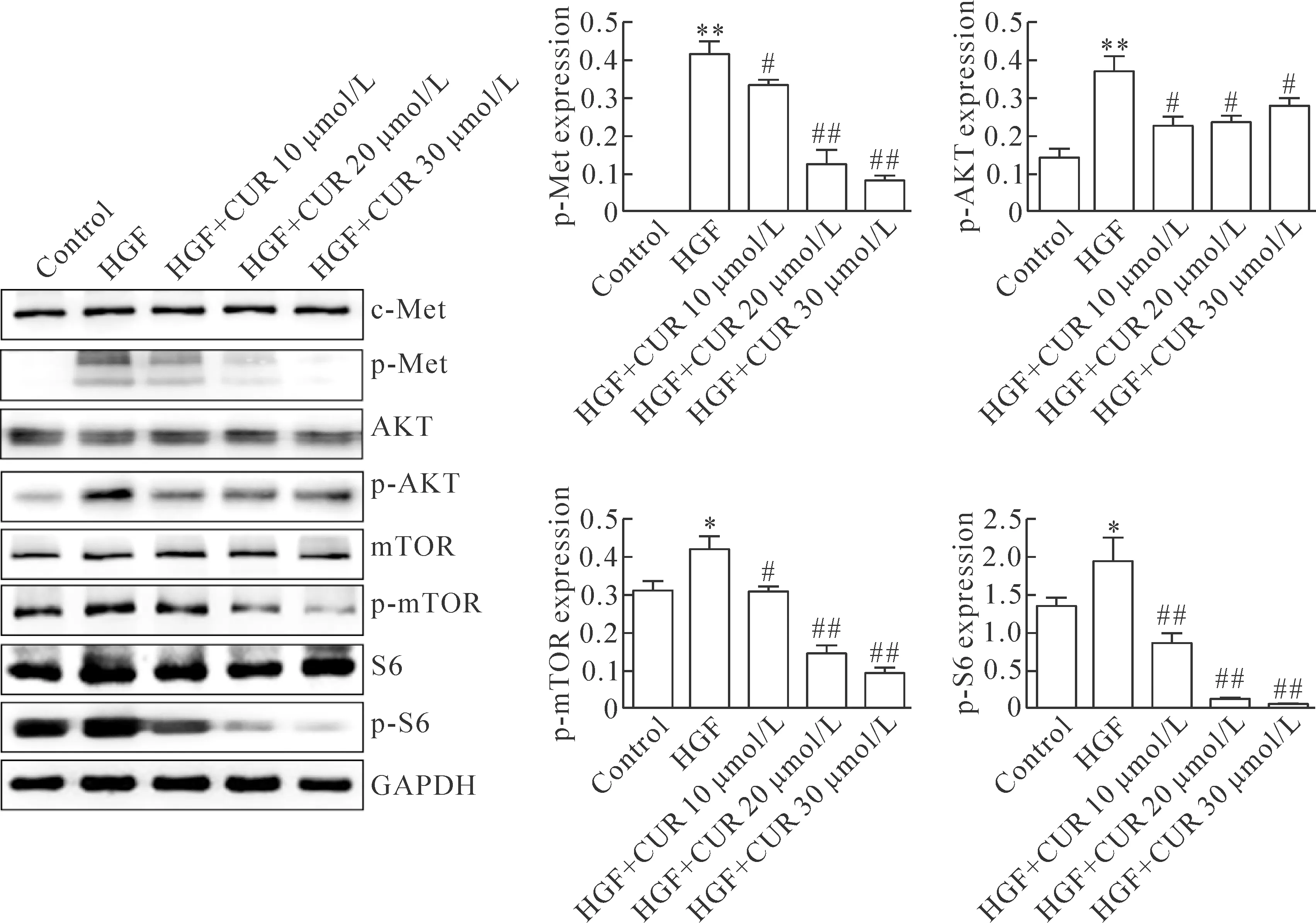
Figure 5.Curcumin inhibited the phosphorylation of c-Met/Akt/mTOR/S6 pathway related molecules induced by HGF. Mean±SD.n=4.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsHGF group.
圖5 姜黃素抑制HGF誘導的c-met/AKT/mTOR/S6通路相關分子的磷酸化

Figure 6.The effect of SU11274 (SU), LY294002 (LY) and rapamycin (RA) on HGF-induced changes of endothelial cell morpho-logy (×200).
圖6 SU11274、LY294002和rapamycin對HGF誘導的內皮細胞形態的影響
10 SU11274、LY294002和rapamycin抑制HGF誘導的c-Met、AKT、mTOR和S6的磷酸化
與對照組相比,HGF可誘導內皮細胞c-Met/AKT/mTOR/S6的磷酸化(P<0.05);與HGF組相比,SU11274、LY294002和rapamycin可抑制HGF誘導的c-Met、AKT、mTOR和S6的磷酸化(P<0.05),見圖10。
11 姜黃素阻斷HGF誘導小鼠肺癌模型瘤體內的血管生成
與對照組相比,瘤內注射HGF可顯著增加組織VEGF的表達(P<0.01)及微血管數量(P<0.01),而灌服姜黃素可以減少瘤體內VEGF的表達(P<0.01)及微血管數量(P<0.01),見圖11。
討 論
血管生成是腫瘤生長和轉移的重要途徑之一,抗血管生成已成為腫瘤治療的重要方向[8]。VEGF/VEGFR通路是介導血管內皮細胞增殖、分裂和遷移的最重要分子信號,抑制該信號可導致內皮細胞凋亡、抑制其遷移,減少腫瘤中血管形成、抑制血管滲透[9]。HGF是c-Met配體,可通過激活c-Met及其下游信號通路誘導細胞發生多種生物學行為,例如增殖、分化、侵襲、遷移等。多項研究表明,HGF/c-Met與血管生成存在密切相關性。劉濱等[10]發現,HGF、c-Met及VEGF的表達與星形細胞瘤惡性程度及腫瘤血管生長呈正相關。Hung等[11]研究發現HGF能誘導內皮細胞的VEGF表達,蛇床子素可通過抑制HGF/c-Met/AKT/mTOR通路抑制VEGF表達。Chen等[12]研究發現miR-206也可通過HGF/c-Met/AKT/mTOR途徑抑制內皮細胞管腔形成。這些研究表明HGF/c-Met/AKT/mTOR在血管形成過程中扮演重要角色,抑制該靶點可能成為抗血管生成的有效機制。

Figure 7.The effect of HGF, SU11274 (SU), LY294002 (LY) and rapamycin (RA) on the endothelial cell migration ability (×100). Mean±SD.n=4.*P<0.05vscontrol group;##P<0.01vsHGF group.
圖7 SU11274、LY294002和rapamycin對HGF誘導的內皮細胞遷移能力的影響

Figure 8.The effect of SU11274 (SU), LY294002 (LY) and rapamycin (RA) on HGF-induced tubule formation of the endothelial cells (×100). Mean±SD.n=4.*P<0.05vscontrol group;##P<0.01vsHGF group.
圖8 SU11274、LY294002和rapamycin對HGF誘導的內皮細胞管腔形成能力的影響

Figure 9.SU11274 (SU), LY294002 (LY) and rapamycin (RA) inhibited VEGF expression induced by HGF. Mean±SD.n=4.**P<0.01vscontrol group;#P<0.05,##P<0.01vsHGF group.
圖9 SU11274、LY294002和rapamycin抑制HGF誘導的VEGF表達
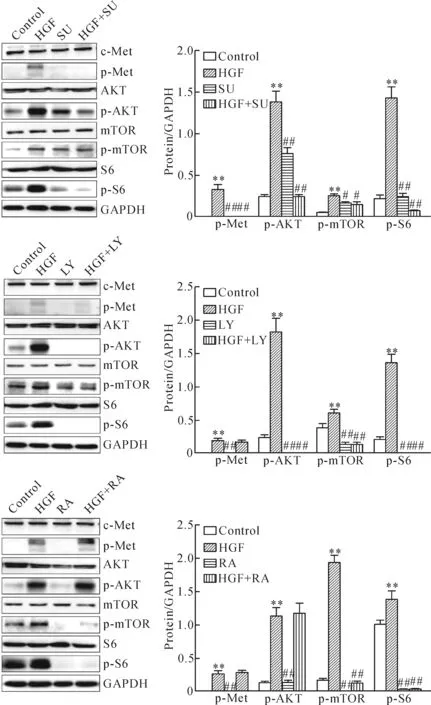
Figure 10.SU11274 (SU), LY294002 (LY) and rapamycin (RA) inhibited the phosphorylation of c-Met/AKT/mTOR/S6 pathway related molecules induced by HGF. Mean±SD.n=4.**P<0.01vscontrol group;#P<0.05,##P<0.01vsHGF group.
圖10 SU11274、LY294002和rapamycin抑制HGF誘導的c-Met/AKT/mTOR/S6通路相關分子的磷酸化

Figure 11.Curcumin inhibited HGF induced VEGF expression and angiogenesis in the tumors (×40). Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsHGF group.
圖11 姜黃素抑制HGF誘導瘤體內VEGF表達及血管生成
以往的研究已證實姜黃素具有多種抗血管生成機制。Fu等[13]研究發現,姜黃素能夠抑制內皮細胞增殖、遷移及VEGF表達,同時也能抑制小鼠肝癌模型內的血管生成。Dai等[14]研究發現姜黃素可抑制低氧條件下誘導的動物肝癌模型中的血管生成。而Bimonte等[15]研究發現,姜黃素能夠通過抑制NF-κB途徑來抑制乳腺癌細胞的增殖、遷移,并阻斷其小鼠模型中的血管生成。但關于姜黃素能否通過HGF/c-Met/AKT/mTOR途徑在體內外抑制血管生成的研究尚無報道。
本研究結果表明,HGF可有效誘導內皮細胞發生遷移及管腔形成,同時還可提高VEGF表達,姜黃素可抑制HGF誘導內皮細胞遷移、管腔形成及VEGF表達。使用c-Met抑制劑作為對照研究后發現,抑制c-Met磷酸化可抑制內皮細胞遷移、管腔形成及VEGF表達,并且使用c-Met下游PI3K、mTOR抑制劑阻斷HGF激活AKT/mTOR磷酸化后,同樣可取得上述效應,表明c-Met/AKT/mTOR通路在血管生成中發揮重要作用。而Western blot實驗結果表明姜黃素也可抑制HGF誘導的內皮細胞c-Met及其下游AKT/mTOR的磷酸化,從而在體外實驗中證實姜黃素抑制血管生成可能是通過抑制c-Met/AKT/mTOR磷酸化進而抑制VEGF表達來實現的。為進一步驗證姜黃素在體內抗血管生成中的作用,我們通過在瘤體內注射HGF,同時灌胃姜黃素的方法研究姜黃素對腫瘤血管生成的確切作用,發現HGF可顯著誘導瘤體內的血管生長,增加微血管密度,提高VEGF蛋白表達,而通過灌服姜黃素可顯著減少瘤體內的血管數量及VEGF表達,證實灌服姜黃素抑制HGF誘導瘤體的血管生成的效果是顯著的。
綜上所述,本研究通過體內外實驗研究發現,姜黃素抑制HGF誘導的血管生成的分子機制可能是通過抑制c-Met/AKT/mTOR/S6信號通路活化進而抑制VEGF蛋白表達實現的,這為姜黃素抗血管生成提供了新的理論依據。
[1] Choi HS, Lee K, Kim MK, et al. DSGOST inhibits tumor growth by blocking VEGF/VEGFR2-activated angiogenesis[J]. Oncotarget, 2016, 7(16):21775-21785.
[2] Gorin C, Rochefort GY, Bascetin R, et al. Priming dental pulp stem cells with fibroblast growth factor-2 increases angiogenesis of implanted tissue-engineered constructs through hepatocyte growth factor and vascular endothelial growth factor secretion[J]. Stem Cells Transl Med, 2016, 5(3):392-404.
[3] Fu X, Yang Y, Li X, et al. RGD peptide-conjugated selenium nanoparticles: antiangiogenesis by suppressing VEGF-VEGFR2-ERK/AKT pathway[J]. Nanomedicine, 2016, 12(6):1627-1639.
[4] Zheng R, You Z, Jia J, et al. Curcumin enhances the antitumor effect of ABT-737 via activation of the ROS-ASK1-JNK pathway in hepatocellular carcinoma cells[J]. Mol Med Rep, 2016, 13(2):1570-1576.
[5] Chen QY, Zheng Y, Jiao DM ,et al. Curcumin inhibits lung cancer cell migration and invasion through Rac1-dependent signaling pathway[J]. J Nutr Biochem, 2014, 25(2):177-185.
[6] Liang Z, Xie W, Wu R ,et al. Inhibition of tobacco smoke-induced bladder MAPK activation and epithelial-mesenchymal transition in mice by curcumin[J]. Int J Clin Exp Pathol, 2015, 8(5):4503-4513.
[7] Hong JH, Lee G, Choi HY. Effect of curcumin on the interaction between androgen receptor and Wnt/β-catenin in LNCaP xenografts[J]. Korean J Urol, 2015, 56(9):656-665.
[8] 吳志豪, 李香利, 鄭 敏. 百里醌抑制乳腺癌血管生長的實驗研究[J]. 中國病理生理雜志, 2016, 32(1):106-111.
[9] Lee WS, Pyun BJ, Kim SW, et al. TTAC-0001, a human monoclonal antibody targeting VEGFR-2/KDR, blocks tumor angiogenesis[J]. MAbs, 2015, 7(5):957-968.
[10]劉 濱, 劉 威, 范海濤, 等. HGF及其受體c-met和VEGF與星形細胞腫瘤惡性程度及其血管生成之間的關系[J]. 山東大學學報: 醫學版, 2011, 49(2):109-118.
[11]Hung CM, Kuo DH, Chou CH, et al. Osthole suppresses hepatocyte growth factor (HGF)-induced epithelial-mesenchymal transition via repression of the c-Met/Akt/mTOR pathway in human breast cancer cells[J]. J Agric Food Chem, 2011, 59(17):9683-9690.
[12]Chen QY, Jiao DM, Wu YQ, et al. MiR-206 inhibits HGF-induced epithelial-mesenchymal transition and angiogenesis in non-small cell lung cancer via c-Met/PI3k/Akt/mTOR pathway[J]. Oncotarget, 2016, 7(14):18247-18261.
[13]Fu ZP, Chen X, Guan SW, et al. Curcumin inhibits angiogenesis and improves defective hematopoiesis induced by tumor-derived VEGF in tumor model through modulating VEGF-VEGFR2 signaling pathway[J]. Oncotarget, 2016, 6(23):19469-19482.
[14]Dai F, Zhang X, Shen W, et al. Liposomal curcumin inhibits hypoxia-induced angiogenesis after transcatheter arterial embolization in VX2 rabbit liver tumors[J]. Onco Targets Ther, 2015, 8:2601-2611.
[15]Bimonte S, Barbieri A, Palma G, et al. Dissecting the role of curcumin in tumour growth and angiogenesis in mouse model of human breast cancer[J]. Biomed Res Int, 2015, 2015:878134.
(責任編輯: 林白霜, 余小慧)
Curcumin inhibits HGF induced vascular endothelial cell migration and VEGF expression in vitro and in vivo
SONG Jia, WANG Jian, LI Yu, HU Hui-zhen, YAN Jie, WU Li-jun, XU Wei, CHEN Qing-yong
(The117thHospitalofPLA,Hangzhou310013,China.E-mail:CQYong117@163.com)
AIM: To explore the molecular mechanism that curcumin inhibits hepatocyte growth factor (HGF) induced angiogenesis. METHODS: The effects of curcumin, c-Met inhibitor SU11274, phosphatidylinositol 3-kinase (PI3K) inhibitor LY294002 and mTOR inhibitor rapamycin on HGF-induced endothelial cell migration, tubule formation ability, vascular endothelial growth factor (VEGF) expression, related signaling pathways and the density of blood vessels in tumors were observed by the methods of capillary forming experiments, wound healing assay, Western blot and animal study. RESULTS: SU11274, LY294002, rapamycin and curcumin significantly inhibited HGF induced endothelial cell migration, tubule formation and VEGF expression, suppressed the phosphorylation of c-Met/AKT/mTOR/S6 pathway related molecules, reduced VEGF expression and microvascular density in the tumors. CONCLUSION: Curcumin inhibits HGF induced angiogenesis by inhibiting c-Met/AKT/mTOR/S6 pathway activation.
Curcumin; Hepatocyte growth factor; Vascular endothelial growth factor; Angiogenesis
1000- 4718(2016)11- 1949- 09
2016- 03- 28
2016- 08- 09
南京軍區醫學科技創新項目(No.14ZD44; No.15MS158);浙江省科技廳公益性技術應用研究計劃(No.2014C33277);杭州市科技發展計劃項目(No.20130633B29; No.20140633B40)
R363
A
10.3969/j.issn.1000- 4718.2016.11.006
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 0571-28084876; E-mail: CQYong117@163.com
▲并列第1作者

