川芎嗪聯合骨髓間充質干細胞移植抑制腦缺血大鼠神經細胞凋亡*
丁文倩, 李 琳, 儲利勝△, 任翠翠, 方 燕, 楊 琰
(浙江中醫藥大學 1藥學院, 2基礎醫學院, 浙江 杭州 310053)
?
川芎嗪聯合骨髓間充質干細胞移植抑制腦缺血大鼠神經細胞凋亡*
丁文倩1, 李 琳2, 儲利勝2△, 任翠翠1, 方 燕2, 楊 琰2
(浙江中醫藥大學1藥學院,2基礎醫學院, 浙江 杭州 310053)
目的: 研究川芎嗪(tetramethylpyrazine,TMP)聯合骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)對腦缺血大鼠神經細胞凋亡及Bcl-2、Bax表達的影響。方法:采用全骨髓貼壁法體外培養BMSCs,傳代至第3代用于尾靜脈移植。采用線栓法誘導大鼠右側大腦中動脈阻塞模型,除假手術組外,大鼠隨機分為模型組、BMSCs(1×109/L)組、川芎嗪(40 mg/kg)組和聯合(川芎嗪+BMSCs)組,每組12只。缺血后第1、7和14天采用改良的神經損傷嚴重程度評分(modified neurological severity scoring,mNSS)進行神經功能評價。缺血后第14 天,甲苯胺藍染色檢測腦梗死體積,HE染色觀察腦組織病理學變化,采用原位末端標記(TUNEL)法觀察神經細胞凋亡數,采用實時熒光定量PCR法和Western blot法檢測Bax和Bcl-2的mRNA及蛋白表達。結果:與BMSCs組和川芎嗪組比較,聯合組mNSS評分顯著減少(P<0.01),梗死體積顯著減少(P<0.01),缺血引起的腦缺血周邊區病理性損傷明顯減輕,TUNEL陽性細胞數顯著減少(P<0.01),Bcl-2的mRNA及蛋白表達顯著增加,Bax的mRNA及蛋白表達顯著降低(P<0.01)。結論:川芎嗪聯合BMSCs移植能顯著促進腦缺血后大鼠的功能恢復,減少梗死體積,減輕腦組織缺血性損傷,抑制神經細胞凋亡,機制可能與調控Bcl-2和Bax的表達有關。
川芎嗪; 骨髓間充質干細胞; 腦缺血; 細胞凋亡
腦缺血是導致成年人死亡和殘疾的主要原因。目前臨床上急性期除了采用組織型纖溶酶原激活物(tissue-type plasminogen activator,tPA)溶栓治療外,尚缺乏其它有效的治療方法。但tPA存在治療時間窗窄(<4.5 h)和出血的風險,嚴重限制其臨床的應用[1]。近年來研究發現,干細胞移植治療腦缺血有很好的應用潛能[2]。其中,骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)具有取材方便、易擴增、低免疫原性和無倫理學爭議等優點,被認為是組織工程的種子細胞。大量動物實驗和臨床研究表明,BMSCs移植不僅能促進腦缺血后神經功能恢復,而且是安全的[3]。
腦缺血發病機制非常復雜,其中缺血周邊區神經細胞凋亡是其發病的主要機制之一[4]。BMSCs移植不僅能促進腦缺血后神經修復,還能抑制缺血周邊區神經細胞凋亡[5]。川芎嗪(tetramethylpyrazine,TMP)是中藥川芎的主要有效成分,具有抗炎、抗氧化和抗凋亡等作用,已被臨床廣泛應用于缺血性腦血管病的治療[6]。最近文獻報道,采用中藥或有效成分聯合BMSCs治療腦缺血具有更好的療效[7],但目前尚缺乏川芎嗪聯合BMSCs移植治療腦缺血的報道。因此,本研究首先觀察川芎嗪聯合BMSCs移植對腦缺血大鼠的治療作用,然后從神經細胞凋亡的角度探討其作用機制。
材 料 和 方 法
1 實驗動物
SPF級SD雄性大鼠,3周齡體重約80~100 g,3~4月齡體重250~300 g,購自上海西普爾-必凱實驗動物有限公司,合格證號為SCK(滬)2013-0016,浙江中醫藥大學實驗動物中心飼養,許可證號為SYXK(浙)2013-0184。室溫(22±1)℃,相對濕度40%~60%,12 h/12 h明暗循環,自由飲食進水。
2 藥物與主要試劑
川芎嗪(阿拉丁試劑有限公司);DMEM/F12培養基(杭州吉諾生物醫藥技術有限公司);優級胎牛血清(Gibco);鼠源單克隆抗體β-actin(Santa Cruz);兔源Bcl-2和Bax多克隆抗體(CST);山羊抗鼠II抗IgG、山羊抗兔II抗IgG和組織總蛋白提取試劑(Thermo);TUNEL細胞凋亡檢測試劑盒(Roche);BCA蛋白濃度測定試劑盒和SDS-PAGE凝膠配制試劑盒(上海碧云天生物技術有限公司);TRIzol試劑盒和逆轉錄試劑盒(TaKaRa);PVDF膜(Millipore)。所用引物由上海生工生物工程股份有限公司設計合成,見表1。
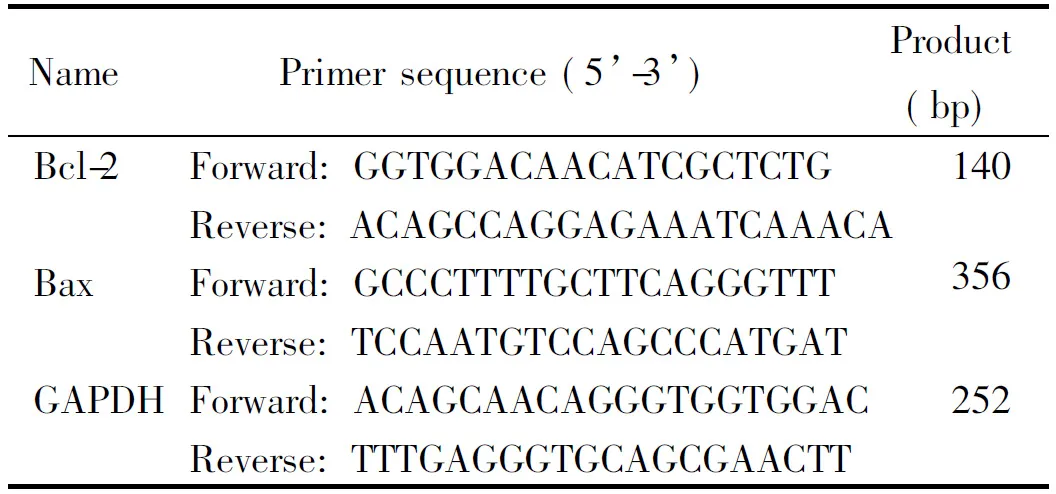
表1 引物序列
3 主要儀器
CO2恒溫培養箱(SANYO);冰凍切片機和正置熒光顯微鏡(Leica);紫外可見分光光度計(Beckman);電泳槽、轉印槽、凝膠成像系統和實時熒光定量PCR儀(Bio-Rad)。
4 主要方法
4.1 骨髓間充質干細胞的分離、培養 取3周齡SD雄性大鼠,頸椎脫臼法處死后迅速浸泡在75%乙醇中15 min,無菌條件下取出兩側后肢股骨和脛骨,除去骨干表面肌肉韌帶等組織,剪去兩側干骺端,用5 mL注射器吸取4 ℃預冷的DMEM/F12培養基沖洗骨髓腔,收集骨髓沖洗液,1 000 r/min離心10 min,棄上清液,用5 mL含10% 胎牛血清、1%雙抗的DMEM/F12培養基重懸細胞,接種于25 cm2的培養瓶,置于37 ℃、5% CO2、飽和濕度的培養箱內培養,48 h后首次更換培養基,待細胞生長至85%~90%時用0.05%胰酶和0.02% EDTA消化收集細胞,按1∶2比例傳代培養,待傳代至第3代時進行實驗。4.2 大鼠局灶性腦缺血模型的制備 取3~4月齡SD雄性大鼠,術前禁食12 h(不禁水),參照Longa等[8]建立大鼠大腦中動脈阻塞(middle cerebral artery occlusion,MCAO)模型。大鼠用10%水合氯醛(400 mg/kg)腹腔麻醉,分離右側頸總動脈、頸外動脈、頸內動脈,結扎并游離頸外動脈主干,在頸外動脈剪一小切口, 將頭端燒圓的3-0單股尼龍線從切口輕輕插入頸內動脈,當尼龍線插入距頸總動脈分叉約18~20 mm處有輕微阻力時,保持尼龍線位置。缺血90 min后將尼龍線拔出再灌注。假手術組,尼龍線只插入5 mm左右。術中光照維持大鼠肛溫在37 ℃左右,術后將大鼠置于恒溫箱中直至蘇醒。
4.3 動物分組及BMSCs移植 大鼠造模后24 h,除假手術組外,隨機分為模型組、BMSCs組、川芎嗪(40 mg/kg)組和聯合(川芎嗪+BMSCs)組。川芎嗪組和聯合組在缺血后2 h腹腔注射川芎嗪(40 mg/kg),每天1次,連續14 d。BMSCs組和聯合組于缺血后24 h經尾靜脈注射1 mL BMSCs(1×109/L),其它組經尾靜脈注射1 mL PBS,每組12只。
4.4 改良的神經損傷嚴重程度評分(modified neurological severity scoring,mNSS) 參照文獻[9]方法,在腦缺血后第1 、7 和14 天檢測。包括一系列的運動、感覺、平衡和反射試驗。神經功能評分的范圍為0~18分(正常為0分,最嚴重為18分)。
4.5 腦組織冰凍切片的制備 大鼠腦缺血后第14天行為學評價結束后,10%水合氯醛腹腔注射麻醉,然后用4℃預冷的0.9%生理鹽水快速進行心臟灌注,再經4%多聚甲醛灌注固定,斷頭取腦,4%多聚甲醛于4℃固定過夜,然后用30%蔗糖溶液脫水。從額極起將大鼠大腦切成6片冠狀切片,每片厚2 mm,然后分別作10 μm和20 μm的切片。
4.6 腦梗死體積的檢測 大鼠腦缺血后第14 天行為學評價結束后,20 μm的腦組織冰凍切片用1%甲苯胺藍染色。腦組織片拍攝圖像,用ImageJ軟件計算腦片梗死區域面積,將每一腦片的缺血面積乘以厚度(2 mm),再將各腦片數值相加,得到全腦梗死灶體積的近似值。
4.7 腦組織的病理學觀察 大鼠腦缺血后第14 天,10 μm的腦組織冰凍切片進行HE染色,冰凍切片先用甲醇固定,蘇木精染色5 min,1%的鹽酸乙醇分化數秒,水洗返藍,伊紅染色1 min,各步驟之間水洗,梯度乙醇脫水,二甲苯透明,中性樹膠封片,顯微鏡下觀察皮層和紋狀體缺血周邊區組織形態。
4.8 TUNEL法檢測細胞凋亡 大鼠腦缺血后第14 天,10 μm的腦組織冰凍切片,經4%多聚甲醛固定30 min后,0.1%檸檬酸鈉-0.1% Triton X-100冰上孵育2 min,3% H2O2-甲醇液孵育10 min,20 mg/L不含DNase I的蛋白酶K于37 ℃孵育20 min,TUNEL反應液37 ℃孵育60 min,封片,熒光顯微鏡下觀察。
4.9 實時熒光定量PCR檢測Bcl-2和Bax的mRNA表達 大鼠腦缺血后第14 天,取缺血周邊區腦組織,按TRIzol試劑盒說明書提取總RNA,逆轉錄成cDNA,qPCR反應總體積10 μL:上游和下游引物各0.2 μL,SYBR Premix Ex Taq Ⅱ(2×) 5 μL,cDNA 1 μL,ddH2O 3.6 μL。反應條件為95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,共40個循環;72 ℃ 5 min;60 ℃ 30 s,共71個循環。結果采用2-ΔΔCt分析相對表達量。4.10 Western blot法檢測Bcl-2和Bax的蛋白表達 大鼠腦缺血后第14 天,取100 mg缺血周邊區腦組織,按照總蛋白提取試劑盒方法提取總蛋白,BCA法測定總蛋白含量,取蛋白樣品進行凝膠電泳,轉膜,封閉,加入I抗(兔抗Bax和Bcl-2多克隆抗體1∶1 000,鼠抗β-actin單克隆抗體1∶1 500)孵育,靜置過夜,洗滌后加入II抗(山羊抗鼠II抗IgG 1∶5 000,山羊抗兔II抗IgG 1∶5 000),室溫孵育1 h,充分洗滌,置于ECL發光劑中,顯影,定影,凝膠圖像處理,采用Bandscan 5.0軟件分析條帶的吸光度值。
5 統計學處理
采用SPSS 17.0統計軟件進行統計學分析。數據用均數±標準差(mean±SD)表示,行為學評分采用非參數Mann-WhitneyU檢驗,其余均采用單因素方差分析(one-way ANOVA)進行比較,組間均數兩兩比較采用 Student-Newman-Keuls法,以P<0.05為差異有統計學意義。
結 果
1 川芎嗪聯合BMSCs移植對腦缺血大鼠神經功能的影響
腦缺血后第1 天,除假手術組外的各組大鼠都表現出嚴重的神經功能缺損。缺血后第7 天,與模型組比較,BMSCs組和聯合組mNSS評分顯著降低(P<0.01),但川芎嗪組差異不顯著;缺血后第14 天,與模型組比較,BMSCs組、川芎嗪組和聯合組mNSS評分顯著降低(P<0.01);與BMSCs組和川芎嗪組比較,缺血后第7 天和14 天,聯合組mNSS評分顯著降低(P<0.01),見圖1。

Figure 1.The effect of TMP combined with BMSCs on the levels of mNSS in the rats with cerebral ischemia. Mean±SD.n=12.**P<0.01vsmodel;##P<0.01vsTMP+BMSCs.
圖1 川芎嗪聯合BMSCs對腦缺血大鼠mNSS評分的影響
2 川芎嗪聯合BMSCs移植對腦缺血大鼠梗死體積的影響
腦缺血后第14 天,除假手術組外的各組大鼠腦組織均有梗死。與模型組比較,BMSCs組、川芎嗪組和聯合組大鼠大腦梗死體積都顯著減少(P<0.01)。與BMSCs組和川芎嗪組比較,聯合組大鼠大腦梗死體積顯著減少(P<0.05),見圖2。
3 川芎嗪聯合BMSCs移植對腦缺血大鼠腦組織病理學的影響
腦缺血后第14 天,假手術組神經細胞核仁大,胞質豐富;模型組大腦皮層和紋狀體缺血周邊區神經細胞稀疏,核固縮,核仁變小;與模型組比較,BMSCs、川芎嗪和聯合組均能減輕神經細胞損傷程度,其中聯合組效果最好,見圖3。
4 川芎嗪聯合BMSCs移植對大鼠腦缺血周邊區神經細胞凋亡的影響
腦缺血后第14 天,與模型組比較,BMSCs組、川芎嗪組和聯合組TUNEL陽性細胞顯著減少(P<0.01);與BMSCs組和川芎嗪組比較,聯合組TUNEL陽性細胞顯著減少(P<0.01),見圖4。
5 川芎嗪聯合BMSCs移植對Bcl-2和Bax mRNA表達的影響
腦缺血后第14 天,與模型組比較,BMSCs組和聯合組Bcl-2的mRNA表達顯著增加,Bax的mRNA表達顯著降低(P<0.01),川芎嗪組Bax的mRNA表達顯著降低(P<0.01),但Bcl-2的mRNA表達差異無統計學顯著性;與BMSCs組和川芎嗪組比較,聯合組Bcl-2的mRNA表達顯著增加,Bax的mRNA表達顯著降低(P<0.01),見表2。

Figure 2. The effect of TMP combined with BMSCs on the infarct volume of brain in the rats with cerebral ischemia. Mean±SD.n=6.**P<0.01vsmodel;#P<0.05vsTMP+BMSCs.
圖2 川芎嗪聯合BMSCs對腦缺血大鼠腦梗死體積的影響
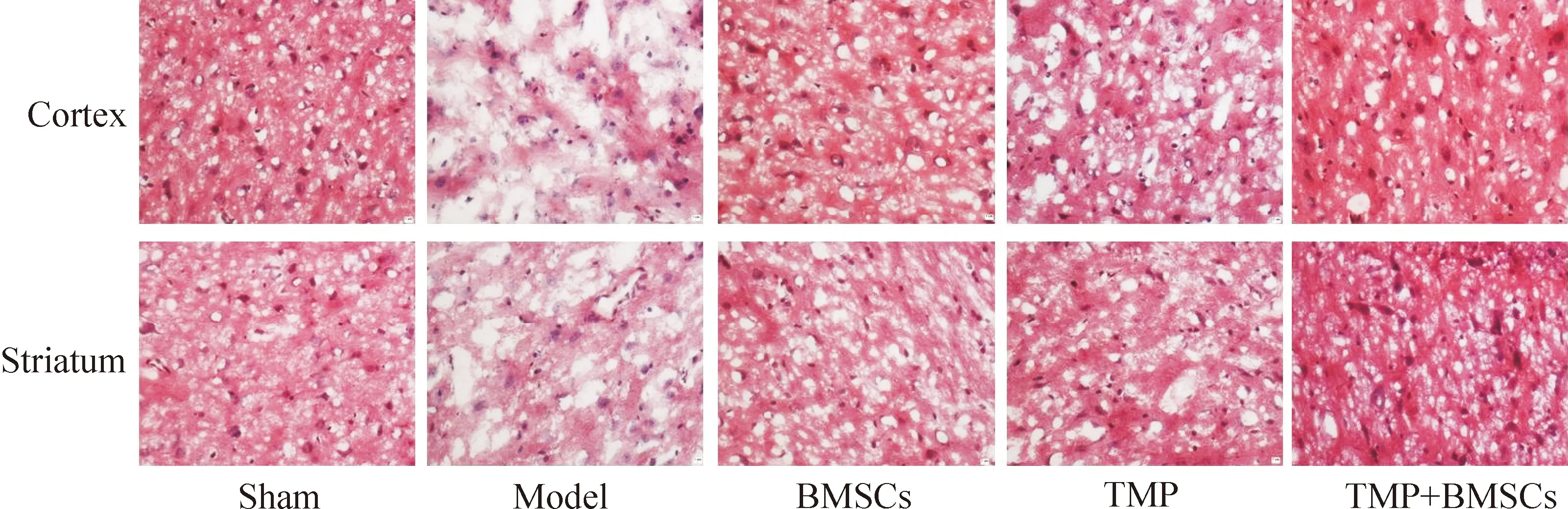
Figure 3. The effect of TMP combined with BMSCs on the pathological changes of brain in the rats with cerebral ischemia (HE staining, ×400).
圖3 川芎嗪聯合BMSCs移植對腦缺血大鼠腦組織病理學的影響
6 川芎嗪聯合BMSCs移植對Bcl-2和Bax蛋白表達的影響
缺血后第14 天,與模型組比較,BMSCs組、川芎嗪組和聯合組Bcl-2蛋白表達顯著增加,Bax蛋白表達顯著降低(P<0.01);與BMSCs組和川芎嗪組比較,聯合組Bcl-2蛋白表達顯著增加,Bax蛋白表達顯著降低(P<0.01),見圖5、表3。
討 論
腦缺血引起神經細胞死亡包括壞死和凋亡兩種形式,缺血核心區內神經元迅速缺血壞死,而缺血周邊區神經細胞主要表現為凋亡,經歷數小時至數天,抑制神經細胞凋亡有助于促進神經功能恢復[10]。本研究發現,川芎嗪聯合BMSCs移植顯著改善腦缺血后神經功能,抑制缺血周邊區神經細胞凋亡,上調Bcl-2表達,抑制Bax表達。

Figure 4. The effect of TMP combined with BMSCs on the neuronal apoptosis (TUNEL staining, ×400). Mean±SD.n=6.**P<0.01vsmodel;##P<0.01vsTMP+BMSCs.
圖4 川芎嗪聯合BMSCs對神經細胞凋亡的影響
表2 川芎嗪聯合BMSCs對腦缺血大鼠Bcl-2和Bax mRNA表達的影響
Table 2. The effect of TMP combined with BMSCs on the mRNA expression of Bcl-2 and Bax in the rats with cerebral ischemia (Mean±SD.n=5)

**P<0.01 vs model; ##P<0.01 vs TMP+BMSCs.
盡管國內外研究證明了BMSCs移植治療腦缺血的安全性和有效性[3, 11],但還有很多問題亟待解決,特別是BMSCs向缺血損傷區遷移率和植入后存活率低是限制其療效的主要原因[12]。近年來文獻報道,采用藥物聯合BMSCs移植可促進BMSCs向缺血損傷區遷移和存活,從而顯著提高BMSCs對腦缺血的治療效果[13]。最近國內研究報道,采用中藥或有效成分聯合BMSCs移植能顯著提高腦缺血的治療效果[7],如補陽還五湯和人參皂苷Rg1聯合BMSCs移植治療腦缺血均有顯著效果[14-15]。川芎是傳統的活血化瘀中藥,也是中醫治療缺血性腦血管病的常用中藥。川芎嗪是川芎的主要有效成分,具有擴血管、抗炎、抗氧化和抗凋亡等多種藥理作用[6]。本研究發現,與川芎嗪和BMSCs比較,兩者聯合治療顯著促進腦缺血后神經功能恢復,減少梗死體積,改善腦組織病理性損傷,這為川芎嗪聯合BMSCs治療缺血性腦血管病提供了實驗依據。
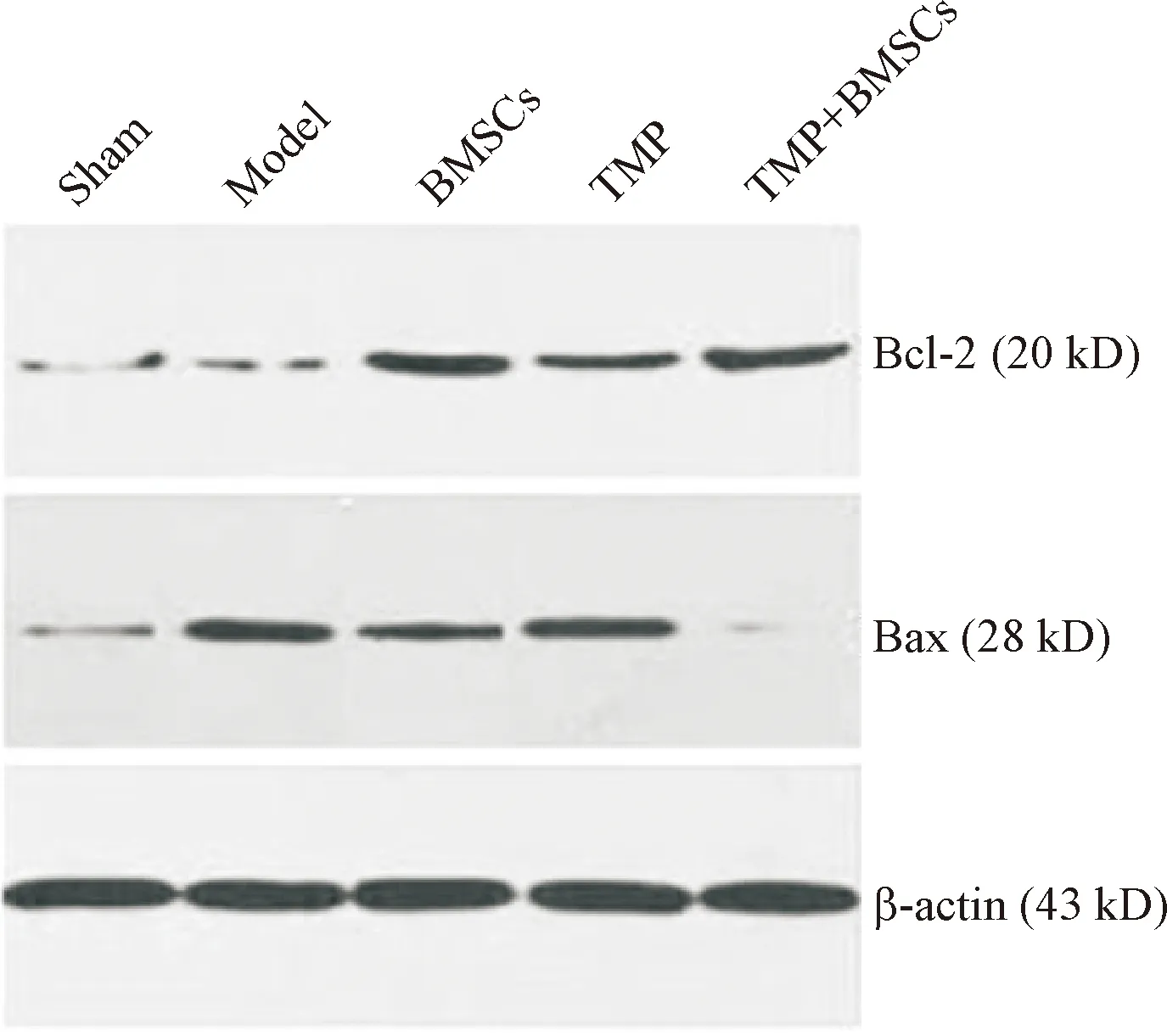
Figure 5.The effect of TMP combined with BMSCs on Bcl-2 and Bax protein expression determined by Western blot.
圖5 川芎嗪聯合BMSCs對Bcl-2和Bax蛋白表達的影響
表3 川芎嗪聯合BMSCs對腦缺血大鼠Bcl-2和Bax蛋白表達的影響
Table 3.The effect of TMP combined with BMSCs on the protein expression of Bcl-2 and Bax in the rats with cerebral ischemia (Mean±SD.n=6)

**P<0.01 vs model; ##P<0.01 vs TMP+BMSCs.
BMSCs移植治療腦缺血的作用機制非常復雜,除了分化替代和旁分泌作用參與神經修復外,還能抑制缺血周邊區神經細胞凋亡[5]。細胞凋亡受特定的基因調控,其中Bcl-2家族在細胞凋亡中發揮重要作用。Bcl-2是一種凋亡抑制蛋白,Bax可對抗Bcl-2,促進細胞凋亡,Bcl-2/Bax比值決定細胞受到凋亡信號刺激后是存活還是凋亡[16]。腦缺血后Bcl-2表達下降和Bax表達增加促進神經細胞凋亡,上調Bcl-2表達或Bcl-2/Bax比值可抑制神經細胞凋亡[4]。有研究報道,奧拉西坦聯合BMSCs較兩者單用能顯著減少腦缺血后神經細胞凋亡,上調Bcl-2表達[17]。本研究結果發現,BMSCs和川芎嗪均能上調腦缺血大鼠Bcl-2表達和下調Bax的表達,減少神經細胞凋亡,但川芎嗪和BMSCs的聯合應用能夠顯著減少神經細胞的凋亡,上調腦缺血后大鼠Bcl-2和下調Bax mRNA和蛋白的表達,其作用效果顯著優于BMSCs和川芎嗪的單獨治療組。
綜上所述,川芎嗪聯合BMSCs移植能促進腦缺血后大鼠的神經功能恢復,減少梗死體積,減輕腦組織缺血性損傷,抑制神經元細胞凋亡,其機制可能與調控Bcl-2、Bax的表達有關。
[1] Tekle WG, Chaudhry SA, Fatima Z, et al. Intravenous thrombolysis in expanded time window (3-4.5 hours) in general practice with concurrent availability of endovascular treatment[J]. J Vasc Interv Neurol, 2012, 5(1):22-27.
[2] Liu X, Ye R, Yan T, et al. Cell based therapies for ischemic stroke: from basic science to bedside[J]. Prog Neurobiol, 2014, 115:92-115.
[3] Bang OY, Lee JS, Lee PH, et al. Autologous mesenchymal stem cell transplantation in stroke patients[J]. Ann Neurol, 2005, 57(6):874-882.
[4] Love S. Apoptosis and brain ischaemia[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2003, 27(2):267-282.
[5] Chen JL, Li Y, Katakowski M, et al. Intravenous bone marrow stromal cell therapy reduces apoptosis and promotes endogenous cell proliferation after stroke in female rat[J]. J Neurosci Res, 2003, 73(6):778-786.
[6] Gao HJ, Liu PF, Li PW, et al. Ligustrazine monomer against cerebral ischemia/reperfusion injury[J]. Neural Regen Res, 2015, 10(5):832-840.
[7] Zhang Q, Zhao YH. Therapeutic angiogenesis after ischemic stroke: Chinese medicines, bone marrow stromal cells (BMSCs) and their combinational treatment[J]. Am J Chin Med, 2014, 42(1):61-77.
[8] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1):84-91.
[9] Chen JL, Sanberg PR, Li Y, et al. Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J]. Stroke, 2001, 32(11):2682-2688.
[10]Martin LJ. Neuronal cell death in nervous system development disease and injury (Review)[J]. Int J Mol Med, 2001, 7(5):455-478.
[11]Lee JS, Hong JM, Moon GJ, et al. A long-term follow-up study of intravenous autologous mesenchymal stem cell transplantation in patients with ischemic stroke[J]. Stem Cells, 2010, 28(6):1099-1106.
[12]Borlongan CV, Glover LE, Tajiri N, et al. The great migration of bone marrow-derived stem cells toward the ischemic brain: therapeutic implications for stroke and other neurological disorders[J]. Prog Neurobiol, 2011, 95(2):213-228.
[13]Cui X, Chopp M, Zacharek A, et al. Chemokine, vascular and therapeutic effects of combination simvastatin and BMSC treatment of stroke[J]. Neurobiol Dis, 2009, 36(1):35-41.
[14]Yang JH, Gao F, Zhang YK, et al. Buyang huanwu decoction (BYHWD) enhances angiogenic effect of mesenchymal stem cell by upregulating VEGF expression after focal cerebral ischemia[J]. J Mol Neurosci, 2015, 56(4):898-906.
[15]Bao CF, Wang Y, Min HM, et al. Combination of ginsenoside Rg1 and bone marrow mesenchymal stem cell transplantation in the treatment of cerebral ischemia reperfusion injury in rats[J]. Cell Physiol Biochem, 2015, 37(3):901-910.
[16]Hara A, Iwai T, Niwa M, et al. Immunohistochemical detection of Bax and Bcl-2 proteins in gerbil hippocampus following transient forebrain ischemia[J]. Brain Res, 1996, 711(1-2):249-253.
[17]Wang CY, Li FQ, Guan Y, et al. Bone marrow stromal cells combined with oxiracetam influences the expression of B-cell lymphoma 2 in rats with ischemic stroke[J]. J Stroke Cerebrovasc Dis, 2014, 23(10):2591-2597.
(責任編輯: 陳妙玲, 羅 森)
Tetramethylpyrazine combined with bone marrow mesenchymal stem cell transplantation inhibits neuronal apoptosis in rats with cerebral ischemia
DING Wen-qian1, LI Lin2, CHU Li-sheng2, REN Cui-cui1, FANG Yan2, YANG Yan2
(1CollegeofPharmacy,2CollegeofBasicMedicalSciences,ZhejiangChineseMedicalUniversity,Hangzhou310053,China.E-mail:chulisheng@21cn.com)
AIM: To investigate the effects of tetramethylpyrazine (TMP) combined with bone marrow mesenchymal stem cells (BMSCs) on neuronal apoptosis, and Bcl-2 and Bax expression in rats with cerebral ischemia. METHODS: The BMSCs were isolated by the whole bone marrow adherent method and cultured, and those in the 3rd passage were used for tail-vein transplantation. The rats were subjected to right middle cerebral artery occlusion (MCAO) using suture method, and the rats except sham group were randomly divided into model group, BMSCs (1×109cells/L) group, TMP (40 mg/kg) group and combination (TMP+BMSCs) group with 12 rats in each group. Neurological function was evaluated by modified neurological severity scoring (mNSS) on 1 d, 7 d and 14 d after cerebral ischemia. Toluidine blue staining was performed to detect cerebral infarct volume, HE staining was used to observe brain histopathological change, neuronal apoptosis was observed by TUNEL staining, and the mRNA and protein expression of Bcl-2 and Bax was detected by real-time fluorescence quantitative PCR and Western blot at 14 d after cerebral ischemia. RESULTS: Compared with BMSCs group and TMP group, TMP combined with BMSCs significantly reduced the score of mNSS (P<0.01) and the infarct volume (P<0.01), alleviated the pathological damage in the peripheral area of cerebral ischemia, decreased the number of TUNEL positive cells (P<0.01), increased the expression of Bcl-2 and decreased the expression of Bax at mRNA and protein levels (P<0.01). CONCLUSION: Tetramethylpyrazine combined with transplantation of BMSCs improves the functional recovery, reduces the infarct volume, relieves the ischemic injury of the brain tissue, and attenuates neuronal apoptosis in the rats with cerebral ischemia. The mechanism may be related to regulating the expression of Bcl-2 and Bax.
Tetramethylpyrazine; Bone marrow mesenchymal stem cells; Cerebral ischemia; Apoptosis
1000- 4718(2016)11- 1984- 06
2016- 04- 19
2016- 08- 26
國家自然科學基金資助項目(No. 81274113);浙江省公益技術應用研究計劃(No. 2016C33185);浙江省教育廳科研項目(No. Z201016310)
R363
A
10.3969/j.issn.1000- 4718.2016.11.011
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 0571-86633149; E-mail: chulisheng@21cn.com

