ATP介導(dǎo)的嘌呤能信號在阿爾茨海默病相關(guān)結(jié)腸運動障礙中的作用*
林旭紅, 王慧超, 郭俊玲, 房曉鵬, 張俊士, 郭俊楠, 李玉霞, 楊瑞林, 李鐵軍, 劉建林
(河南大學(xué) 1淮河醫(yī)院檢驗科,轉(zhuǎn)化醫(yī)學(xué)中心, 2第一附屬醫(yī)院腎內(nèi)科,3淮河醫(yī)院心內(nèi)科, 4醫(yī)學(xué)院, 5淮河醫(yī)院神經(jīng)內(nèi)科,河南 開封 475000)
·論 著·
ATP介導(dǎo)的嘌呤能信號在阿爾茨海默病相關(guān)結(jié)腸運動障礙中的作用*
林旭紅1, 王慧超2△, 郭俊玲3,4, 房曉鵬1, 張俊士5, 郭俊楠5, 李玉霞1, 楊瑞林1, 李鐵軍2, 劉建林2
(河南大學(xué)1淮河醫(yī)院檢驗科,轉(zhuǎn)化醫(yī)學(xué)中心,2第一附屬醫(yī)院腎內(nèi)科,3淮河醫(yī)院心內(nèi)科,4醫(yī)學(xué)院,5淮河醫(yī)院神經(jīng)內(nèi)科,河南 開封 475000)
目的: 探討ATP介導(dǎo)的嘌呤能信號在阿爾茨海默病(Alzheimer’s disease,AD)相關(guān)結(jié)腸運動障礙中的作用及其相關(guān)的分子機制。方法:(1)臨床試驗:收集我院20例AD患者進行研究,放射免疫法測定血漿中胃動素(motilin,MTL)、膽囊收縮素(cholecystokinin,CCK)、血管活性腸肽(vasoactive intestinal peptide,VIP)和一氧化氮(nitric oxide,NO)水平;高效液相色譜法(high-performance liquid chromatography,HPLC)檢測血漿三磷酸腺苷(adenosine triphosphate,ATP)水平,同時對患者進行神經(jīng)心理學(xué)檢查并積分。(2)動物實驗:利用AD小鼠進行Morris水迷宮實驗,評估空間學(xué)習(xí)記憶功能;放射免疫法測定血漿中MTL、CCK、VIP和NO水平,HPLC法檢測血漿ATP水平;免疫組織化學(xué)法檢測乙酰膽堿轉(zhuǎn)移酶(choline acetyltransferase,ChAT)、VIP、一氧化氮合酶(nitric oxide synthase,NOS)和ATP合酶的變化;Western blot和免疫組化法檢測P2Y受體表達水平的變化。(3)離體實驗:離體器官浴槽系統(tǒng)觀察P2Y受體激動劑α,β-亞甲基ATP(α,β-methylene ATP, α,β-MeATP)對自發(fā)性及電刺激誘導(dǎo)的結(jié)腸平滑肌收縮的影響,細(xì)胞內(nèi)微電極技術(shù)觀察α,β-MeATP對結(jié)腸平滑肌細(xì)胞膜電位的影響。結(jié)果:與對照組比較,AD患者血漿的MTL和CCK水平明顯降低(P<0.01),NO和ATP水平顯著升高(P<0.05或P<0.01),VIP無明顯變化。患者簡明精神狀態(tài)檢查積分(MMSE)降低(P<0.05),AD評定量表-認(rèn)知分量表(ADAS-Cog)積分、神經(jīng)精神問卷(NPI)積分和AD協(xié)作研究日常能力量表(ADCS-ADL)積分均明顯高于對照組(P<0.01)。AD小鼠4~6 d逃逸潛伏期明顯延長(P<0.05),空間探索能力明顯降低(P<0.05),AD小鼠血漿中MTL和CCK水平明顯降低(P<0.01),NO和ATP水平顯著升高(P<0.05或P<0.01),VIP無明顯變化,AD小鼠結(jié)腸表達ATP合酶的水平明顯上調(diào)(P<0.05),但ChAT、VIP和NOS無明顯改變,同時P2Y受體表達水平升高(P<0.01)。體外實驗表明,α,β-MeATP呈濃度依賴性抑制對照組和AD組小鼠結(jié)腸平滑肌自發(fā)性收縮(P<0.05或P<0.01),且這種抑制作用可被Na+通道阻斷劑河豚毒素(tetrodotoxin,TTX)逆轉(zhuǎn)(P<0.05或P<0.01),α,β-MeATP在100 μmol/L時對AD小鼠自發(fā)性收縮的抑制作用更明顯(P<0.05),AD小鼠與正常小鼠比較,TTX對100 μmol/L的α,β-MeATP的拮抗作用差異也有統(tǒng)計學(xué)顯著性(P<0.05)。在10 Hz電刺激誘導(dǎo)的結(jié)腸平滑肌收縮中,α,β-MeATP抑制正常小鼠和AD組小鼠的收縮(P<0.05或P<0.01),且40 μmol/L和100 μmol/L時對AD小鼠的抑制作用比正常小鼠明顯(P<0.05或P<0.01)。平滑肌細(xì)胞膜電位實驗顯示,α,β-MeATP不影響結(jié)腸平滑肌膜電位(P>0.05)。結(jié)論:AD患者和AD小鼠血漿中促進胃腸運動的激素MTL和CCK水平降低,抑制胃腸運動的激素NO水平升高,胃腸總體運動功能被抑制;AD小鼠血漿ATP水平升高,同時ATP嘌呤能神經(jīng)元增加,P2Y受體表達上調(diào);在AD發(fā)病中,ATP介導(dǎo)的嘌呤能信號可能通過抑制結(jié)腸平滑肌收縮,從而導(dǎo)致結(jié)腸運動功能障礙。
P2Y受體; 阿爾茨海默病; 腸神經(jīng)系統(tǒng); 結(jié)腸運動障礙
阿爾茨海默病(Alzheimer’s disease,AD)又稱早老性癡呆,是典型的神經(jīng)退行性疾病,以進展性腦部神經(jīng)丟失為特征,伴隨細(xì)胞外淀粉樣肽斑塊等明顯病理改變,最終導(dǎo)致嚴(yán)重的認(rèn)知缺陷和記憶減退,并呈進行性加重[1]。隨著人口老齡化進程加快,AD患者越來越多,不但影響人們生活質(zhì)量,威脅人類晚年健康,而且將成為嚴(yán)重危害人類生活和阻礙社會發(fā)展的重大問題。
目前臨床尚無可靠的指標(biāo)早期確診AD,只能在認(rèn)知缺陷發(fā)生后進行AD的可靠診斷,而臨床癥狀出現(xiàn)后,組織改變和丟失已經(jīng)非常嚴(yán)重,以至于不能逆轉(zhuǎn),這是導(dǎo)致患者不能順利進行早期治療的關(guān)鍵,也是臨床所有AD的治療僅能減輕癥狀,而不能阻斷疾病進展的主要瓶頸[2]。因此尋找盡早診斷AD的敏感度高、特異性強的方法,增加治療效應(yīng)的機會,成為AD研究領(lǐng)域亟待解決的問題[3]。
腸神經(jīng)系統(tǒng)(enteric nervous system,ENS)是獨立于大腦之外的外周神經(jīng)系統(tǒng)的最大部分,包括上百萬感覺、中間和運動神經(jīng)元,有與腦組織相同的疾病相關(guān)性,促進整個胃腸道活動,且ENS容易通過抽吸等方式進行活檢,因此是傳遞神經(jīng)系統(tǒng)真實狀態(tài)有價值信息[4]的部位。目前已在帕金森病(Parkinson’s disease,PD)及其模型中發(fā)現(xiàn)ENS的改變,如過表達synuclein[4]、多巴胺分布的丟失[5]、胃腸道運動功能性缺陷[6-7]等。Sprenger等[8]比較了正常人、PD、PD前驅(qū)期特發(fā)性快速眼動睡眠行為障礙(idiopathic REM sleep behavior disorder,iRBD)等人群結(jié)腸組織synuclein免疫染色,發(fā)現(xiàn)在3組都有表達,而p-synuclein僅在iRBD組表達,提出p-synuclein可能是高危人群PD前驅(qū)期合適的組織標(biāo)志物。作為腸運動功能的指揮者,ENS在AD小鼠淀粉樣前體蛋白表達早期發(fā)生中也經(jīng)歷明顯的變化,且變化早于腦組織變化[9]。這些研究提示ENS有望成為AD早期組織學(xué)診斷的替代指標(biāo)。ENS內(nèi)神經(jīng)元可通過分泌興奮性神經(jīng)遞質(zhì)如P物質(zhì)(substance P,SP)、乙酰膽堿(acetylcholine,ACh)和5-羥色胺(5-hydroxytryptamine或serotonin,5-HT),以及抑制性神經(jīng)遞質(zhì)如一氧化氮(nitric oxide,NO)、血管活性腸肽(vasoactive intestinal peptide,VIP)和三磷酸腺苷(adenosine triphosphate,ATP),調(diào)節(jié)腸道功能。根據(jù)遞質(zhì)的不同,神經(jīng)元可分為膽堿能神經(jīng)元、腎上腺素能神經(jīng)元、NO及VIP抑制性非腎上腺能非膽堿能神經(jīng)元和ATP介導(dǎo)的嘌呤能神經(jīng)元等,近年來,對ENS中研究最多的抑制性神經(jīng)遞質(zhì)是VIP和NO,而對于ATP的研究很少[10-11]。
ATP的功能并不局限于單一的能量單位,還可以作為一個信號分子參與細(xì)胞之間的交流,同時被釋放的ATP能夠行使神經(jīng)遞質(zhì)和神經(jīng)調(diào)質(zhì)的作用,參與細(xì)胞的增殖、分化、遷移和凋亡等。ATP在細(xì)胞上的生物學(xué)作用主要是由細(xì)胞膜上的嘌呤能P2受體來介導(dǎo)的[12]。嘌呤能P2受體家族分為離子通道P2X受體和G蛋白偶聯(lián)的促代謝型P2Y受體。有研究表明,ATP可能是通過P2X或P2Y嘌呤能受體,激活細(xì)胞內(nèi)某些信號傳導(dǎo)進而影響成纖維細(xì)胞增殖[13];敲除P2Y1受體,小鼠胃、盲腸和結(jié)腸均缺乏嘌呤能神經(jīng)肌肉轉(zhuǎn)運[14-15];大鼠結(jié)腸中,抑制性神經(jīng)肌肉轉(zhuǎn)運也由P2Y1受體介導(dǎo)[16]。但是AD患者胃腸道功能變化過程中嘌呤能信號的變化及機制,目前未見相關(guān)報道。本文通過臨床試驗、動物實驗及體外組織實驗重點探討ATP介導(dǎo)的嘌呤能信號在AD患者結(jié)腸運動障礙中的作用及機制。
材 料 和 方 法
1 AD患者收集及臨床信息采集
根據(jù)2011年美國國立老化研究所和阿爾茨海默病協(xié)會修訂的標(biāo)準(zhǔn),收集我院可能的20例AD患者,男性13例,女性7例,平均年齡(67.65±1.93)歲,并選擇20例健康人作為對照。AD的納入標(biāo)準(zhǔn):(1)有認(rèn)知損害病史如失語或者情緒障礙等;(2)表現(xiàn)為學(xué)習(xí)和(或)記憶下降;(3)存在視空間或執(zhí)行功能的損害等;(4)進行正規(guī)神經(jīng)心理學(xué)測驗提示AD;(5)影像學(xué)檢查符合AD的相關(guān)改變。同時排除以下情況:(1)既往卒中史、存在多發(fā)或廣泛腦梗死或存在嚴(yán)重的白質(zhì)病變等;(2)有路易體癡呆的顯著特征;(3)有額顳葉癡呆的核心癥狀;(4)有原發(fā)性進行失語的表現(xiàn);(5)有其它引起進行性記憶和認(rèn)知功能損害的相關(guān)疾病;(6)既往過量或濫用藥物病史。
2 動物及分組
6~8月齡C57 BL/6J小鼠(雌雄各半)16只,購自河南大學(xué)實驗動物中心,AD轉(zhuǎn)基因小鼠模型即APP/PS1 基因突變小鼠購自南京大學(xué)模式動物研究所(由JAX 實驗室引進),實驗前禁食不禁水12 h。所有操作程序均獲得河南大學(xué)醫(yī)學(xué)倫理委員會批準(zhǔn)。
3 實驗方法
3.1 放射免疫測定血漿中胃動素(motilin,MTL)、膽囊收縮素(cholecystokinin,CCK)、VIP和NO水平 按照試劑盒操作說明,用放射免疫法分別檢測各組標(biāo)本血漿MTL、CCK、VIP和NO水平。
3.2 HPLC法檢測血漿ATP水平 參照Sperlagh等[17]的方法設(shè)置參數(shù),流動相為磷酸鹽緩沖液(100 mmol/L K2HPO4),采用等度洗脫,色譜柱用Eclipse XDB-C18柱,流速為每分鐘0.6 mL,進樣量10 μL,254 nm檢測。血漿加入等比例7% HClO4,經(jīng)離心留取上清,用 10% KOH中和至pH 7.0,離心后直接上柱分析。同時做標(biāo)準(zhǔn)曲線,測定峰面積,計算樣品濃度。
3.3 神經(jīng)心理學(xué)檢查 采用簡明精神狀態(tài)檢查(Mini-Mental State Examination,MMSE)、阿爾茨海默病評定量表認(rèn)知分量表 (Alzheimer’s Disease Assessment Scale-Cognitive Subscale,ADAS-Cog)、 神經(jīng)精神問卷(Neuropsychiatric Inventory,NPI)、阿爾茨海默病協(xié)作研究日常能力量表(Alzheimer’s Disease Cooperative Study-Activities of Daily Living Scale, ADCS-ADL)等對患者進行神經(jīng)心理學(xué)檢查并積分。MMSE包括定向力、記憶力、注意及計算力、回憶和語言5個方面的檢測,主要評估患者的認(rèn)知功能, 評分從0分到30分,得分越高說明認(rèn)知功能越好。ADAS-Cog可有效評估患者的認(rèn)知功能,主要包括詞語回憶、物品及手指命名、指令、結(jié)構(gòu)性運用、觀念性運用、定向力、言語能力、語言理解、找詞困難、記憶再現(xiàn)11項,滿分70分,得分越低說明認(rèn)知功能越好。NPI主要評價患者的精神行為癥狀,得分越低精神行為癥狀越好。ADCS-ADL評價患者日常生活能力和社會功能,得分越低說明生活能力越好。
3.4 AD轉(zhuǎn)基因小鼠模型的建立 購自南京大學(xué)模式動物研究所的APP/PS1雙轉(zhuǎn)基因突變小鼠,取其下一代,同C57BL/6J小鼠雜交,經(jīng)過PCR方法鑒定,得到具有C57BL/6J 背景的APP/PS1轉(zhuǎn)基因模型小鼠,選擇6~8月齡16只,雌雄各半進行實驗。
3.5 Morris水迷宮實驗 參照Wang等[18]的方法,進行Morris水迷宮(水池直徑100 cm,高50 cm;平臺直徑5 cm,高25 cm)實驗,定位航行實驗記錄小鼠的逃逸潛伏期(從實驗開始到小鼠找到平臺并在平臺上停留時間達到3 s的這段時間),每只小鼠每天進行4 次實驗,每次間隔大于30 min,連續(xù)6 d進行定位航行實驗;第7天進行空間探索實驗(撤去平臺),即將小鼠置于同樣的起始點,檢測小鼠在60 s內(nèi)穿越平臺位置的次數(shù)及在目標(biāo)象限(平臺所在象限位置)停留的時間,用來檢測小鼠的記憶能力改變情況。
3.6 免疫組織化學(xué)法觀察結(jié)腸乙酰膽堿轉(zhuǎn)移酶(choline acetyltransferase,ChAT)、VIP、一氧化氮合酶(nitric oxide synthase,NOS)、ATP合酶和P2Y受體的表達及分布 參照Li等[19]的方法,即切片脫蠟至水化,3% H2O2阻斷內(nèi)源性過氧化物酶,微波修復(fù)抗原后,分別與抗ChAT、VIP、NOS、ATP合酶和P2Y受體的 I 抗4 ℃孵育過夜,滴加 II 抗及辣根酶標(biāo)記鏈霉卵白素工作液,DAB顯色,棕褐色反應(yīng)產(chǎn)物代表抗原定位。
3.7 Western blot法檢測P2Y的表達 參照Li 等[20]的方法制備蛋白樣品,運用BCA蛋白定量法測定蛋白質(zhì)濃度, SDS-PAGE分離蛋白后轉(zhuǎn)膜,用5%牛奶封閉;經(jīng)抗體雜交,4 ℃過夜,II 抗37 ℃ 1 h,ECL發(fā)光液處理,曝片。內(nèi)參照用β-actin。目的條帶運用軟件ImageJ分析蛋白條帶灰度值,目的蛋白的相對表達量用目的條帶的灰度值與β-actin條帶灰度值的比值表示。
3.8 體外器官浴槽觀察α,β-亞甲基ATP(α,β-methylene ATP, α,β-MeATP)對自發(fā)性結(jié)腸平滑肌收縮的影響及Na+通道阻斷劑河豚毒素(tetrodotoxin,TTX)對其的效應(yīng) 實驗操作前小鼠禁食12 h,脫頸椎處死,迅速取出近端結(jié)腸,置體視顯微鏡下,剝離結(jié)腸肌條[21]。預(yù)收縮后進行標(biāo)本穩(wěn)定,然后開始實驗。
待肌條自發(fā)收縮活動平穩(wěn)后,向浴槽內(nèi)分別加入 5、10、20、40和100 μmol/L α,β-MeATP,作用20 min,觀察肌條收縮情況的變化。選擇合適的α, β-MeATP濃度組別,分別加入0.2 μmol/L TTX觀察其對α, β-MeATP的效應(yīng)。實驗結(jié)束時,選擇反應(yīng)良好的肌條 (用10-4mol/L ACh檢測)進行統(tǒng)計。加藥前5 min作對照,加藥后15~20 min內(nèi)平滑肌收縮活動(SMUP-E4生物電信號處理系統(tǒng)記錄)平均振幅的變化作為加藥組的結(jié)果。
3.9 體外器官浴槽觀察α,β-MeATP對電刺激誘導(dǎo)的結(jié)腸平滑肌收縮的影響 結(jié)腸肌條制備同上,電刺激誘導(dǎo)結(jié)腸平滑肌收縮實驗參照林旭紅等[22]的方法,向浴槽內(nèi)分別加入 5、10、20、40和100 μmol/L α,β-MeATP,平滑肌收縮變化用Spike 軟件記錄連續(xù)3次電刺激誘導(dǎo)收縮的均值,結(jié)果表示為加藥后15~20 min內(nèi)平滑肌收縮活動平均振幅的變化。
3.10 細(xì)胞內(nèi)微電極技術(shù)觀察α,β-MeATP對各組結(jié)腸平滑肌膜電位(membrane potential,Em)的影響 同上方法在體視顯微鏡下制備結(jié)腸平滑肌肌條,將肌條環(huán)形肌面朝上固定于硅膠板上,置于組織浴槽底部(寬8 mm,深8 mm,長20 mm), 在37 ℃充以氧氣和二氧化碳的Kreb’s液中孵育,以2 mL/min的速度持續(xù)灌流,穩(wěn)定2 h。根據(jù)課題組既往采用傳統(tǒng)的細(xì)胞內(nèi)微電極技術(shù)法記錄平滑肌細(xì)胞細(xì)胞內(nèi)Em[22]。獲得小鼠結(jié)腸平滑肌細(xì)胞基礎(chǔ)Em活動后,在灌流液中加入5、10、20、40和100 μmol/L α,β-MeATP,觀測其對Em活動的影響。
4 統(tǒng)計學(xué)處理
應(yīng)用SPSS 13.0 統(tǒng)計分析軟件,各組數(shù)據(jù)以均數(shù)±標(biāo)準(zhǔn)誤(mean±SEM)表示,采用獨立樣本t檢驗和單因素方差分析的方法進行統(tǒng)計學(xué)分析,單因素方差分析后的兩兩比較采用SNK-q檢驗,以P<0.05為差異有統(tǒng)計學(xué)意義。
結(jié) 果
1 AD患者血漿MTL、CCK、VIP、NO和ATP水平
如圖1所示,正常對照組血漿MTL、CCK、VIP、NO和ATP水平分別為(329.07±59.60) ng/L、(5.66±1.02) pmol/L、(22.39±5.83) ng/L、(25.01±3.93) μmol/L和(0.51±0.18) mmol/L,AD患者分別降低至(101.62±28.97) ng/L和(1.21±0.37) pmol/L,升高至(28.61±7.36) ng/L、(47.62±8.29) μmol/L和(5.23±1.32) mmol/L,與對照組比較,除VIP外,其它各項差異均具有統(tǒng)計學(xué)顯著性(P<0.05或P<0.01)。
2 AD患者神經(jīng)心理學(xué)檢查的變化
對照組的MMSE、ADAS-Cog、NPI和ADL評分分別為27.40±10.50、13.10±3.50、6.80±1.30和5.40±1.40,AD患者分別為18.60±7.90、51.30±16.80、26.70±12.10和28.60±12.90,與對照組比較,差異均有統(tǒng)計學(xué)顯著性(P<0.05或P<0.01),見表1。

Figure 1.The plasma levels of motilin, CCK, VIP, NO and ATP in the patients with AD measured by radioimmunoassay. Mean±SEM.n=20.*P<0.05,**P<0.01vscontrol group.
圖1 AD患者血漿motilin、CCK、VIP、NO和ATP水平的變化

表1 各組MMSE、ADAS-Cog、NPI和ADCS-ADL評分情況的比較
*P<0.05,**P<0.01vscontrol.
3 各組小鼠學(xué)習(xí)記憶力的變化
為了觀察各組小鼠認(rèn)知能力的情況,我們進行了Morris 水迷宮實驗,結(jié)果如圖2所示,經(jīng)過前5天的學(xué)習(xí),觀察第6天水迷宮軌跡圖發(fā)現(xiàn),正常對照組小鼠找到平臺的路程最短,AD組探尋平臺的軌跡復(fù)雜化;在前6天的定位航行試驗中,前3天的定位航行實驗各組小鼠逃逸潛伏期比較長且差異沒有統(tǒng)計學(xué)顯著性。從第4天起,AD 組比正常對照組小鼠用時延長(P<0.05);比較撤去平臺觀察各組小鼠第7天的空間探索能力發(fā)現(xiàn),AD組比對照組小鼠游經(jīng)原平臺所在象限的次數(shù)減少,其差異有統(tǒng)計學(xué)意義(P<0.05)。
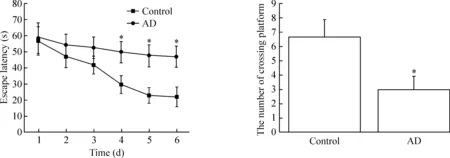
Figure 2.The changes of learning and memory ability in the AD mice. The escape latency and the number of crossing platform were tested by Morris maze experiment in water. The escape latency was estimated by the time since the mice into water to finding the platform and stopping there over 3 s. The experiment was taken for 6 d. In the first 3 d, the time between control group and AD group had no difference. After 4 d, the escape latency of the AD mice was longer than that in the normal mice. On the 7th day, crossing platform experiment was taken, and the number of the AD mice was significantly less than that of the normal mice. The AD mice wereAPP/PS1 mutant mice aged 6~8 months. Mean±SEM.n=16.*P<0.05vscontrol group.
圖2 AD小鼠學(xué)習(xí)和記憶能力的變化
4 各組小鼠血漿MTL、CCK、VIP、NO和ATP水平的變化
正常小鼠血漿的MTL、CCK、VIP、NO和ATP水平分別為(196.05±63.60) ng/L、(3.18±0.92) pmol/L、(15.21±5.79) ng/L、(18.03±4.62) μmol/L和(0.29±0.20) mmol/L,AD小鼠分別降低至(91.65±34.93) ng/L、(0.21±0.08) pmol/L和(13.66±7.28) ng/L,升高至(35.74±9.35) μmol/L和(4.67±1.58) mmol/L,與對照組比較,除VIP外,其它各項差異均具有統(tǒng)計學(xué)顯著性(P<0.05或P<0.01),見圖3。
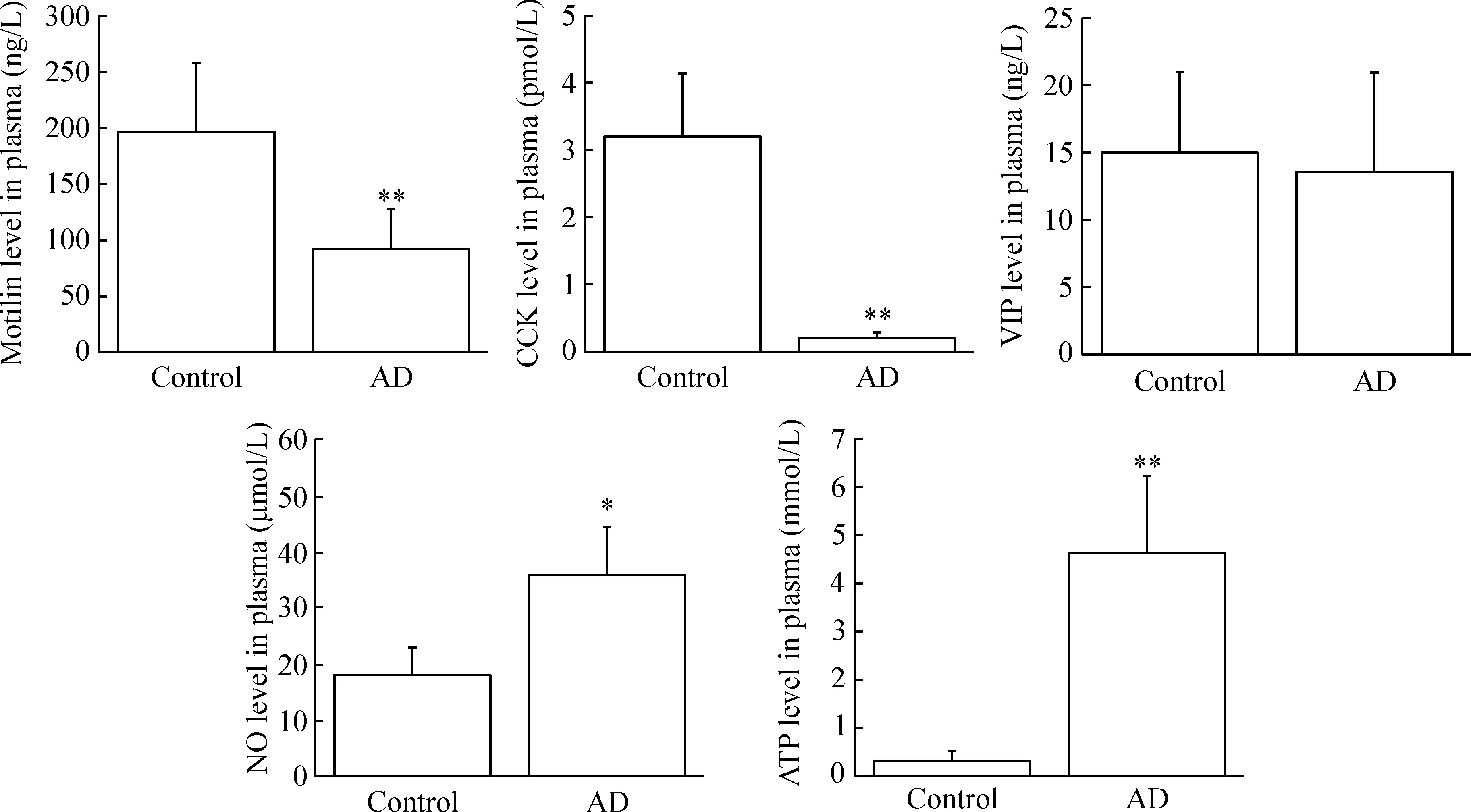
Figure 3.The plasma levels of motilin, CCK, VIP, NO and ATP in the mice. The AD mice wereAPP/PS1 mutant mice aged 6~8 months. Mean±SEM.n=16.*P<0.05,**P<0.01vscontrol group.
圖3 小鼠血漿motilin、CCK、VIP、NO和ATP水平的變化
5 各組小鼠結(jié)腸組織ChAT、VIP、NOS和ATP合酶的表達
免疫組化結(jié)果顯示,與對照組比較,AD小鼠的ATP合酶在結(jié)腸表達明顯上調(diào)(P<0.05),而ChAT、VIP和NOS表達無明顯改變,見圖4。
6 各組小鼠結(jié)腸組織P2Y受體的表達
免疫組化結(jié)果顯示,AD小鼠P2Y受體表達水平較對照組明顯上調(diào),陽性染色主要位于神經(jīng)纖維分布區(qū)域,Western blot實驗結(jié)果也表明P2Y受體表達明顯上調(diào)(P<0.01),見圖5。
7 α,β-MeATP對小鼠自發(fā)性結(jié)腸平滑肌收縮的影響
體外實驗發(fā)現(xiàn),正常小鼠結(jié)腸平滑肌呈節(jié)律一致性自發(fā)性收縮,約每分鐘30次,5 μmol/L和10 μmol/L的α,β-MeATP對這種收縮無明顯影響,從20 μmol/L起,α,β-MeATP可濃度依賴性抑制正常小鼠結(jié)腸平滑肌自發(fā)性收縮(P<0.05或P<0.01),且這種抑制作用可被Na+通道阻斷劑TTX逆轉(zhuǎn)(P<0.05)。α,β-MeATP對AD小鼠自發(fā)收縮也具有明顯的抑制作用(P<0.01),其抑制作用也能被TTX拮抗(P<0.05或P<0.01)。α,β-MeATP在100 μmol/L時對AD小鼠自發(fā)性收縮的抑制作用更明顯(P<0.05),AD小鼠與正常小鼠比較,TTX對100 μmol/L α,β-MeATP的拮抗作用差異也有統(tǒng)計學(xué)顯著性(P<0.05),見圖6。
8 α,β-MeATP對小鼠電刺激誘導(dǎo)的結(jié)腸平滑肌收縮的影響
電刺激引起小鼠回腸規(guī)律性的相位性收縮,隨著刺激頻率的增高,收縮振幅逐漸升高,10~20 Hz刺激時變化最明顯,至50 Hz時達到最大收縮[19],我們選用10 Hz作為后續(xù)研究的基礎(chǔ)。實驗發(fā)現(xiàn)20 μmol/L、40 μmol/L和100 μmol/L的α,β-MeATP明顯降低電刺激誘導(dǎo)的結(jié)腸收縮,AD小鼠和正常小鼠中差異均具有統(tǒng)計學(xué)顯著性(P<0.05或P<0.01)。40 μmol/L和100 μmol/L α,β-MeATP對AD小鼠的抑制作用比正常小鼠更明顯(P<0.05或P<0.01),見圖7。
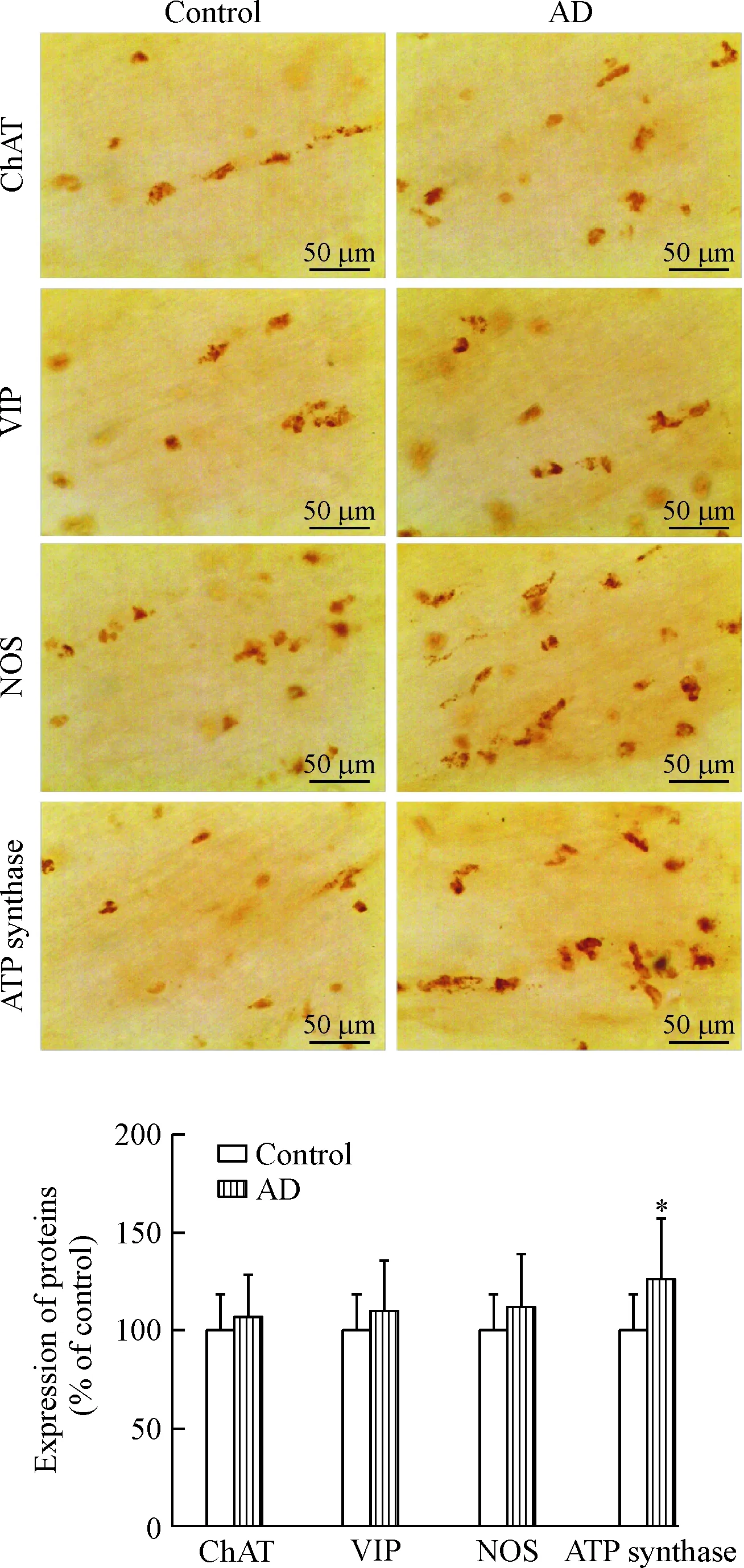
Figure 4.The expression of ChAT, VIP, NOS and ATP synthase in the mouse colonic smooth muscles detected by the method of immunohistochemistry. The brown granules indicate positive staining. Mean±SEM.n=16.*P<0.05vscontrol group.
圖4 小鼠結(jié)腸平滑肌組織中ChAT、VIP、NOS和ATP合酶的表達
9 α,β-MeATP對小鼠結(jié)腸平滑肌Em的影響
如圖8所示,各濃度的α,β-MeATP對小鼠結(jié)腸平滑肌細(xì)胞的Em無明顯影響。
討 論
越來越多的證據(jù)表明,AD是一種影響多系統(tǒng)的疾病,除累及中樞神經(jīng)系統(tǒng)外,還牽涉其它多個系統(tǒng)[23],其中,胃腸道的生理改變和臨床意義得到越來越多的關(guān)注。已有臨床研究發(fā)現(xiàn)[24],與對照組相比,PD患者存在更多的排便障礙,而嚴(yán)重的便秘與疾病確診時間和嚴(yán)重程度有關(guān)。臨床發(fā)現(xiàn),AD患者也存在嚴(yán)重的便秘,并受諸多危險因素的影響,是便秘的高發(fā)人群[25]。動物實驗也表明,AD模型小鼠結(jié)腸運動功能有改變[26]。為了進一步研究AD患者是否存在結(jié)腸運動功能障礙及機制,本課題選取20例AD患者和20例健康人,通過檢測其血漿中MTL、CCK、VIP、NO和ATP水平,來評價結(jié)腸運動功能;另外通過神經(jīng)心理學(xué)相關(guān)評分,來檢測AD患者的神經(jīng)心理學(xué)的情況。本實驗發(fā)現(xiàn),與對照組相比,AD患者神經(jīng)心理學(xué)普遍存在變化,同時血漿中促進胃腸運動的激素MTL和CCK水平降低,抑制胃腸運動的激素NO和ATP水平升高,提示患者可能存在胃腸運動功能障礙。

Figure 5.The expression of P2Y receptor in the mouse colonic tissues detected by the methods of immunohistochemi-stry (A) and Western blot (B). Mean±SEM.n=16.*P< 0.05,**P<0.01vscontrol group.
圖5 小鼠結(jié)腸組織P2Y的表達


Figure 6.The effect of α,β-MeATP on the spontaneous contraction of colon smooth muscle in the mice. A: the raw traces of normal mice; B: the raw traces of AD mice; C: the statistical profiling of spontaneous contraction of muscle strip in normal mice; D: the statistical profiling of spontaneous contraction of muscle in AD mice; E: the comparison of the muscle spontaneous contraction between normal mice and AD mice. Mean±SEM.n=6.*P<0.05,**P<0.01vscontrol group (without treatment);#P<0.05,##P<0.01vsthe same dose of α,β-MeATP;$P<0.05vsα,β-MeATP (normal);&P<0.05vsα,β-MeATP+TTX (normal).
圖6 α,β-MeATP對小鼠自發(fā)性結(jié)腸平滑肌收縮的影響
為證實這一假設(shè),我們利用AD模型小鼠進行動物實驗,即APP/PS1雙轉(zhuǎn)基因的下一代與C57BL/6J小鼠雜交得到的AD模型小鼠。APP/PS1雙轉(zhuǎn)基因小鼠是2個基因的融合體,即突變的人鼠淀粉樣前體蛋白APPswe和人類早老素ΔE9基因,它們的啟動都是由小鼠朊病毒蛋白啟動子操縱的。APP/PS1雙轉(zhuǎn)基因的小鼠存在人類早老素基因的第9個外顯子的缺失,以及ΔE9的突變,從而出現(xiàn)早發(fā)性老年癡呆。此APP/PS1雙轉(zhuǎn)基因的小鼠內(nèi)源性蛋白被人類早老素蛋白所代替,并且在腦勻漿中還檢測到了人源淀粉樣前蛋白,同時實驗中還發(fā)現(xiàn)6~7月齡的小鼠腦內(nèi)即形成β淀粉狀蛋白沉淀,這比實驗室之前應(yīng)用的Tg2576轉(zhuǎn)基因AD小鼠特征更加明顯,因此選用APP/PS1雙轉(zhuǎn)基因進行實驗操作。在水迷宮實驗中,AD小鼠學(xué)習(xí)記憶力出現(xiàn)明顯變化,主要表現(xiàn)為逃逸潛伏期比正常對照組小鼠用時延長,空間探索能力方面,也比對照組小鼠游經(jīng)原平臺所在象限的次數(shù)減少;同時AD小鼠胃腸運動激素也經(jīng)歷了AD患者同樣的變化,也表現(xiàn)為血漿中促進胃腸運動的激素MTL和CCK水平降低,抑制胃腸運動的激素NO和ATP水平升高,同時進一步檢測結(jié)腸組織中ENS系統(tǒng)的變化,發(fā)現(xiàn)AD模型小鼠結(jié)腸組織整體ENS數(shù)量明顯增加,其中膽堿能神經(jīng)和腎上腺素能神經(jīng)無明顯變化,NO及VIP抑制性非腎上腺能非膽堿能(non-adrenergic non-cholinergic,NANC)神經(jīng)元也無明顯變化,而ATP嘌呤能神經(jīng)元有所增加,這與血漿ATP水平升高結(jié)果一致,表明ATP嘌呤能神經(jīng)信號可能在AD伴發(fā)的胃腸運動障礙中起重要作用。
為進一步探討ATP嘌呤能信號在AD發(fā)病中的作用及其機制,我們測定了與AD及胃腸道關(guān)系均密切的P2Y受體,與正常對照小鼠比較,發(fā)現(xiàn)在蛋白水平,AD小鼠結(jié)腸表達P2Y受體水平明顯上調(diào),提示P2Y受體可能是ATP發(fā)揮作用的關(guān)鍵因素;另外利用ATP的模擬物α,β-MeATP進行體外實驗,表明α,β-MeATP濃度依賴性抑制小鼠結(jié)腸平滑肌自發(fā)性收縮,且這種抑制作用能被TTX阻斷,提示其作用位點在ENS,而這些效應(yīng)在AD小鼠更明顯,這與AD小鼠體內(nèi)實驗結(jié)果一致,說明嘌呤能信號在改變AD小鼠結(jié)腸平滑肌收縮活性及結(jié)腸運動功能障礙中起重要作用。

Figure 7.The effect of α,β-MeATP on the contraction of colon smooth muscle induced by electrical stimulation in the mice. A: the raw traces of normal mice; B: the raw traces of AD mice; C: the statistical profiling of contraction of muscle strip after 10 Hz electrical stimulation in normal mice; D: the statistical profiling of contraction of muscle after 10 Hz electrical stimulation in AD mice; E: the comparison of muscle contraction in normal mice and AD mice. Mean±SEM.n=6.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsnormal mice.
圖7 α,β-MeATP對小鼠電刺激誘導(dǎo)的結(jié)腸平滑肌收縮的影響

Figure 8.The effect of α,β-MeATP on the membrane potential of colon smooth muscle. A: the raw traces of membrane potential in the colon smooth muscle; B: the effect of α,β-MeATP on the membrane potential in mice. Mean±SEM.n=6.
圖8 α,β-MeATP對小鼠結(jié)腸平滑肌膜電位的影響
胃腸道平滑肌細(xì)胞Em是影響平滑肌反應(yīng)性、進而改變其舒縮活動的主要因素,為了進一步明確α,β-MeATP對小鼠結(jié)腸運動的作用機制,我們觀察了其對小鼠結(jié)腸平滑肌細(xì)胞Em的影響,發(fā)現(xiàn)α,β-MeATP不改變AD小鼠平滑肌細(xì)胞Em,提示ATP嘌呤能信號對結(jié)腸平滑肌的舒張作用并不是通過改變Em實現(xiàn)的。
綜上所述,AD患者和AD小鼠血漿中促進胃腸運動的激素MTL和CCK水平降低,抑制胃腸運動的激素NO水平升高,胃腸總體運動功能被抑制;AD小鼠血漿ATP水平升高,同時ATP嘌呤能神經(jīng)元增加,P2Y受體表達上調(diào);在AD發(fā)病中,ATP介導(dǎo)的嘌呤能信號可能通過抑制結(jié)腸平滑肌收縮,從而導(dǎo)致結(jié)腸運動功能障礙。
[1] Tachibana H, Washida K, Kowa H, et al. Vascular function in Alzheimer’s disease and vascular dementia[J]. Am J Alzheimers Dis Other Demen, 2016, 31(5):437-442.
[2] Stone JG, Casadesus G, Gustaw-Rothenberg K, et al. Frontiers in Alzheimer’s disease therapeutics[J]. Ther Adv Chronic Dis, 2011, 2(1):9-23.
[3] Galimberti D, Scarpini E. Progress in Alzheimer’s di-sease[J]. J Neurol, 2012, 259(2):201-211.
[4] Shannon KM, Keshavarzian A, Mutlu E, et al. Alpha-synuclein in colonic submucosa in early untreated Parkinson’s disease[J]. Mov Disord, 2012, 27(6):709-715.
[5] Singaram C, Ashraf W, Gaumnitz EA, et al. Dopaminergic defect of enteric nervous system in Parkinson’s disease patients with chronic constipation[J]. Lancet, 1995, 346(8979):861-864.
[6] Wang L, Fleming SM, Chesselet MF, et al. Abnormal colonic motility in mice overexpressing human wild-type alpha-synuclein[J]. Neuroreport, 2008, 19(8): 873-876.
[7] Abbott RD, Petrovitch H, White LR, et al. Frequency of bowel movements and the future risk of Parkinson’s di-sease[J]. Neurology, 2001, 57(3):456-462.
[8] Sprenger FS, Stefanova N, Gelpi E, et al. Enteric ner-vous system alpha-synuclein immunoreactivity in idiopathic REM sleep behavior disorder[J]. Neurology, 2015, 85(20):1761-1768.
[9] Semar S, Klotz M, Letiembre M, et al. Changes of the enteric nervous system in amyloid-beta protein precursor transgenic mice correlate with disease progression[J]. J Alzheimers Dis, 2013, 36(1):7-20.
[10]黃 旭, 張 揚, 高 玲, 等. P2X受體對豚鼠胃竇環(huán)行肌自發(fā)性收縮運動的影響[J]. 世界華人消化雜志, 2007, 15(11):1185-1190.
[11]黃 旭. P2X受體對豚鼠胃竇環(huán)行肌自發(fā)性收縮運動的影響[D]. 上海:上海交通大學(xué), 2007.
[12]馮吉鋒. 嘌呤能信號在神經(jīng)系統(tǒng)中的作用[D].上海:第二軍醫(yī)大學(xué), 2015.
[13]李君武. ATP及其衍生物影響不死化人成纖維細(xì)胞增殖的實驗研究[J]. 中國病理生理雜志, 2001, 17(2):55-58.
[14]Gil V, Martinez-Cutillas M, Mane N, et al. P2Y1knockout mice lack purinergic neuromuscular transmission in the antrum and cecum[J]. Neurogastroenterol Motil, 2013, 25(3):e170-e182.
[15]Gallego D, Gil V, Martinez-Cutillas M, et al. Purinergic neuromuscular transmission is absent in the colon of P2Y1knocked out mice[J]. J Physiol, 2012, 590(8):1943-1956.
[16]Grasa L, Gil V, Gallego D, et al. P2Y1receptors mediate inhibitory neuromuscular transmission in the rat colon[J]. Br J Pharmacol, 2009, 158(6): 1641-1652.
[17]Sperlagh B, Heinrich A, Csolle C. P2 receptor-mediated modulation of neurotransmitter release: an update[J]. Purinergic Signal, 2007, 3(4):269-284.
[18]Wang S, Zhang Y, Liu G, et al. Detection of Alzheimer’s disease by three-dimensional displacement field estimation in structural magnetic resonance imaging[J]. J Alzheimers Dis, 2015, 50(1):233-248.
[19]Li YY, Cao MH, Goetz B, et al. The dual effect of cannabinoid receptor-1 deficiency on the murine postoperative ileus[J]. PLoS One, 2013, 8(7):e67427.
[20]Li K, Feng JY, Li YY, et al. Anti-inflammatory role of cannabidiol and O-1602 in cerulein-induced acute pan-creatitis in mice[J]. Pancreas, 2013, 42(1):123-129.
[21]Bashashati M, Storr MA, Nikas SP, et al. Inhibiting fatty acid amide hydrolase normalizes endotoxin-induced enhanced gastrointestinal motility in mice[J]. Br J Pharmacol, 2012, 165(5):1556-1571.
[22]林旭紅, 李永渝, 馮雅靜, 等. 新型大麻制劑O-1602和大麻二酚對LPS導(dǎo)致的嚙齒動物小腸運動紊亂的影響[J]. 中國病理生理雜志, 2012, 28(6):1082-1090.
[23]Karri S, Acosta-Martinez V, Coimbatore G. Effect of dihydrotestosterone on gastrointestinal tract of male Alzheimer’s disease transgenic mice[J]. Indian J Exp Biol, 2010, 48(5):453-465.
[24]Krogh K, Ostergaard K, Sabroe S, et al. Clinical aspects of bowel symptoms in Parkinson’s disease[J]. Acta Neurol Scand, 2008, 117(1):60-64.
[25]Coggrave M, Norton C. Management of faecal incontinence and constipation in adults with central neurological diseases[J]. Cochrane Database Syst Rev, 2013(12):CD002115.
[26]Andrada MJP, Cano FEM, Morales I, et al. Changes in colonic motility in a murine model of Alzheimer Disease[J]. Neurogastroenterol Motility, 2012, 24:50.
(責(zé)任編輯: 盧 萍, 羅 森)
Role of purinergic signaling mediated by ATP in Alzheimer’s disease-associated colonic motility disorder
LIN Xu-hong1, WANG Hui-chao2, GUO Jun-ling3,4, FANG Xiao-peng1, ZHANG Jun-shi5, GUO Jun-nan5, LI Yu-xia1, YANG Rui-lin1, LI Tie-jun2, LIU Jian-lin2
(1DepartmentofClinicalLaboratory,TranslationalMedicalCenter,HuaiheHospital,2DepartmentofNephrology,TheFirstAffiliatedHospital,3DepartmentofClinicalCardiology,HuaiheHospital,4SchoolofMedicine,5DepartmentofNeurology,HuaiheHospital,HenanUniversity,Kaifeng475000,China.E-mail:uhchao@163.com)
AIM: To explore the role of purinergic signaling mediated by ATP in the Alzheimer’s disease (AD)-related colon motility disorder and its related molecular mechanisms.METHODS: (1)Clinical trials: AD patients in our hospital were collected and studied. Radioimmunoassay was used for the determination of plasma motilin (MTL), cholecystokinin (CCK), vasoactive intestinal peptide (VIP) and nitric oxide (NO), and high-performance liquid chromatography (HPLC) was applied to test the level of adenosine triphosphate (ATP). The patients were assessed by neuropsychology and scored accordingly. (2)In animal experiments, AD mice received Morris water maze test, and the spatial learning and memory function were evaluated. The plasma levels of MTL, CCK, VIP and NO were examined by radioimmunoassay, and the level of ATP was measured by HPLC. Choline acetyltransferase (ChAT), VIP, nitric oxide synthase (NOS) and ATP synthase were detected by immunohistochemistry. Western blot and immunohistochemistry were used to detect the expression of P2Y receptor. (3)Invitro, organ bath was applied to observe the effect of α,β-methylene ATP (α,β-MeATP), an agonist of P2Y receptor, on both spontaneous and electrically evoked contraction of colonic smooth muscle strip, and the technique of intracellular microelectrode was applied to observe the effect of α,β-MeATP on the membrane potential of colonic smooth muscle cells.RESULTS: Compared with control group, the levels of MTL and CCK were decreased (P<0.01), and the levels of NO and ATP were increased (P<0.05 orP<0.01), while the VIP level was not changed. Mini-Mental State Examination (MMSE) score was decreased (P<0.05), Alzheimer’s Disease Assessment Scale-Cognitive Subscale (ADAS-Cog) score, Neuropsychiatric Inventory (NPI) score and Alzheimer’s Disease Cooperative Study-Activities of Daily Living Scale (ADCS-ADL) were all increased as compared with control group (P<0.01). The 4~6 d escape latency ofAPP/PS1 AD mice was significantly prolonged (P<0.05), and the space exploration ability distinctly reduced (P<0.05). In AD mice, the levels of MTL and CCK were decreased (P<0.01), and the levels of NO and ATP were increased (P<0.05 orP<0.01), while the VIP level was not changed. The protein expression of colonic ATP synthase was significantly increased (P<0.05), but the expression of ChAT, VIP and NOS was not changed. The expression of P2Y receptor was increased (P<0.01). The results ofinvitroexperiment displayed that α,β-MeATP, from 20 μmol/L to 100 μmol/L, inhibited the spontaneous contraction of colonic smooth muscle strip in the normal mice and AD mice (P<0.05 orP<0.01), and this inhibition was reversed by Na+channel inhibitor tetrodotoxin (TTX) (P<0.05 orP<0.01). In addition, the effect of α,β-MeATP at 100 μmol/L on the AD mice was more obvious than that on the normal mice (P<0.05), and this inhibition was also antagonized by TTX (P<0.05 orP<0.01), pro-minent in AD group as compared with control group (P<0.05). In 10 Hz electrically evoked contraction of colonic smooth muscle strip, α,β-MeATP inhibited both the normal and AD mice (P<0.05 orP<0.01), while the inhibition was more obvious in the AD mice at the concentration of 40 μmol/L or 100 μmol/L (P<0.05 orP<0.01). CONCLUSION: AD patients and AD mice are accompanied by decreased MTL and CCK levels, and enhanced NO level, thus inducing colonic motor dysfunction along with AD. Meanwhile, ATP in plasma, purinergic neurons, and P2Y receptor expression are increased in the AD mice. Purinergic signaling mediated by ATP inhibits colonic smooth muscle strip contraction and further paralyzes the colonic movement function in AD.
P2Y receptor; Alzheimer’s disease; Enteric nervous system; Colonic motility disorder
1000- 4718(2016)12- 2113- 12
2016- 08- 15
2016- 09- 27
國家自然科學(xué)基金資助項目 (No.U1304802; No.81500430)
R363; R749.1+6
A
10.3969/j.issn.1000- 4718.2016.12.001
雜志網(wǎng)址: http://www.cjpp.net
△通訊作者 Tel: 0371-22736820; E-mail: uhchao@163.com

