miR-30c調控PAI-1對血管內皮細胞活力和遷移的影響*
譚曉勇, 羅 茂, 盧培林, 吳劍波
(西南醫科大學藥物研究中心, 藥學院心血管藥理實驗室, 四川 瀘州 646000)
miR-30c調控PAI-1對血管內皮細胞活力和遷移的影響*
譚曉勇▲, 羅 茂▲, 盧培林, 吳劍波△
(西南醫科大學藥物研究中心, 藥學院心血管藥理實驗室, 四川 瀘州 646000)
目的: 深入研究微小RNA (miR)-30c靶向調控纖溶酶原激活物抑制物1(PAI-1)表達對血管內皮細胞活力和遷移能力的影響。方法:應用miR-30c模擬物(mimic)、抑制物(inhibitor)及陰性對照(NC)序列轉染人臍靜脈內皮細胞(HUVECs)后,RT-qPCR檢測miR-30c水平及PAI-1的mRNA表達,Western blot法檢測PAI-1蛋白的表達,CCK-8法和劃痕實驗分別檢測細胞活力和遷移能力。生物信息學方法預測miR-30c與PAI-1的mRNA 3’-UTR結合位點,并用雙螢光素酶報告基因驗證miR-30c對PAI-1 mRNA的靶向作用。結果:miR-30c能夠靶向調控PAI-1的mRNA和蛋白表達,與對照組和NC序列轉染組比較,增加miR-30c表達可導致PAI-1的mRNA和蛋白表達降低,進而增強HUVECs的活力和遷移能力;相反,抑制miR-30c表達可導致PAI-1 的mRNA和蛋白表達升高,進而抑制HUVECs的活力和遷移能力。結論:高表達miR-30c可抑制PAI-1表達,導致HUVECs 活力和遷移能力明顯增強,提示miR-30c可能參與調節內皮細胞功能。
微小RNA-30c; 人臍靜脈內皮細胞; 纖溶酶原激活物抑制物1; 細胞活力; 細胞遷移
血管內皮細胞的激活、增殖、遷移是血管生成的關鍵[1-2]。研究顯示,內皮細胞的損傷、激活和修復與部分心血管疾病如動脈粥樣硬化、冠心病、高血壓、糖尿病等的發生和發展密切相關[3]。微小RNA (microRNA, miRNA, miR)是一類內源性的、19~25個堿基長度的小分子非編碼RNA,它可以通過與靶mRNA的3’-UTR互補導致其降解或抑制蛋白翻譯,從而在人體生命活動中具有廣泛的調控作用[4-5]。近來研究表明,部分miRNA廣泛參與調節血管內皮細胞功能如增殖、遷移和凋亡等過程,參與血管生成的調節,與諸多心血管疾病的病理生理進程密切相關[6-7]。
已有研究表明,miR-30c與腫瘤發生發展關系密切[8],但miR-30c與心血管類疾病的研究尚少。其中,Duisters等[9]研究表明左心室肥厚病人和動物模型心肌組織中miR-30c表達下調,導致miR-30c靶標結締組織生長因子(connective tissue growth factor,CTGF)表達升高,促進心室重構;Patel 等[10]研究發現人肺動脈內皮細胞的miR-30c能夠直接靶向作用于組織型纖溶酶原激活物抑制物1(plasminogen activator inhibitor-1,PAI-1)表達,參與鐮狀細胞貧血,該過程受胎盤生長因子(placental growth factor,PIGF)誘導。PAI-1 是調節纖溶活性的重要因子,生理條件下是組織纖溶酶原激活物(tissue plasminogen activator,t-PA)和尿激酶型纖溶酶原激活物(urokinase-type plasminogen activator,u-PA)的特異性抑制物[11-13]。研究顯示,PAI-1 能夠通過影響細胞外基質的降解過程和細胞黏附功能從而參與調節血管生成[13]。綜合提示,miR-30c可能通過靶向調控PAI-1表達,參與內皮細胞的增殖、遷移調節,進而調節內皮功能和血管生成。
材 料 和 方 法
1 材料
人臍靜脈血管內皮細胞(human umbilical vein endothelial cells,HUVECs)購自ATCC;改良型RPMI-1640細胞培養基(HyClone);細胞轉染試劑Lipofectamine 2000、TRIzol和DEPC水(Invitrogen);Mir-XTMmiRNA第1鏈合成試劑盒和SYBR?RT-qPCR試劑盒(Clontech);PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)試劑盒(TaKaRa);E.colipoly (A) Polymerase和rATP (NEB);DNA Ladder Marker和2×Taq PCR Master Mix(北京天根生化科技公司);CCK-8試劑盒、胰蛋白酶、青霉素和鏈霉素(碧云天生物技術研究所);兔抗人β-actin、PAI-1單克隆Ⅰ抗和抗兔IgG Ⅱ抗(CST);雙螢光素酶報告基因檢測系統(Promega);其它試劑為進口產品或國產分析純產品。高速冷凍離心機(Eppendorf);自動凝膠成像系統Gel DocXR+、蛋白電泳及轉膜系統和CFX96 Touch 實時熒光定量PCR儀(Bio-Rad);ND-1000微量紫外可見分光光度計(NanoDrop);超凈工作臺(SW-CJ);-80 ℃超低溫冰箱(Thermo)。吸頭、離心管等經0.1% DEPC水浸泡24 h后高溫滅菌,50 ℃烘干備用。PCR引物由Invitrogen公司合成,具體序列見表1。

表1 引物序列
F: forward; R: reverse.
2 方法
2.1 HUVECs的培養 使用含10%胎牛血清的改良型RPMI-1640細胞培養基(1×105U/L青霉素和100 mg/L鏈霉素)培養HUVECs,置于37 ℃、5% CO2、飽和濕度培養箱中常規培養。
2.2 miR-30c靶基因的預測 應用在線軟件miRBase[14](http://www.mirbase.org/)獲得miR-30c的基本信息,結合miRanda[15](http://www.microrna.org/)、TargetScan 6.2[16](http://www.targetscan. org/)和PicTar[17](http://www.pictar.org/)靶基因預測結果,分析其中交集結果并提交miTarbas[18](http://mirtarbase.mbc.nctu.edu.tw/)與已證實靶基因比對,結合已有文獻報道[10],預測miR-30c與PAI-1 mRNA存在的靶向結合位點,用于后續實驗分析。
2.3 miR-30c的轉染 轉染前24 h,取對數生長期HUVECs(1×105)鋪于6孔板中,待生長至60%~70%匯合時,更換無血清培養基后同步進行miR-30c mimic (50 nmol/L)、miR-30c inhibitor (100 nmol/L)及對應陰性對照(negative control,NC)序列的轉染。按照Lipofectamine 2000 轉染試劑說明書進行,轉染12 h 后更換新鮮培養基,24 h收集細胞提取總RNA,48 h收集細胞提取蛋白。
2.4 pMIR-REPORT螢光素酶報告基因檢測 根據預測的靶基因結合位點設計并合成 miR-30c 與 PAI-1 mRNA 3’-UTR 結合的30~60 bp 寡核苷酸序列并插入雙酶切位點,經酶切、PCR擴增鑒定、質粒抽提以及測序等步驟確定重組載體質粒pMIR-Luc-miR-30c-PAI-1 3’-UTR構建成功。進一步以構建的質粒為模板進行定點突變,構建突變型質粒。各步所用引物序列見表1。
將HEK 293細胞鋪于48孔板,利用Lipofectamine 2000轉染試劑,結合pMIR-Luc-miR-30c-PAI-1 3’-UTR重組質粒、對應的突變型質粒和miR-30c mimic (50 nmol/L)、miR-30c inhibitor (100 nmol/L)及其對應NC共轉染HEK 293細胞72 h后,利用螢光素酶檢測試劑盒(Promega)檢測螢光素酶活性,驗證作用靶點的真實性。
2.5 用RT-qPCR檢測miR-30c的水平和靶標PAI-1的mRNA表達 TRIzol試劑盒提取各實驗組的細胞總RNA,并分別應用Mir-XTMmiRNA 第1鏈合成試劑盒和SYBR?RT-qPCR 試劑盒和PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)試劑盒制備cDNA模板。分別以U6 和 18S rRNA為內參照檢測miR-30c的水平和靶標PAI-1的mRNA表達。應用SYBR Premix Ex Taq II (TaKaRa)進行qPCR檢測。擴增條件為: 95 ℃ 10 min; 95 ℃ 10 s, 50 ℃~ 60 ℃ 20 s, 72 ℃ 30 s, 40個循環; 72 ℃ 3 min, 60 ℃~95 ℃繪制熔解曲線。應用2-ΔΔCt法計算miR-30c和靶標PAI-1 mRNA的表達量,引物見表1。
2.6 Western blot法檢測PAI-1蛋白的表達 細胞轉染48 h后加入適量預冷的RIPA buffer(含Roche蛋白酶抑制劑cocktail),超聲裂解后12 000 r/min,4 ℃ 離心15 min,取上清。BCA法測定蛋白濃度后,樣品蛋白:5×上樣緩沖液比例為4∶1,100 ℃變性后,進行10% SDS-PAGE膠上樣并轉至PVDF膜。經封閉1 h后加入I抗4 ℃孵育過夜(PAI-1和內參照β-actin抗體的稀釋比例均為1∶2 000)。TBST洗膜3次后,II抗孵育1 h,再次TBST漂洗3次后顯影。
2.7 細胞活力和遷移能力的檢測 HUVECs(1×104)接種于96孔板,待其基本融合時更換無血清培養基培養24 h后,每孔加入10 μL的CCK-8試劑37 ℃孵育1 h,全自動酶標儀測定450 nm波長處的吸光度(A),每組均取6復孔計算均值,統計學分析比較細胞活力的變化。HUVECs轉染24 h后按1×105接種至6孔板,設置4個復孔,待細胞基本匯合后,在細胞表面劃1條粗細均一的劃痕,洗去懸浮的細胞并更換低血清培養基,于培養0 h、12 h和24 h時,倒置顯微鏡下觀察拍照,使用ImageJ 軟件分析遷移距離評估遷移能力的變化。
3 統計學處理
采用 SPSS 16.0 軟件統計分析,所有實驗數值以均數±標準差(mean±SD)表示,多組間比較采用單因素方差分析(one-way ANOVA)和方差齊性檢驗,兩兩比較用Bonferroni校正的t檢驗,以P<0.05為差異有統計學意義。
結 果
1 miR-30c對HUVECs活力和遷移能力的影響
應用劃痕實驗和CCK-8法分析HUVECs的遷移能力和細胞活力,結果顯示與對照組和NC組比較,miR-30c mimic組的HUVECs遷移能力及細胞活力增高;反之,miR-30c inhibitor組的HUVECs遷移能力及細胞活力均下降(P<0.05)。上述結果說明過表達miR-30c可以顯著促進內皮細胞的遷移和細胞活力;抑制miR-30c表達可明顯抑制內皮細胞的遷移和細胞活力,見圖1。
2 miR-30c靶基因PAI-1的預測及螢光素酶報告基因驗證
在線軟件預測、比對及文獻分析結果顯示,存在miR-30c與PAI-1 mRNA 3’-UTR區的靶向結合位點,可用于后續轉錄調控實驗驗證。根據預測的靶基因結合位點,我們成功構建pMIR-Luc-miR-30c-PAI-1 3’-UTR重組質粒及其突變型質粒。螢光素酶報告基因實驗結果顯示,與對照組和NC組比較,轉染miR-30c mimic可顯著抑制螢光素酶活性,轉染miR-30c inhibitor抑制miR-30c后螢光素酶活性增強(P<0.05),而共轉染突變型質粒組各組螢光素酶活性均無明顯變化(數據未顯示),提示miR-30c可直接結合于PAI-1 3’-UTR,靶向調控PAI-1的表達,見圖2。

Figure 1.The effect of miR-30c on the migratory ability and viability of HUVECs. A: the representative images and quantitative analysis of the wound healing test (scale bar=1 mm;n=4); B: the result of CCK-8 assay (n=6). Mean±SD.*P<0.05vscontrol group;#P<0.05vsNC group.
圖1 miR-30c對內皮細胞遷移能力和細胞活力的影響

Figure 2.Bioinformatic predictions and reporter gene assay of miR-30c targeting PAI-1. A: stem-and-loop structure of miR-30c; B: predictions of miR-30c binding to PAI-1; C: assessment of miR-30c binding to PAI-1 3’-UTR by reporter gene assays. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsNC group.
圖2 miR-30c靶基因PAI-1的生物信息學預測及螢光素酶報告基因驗證
3 miR-30c調控靶標PAI-1的mRNA表達
與對照組和NC組比較,過表達miR-30c能夠顯著抑制靶基因PAI-1 的mRNA表達;反之,抑制miR-30c表達可顯著增強PAI-1的mRNA表達(P<0.05),見圖3。

Figure 3.The expression levels of miR-30c (A) and its target PAI-1 mRNA (B) measured by RT-qPCR. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsNC group.
圖3 miR-30c對靶標PAI-1 mRNA表達的影響
4 miR-30c調控靶標PAI-1蛋白表達
如圖4所示,Western blot實驗的結果表明,與對照組和NC組比較,過表達miR-30c能夠明顯抑制靶標PAI-1 蛋白的表達;相反,抑制miR-30c表達可明顯增強PAI-1蛋白的表達(P<0.05)。
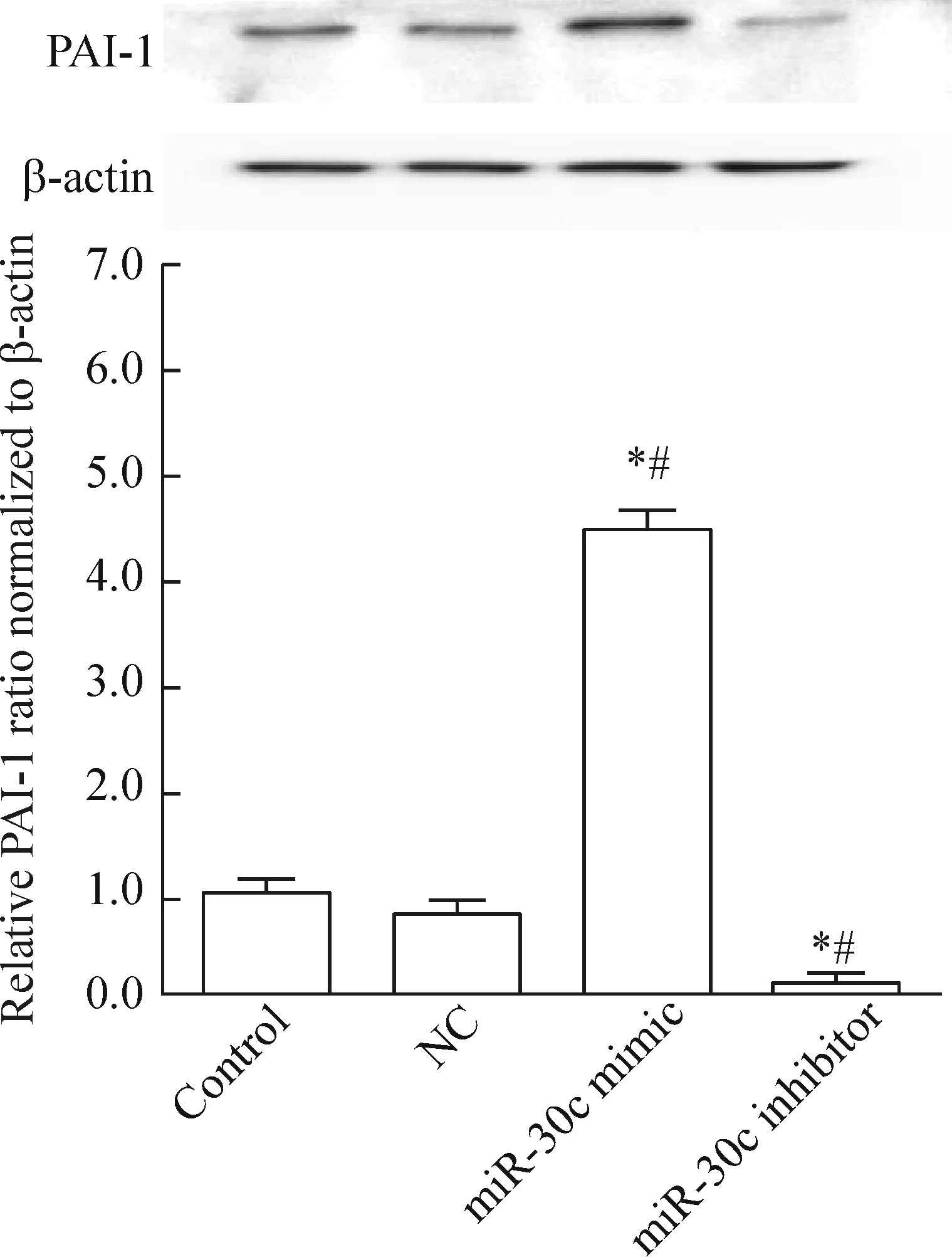
Figure 4.The effect of miR-30c on the protein levels of PAI-1. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsNC group.
圖4 miR-30c對靶標PAI-1 蛋白表達的影響
討 論
研究表明,血管生成過程中血管內皮細胞的功能激活是關鍵,血管內皮細胞的增殖、遷移等功能變化對維持血管壁穩定與循環系統穩態至關重要,與心血管系統疾病如動脈粥樣硬化、冠心病、高血壓等發生和發展密切相關。研究顯示部分miRNA可以調節內皮細胞功能,參與內皮細胞的損傷、激活和修復等過程調節,進而影響內皮細胞介導的血管生成,在大量心血管疾病病理生理過程中發揮重要調控作用[6-7, 19]。例如,Bernstein 等[19]研究顯示,大量miRNA通過Dicer通路加工形成,進而調控內皮毛細血管芽生和管腔形成,調控部分促血管生成的重要因子如血管內皮生長因子(vascular endothelial growth factor,VEGF)、血管生成素1/2(angiopoietin 1/2,Ang-1/2)等表達變化,進而調控血管的生成。
PAI-1是調節纖溶活性的重要因子,生理條件下是t-PA和u-PA的特異性抑制物[11-13]。研究顯示,PAI-1能夠通過影響細胞外基質的降解過程和細胞黏附功能從而參與調節血管生成[11]。進一步推測其機制,PAI-1活性升高,可抑制纖溶,導致細胞外基質(extracellular matrix,ECM)降解障礙;高水平PAI-1也通過阻止玻連蛋白(vitronectin)的精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)親合力功能區從而破壞細胞的黏附和遷移功能。其中,玻連蛋白是細胞外基質中的主要黏附成分[12]。我們最近發現PAI-1與玻連蛋白結合可通過αvβ3整合素通路阻止VEGF誘導的VEGFR-2磷酸化,進一步研究顯示通過調節纖維蛋白溶酶、尿激酶受體和αvβ3整合素受體,PAI-1 能夠抑制VEGF誘導的血管形成[13]。
已有研究表明,miR-30c與脂肪干細胞分化、上皮細胞間質轉化和腫瘤等相關[20-21]。最近研究揭示,miR-30c在心血管系統中同樣扮演著重要角色[9-10]。例如,miR-30c通過靶向調控結締組織生長因子表達,參與心室重構過程的調節[9];HPMVEC細胞內miR-30c經PIGF誘導后靶向調控PAI-1表達,參與鐮狀細胞貧血過程的調節[10];本文研究結果顯示,miR-30c能夠靶向結合PAI-1 3’-UTR種子序列,從而直接靶向負調控PAI-1的mRNA和蛋白表達,參與內皮細胞的遷移、細胞活力的調節,提示過表達miR-30c可抑制PAI-1表達,導致HUVECs 細胞活力和遷移能力的明顯增強,推測miR-30c可能通過直接靶向調控PAI-1表達,影響細胞外基質的降解或黏附過程,進而參與血管生成過程。
Wu等[13]研究表明2 型糖尿病中應用PAI-1 抑制劑可明顯修復缺血誘導的血管生成,增加下肢的血流灌注,提示PAI-1 可作為糖尿病微血管并發癥血管生成治療的一個潛在重要靶點,臨床研發如miR-30c增強劑等新型PAI-1抑制劑將可能改善心血管類血管并發癥的治療及預后,如糖尿病下肢缺血血管生成治療過程,增加血管重構,阻止血管滲漏,達到最理想治療效果。本研究結果為進一步設計新型PAI-1抑制劑提供一定依據,其結果具有潛在的臨床應用價值。
[1] Friis T, Engel AM, Bendiksen CD, et al. Influence of levamisole and other angiogenesis inhibitors on angiogenesis and endothelial cell morphologyinvitro[J]. Cancers (Basel), 2013, 5(3):762-785.
[2] Ju R, Cirone P, Lin S, et al. Activation of the planar cell polarity formin DAAM1 leads to inhibition of endothelial cell proliferation, migration, and angiogenesis[J]. Proc Natl Acad Sci U S A, 2010, 107(15): 6906-6911.
[3] 李乾豪, 仉紅剛. 細胞微泡 miRNA 對內皮細胞的調控[J]. 中國病理生理雜志, 2015, 31(8):1531-1536.
[4] Gao Y, Peng J, Ren Z, et al. Functional regulatory roles of microRNAs in atherosclerosis[J]. Clin Chim Acta, 2016, 460:164-171.
[5] Samanta S, Balasubramanian S, Rajasingh S, et al. MicroRNA: a new therapeutic strategy for cardiovascular di-seases[J].Trends Cardiovasc Med, 2016, 26(5):407-419.
[6] 張文宇, 王 輝, 李玉媚, 等. miRNA-24對內皮型一氧化氮合酶表達調節及血管內皮細胞增殖的影響[J]. 中國病理生理雜志, 2014, 30(8):1415-1420.
[7] 鄭志偉, 勞海燕, 余細勇, 等. 冠心病患者血漿循環miR-126的表達及其對血管內皮細胞的影響[J]. 中國病理生理雜志, 2011, 27(12):2313-2317.
[8] Irani S, Hussain MM. Role of microRNA-30c in lipid metabolism, adipogenesis, cardiac remodeling and cancer[J]. Curr Opin Lipidol, 2015, 26(2):139-146.
[9] Duisters RF, Tijsen AJ, Schroen B, et al. miR-133 and miR-30 regulate connective tissue growth factor: implications for a role of microRNAs in myocardial matrix remodeling[J]. Circ Res, 2009, 104(2):170-178.
[10]Patel N, Tahara SM, Malik P, et al. Involvement of miR-30c and miR-301a in immediate induction of plasminogen activator inhibitor-1 by placental growth factor in human pulmonary endothelial cells[J]. Biochem J, 2011, 434(3):473-482.
[11]Yasar Yildiz S, Kuru P, Toksoy Oner E, et al. Functional stability of plasminogen activator inhibitor-1[J]. Sci World J, 2014, 2014:858293.
[12]Czekay RP, Loskutoff DJ. Plasminogen activator inhibitors regulate cell adhesion through a uPAR-dependent mechanism[J]. J Cell Physiol, 2009, 220(5):655-663.
[13]Wu J, Strawn TL, Luo M, et al. Plasminogen activator inhibitor-1 inhibits angiogenic signaling by uncoupling vascular endothelial growth factor receptor-2-αVβ3 integrin cross talk[J]. Arterioscler Thromb Vasc Biol, 2015, 35(1):111-120.
[14]Griffiths-Jones S, Grocock RJ, van Dongen S, et al. miRBase: microRNA sequences, targets and gene nomenclature[J]. Nucleic Acids Res, 2006, 34(Database issue):D140-D144.
[15]John B, Enright AJ, Aravin A, et al. Human microRNA targets[J]. PLoS Biol, 2004, 2(11):e363.
[16]Lewis BP, Burge CB, Bartel DP, et al. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J]. Cell, 2005, 120(1):15-20.
[17]Chen K, Rajewsky N. Natural selection on human micro-RNA binding sites inferred from SNP data[J]. Nat Genet, 2006, 38(12):1452-1456.
[18]Chou CH, Chang NW, Shrestha S, et al. miRTarBase 2016: updates to the experimentally validated miRNA-target interactions database[J]. Nucleic Acids Res, 2016, 44(D1):D239-D247.
[19]Bernstein E, Kim SY, Carmell MA, et al. Dicer is essential for mouse development[J]. Nat Genet, 2003, 35(3):215-217.
[20]Irani S, Hussain MM. Role of microRNA-30c in lipid metabolism, adipogenesis, cardiac remodeling and cancer[J]. Curr Opin Lipidol, 2015, 26(2):139-146.
[21]Wen M, Men R, Liu X, et al. Involvement of miR-30c in hepatic stellate cell activation through the repression of plasminogen activator inhibitor-1[J]. Life Sci, 2016, 155:21-28.
(責任編輯: 盧 萍, 羅 森)
Effects of miR-30c on viability and migratory ability of HUVECs by targeting
PAI-1TAN Xiao-yong, LUO Mao, LU Pei-lin, WU Jian-bo
(DrugDiscoveryResearchCenter,LaboratoryforCardiovascularPharmacology,TheSchoolofPharmacy,SouthwestMedicalUniversity,Luzhou646000,China.E-mail:jbwucn@163.com)
AIM: To investigate the effect of microRNA (miR)-30c on the viability and migratory ability of human umbilical vein endothelial cells (HUVECs) by targeting plasminogen activator inhibitor-1 (PAI-1).METHODS: The HUVECs were transfected with miR-30c mimic and inhibitor or negative control (NC), and then the expression levels of miR-30c, PAI-1 mRNA and protein were detected by RT-qPCR and Western blot. The viability and migratory ability of HUVECs were measured by CCK-8 assay and wound healing test. After bioinformatic analysis, the assessment of miR-30c binding to PAI-1 3’-UTR was carried out using a luciferase reporter gene assay. RESULTS: miR-30c directly down-regulated PAI-1 levels by binding to the 3’ UTR seed sequence of PAI-1 mRNA. Furthermore, transfection of a miR-30c mimic down-regulated the expression of PAI-1 at mRNA and protein levels, leading to enhanced migratory ability and viability of the HUVECs. However, transfection of a miR-30c inhibitor up-regulated the expression of PAI-1 at mRNA and protein le-vels, leading to decreased migratory ability and viability. CONCLUSION: Regulation of miR-30c level changes the migratory ability and viability of HUVECs by affecting the PAI-1 expression, indicating the involvement of miR-30c in modulating endothelial function.
MicroRNA-30c; Human umbilical vein endothelial cells; Plasminogen activator inhibitor-1; Cell viability; Cell migration
1000- 4718(2016)12- 2199- 06
2016- 07- 15
2016- 08- 30
國家自然科學基金資助項目(No. 81172050; No. 81570263);四川省科技廳課題(No. 2014FZ0104);四川省教育廳課題(No.16ZA0178)
R363
A
10.3969/j.issn.1000- 4718.2016.12.012
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 0830-3161673; E-mail: jbwucn@163.com
▲并列第1作者

