用雙螢光素酶報告基因技術驗證小鼠lncRNA-H19與miR-199a-5p的靶向關系*
侯婧瑛, 周長青, 鄭韶欣, 郭天柱, 龍會寶, 伍權華, 鐘婷婷, 吳 浩, 汪 蕾, 王 彤△
(中山大學孫逸仙紀念醫院 1急診科, 2心內科, 廣東 廣州 510120)
用雙螢光素酶報告基因技術驗證小鼠lncRNA-H19與miR-199a-5p的靶向關系*
侯婧瑛1, 周長青1, 鄭韶欣2, 郭天柱1, 龍會寶1, 伍權華1, 鐘婷婷1, 吳 浩1, 汪 蕾1, 王 彤1△
(中山大學孫逸仙紀念醫院1急診科,2心內科, 廣東 廣州 510120)
目的: 構建長鏈非編碼RNA-H19(lncRNA-H19)螢光素酶報告質粒,利用雙螢光素酶報告基因技術驗證小鼠lncRNA-H19與微小RNA-199a-5p(miR-199a-5p)的靶向關系。方法:通過生物信息學網站RegRNA 2.0預測獲取小鼠lncRNA-H19 與miR-199a-5p潛在的互補結合位點。將H19及其突變體克隆到螢光素酶載體psiCHECK-2中,構建H19 野生型和突變型質粒,并采用酶切和測序方法鑒定psiCHECK-2-H19 載體是否構建成功。將H19 野生型和突變型質粒分別與miR-199a-5p模擬物、miR-199a-5p抑制劑、miR-199a-5p模擬物陰性對照或miR-199a-5p 抑制劑陰性對照在293T 細胞中共轉染。收集細胞后通過雙螢光素酶報告系統檢測不同組別的螢光素酶活性,從而對lncRNA-H19 與miR-199a-5p的靶向調節關系進行驗證。結果:構建的重組螢光素酶報告質粒經酶切及測序鑒定正確,雙螢光素酶報告基因檢測顯示,與miR-199a-5p模擬物陰性對照組相比,miR-199a-5p模擬物組H19野生型報告基因的螢光素酶活性顯著降低,下降約49%左右(P<0.01),而miR-199a-5p 抑制劑組H19 野生型報告基因的螢光素酶活性較miR-199a-5p模擬物組明顯增高(P<0.01)。miR-199a-5p模擬物、miR-199a-5p抑制劑、miR-199a-5p模擬物陰性對照以及miR-199a-5p 抑制劑陰性對照對H19突變型的螢光素酶活性均無明顯影響。結論:lncRNA-H19能夠靶向結合miR-199a-5p,并在轉錄后水平對其有直接抑制作用。
長鏈非編碼RNA-H19; 微小RNA-199a-5p; 雙螢光素酶報告基因
非編碼RNA在蛋白表達中具有重要調控作用。長鏈非編碼RNA (long noncoding RNA, lncRNA)是一類轉錄本長度超過200個核苷酸的功能性RNA分子,其能夠從不同層面實現對基因表達的調控作用[1]。微小RNA (microRNA, miRNA)是一類長約22個核苷酸分子的內源性非編碼RNA,通過與靶基因3’端非翻譯區(untranslated region, UTR)的不完全結合而發揮對基因表達的負向調節[2]。現有的證據表明lncRNA可通過堿基互補配對原則競爭性結合miRNA從而抑制miRNA對靶基因表達的調控[3-4]。在本研究中,我們通過生物信息學網站RegRNA 2.0數據庫進行預測獲取小鼠lncRNA-H19 與miR-199a-5p潛在的互補結合位點,在此基礎上,進一步構建含小鼠lncRNA-H19序列的野生型和突變型質粒的雙螢光素酶報告基因載體,并采用雙螢光素酶報告基因檢測驗證小鼠lncRNA-H19與miR-199a-5p之間的靶向關系。
材 料 和 方 法
1 細胞系和試劑
DMEM 高糖培養液、胎牛血清(fetal bovine se-rum,FBS)和胰蛋白酶均購自HyClone;miR-199a-5p模擬物、抑制劑及相應對照序列(廣州銳博生物科技有限公司);psiCHECK-2 雙螢光素酶報告基因載體、螢光素酶檢測試劑盒和雙螢光素酶基因報告分析系統(Promega);轉染試劑Lipofectamine 2000 (Invitrogen);293T 細胞(中國科學院細胞庫)。
2 細胞培養
293T細胞使用含10% FBS 的DMEM (含4.0 mmol/L 谷氨酰胺、1×105U/L青霉素和100 mg/L鏈霉素),37 ℃、5% CO2飽和濕度培養箱中培養。待細胞生長成均勻單層細胞并達90%以上聚集度時傳代,將培養基吸出加入500μL 0.25%胰蛋白酶室溫下短暫消化,于顯微鏡下觀察當細胞皺縮變圓時立即加入DMEM培養基,反復吹打成細胞懸液,血球計數板計數,以含10% FBS的DMEM調整細胞密度后重新接種于10 cm 細胞培養皿,每皿5×106細胞,置于37 ℃ 、5% CO2培養箱內培養。24 h待細胞密度達70%~80%時即可用于轉染。
3 方法
3.1 實驗分組和相關序列信息 本實驗設立小鼠lncRNA-H19野生型和突變型(H19-Mut),其中各型又分為5組:空白組(blank組,為單純的293T細胞)、miR-199a-5p模擬物組(miR-199a-5p組)、miR-199a-5p模擬物陰性對照(negative control, NC)組、miR-199a-5p抑制劑組(miR-199a-5p inhibitor組)和miR-199a-5p抑制劑陰性對照組(NC inhibitor組)。NC組采用通用的miRNA mimic N control #24,成熟miRNA名稱為cel-miR-67-3p,編號為MIMAT0000039。以上所涉及引物序列信息詳見表1。

表1 引物序列
F: forward; R: reverse.
3.2 小鼠lncRNA-H19表達載體及其突變載體構建 分析lncRNA-H19基因序列,確定與miR-199a-5p潛在結合位點,H19擴增引物序列由蘇州金唯智公司合成,PCR擴增后進行產物回收,再進行載體雙酶切,XhoI酶切位點和NotI酶切位點見圖1和表1下劃線所示,擴增片段為2 288 bp。將酶切回收的PCR產物與psiCHECK-2載體進行連接。連接產物轉化后質粒提取并酶切鑒定陽性克隆,送陽性質粒測序。H19突變采用overlap PCR法。測序結果進行BLAST比對確認H19以及H19-Mut已成功克隆至psiCHECK-2載體中。H19突變位點如圖2所示。

Figure 1.Vector structure map of psiCHECK.
圖1 psiCHECK-2載體結構圖譜

Figure 2.Combination site of miR-199a-5p and lncRNA-H19, and mutation site of H19.
圖2 miR-199a-5p與lncRNA-H19結合位點及H19突變位點
3.3 陽離子脂質體法進行細胞轉染 轉染前1 d,細胞按2×104cells/well接種于含10% FBS的DMEM 高糖培養基測定24孔板上。轉染當天,細胞匯合度約為70%~80%,吸去舊的培養基,用PBS洗滌2次,然后每孔加入300 μL OPTI-MEM培養基,置于5% CO2、37 ℃培養箱中;每個孔用OPTI-MEM培養基稀釋1 μL Lipofectamine 2000,終體積為50 μL,室溫下靜置5 min;每個孔加入20 μmol/L濃度的microRNA 1 μL或microRNA抑制劑和0.5 μg質粒,再加入OPTI-MEM至總體積50 μL(最終孵育液中為50 nmol/L microRNA或100 nmol/L microRNA抑制劑),室溫下靜置5 min;復合上述2個步驟中的稀釋液,室溫下靜置20 min;每孔加入100 μL轉染復合液,晃動24孔板稍加混勻;在5% CO2、37 ℃培養箱中孵育5 h,用新鮮的完全培養基(含FBS)替換含有轉染復合物的培養基。
3.4 螢光素酶活性檢測 用Promega的雙螢光素酶基因報告分析系統進行樣品螢光素酶活性檢測。 轉染48 h后,吸去舊的培養基,用PBS清洗2次,每孔細胞加入100 μL的PLB 緩沖液,室溫輕微振搖15 min,收集細胞裂解液。將20 μL細胞裂解液加入發光板后,用GloMax生物發光檢測儀讀取背景值2 s,每樣品加入100 μL LAR II工作液,快速混勻,讀值2 s。讀值完畢后,每樣品再加入100 μL Stop & Glo?Reagent,快速混勻后,放入發光檢測儀中,讀值2 s。記錄結果和保存數據。
4 統計學處理
統計學方法采用SPSS 17.0 統計軟件分析,計量資料以均數±標準差(mean±SD)表示,報告基因分析中多組之間的差異比較采用單因素方差分析,組間兩兩比較采用Bonferroni法,以P<0.05 為差異有統計學意義。
結 果
1 psiCHECK-2-H19雙螢光素酶報告基因載體的酶切鑒定和測序
psiCHECK-2-H19野生型和psiCHECK-2-H19 突變型酶切鑒定及測序結果均顯示,目的基因H19和其突變型均已成功轉入psiCHECK-2 載體中(圖3)。酶切結果分析可見H19(2 288 bp)在相應的位置切出一條目的條帶(圖3紅色箭頭所指為目的片段),psiCHECK-2-H19雙螢光素酶報告基因載體構建成功。

Figure 3.Endonuclease digestion and sequence analysis of the constructed recombinant plasmid.
圖3 重組質粒酶切鑒定和測序
2 Promega 雙螢光素酶報告基因檢測
雙螢光素酶報告基因檢測顯示,miR-199a-5p模擬物與小鼠H19野生型和突變型報告基因共轉染293T 細胞后,H19野生型miR-199a-5p模擬物組的雙螢光素酶活性相對值與空白組和NC組相比明顯降低,下調約49%(P<0.01),而H19野生型miR-199a-5p抑制劑組雙螢光素酶活性相對值與H19野生型miR-199a-5p模擬物組相比明顯增加,上調48%(P<0.01)。miR-199a-5p模擬物、miR-199a-5p抑制劑、miR-199a-5p模擬物陰性對照和miR-199a-5p 抑制劑陰性對照對H19突變型螢光素酶活性無明顯影響,見圖4。
討 論
lncRNA 作為一類新型的非編碼RNA分子,在表觀遺傳調控、轉錄調控及轉錄后調控中均發揮重要作用[5-7],并且參與了細胞凋亡、增殖、分化等多種生物學過程[8]。lncRNA 已被證實與多種疾病的病理生理進程密切相關。miRNA是一類對基因表達進行負調控的分子,它能夠阻遏靶標基因的翻譯,也可以導致mRNA降解,在轉錄和翻譯水平調節內源基因的表達[9]。現已證實 lncRNA與miRNA存在緊密聯系,它可作為miRNA的前體,經過序列剪切產生 miRNA[10]。由lncRNA單一鏈加工形成的miRNA可分布于多種不同的亞細胞結構并執行相應的生物學功能。不僅如此,lncRNA還能夠與具有相同miRNA應答元件的miRNA相結合,通過內源性競爭抑制效應調節相應miRNA的表達水平,從而影響相關靶基因的表達[11]。
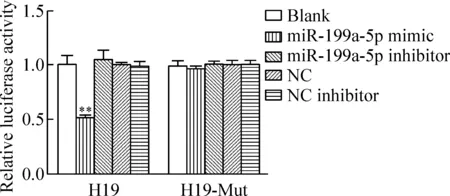
Figure 4.The results of Promega dual-luciferase reporter gene assay. Mean±SD.n=3.**P<0.05vsblank.
圖4 Promega 雙螢光素酶報告基因檢測結果
lncRNA-H19是最先被報道的lncRNA之一,也是最早發現的印記基因之一,進化上高度保守,胚胎發育期呈高表達,出生后在大多數組織中表達下調[12],在調控細胞生長、凋亡、擴增及分化中具有重要作用,它能夠促進細胞生長和對抗凋亡[13-14],而miR-199a-5p則被證實能夠抑制細胞生存和產生促凋亡效應[15],小鼠的基因組在DNA和轉錄水平上與人類高度相似,目前小鼠模型已經用于研究多種人類疾病,其在功能基因組學和臨床前藥物研發等領域是一個十分重要的模型系統。本研究首先采用生物信息學網站RegRNA 2.0數據庫預測獲得小鼠lncRNA-H19和miR-199a-5p的可能結合位點,在此基礎上構建含有小鼠H19野生型和突變型質粒的雙螢光素酶報告載體,經雙螢光素酶報告基因檢測分析H19與miR-199a-5p之間的靶向作用關系。我們發現,miR-199a-5p轉染組含H19野生型報告基因的螢光素酶活性顯著降低,miR-199a-5p 抑制劑組H19 野生型報告基因的螢光素酶活性則較miR-199a-5p組明顯增加,而miR-199a-5p模擬物、miR-199a-5p抑制劑以及陰性對照對H19突變型的表達均無明顯影響。以上結果說明了lncRNA-H19與miR-199a-5p存在靶向結合作用,其在轉錄后水平對miR-199a-5p 有直接的抑制作用。而lncRNA-H19對miR-199a-5p的這種抑制作用對細胞生物學行為方面的具體影響如何將有待于我們在今后的研究中做進一步的深入探索。
[1] Hou J, Zhou C, Long H, et al. Long noncoding RNAs: novel molecules in cardiovascular biology, disease and regeneration [J]. Exp Mol Pathol, 2016, 100(3):493-501.
[2] Eguchi T, Kuboki T. Cellular reprogramming using defined factors and microRNAs [J]. Stem Cells Int, 2016, 2016:7530942.
[3] Liu L, Yang J, Zhu X, et al. Long noncoding RNA H19 competitively binds miR-17-5p to regulate YES1 expression in thyroid cancer [J]. FEBS J, 2016, 283(12):2326-2339.
[4] Su Z, Zhi X, Zhang Q, et al. LncRNA H19 functions as a competing endogenous RNA to regulate AQP3 expression by sponging miR-874 in the intestinal barrier [J]. FEBS Lett, 2016, 590(9):1354-1364.
[5] 覃偉峰, 仉紅剛. lncRNA在心血管疾病中作用的研究進展 [J].中國病理生理雜志,2016,32(8):1471-1477.
[6] Schmitz SU, Grote P, Herrmann BG. Mechanisms of long noncoding RNA function in development and disease [J]. Cell Mol Life Sci, 2016, 73(13):2491-2509.
[7] Boon RA, Jaé N, Holdt L, et al. Long noncoding RNAs: from clinical genetics to therapeutic targets? [J]. J Am Coll Cardiol, 2016, 67(10):1214-1226.
[8] Piccoli MT, Gupta SK, Thum T. Noncoding RNAs as regulators of cardiomyocyte proliferation and death [J]. J Mol Cell Cardiol, 2015, 89(Pt A):59-67.
[9] Brümmer A, Hausser J. MicroRNA binding sites in the coding region of mRNAs: extending the repertoire of post-transcriptional gene regulation [J]. Bioessays, 2014, 36(6):617-626.
[10]Zhuang M, Gao W, Xu J, et al. The long non-coding RNA H19-derived miR-675 modulates human gastric can-cer cell proliferation by targeting tumor suppressor RUNX1 [J]. Biochem Biophys Res Commun, 2014, 448(3):315-322.
[11]Ergun S, Oztuzcu S. Oncocers: ceRNA-mediated cross-talk by sponging miRNAs in oncogenic pathways [J]. Tumour Biol, 2015, 36(5):3129-3136.
[12]Ratajczak MZ. Igf2-H19, an imprinted tandem gene, is an important regulator of embryonic development, a guardian of proliferation of adult pluripotent stem cells, a regulator of longevity, and a ‘passkey’ to cancerogenesis[J]. Folia Histochem Cytobiol, 2012, 50(2):171-179.
[13]Kawahara M, Wu Q, Kono T. Involvement of insulin-like growth factor 2 in angiogenic factor transcription in bi-maternal mouse conceptuses [J]. J Reprod Dev, 2010, 56(1):79-85.
[14]He P, Zhang Z, Huang G, et al. miR-141 modulates osteoblastic cell proliferation by regulating the target gene of lncRNA H19 and lncRNA H19-derived miR-675[J]. Am J Transl Res, 2016, 8(4):1780-1788.
[15]Song J, Gao L, Yang G, et al. MiR-199a regulates cell proliferation and survival by targeting FZD7 [J]. PLoS One, 2014, 9(10):e110074.
(責任編輯: 林白霜, 羅 森)
Identification of targeting relationship between mouse lncRNA-H19 and miR-199a-5p by dual-luciferase reporter assay
HOU Jing-ying1, ZHOU Chang-qing1, ZHENG Shao-xin2, GUO Tian-zhu1, LONG Hui-bao1, WU Quan-hua1, ZHONG Ting-ting1, WU Hao1, WANG Lei1, WANG Tong1
(1DepartmentofEmergency,2DepartmentofCardiology,SunYat-senMemorialHospitalofSunYat-senUniversity,Guangzhou510120,China.E-mail:tongwang316@163.com)
AIM: To validate the association between long noncoding (lncRNA)-H19 and microRNA-199a-5p (miR-199a-5p) through the dual-luciferase reporter gene system by construction of a luciferase reporter vector containing the gene of lncRNA-H19. METHODS: The potential complementary binding sites of lncRNA-H19 and miR-199a-5p were predicted by RegRNA 2.0. The H19 gene or its mutant (Mut) fragment was cloned into luciferase reporter vector psiCHECK-2. Restriction enzyme analysis and sequence analysis were used to identify whether the recombinant plasmids of the H19 and H19-Mut were successfully constructed. miR-199a-5p mimics, miR-199a-5p inhibitor, miR-199a-5p mimics negative control or miR-199a-5p inhibitor negative control was co-transfected into the 293T cells with the luciferase reporters containing H19 or H19-Mut. Dual-luciferase reporter assay was performed to detect the luciferase activity in different groups in order to verify the relationship between lncRNA-H19 and miR-199a-5p.RESULTS: The results of double enzyme digestion and DNA sequencing showed that the sequence of luciferase reporter vector was correct. The results of dual-luciferase reporter assay indicated that the H19 reporter gene luciferase activity significantly decreased in miR-199a-5p mimics group by 49% (P<0.01), and the H19 reporter gene luciferase activity was obviously upregulated in miR-199a-5p inhibitor group compared with miR-199a-5p mimics group (P<0.01). However, miR-199a-5p mimics, miR-199a-5p inhibitor, miR-199a-5p mimics negative control and miR-199a-5p inhibitor negative control showed no effect at H19-Mut reporter gene.CONCLUSION: lncRNA-H19 binds to miR-199a-5p to exert an inhibitory effect at transcriptional level.
Long noncoding RNA-H19; MicroRNA-199a-5p; Dual-luciferase reporter gene
1000- 4718(2016)12- 2256- 05
2016- 08- 23
2016- 10- 27
國家自然科學基金資助項目(No. 81270213; No. 81070125; No. 81670306);廣東省科技計劃(No. 2010B031600032; No. 2014A020211002);高校基本科研業務費中山大學青年教師重點培育項目(No.13ykzd16);廣東省醫學科研基金資助項目(No. A2016264)
R363
A
10.3969/j.issn.1000- 4718.2016.12.022
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 020-34071012; E-mail: tongwang316@163.com

