利拉魯肽通過microRNA-33對2型糖尿病小鼠肝損傷的治療作用
郜 娜, 楊慶宇, 劉秀梅
(1鄭州大學附屬腫瘤醫院, 河南省腫瘤醫院藥學部, 2鄭州人民醫院藥學部,河南 鄭州 450000)
?
利拉魯肽通過microRNA-33對2型糖尿病小鼠肝損傷的治療作用
郜 娜1△, 楊慶宇2, 劉秀梅2
(1鄭州大學附屬腫瘤醫院, 河南省腫瘤醫院藥學部,2鄭州人民醫院藥學部,河南 鄭州 450000)
目的: 觀察利拉魯肽對2型糖尿病小鼠肝組織微小RNA-33(microRNA-33,miR-33)、腺苷酸活化蛋白激酶(AMPK)及肝細胞凋亡通路相關蛋白的影響,探討其可能作用機制,為臨床應用提供藥效學依據。方法: 采用高脂飲食聯合鏈脲佐菌素(STZ)腹腔注射復制C57BL/6小鼠2型糖尿病模型。小鼠隨機分為4組,每組15只:對照組為正常小鼠皮下注射等量的生理鹽水;模型組為T2DM小鼠皮下注射等量的生理鹽水;利拉魯肽低劑量組為T2DM小鼠皮下注射100 μg·kg-1·d-1利拉魯肽;利拉魯肽高劑量組為T2DM小鼠皮下注射200 μg·kg-1·d-1利拉魯肽。給藥4周后進行口服葡萄糖耐量試驗(OGTT),檢測各組小鼠空腹血糖(FBG)、甘油三酯(TG)、總膽固醇(TC)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、丙氨酸氨基轉移酶(ALT)及天冬氨酸氨基轉移酶(AST)的含量;HE染色檢測肝組織病理學變化;免疫熒光檢測肝組織的cleaved caspase-3;Western blot法檢測p-AMPK/AMPK及凋亡相關蛋白Bcl-2、caspase-3的水平;實時定量PCR檢測肝組織miR-33的水平。結果: 與模型組相比,利拉魯肽高、低劑量組小鼠FBG、TG、TC、LDL-C、ALT及AST含量明顯降低,HDL-C含量明顯升高(P<0.05);肝組織病理結構的紊亂得到明顯改善;免疫熒光結果可見,利拉魯肽高、低劑量給藥組小鼠的cleaved caspase-3明顯降低;Western blot實驗結果可見,利拉魯肽高、低劑量給藥組小鼠肝組織的Bcl-2表達明顯增高,caspase-3表達顯著下降(P<0.05),肝組織AMPK磷酸化水平顯著增加(P<0.01);且肝組織miR-33水平顯著降低(P<0.01),且呈一定的劑量依賴性。結論: 利拉魯肽可以緩解2型糖尿病小鼠肝損傷,其機制可能與降低肝組織miR-33表達,從而增加AMPK磷酸化水平,進而抑制肝細胞凋亡有關。
利拉魯肽; 微小RNA-33; 腺苷酸活化蛋白激酶; 肝細胞凋亡
糖尿病肝損傷是繼發于糖尿病,以肝功能損害為特點的慢性并發癥,表現為肝臟組織學和功能變化的改變。糖尿病導致脂質代謝紊亂,肝內脂肪酸增多,脂肪在肝細胞中堆積形成脂肪肝,甚至演變為肝硬化,進而加重糖尿病肝損傷。近年來研究表明肝細胞凋亡是加速肝損傷的關鍵因素之一[1]。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是廣泛分布于生物體內的高度保守的蛋白激酶,具有抗氧化應激、抗炎、抗增殖和抗凋亡等多種生物學作用,可從多途徑影響脂代謝,包括抑制脂肪酸與甘油三酯的合成,抑制膽固醇的合成以及促進脂肪酸氧化分解等,且AMPK在抑制肝細胞凋亡方面具有很重要作用[2]。Jung 等[3]與Wu[4]等均報道,AMPK的激活可抑制肝細胞過度氧化應激和改善線粒體功能。MicroRNA與脂質代謝密切相關,參與調控三酰甘油和膽固醇的合成、脂肪酸的氧化與合成、相關酶的活性等[5-6]。并有報道微小RNA-33(microRNA-33,miR-33)能夠靶向沉默AMPK,控制甘油三酯的合成[7]。屈展[8]的研究亦表明,在人肝癌細胞(HepG2)中,miR-33可影響細胞內甘油三酯的水平,其可能機制為靶向結合AMPK沉默其表達來調控細胞內甘油三酯的代謝。利拉魯肽(liraglutide,商品名Victoza,中文名“諾和力”)是長效人胰高血糖素樣肽1(glucagon-like peptide 1,GLP-1)類似物,其作為新型抗糖尿病藥物已被廣泛應用。研究表明利拉魯肽除降糖,亦有多種作用,如可明顯降低糖尿病大鼠肝臟內的脂質含量,減輕糖尿病大鼠肝臟病變;可減少游離脂肪酸和細胞因子誘導的β細胞凋亡[9]。本實驗在2型糖尿病(type 2 diabetes mellitus,T2DM)C57BL/6小鼠模型上研究糖尿病肝損傷過程是否與miR-33-AMPK相關,且利拉魯肽是否通過調控miR-33改善糖尿病肝損傷。
材 料 和 方 法
1 實驗動物、試劑和儀器
雄性C57BL/6小鼠,18~22 g,購自北京維通利華實驗動物技術有限公司,合格證編號為SCXK(京)2011-0001。利拉魯肽購自諾和諾德制藥有限公司,國藥準字J20110026;血糖、總膽固醇(total choleste-rol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白膽固醇(high-density lipoprotein cholesterol,HDL-C)、丙氨酸氨基轉移酶(alanine aminotransferase,ALT)及天冬氨酸氨基轉移酶(aspartate aminotransferase,AST)試劑盒均購自南京建成生物工程研究所;BCA蛋白濃度測定試劑盒生產于碧云天生物技術公司;I 抗GAPDH、AMPK、p-AMPK、Bcl-2、caspase-3、cleaved caspase-3及 II 抗購自CST;FITC熒光 II抗購自武漢奈德生命科技有限責任公司;Hoechst33342購自上海前生生物科技有限公司。低溫超速離心機(Thermo);Western blot電泳系統(Bio-Rad);凝膠成像系統(Tanon);熒光顯微鏡(OLYMPUS);分析天平(METTLER TOLEDO)。
2 方法
2.1 動物分組、模型復制及給藥 所有80只小鼠飼養于清潔級環境中,溫度25 ℃,濕度55%~65%,維持12 h/12 h明暗交替。適應性喂養1周后,其中65只高脂喂養4周后,腹腔注射100 mg/kg鏈脲菌素(streptozocin,STZ)復制T2DM小鼠模型,4周后檢測空腹血糖,選取血糖在7.8~15 mmol/L的45只小鼠納入實驗并隨機分為3組,即模型組:T2DM小鼠皮下注射等量的生理鹽水;利拉魯肽低劑量組:T2DM小鼠皮下注射100 μg·kg-1·d-1利拉魯肽;利拉魯肽高劑量組:T2DM小鼠皮下注射200 μg·kg-1·d-1利拉魯肽。其余15只正常小鼠作為對照組,皮下注射等量的生理鹽水。給藥4周后,摘眼球取血,3 500 r/min離心15 min,吸取上清保存于-80 ℃冰箱中待用。分離肝臟,一部分保存于-80 ℃冰箱,一部分固定于10%的甲醛溶液中待用。
2.2 生化指標的測定 小鼠禁食12 h后,眼眶靜脈叢取血,檢測空腹血糖(fasting blood glucose,FBG)、TC、TG、HDL-C、LDL-C、ALT 及AST含量。
2.3 口服葡萄糖耐量實驗(oral glucose tolerance test,OGTT) 給藥4周后進行OGTT,所有小鼠禁食過夜后,給予40%葡萄糖(2 g/kg)處理,分別于0 min、30 min、60 min、90 min和120 min眼眶靜脈叢采取血樣,3 500 r/min離心15 min,吸取上清用于測定血糖。
2.4 HE染色 將固定于10%甲醛溶液中的肝組織脫水后常規石蠟包埋,切片。切片經二甲苯脫蠟,梯度酒精水化,伊紅染色,蘇木精復染,梯度脫水,二甲苯透明,樹脂封片,光鏡下觀察,進行病理學分析。
2.5 免疫熒光檢測肝組織的cleaved caspase-3 將固定于10%甲醛中的肝組織脫水后常規石蠟包埋,切片。切片如下處理:二甲苯脫蠟,梯度乙醇復水,PBS洗5 min 3次,5%~10%山羊血清室溫孵育30 min,0.3% Triton X打孔, I 抗cleaved caspase-3(1∶100)孵育過夜,PBS洗5 min 3次,熒光II抗(1∶200)室溫避光孵育120 min,PBS洗5 min 3次,Hoechst 33342室溫避光染色120 min,PBS洗5 min 3次,封片,顯微鏡下觀察。
2.6 Western blot法檢測AMPK及凋亡相關蛋白表達 提取肝組織蛋白,測定樣品蛋白含量并稀釋樣本,配制5%濃縮膠、12%和15%分離膠,上樣,電泳,轉膜,于5% BSA或 5%脫脂奶粉封閉液于室溫封閉2 h,TBST洗膜5 min 3次,加入I抗[AMPK(1∶1 000)、p-AMPK(1∶1 000)、Bcl-2(1∶1 000)、caspase-3(1∶1 000)和GAPDH(1∶5 000)],4 ℃冰箱過夜孵育,TBST洗膜5 min 3次,II 抗(1∶5 000)室溫孵育2 h,TBST洗膜5 min 3次,ECL化學發光法顯色,使用Quantity One軟件對結果進行分析。
2.7 Real-time PCR檢測肝組織中miR-33水平 采用TRIzol兩步法抽提小鼠肝組織總RNA,按照逆轉錄試劑盒說明書進行逆轉錄操作。采用20 μL反應體系,反應條件為:42 ℃ 30 min; 85 ℃ 5 min。所得cDNA于-20 ℃中保存待用。
采用real-time PCR 檢測小鼠肝組織中 miR-33含量,以U6作為內參照。miR-33的上游引物為5′-GCCGTGCATTGTAGTTGC-3′,下游引物為5′-GTGCAGGGTCCGAGGT-3′;U6的下游引物為5′-AACGCTTCACGAATTGCG-3′,上游引物為5′-CTCGCTTCGGCAGCACATA-3′。PCR反應條件為:95 ℃ 10 min; 95 ℃ 15 s, 60 ℃ 1 min, 40個循環; 95 ℃ 15 s, 60 ℃ 30 s, 95 ℃ 15 s。miR-33含量按公式2-ΔΔCt計算。
3 統計學處理
統計學處理計量資料均以均數±標準誤(mean±SEM)表示,使用SPSS 17.0軟件進行數據統計。組間比較采用單因素方差分析(one-way ANOVA),兩兩比較采用SNK-q檢驗,以P<0.05為方差有統計學意義。
結 果
1 各組小鼠血清生化指標的變化
與對照組相比,模型組小鼠血糖水平顯著升高(P<0.01),脂質代謝嚴重紊亂即血清中TC、TG、LDL-C、ALT及AST含量顯著升高(P<0.01),HDL-C含量顯著降低(P<0.05);與模型組比較,利拉魯肽高、低劑量組小鼠空腹血糖明顯降低(P<0.05),脂質代謝紊亂得到一定改善,即血清中TC、TG、LDL-C、ALT及AST含量明顯降低(P<0.05),HDL-C含量明顯升高(P<0.05),且呈劑量依賴性,見表1。
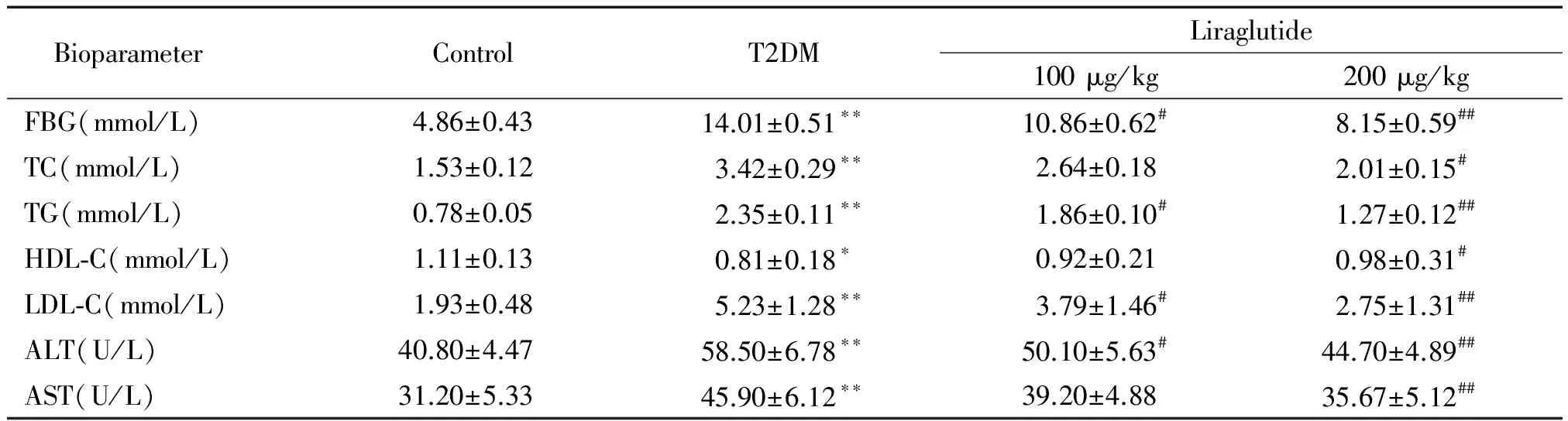
表1 各組小鼠血清生化指標
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsT2DM group.
2 葡萄糖耐量實驗
對照組、模型組以及利拉魯肽高、低劑量組小鼠血糖均在給予葡萄糖30 min后達到峰值,隨后下降。與對照組相比,模型組小鼠血糖在各時點處在高水平狀態;與模型組比較,利拉魯肽高、低劑量組小鼠血糖水平有顯著下降,且呈劑量依賴性。曲線下面積計算結果亦顯示模型組明顯高于對照組,而給藥組明顯低于模型組(P<0.05),見圖1。
3 利拉魯肽對糖尿病小鼠肝組織病理學變化的影響
對照組小鼠肝組織結構正常,肝細胞索、肝竇排列規則,且肝小葉分界明顯,肝細胞胞質均勻,無顆粒、脂肪、纖維變性等;而模型組小鼠肝組織結構紊亂,肝細胞索、肝竇排列不規則,肝細胞腫大、輕度變形;給藥組小鼠肝組織趨于正常,肝細胞索、肝竇排列較規則,且高劑量組治療作用優于低劑量組,見圖2。
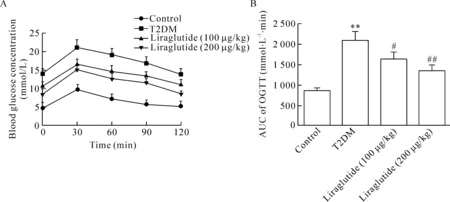
Figure 1.Curves of blood glucose concentration versus time (A) and area under the curve (AUC; B) in oral glucose tolerance test (OGTT). Mean±SEM.n=15.**P<0.01vscontrol group;#P<0.05,##P<0.01vsT2DM group.
圖1 OGTT曲線及OGTT曲線下面積
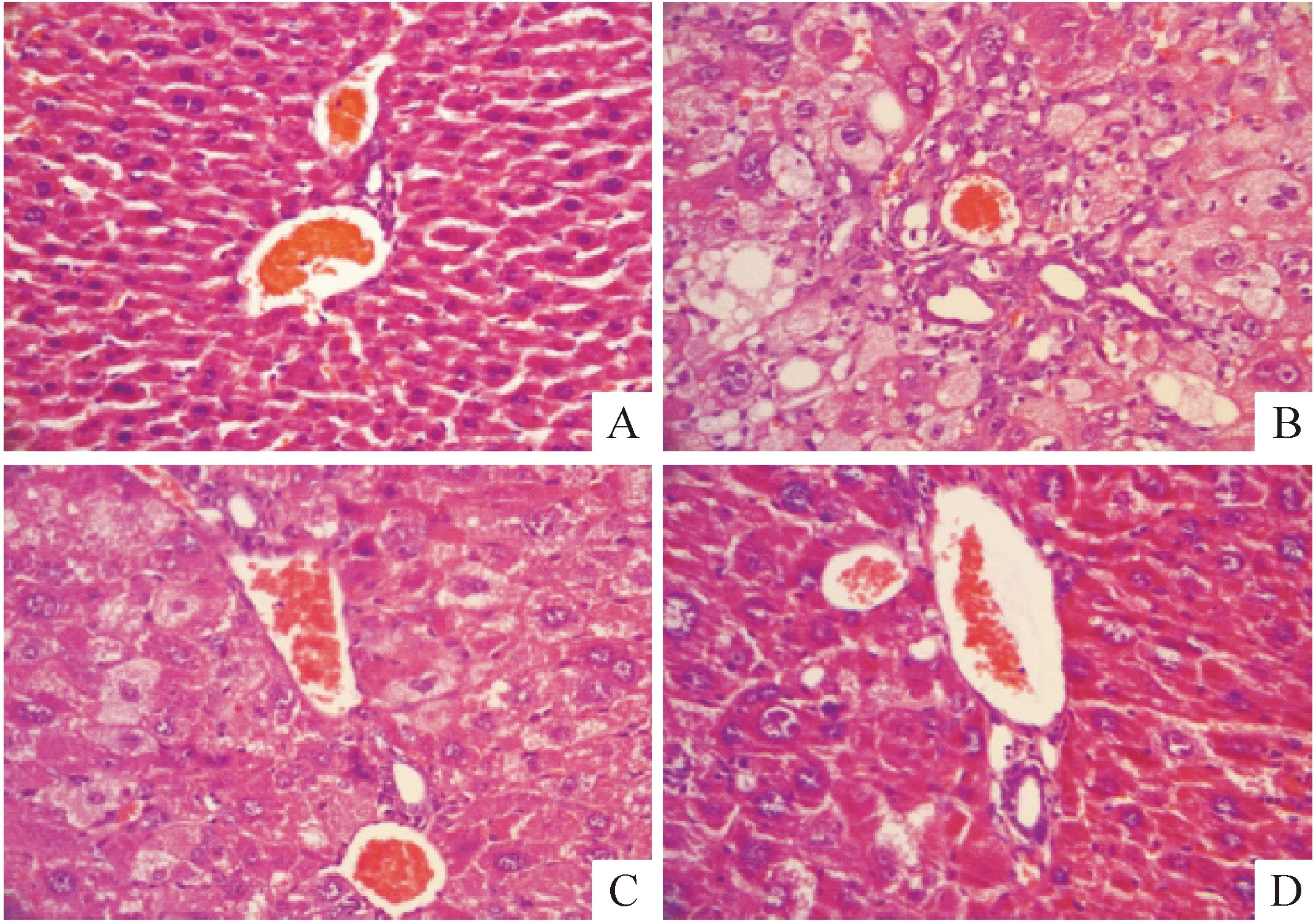
Figure 2.Histological examination of liver in each group (HE staining, ×200). A: control; B: model; C: liraglutide (100 μg/kg); D: liraglutide (200 μg/kg).
圖2 各組小鼠肝臟病理學檢查
4 免疫熒光檢測肝組織cleaved caspase-3的變化
與對照組比較,模型組小鼠肝組織綠色熒光強度明顯增強,cleaved caspase-3明顯增加;與模型組比較,利拉魯肽高、低劑量組小鼠肝組織綠色熒光強度明顯減弱,cleaved caspase-3明顯降低,且呈劑量依賴性,見圖3。
5 利拉魯肽對肝組織AMPK及凋亡相關蛋白的影響
與對照組相比,模型組小鼠AMPK磷酸化水平顯著降低,凋亡抑制蛋白Bcl-2表達明顯降低,凋亡相關蛋白caspase-3剪切水平明顯增加,差異具有統計學顯著性(P<0.01);與模型組相比,利拉魯肽高、低劑量組小鼠肝組織AMPK磷酸化水平明顯升高,凋亡抑制蛋白Bcl-2表達明顯升高,凋亡相關蛋白caspase-3剪切水平明顯降低,差異具有統計學意義(P<0.05),且呈劑量依賴性,見圖4。
6 利拉魯肽對肝組織miR-33表達的影響
與對照組比較,模型組小鼠肝組織中的miR-33含量顯著增加(P<0.01);與模型組比較,利拉魯肽高、低劑量組小鼠肝組織中的miR-33含量明顯降低(P<0.05),且呈劑量依賴性,見圖5。
討 論
繼心血管疾病和惡性腫瘤之后,糖尿病作為第三大嚴重危害人類健康的疾病,其發病率在全球范圍內逐年上升。糖尿病性肝損傷是一種常見的糖尿病并發癥,但由于肝臟巨大的代償功能,其臨床表現隱匿,容易被忽視[10]。因此,明確糖尿病肝損傷的發病機制以及尋求有效的藥物治療具有非常重要的意義。

Figure 3.Expression of cleaved caspase-3 in liver detected by immunofluorescence. A: control; B: model; C: liraglutide (100 μg/kg); D: liraglutide (200 μg/kg).
圖3 免疫熒光檢測肝組織的cleaved caspase-3
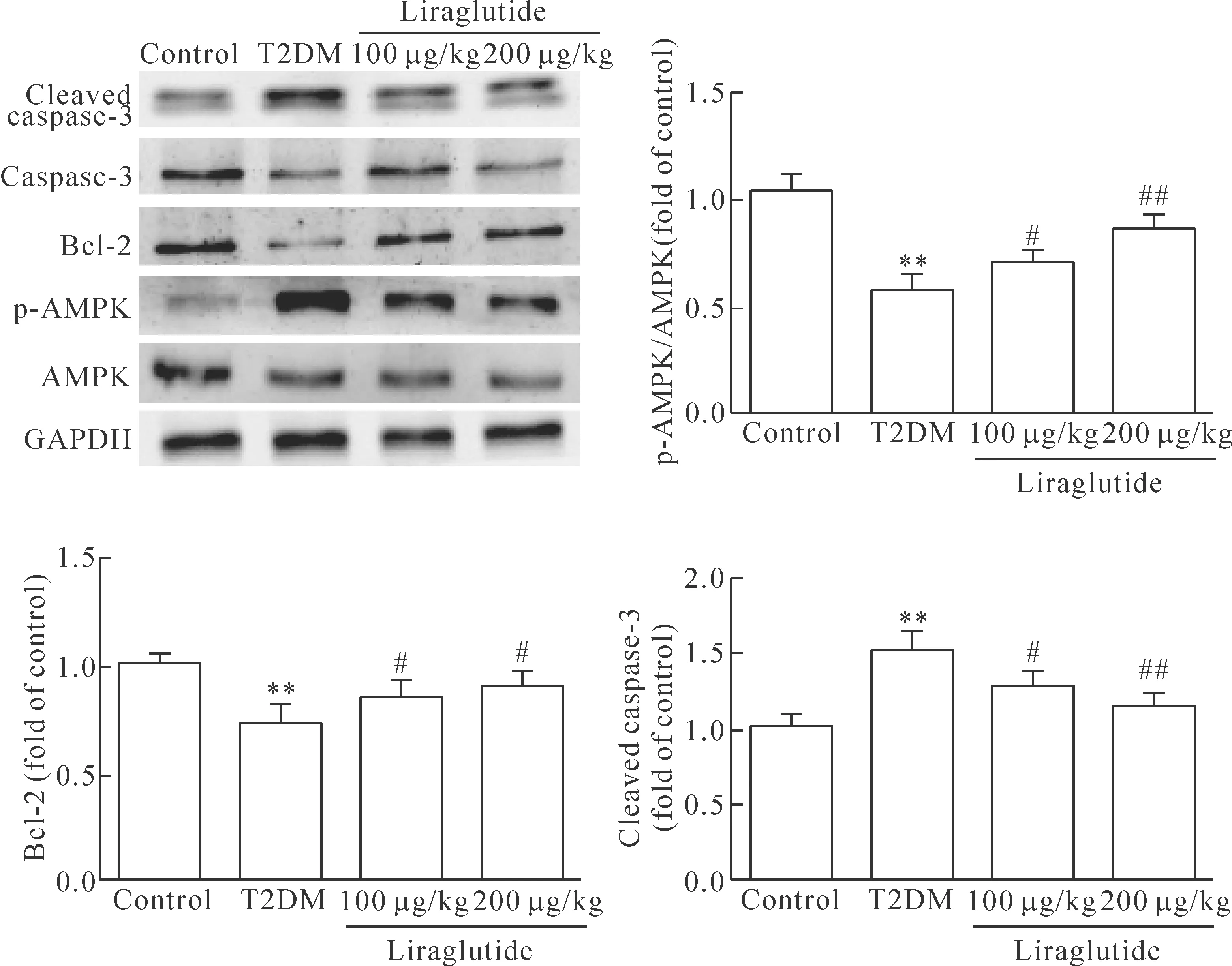
Figure 4.Expression of AMPK, Bcl-2 and caspase-3 in liver of each group. Mean±SEM.n=6.**P<0.01vscontrol group;#P<0.05,##P<0.01vsT2DM group.
圖4 各組小鼠肝組織中AMPK及凋亡相關蛋白的表達
越來越多的研究表明胰島素抵抗可能是糖尿病肝損傷的啟動因素,外周胰島素抵抗導致脂肪組織的脂解作用增強,肝臟內三酰甘油及游離脂肪酸的含量增加,從而誘導氧化應激并引起肝細胞的凋亡。進而,肝損傷又加重胰島素抵抗,導致脂質過氧化、肝細胞炎癥壞死及纖維化等[11-12]。AMPK是廣泛分布于生物體內的高度保守的蛋白激酶,具有多種生物學作用,參與調控多種疾病的發生過程,在控制機體代謝平衡方面發揮重要作用。AMPK可從多種途徑影響脂質代謝,包括抑制脂肪酸和甘油三酯的合成,抑制膽固醇的合成以及促進脂肪酸氧化分解等。此外,AMPK在抑制肝細胞凋亡方面具有很重要作用。
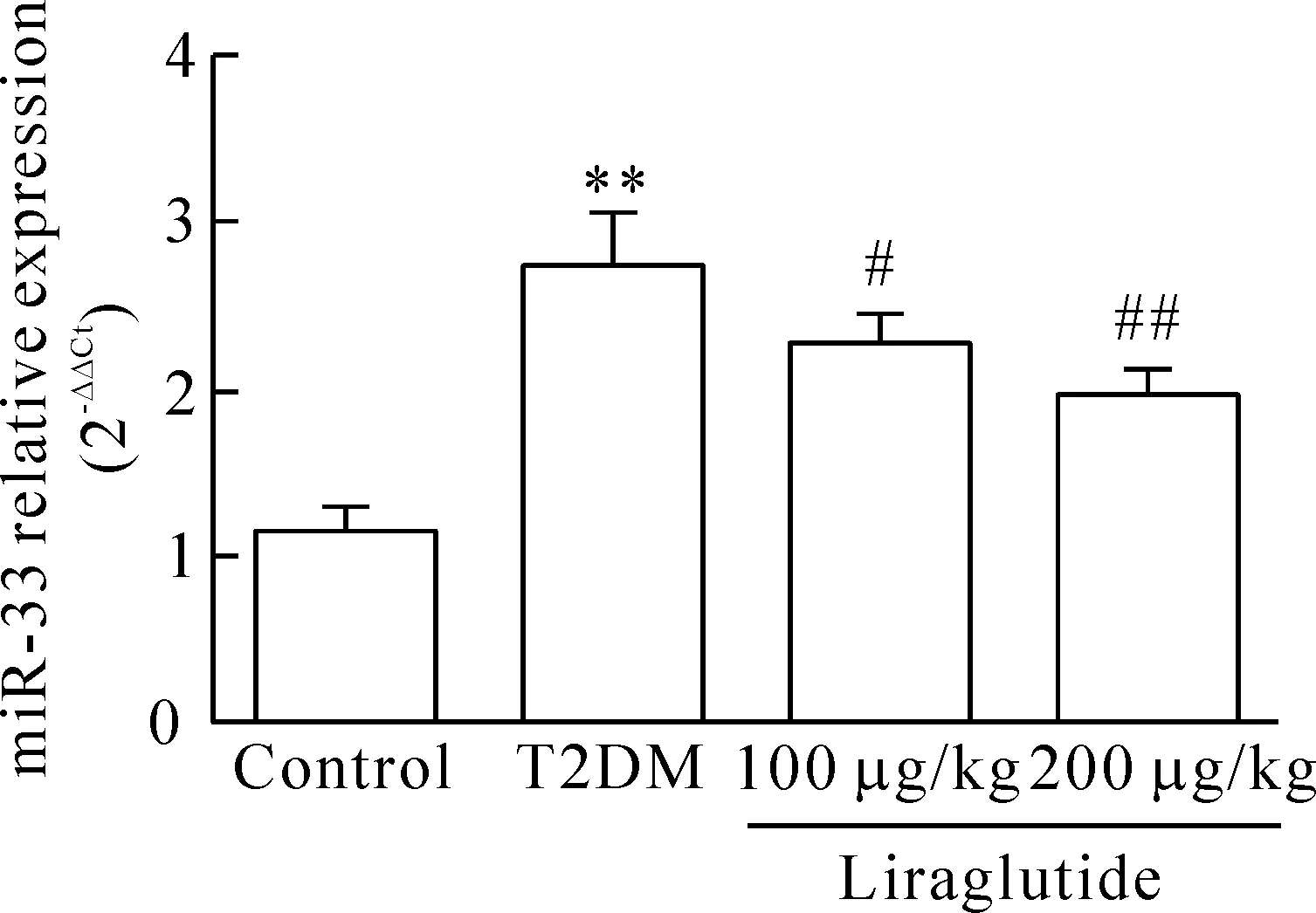
Figure 5.Expression of miR-33 in liver of each group. Mean±SEM.n=6.**P<0.01vscontrol group;#P<0.05,##P<0.01vsT2DM group.
圖5 各組小鼠肝組織miR-33含量的變化
利拉魯肽是長效人GLP-1的類似物,其作為新型抗糖尿病藥物已廣泛應用于臨床。研究表明利拉魯肽具有降血糖以外的多種作用,利拉魯肽顯著減少糖尿病大鼠肝臟內的脂質含量,減輕糖尿病大鼠肝臟病變;減少細胞因子和游離脂肪酸誘導的β細胞凋亡。
本文主要探討利拉魯肽通過調節miR-33-AMPK抑制肝細胞凋亡的作用機制。利拉魯肽能夠明顯改善糖尿病小鼠肝臟病理變化,與模型組比較,HE染色結果顯示利拉魯肽組小鼠組織趨于正常,肝臟肝細胞索、肝竇排列較規則。利拉魯肽能夠顯著降低糖尿病小鼠血糖血脂水平及脂質堆積,血清生化指標結果顯示利拉魯肽組FBS、TG、TC、LDL-C、ALT及AST含量明顯降低,HDL-C含量明顯升高。免疫熒光結果顯示肝組織cleaved caspase-3明顯降低,Western blot實驗結果顯示Bcl-2表達明顯降低,caspase-3表達水平明顯增加,其機制可能與利拉魯肽通過降低肝組織miR-33水平,進而抑制AMPK磷酸化有關。
綜上所述,糖尿病小鼠肝組織的miR-33含量增加,抑制AMPK磷酸化水平,加速肝細胞凋亡;利拉魯肽可顯著降低肝組織中miR-33的含量,進而使AMPK活化程度增加,抑制肝細胞凋亡。
[1] Jou J, Choi SS, Diehl AM. Mechanisms of disease progression in nonalcoholic fatty liver disease[J]. Semin Liver Dis, 2008, 28(4):370-379.
[2] Viollet B, Guigas B, Leclerc J, et al. AMP-activated protein kinase in the regulation of hepatic energy metabolism: from physiology to therapeutic perspectives[J]. Acta Physiol (Oxf), 2009, 196(1):81-98.
[3] Jung EH, Lee JH, Kim SC, et al. AMPK activation by liquiritigenin inhibited oxidative hepatic injury and mitochondrial dysfunction induced by nutrition deprivation as mediated with induction of farnesoid X receptor[J]. Eur J Nutr, 2015, Dec 8. [Epub ahead of print]
[4] Wu SB, Wu YT, Wu TP, et al. Role of AMPK-mediated adaptive responses in human cells with mitochondrial dysfunction to oxidative stress[J]. Biochim Biophys Acta, 2014, 1840(4):1331-1344.
[5] Moore KJ, Rayner KJ, Suárez Y, et al. The role of microRNAs in cholesterol efflux and hepatic lipid metabolism[J]. Annu Rev Nutr, 2011, 31:49-63.
[6] Fernández-Hernando C, Suárez Y, Rayner KJ, et al. MicroRNAs in lipid metabolism[J]. Curr Opin Lipidol, 2011, 22(2):86-92.
[7] Rottiers V, Najafi-Shoushtari SH, Kristo F, et al. MicroRNAs in metabolism and metabolic diseases[J]. Cold Spring Harb Symp Quant Biol, 2011, 76:225-233.
[8] 屈 展. 二甲雙胍對肝癌細胞體內外增殖及凋亡的影響及其機制研究[D]. 長沙: 中南大學, 2012.
[9] Samson SL, Bajaj M. Potential of incretin-based therapies for non-alcoholic fatty liver disease[J]. J Diabetes Complications, 2013, 27(4):401-406.
[10]Wlazlo N, Beijers HJ, Schoon EJ, et al. High prevalence of diabetes mellitus in patients with liver cirrhosis[J]. Diabet Med, 2010, 27(11):1308-1311.
[11]Bianchi G, Bugianesi E, Frystyk J, et al. Adiponectin isoforms, insulin resistance and liver histology in nonalcoholic fatty liver disease[J]. Dig Liver Dis, 2011, 43(1):73-77.
[12]Sanyal AJ, Campbell-Sargent C, Mirshahi F, et al. Nonalcoholic steatohepatitis: association of insulin resistance and mitochondrial abnormalities[J]. Gastroenterology, 2001, 120(5):1183-1192.
(責任編輯: 陳妙玲, 羅 森)
Liraglutide ameliorates liver injury of type 2 diabetic mice via micro-RNA-33-AMPK pathway
GAO Na1, YANG Qing-yu2, LIU Xiu-mei2
(1DepartmentofPharmacy,AffiliatedTumorHospitalofZhengzhouUniversity,HenanCancerHospital,2DepartmentofPharmacy,People’sHospitalofZhengzhou,Zhengzhou450000,China.E-mail:gn_submit@163.com)
AIM: To observe the effects of liraglutide on the level of microRNA-33 (miR-33) and the expression of AMP-activated protein kinase (AMPK) and apoptosis-related proteins in mice with type 2 diabetes mellitus (T2DM), and to explore its possible mechanism. METHODS: High-fat diet and intraperitoneal injection of streptozocin were used to establish the type 2 diabetic model in C57BL/6 mice. The mice were randomly divided into 4 groups (n=15): in control group, the normal mice were subcutaneously injected with equivalent volume of saline; in model group, the T2DM mice were subcutaneously injected with equivalent volume of saline; in low- and high-dose liraglutide treatment groups, the T2DM mice were subcutaneously injected with 100 and 200 μg·kg-1·d-1, respectively. After 4 weeks of administration, the levels of FBG, TG, TC, HDL-C, LDL-C, ALT and AST were determined. HE staining was used to observe the pathological changes of the liver tissues. The protein level of cleaved caspase-3 in the liver tissue was detected by the technique of immunofluorescence. The protein levels of p-AMPK/AMPK and apoptosis-related proteins were detected by Western blot. The expression of miR-33 in the liver tissues was detected by real-time PCR. RESULTS: Compared with model group, the contents of FBG, TG, TC, LDL-C, ALT and AST were decreased significantly, while the content of HDL-C was increased significantly in low-dose liraglutide group and high-dose liraglutide group (P<0.05). The protein levels of phosphorylated AMPK and Bcl-2 were up-regulated significantly, and the expression of cleaved caspase-3 was down-regulated significantly (P<0.05). The level of miR-33 was decreased significantly (P<0.01). CONCLUSION: Liraglutide alleviates liver injury in type 2 diabetic mice, and the mechanism may be associated with reducing the level of miR-33 and increasing the phosphorylation of AMPK in the liver tissues, thereby inhibiting hepatocyte apoptosis.
Liraglutide; MicroRNA-33; AMP-activated protein kinase; Hepatocyte apoptosis
1000- 4718(2017)01- 0086- 06
2016- 04- 05
2016- 07- 13
R587.1; R363
A
10.3969/j.issn.1000- 4718.2017.01.014
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 0371-65587016; E-mail: gn_submit@163.com

