血管緊張素Ⅱ 2型受體拮抗劑EMA401對神經性疼痛模型大鼠的鎮痛效應及機制研究*
肖韓艷, 張本卓, 韓麗萍, 徐 鳳
(牡丹江醫學院第二附屬醫院 1神經內科, 2兒科, 3老年病科,黑龍江 牡丹江 157011)
?
血管緊張素Ⅱ 2型受體拮抗劑EMA401對神經性疼痛模型大鼠的鎮痛效應及機制研究*
肖韓艷1, 張本卓1, 韓麗萍2, 徐 鳳3△
(牡丹江醫學院第二附屬醫院1神經內科,2兒科,3老年病科,黑龍江 牡丹江 157011)
目的: 觀察血管緊張素Ⅱ 2型受體拮抗劑EMA401對坐骨神經慢性壓迫性損傷(chronic constriction injury,CCI)模型大鼠的鎮痛效應及背根神經節(dorsal root ganglion,DRG)生長相關蛋白43(growth-associated protein-43,GAP-43)、蛋白激酶C(protein kinase C,PKC)和鈣調素(calmodulin,CaM)表達的影響。方法: 采用SD大鼠建立CCI模型,隨機分為4組:模型組(model組),給予等體積生理鹽水灌胃;低劑量組,按照EMA401 5 mg/kg劑量灌胃;中劑量組,按照EMA401 10 mg/kg劑量灌胃;高劑量組,按照EMA401 20 mg/kg劑量灌胃。另設假手術組,給予等體積生理鹽水灌胃。各組于術前、術后7 d、14 d和28 d同一時間測定熱縮足反射潛伏期(thermal withdrawal latency,TWL)和機械縮足閾值(mechanical withdrawal threshold,MWT)行為學指標。行為學檢測完畢后,各組大鼠取腰段DRG,采用鄰甲酚酞絡合銅微板法檢測DRG內Ca2+濃度,采用Western blotting和RT-PCR分析檢測DRG內GAP-43、PKC和CaM蛋白和mRNA的相對表達量。結果: 與model組比較,EMA401顯著升高CCI大鼠TWL和MWT(P<0.05);與model組比較,EMA401顯著降低DRG內Ca2+濃度及GAP-43、PKC、CaM蛋白和mRNA的相對表達量(P<0.05)。結論: EMA401對CCI大鼠具有明顯的鎮痛效應,其機制可能與抑制DRG內Ca2+濃度及GAP-43、PKC、CaM表達有關。
EMA401; 神經性疼痛; 生長相關蛋白43; 蛋白激酶C; 鈣調素
神經性疼痛(neuropathic pain)是由于多種誘因引起的外周或中樞神經系統最初的損傷或功能紊亂而導致的慢性疼痛,患病率為1%~8%,臨床上可表現為燒灼痛和痛覺異常、自發性疼痛、痛覺過敏等,其患病率高,病因復雜,嚴重影響患者的生活質量[1-2]。近年來,神經性疼痛機制存在多種學說,其中以中樞敏化學說研究較多,但是具體機制仍然不清。中樞敏化是產生神經性疼痛敏感的重要原因,具有存在上揚現象和長時程增強效應(long-term potentiation,LTP)的特點。
已知血管緊張素II(angiotensin II,Ang II)參與了神經性疼痛的機制。EMA401是一種新型小分子高選擇性血管緊張素II 2型受體(angiotensin II type 2 receptor,AT2R)拮抗劑,對神經性疼痛具有明顯的鎮痛作用[3]。據報道,EMA401可通過抑制脊髓背根神經節(dorsal root ganglion,DRG)內Ang II/神經生長因子(nerve growth factor,NGF)/瞬時受體電位香草酸受體1(transient receptor potential vanilloid subfamily member 1,TRPV1)信號通路而對神經性疼痛產生鎮痛效應[4]。但是,關于EMA401與神經性疼痛中樞敏化的關系鮮見報道。故此,本研究通過建立坐骨神經慢性壓迫性損傷(chronic constriction injury,CCI)模型,觀察EMA401對神經性疼痛的鎮痛效應,并且進一步觀察其對DRG內Ca2+濃度及蛋白激酶C(protein kinase C,PKC)、鈣調素(calmodulin,CaM)和生長相關蛋白43(growth-associated protein-43,GAP-43)表達的影響,探討EMA401對神經性疼痛的鎮痛效應的可能機制,為其臨床應用提供理論依據。
材 料 和 方 法
1 材料
1.1 實驗動物 健康SPF級雄性SD大鼠60只,體重(200±20)g,自由攝食飲水,光照周期12 h/12 h,室溫(20±2)℃,濕度40%~60%飼養。由哈爾濱醫科大學動物實驗中心提供,實驗動物合格證號為P00102008。
1.2 藥物和試劑 EMA401(Spinifex)純度>99.0%,以生理鹽水配制成2 g/L溶液,4 ℃儲存,備用;Ca2+檢測試劑盒(北京百奧萊博科技有限公司);小鼠抗大鼠GAP-43抗體、CaM多克隆抗體、PKC多克隆抗體、兔抗GAPDH多克隆抗體和過氧化物酶標記的IgGⅡ抗(Santa Cruz);ECL化學發光試劑盒(中杉金橋公司);二喹啉酸(bicinchoninic acid,BCA)蛋白定量試劑盒(北京原平皓生物技術有限公司);RT-qPCR試劑盒(上海生物科技公司)。
1.3 主要儀器 Vonfrey 測痛套件(DanMic Glo-bal);熱輻射測痛儀(IITC Life Science);紫外分光光度計(普析通用公司);PCR儀(Thermofisher Scientific);電泳儀(Bio-Rad)。
2 方法
2.1 CCI模型制備及分組 SD大鼠60只,分別沿大鼠脊柱L5~L6節段處做一約3 cm縱向正中皮膚切口,將肌肉做鈍性分離,暴露出椎骨,去除棘突和椎板。將20 mL注射器針頭緩慢穿入L5/L6椎間隙,以大鼠出現一過性甩尾或后肢抽動作為針頭穿過硬脊膜的標準。PE-10導管(注滿生理鹽水)通過針頭送入蛛網膜下腔至L5~L6節段脊髓腰段處,固定導管,依次將肌肉和皮膚進行縫合。置管3 d后,選取無出現運動障礙的大鼠鞘內注射2% 利多卡因20μL。如注藥30 s后,未出現雙下肢麻痹,舍去;如注藥30 s后,出現雙下肢麻痹表示置管成功。共成功45只,正常飼養5 d,用于實驗。采用隨機數字表法,將置管成功的45只大鼠隨機分為5組(n=9):假手術組(sham組),消毒后麻醉,只暴露坐骨神經,但不結扎,灌胃給予等劑量生理鹽水, 每天2次,共28 d;CCI模型組(model組),消毒后麻醉,暴露坐骨神經并結扎,結扎強度以不完全阻斷血管為宜,灌胃給予等劑量生理鹽水, 每天2次,共28 d;EMA401治療組,消毒后麻醉,暴露坐骨神經并結扎,結扎強度以不完全阻斷血管為宜,分為低劑量(low dose, LD)組、中劑量(medium dose, MD)組、高劑量(high dose, HD)組,分別按照5 mg/kg、10 mg/kg、20 mg/kg灌胃給予EMA401, 每天2次,共28 d[5]。
2.2 疼痛行為學檢測
2.2.1 熱縮足反射潛伏期(thermal withdrawal latency,TWL)的測定 各組大鼠于術前24 h測定TWL作為基礎痛閾,術后7 d、14 d和28 d再分別測定TWL。測定時間固定于上午8∶00~12∶00,室溫維持在(25.0±0.5)℃。使用ⅡTC熱輻射測痛儀測定TWL。評價標準:用熱輻射測痛儀照射模型大鼠跖部,從照射開始直到大鼠出現縮腿回避反射的時間作為TWL。將大鼠放置在透明有機玻璃檢測箱中(20 cm×20 cm×20 cm),檢測箱的底部為2 mm的普通玻璃板,待模型大鼠安靜30 min以適應檢測箱環境。測定開始時,將輻射燈頭從檢測箱底部的玻璃板以一定的距離照射大鼠一側后肢跖部中后1/3處,當大鼠該側出現縮腿回避反射時,記錄時間,即為TWL。熱輻射強度在整個實驗過程中保持一致,如TWL超過30 s,測痛儀自動關閉,防止灼傷大鼠,TWL記錄為30 s。每只大鼠測定3次,每次間隔時間30 min,取其平均值。
2.2.2 機械縮足閾值(mechanical withdrawal thres-hold,MWT)的測定 各組大鼠于術前24 h測定MWT作為基礎痛閾,術后7 d、14 d、28 d再分別測定MWT。測定時間固定于上午8:00~12:00,室溫維持在(25±0.5)℃。使用Vonfrey 測痛套件測定MWT。評價標準:大鼠出現抬足或舔足行為視為陽性反應,Vonfrey纖維絲彎曲90°無抬足反應為陰性。將大鼠放置在透明有機玻璃檢測箱中(22 cm×12 cm×22 cm),檢測箱的底部為金屬篩網,待模型大鼠安靜30 min以適應檢測箱環境。用von Frey 纖維絲(壓力值依次為0.41、0.52、0.87、1.16、2.05、3.61、5.50、8.28、10.33和15 g)垂直刺激大鼠一側后肢跖部中部,持續時間不要超過30 s,初始刺激壓力值2.05 g,如果出現陰性反應,則選擇高一級壓力值;如果出現陽性反應,則選擇低一級壓力值,依此類推,直至出現第一次陽性和陰性反應的壓力值(最大壓力值為15 g,大于15 g時,記錄為15 g),再連續測定3次,每次間隔時間30 min。計算每只大鼠的50 %機械縮足反應閾值(內推法)作為MWT,50 %機械縮足閾值=10logX+κδ(X代表最后一次刺激壓力值;κ代表不同刺激方式的系數,到內推法的表格中查找對應的值;δ=0.179,代表刺激壓力值取對數后間距的平均值)。
2.3 細胞內Ca2+濃度檢測 疼痛行為學檢測完畢后,每組取3只大鼠,腹腔注射10%水合氯醛(300 mg/kg)麻醉,行左心室-主動脈插管,經管依次37 ℃生理鹽水200 mL快速沖洗, 37 ℃ PBS(含4%多聚甲醛)350 mL灌流。迅速取出左側L5~L6背根神經節,加入RIPA裂解液和PMSF蛋白酶抑制劑,冰上研磨,10 000 r/min 4 ℃離心10 min,取上清。按照Ca2+檢測試劑盒[鄰甲酚酞絡合銅(o-cresolphthalein complexone,OCPC)微板法]說明書檢測細胞內Ca2+濃度。配置Ca2+及考馬斯亮藍G250蛋白標準品檢測工作液,分光光度計于575 nm處檢測各組吸光度(A),以空白調零。Ca2+濃度(mol/g)=A測定/A標準×2.5/考馬斯亮藍G250蛋白標準品濃度(mg/L)。每份樣品檢測3次。
2.4 Western blotting分析蛋白表達 疼痛行為學檢測完畢后,每組取大鼠3只,取L5~L6DRG。BCA法測定總蛋白濃度。取30 μg蛋白上樣后進行10% SDS-PAGE。當電泳完成后,電轉至0.45 μm PVDF膜上,5%脫脂奶粉PBST(含25 mol/L、150 mol/L NaCl和0.1% Tween 20)4 ℃封閉2 h。然后加入小鼠抗大鼠GAP-43抗體、CaM多克隆抗體和PKC多克隆抗體(1∶1 000稀釋;對照組以PBS代替Ⅰ抗)4 ℃孵育過夜。PBST洗滌后,加入生物素標記的山羊抗兔第Ⅱ抗體(1∶2 000稀釋;對照組以PBS代替第Ⅱ抗體)室溫孵育2 h。PBST洗滌 5 min、3次,ECL化學發光試劑顯色,Bio-Rad凝膠成像系統對各組條帶進行灰度值及統計分析。GAPDH抗體孵育方法與上述方法相同,蛋白的相對表達強度=目標蛋白灰度值/GAPDH蛋白灰度值。每份樣品檢測3次。
2.5 RT-PCR分析mRNA表達 疼痛行為學檢測完畢后,每組取大鼠3只,取L5~L6DRG。TRIzol試劑提取細胞總RNA,檢測RNA純度,按照反轉錄試劑盒說明進行cDNA逆轉錄。利用Pubmed查找相關基因序列,并利用引物合成軟件Primer Premier 5.0設計引物。GAP-43的上游引物序列為5’-TGCCTGCTGCTGTCACTGA-3’,下游引物序列為5’-GGCAGGAGAGACAGGGTTCA-3’,擴增產物片段為254 bp;PKC的上游引物序列為5’-CCGCCTCTACTTTGTGAT-3’,下游引物序列為5’-CCTTGCGTTCGAGTTTCT-3’,擴增產物片段為592 bp;CaM的上游引物序列為5’-TGGCTACCCACCCTTTTATG-3’,下游引物序列為5’-CTTGATCTGCTCGCTCACTG-3’,擴增產物片段為115 bp;GAPDH的上游引物序列為5’-TACAACCTTCTTGCAGCTCC-3’,下游引物序列為5’-ACAATGCCGTGTTCAATGG-3’,擴增產物片段為245 bp。反應體系為RT-PCR酶混合物2.0 μL。反應條件為:94 ℃ 5 min; 94 ℃ 30 s, 59 ℃ 30 s, 72 ℃ 60 s,共32個循環。用1.5%瓊脂糖凝膠電泳,溴化乙啶染色。Gel Doc 1000成像系統進行圖像掃描和條帶灰度值分析。相對mRNA表達水平=目的基因條帶灰度值/GAPDH條帶灰度值。每份樣品檢測3次。
3 統計學處理
采用GraphPad Prism 5.0軟件進行描述性統計。計量資料用以均數±標準差(mean±SD)表示。首先對數據的正態分布和方差齊性進行檢驗,經檢驗所有數據符合正態分布,繼之多組間均數比較,采用單因素方差分析(one-way ANOVA),組間兩兩比較,采用Bonferroni校正的t檢驗。以P<0.05為差異有統計學意義。
結 果
1 疼痛行為學檢測結果
各組大鼠術前的TWL和MWT之間比較,差異無統計學顯著性。Model組大鼠術后全部出現了舔舐、懸空、足呈輕度外翻狀、跛行等疼痛行為學表現,TWL和MWT均顯著降低,與術前和sham組比較,差異具有統計學意義(P<0.05)。LD組、MD組和HD組7 d、14 d和28 d 的TWL和MWT均顯著升高,與model組比較,差異具有統計學意義(P<0.05),見表1。
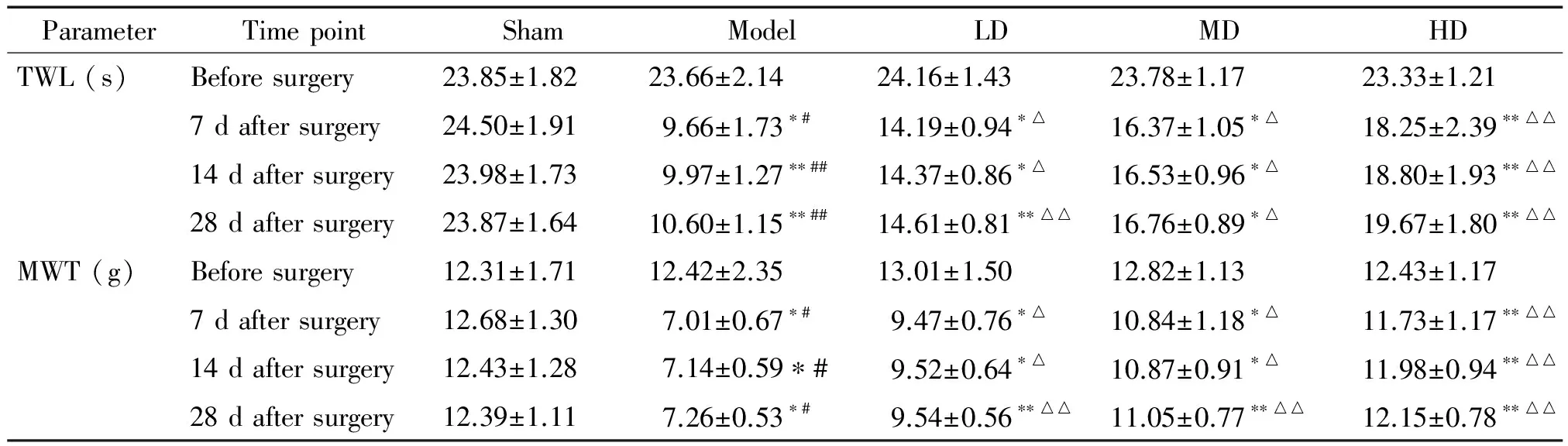
表1 各時點每組大鼠TWL和MWT的變化
*P<0.05,**P<0.01vsbefore surgery;#P<0.05,##P<0.01vssham group;△P<0.05,△△P<0.01vsmodel group.
2 DRG內Ca2+濃度的檢測結果
Model組大鼠DRG內的Ca2+濃度顯著升高,與sham組比較,差異具有統計學意義(P<0.01)。LD組、MD組和HD組DRG內的Ca2+濃度顯著降低,與model組比較,差異具有統計學意義(P<0.05),見圖1。
3 Western blotting分析結果
Model組大鼠DRG內的GAP-43、PKC 和 CaM均呈高表達,與sham組比較,差異有統計學意義(P<0.01)。LD、MD和HD組DRG內的GAP-43、PKC和CaM表達量均顯著降低,與model組比較,差異具有統計學意義(P<0.05),見圖2。
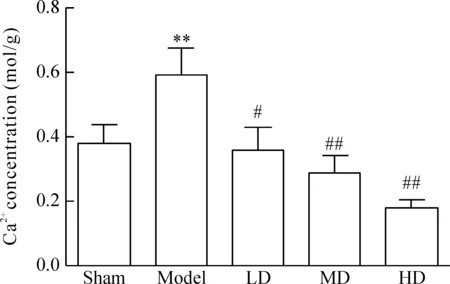
Figure 1.The Ca2+concentration detected by OCPC microplating method. Mean±SD.n=9.**P<0.01vssham group;#P<0.05,##P<0.01vsmodel group.
圖1 EMA401對Ca2+濃度的影響
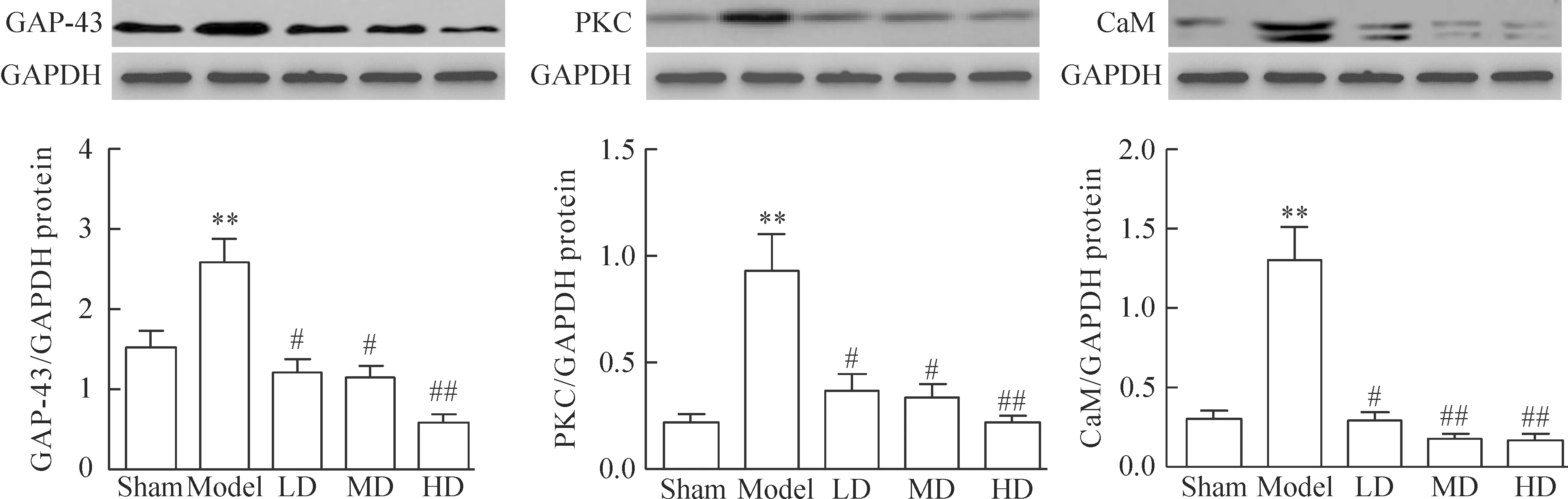
Figure 2.The protein levels of GAP-43, PKC and CaM detected by Western blotting. Mean±SD.n=9.**P<0.01vssham group;#P<0.05,##P<0.01vsmodel group.
圖2 EMA401對GAP-43、PKC和CaM蛋白表達的影響
4 RT-PCR分析結果
Model組大鼠DRG內GAP-43、PKC 和 CaM的mRNA均呈高表達,與sham組比較,差異具有統計學意義(P<0.01)。LD、MD和HD組DRG內GAP-43、PKC和CaM的mRNA表達量均顯著降低,與model組比較,差異具有統計學意義(P<0.05),見圖3。
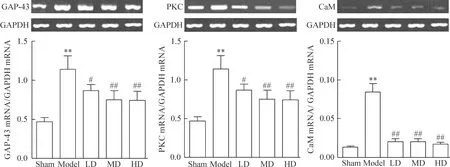
Figure 3.The mRNA expression of GAP-43, PKC and CaM detected by RT-PCR. Mean±SD.n=9.**P<0.01vssham group;#P<0.05,##P<0.01vsmodel group.
圖3 EMA401對GAP-43、PKC和CaM mRNA表達的影響
討 論
EMA401是一種通過阻斷Ang II而治療神經疼痛的藥物,目前已經進入II期臨床研究階段,可使58%的實驗組患者平均疼痛強度較前下降30%,而且具有很好的安全性,最大耐受量(maximum tolerated dose,MTD)可達400 mg。本研究中,model組TWL和MWT均顯著升高,說明神經性疼痛模型制備成功。參照文獻[3]并根據臨床給藥途徑和給藥時間,按照體表面積折算后,按照10 mg/kg給予EMA401灌胃給藥,并增設5 mg/kg和20 mg/kg 2組,結果表明,EMA401可使CCI大鼠TWL和MWT顯著延長。以上結果說明,EMA401確實對神經性疼痛具有鎮痛效應,可以抑制痛覺過敏,與文獻報道相一致。
研究證實,神經性疼痛和神經系統可塑性功能的主要表現模式——LTP密切相關[6]。LTP與神經元的生長發育、損傷和再生有關的GAP-43常常作為神經可塑性的分子標志。GAP-43是神經發育和再生過程中與軸突生長有關的內在決定因子和標志性蛋白,參與軸突和突觸形成,在生長的神經中GAP-43表達增多,可作為神經生長的標志[7-9]。有研究表明,GAP-43是參與形成神經性疼痛過敏的基礎之一,GAP-43的表達增加,引起痛覺過敏和超敏,參與和維持LTP[10]。另外,GAP-43除了參與細胞排粒作用、靶細胞識別、神經遞質釋放、軸突生長及轉運以及突觸建立、再生和功能調節外,其磷酸化狀態與LTP的建立和維持關系密切,進而對突觸的可塑性產生影響[11]。GAP-43含有一個與CaM結合域同源的“IQ”序列,從而使其具備調節Ca2+流量和CaM的能力,GAP-43與CaM的動力學結合/離解過程在神經生長、出芽、再生、突觸形成過程中扮演重要角色[12]。當傷害性刺激傳入末梢所釋放的興奮性氨基酸(如谷氨酸)興奮DRG,突觸后膜內游離Ca2+增多,激活鈣蛋白酶、磷脂酶C等多種鈣依賴酶,隨后鈣貯存庫釋放細胞內Ca2+,Ca2+濃度進一步升高,GAP-43/CaM解離,激活PKC對GAP-43的磷酸化,誘發LTP。
本研究發現,EMA401可使DRG內Ca2+濃度降低,GAP-43、PKC和CaM表達均降低,其機制可能是EMA401阻斷AT2R,減少Ca2+內流,導致DGR內GAP-43/CaM不易解離,從而抑制PKC活性,進而使GAP-43釋放水平降低,LTP得到抑制,最終緩解神經性疼痛。
綜上所述,EMA401對神經病理性疼痛大鼠有良好的鎮痛效應,其機制可能與其降低DRG內Ca2+濃度,從而降低GAP-43、PKC和CaM的表達有關。
[1] 葉永賢,林 洪,沙 漠,等. 神經病理性疼痛大鼠脊髓NF-κB、NR2B和iNOS的表達及意義[J]. 中國病理生理雜志,2014,30(4):598-602.
[2] Nascimento OJ, Pessoa BL, Orsini M, et al. Neuropathic pain treatment: still a challenge[J]. Neurol Int, 2016, 8(2):6322.
[3] Smith MT, Wyse BD, Edwards SR. Small molecule angiotensin II type 2 receptor (AT2R) antagonists as novel analgesics for neuropathic pain: comparative pharmaco-kinetics, radioligand binding, and efficacy in rats[J]. Pain Med, 2013, 14(5):692-705.
[4] Anand U, Yiangou Y, Sinisi M, et al. Mechanisms underlying clinical efficacy of angiotensin II type 2 receptor (AT2R) antagonist EMA401 in neuropathic pain: clinical tissue andinvitrostudies[J]. Mol Pain, 2015, 11:38.
[5] Anand U, Facer P, Yiangou Y, et al. Angiotensin II type 2 receptor (AT2R) localization and antagonist-mediated inhibition of capsaicin responses neurite outgrowth in human and rat sensory neurons[J]. Eur J Pain, 2013, 17(7):1012-1026.
[6] Ohnami S, Kato A, Ogawa K, et al. Effects of milnacipran, a 5-HT and noradrenaline reuptake inhibitor, on C-fibre-evoked field potentials in spinal long-term potentiation and neuropathic pain[J]. Br J Pharmacol, 2012, 167(3):537-547.
[7] Grasselli G, Mandolesi G, Strata P, et al. Impaired sprouting and axonal atrophy in cerebellar climbing fibres followinginvivosilencing of the growth-associated protein GAP-43[J]. PLoS One, 2011, 6(6):e20791.
[8] 姜月華, 馬度芳, 楊金龍, 等. 交感神經損毀導致的心肌損傷及桂枝湯的保護作用[J].中國病理生理雜志, 2015, 31(4):750-754.
[9] 冷玉芳, 高翊博, 白 潔. 腹腔聯合注射氯胺酮及可樂定對CCI模型大鼠的鎮痛效應[J].中國疼痛醫學雜志, 2011, 17(5):304-308.
[10]Williams S, Mmbaga N, Chirwa S. Dopaminergic D1 receptor agonist SKF 38393 induces GAP-43 expression and long-term potentiation in hippocampusinvivo[J]. Neurosci Lett, 2006, 402(1-2):46-50.
[11]Bekar E, Altunkaynak BZ, BalcK, et al. Effects of high fat diet induced obesity on peripheral nerve regeneration and levels of GAP 43 and TGF-β in rats[J]. Biotech Histochem, 2014, 89(6):446-456.
[12]冷玉芳, 高翊博, 白 潔. 氯胺酮對CCI大鼠背根神經節GAP-43 mRNA表達的影響[J].臨床麻醉學雜志, 2010, 26(11):996-998.
(責任編輯: 陳妙玲, 羅 森)
Analgesic effect of angiotensin angiotensin Ⅱ type 2 receptor antagonist EMA401 on neuropathic pain in rats and its mechanism
XIAO Han-yan1, ZHANG Ben-zhuo1, HAN Li-ping2, XU Feng3
(1DepartmentofNeurology,2DepartmentofPediatrics,3DepartmentofGeriatrics,theSecondAffiliatedHospitalofMudanjiangMedicalUniversity,Mudanjiang157011,China.E-mail:xufeng1976@sina.com)
AIM: To explore whether angiotensin Ⅱ type 2 receptor antagonist EMA401 decreases neuropathic pain and the expression of growth-associated protein-43 (GAP-43), protein kinase C (PKC) and calmodulin (CaM) in dorsal root ganglia (DRG) during chronic constriction injury (CCI) in rats. METHODS: SD rats were used to establish CCI model and randomly divided into 4 groups. The rats in model group were given equal volume of normal saline by intragastric administration. The rats in low dose (LD) group were given 5 mg/kg EMA401 by intragastric administration. The rats in middle dose (MD) group were given 10 mg/kg EMA401 by intragastric administration. The rats high dose (HD) group were given 20 mg/kg EMA401 by intragastric administration. The rats in sham operation group received equal volume of normal saline by intragastric administration. Thermal withdrawal latency (TWL) and mechanical withdrawal threshold (MWT) were measured before operation and 7 d, 14 d and 28 d after CCI. After behavioral test, DRG of lumbar spinal was obtained from each group, and was used to determine Ca2+concentration byo-cresolphthalein complexone microplating method, and the expression of GAP-43, PKC and CaM at mRNA and protein levels by Western blotting and RT-PCR. RESULTS: Compared with model group, EMA401 significantly increased the TWL and MWT (P<0.05). Meanwhile, EMA401 significantly reduced Ca2+concentration and the expression of GAP-43, PKC and CaM at mRNA and protein levels in the DRG (P<0.05). CONCLUSION: EMA401 may attenuate neuropathic pain of CCI by inhibiting Ca2+concentration and the expression of GAP-43, PKC and CaM.
EMA401; Neuropathic pain; Growth-associated protein-43; Protein kinase C; Calmodulin
1000- 4718(2017)01- 0110- 06
2016- 08- 02
2016- 09- 28
黑龍江省衛生計生委科研課題(No. JS215H647)
R363
A
10.3969/j.issn.1000- 4718.2017.01.018
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 0453-8927654; E-mail: xufeng1976@sina.com

