牛磺酸減輕內毒素誘導的大鼠心肌損傷*
湯文天, 王 靜, 劉 駿 △, 陸曉華, 王國光, 姜玉新
(1蕪湖市第一人民醫院心血管內一科, 安徽 蕪湖 241000; 皖南醫學院 2機能實驗中心,3病理生理教研室, 4生理教研室, 安徽 蕪湖 241002)
?
牛磺酸減輕內毒素誘導的大鼠心肌損傷*
湯文天1, 王 靜1, 劉 駿1△, 陸曉華2, 王國光3, 姜玉新4
(1蕪湖市第一人民醫院心血管內一科, 安徽 蕪湖 241000; 皖南醫學院2機能實驗中心,3病理生理教研室,4生理教研室, 安徽 蕪湖 241002)
目的: 探討牛磺酸對內毒素(即脂多糖, LPS)誘導的大鼠心肌損傷的影響。方法: 健康雄性Sprague-Dawley(SD)大鼠30只隨機分為3組:正常對照組、內毒素模型組及牛磺酸處理組。正常對照組和內毒素模型組大鼠尾靜脈注射生理鹽水,牛磺酸處理組大鼠尾靜脈注射牛磺酸(100 mg/kg),2 h后,內毒素模型組和牛磺酸處理組大鼠腹腔注射LPS(10 mg/kg),正常對照組大鼠腹腔注射生理鹽水。注射內毒素6 h后,采集血樣品和心肌組織,檢測血清超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量、腫瘤壞死因子α(TNF-α)及白細胞介素6(IL-6)水平;光鏡下觀察心肌形態學變化;Western blot檢測心肌組織磷酸化核因子κB(p-NF-κB)、環氧合酶2(COX-2)、TNF-α、IL-6及血紅素加氧酶1(HO-1)的表達。結果: 與正常對照組比較,內毒素模型組大鼠血清SOD活性及心肌組織HO-1表達明顯降低(P<0.01),血清MDA、TNF-α和IL-6水平明顯升高(P<0.01),心肌組織p-NF-κB、 COX-2、TNF-α及IL-6水平明顯升高(P<0.01)。與內毒素模型組比較,牛磺酸處理組大鼠血清MDA、TNF-α和IL-6水平明顯降低(P<0.01),牛磺酸處理明顯降低心肌組織COX-2、TNF-α、IL-6及p-NF-κB水平(P<0.01),血清SOD活性及心肌組織HO-1表達明顯提高(P<0.01)。組織學觀察顯示內毒素模型組大鼠心肌組織有炎癥細胞浸潤,心肌纖維排列疏松不規則,而正常對照組和牛磺酸處理組大鼠心肌纖維排列整齊規則。結論: 牛磺酸預處理能減輕內毒素誘導的心肌損傷,其機制可能通過HO-1/CO信號下調p-NF-κB/COX-2而發揮作用。
牛磺酸; 脂多糖; 心肌損傷
內毒素亦稱脂多糖(lipopolysaccharide,LPS),是革蘭氏陰性菌細胞壁的組成成分之一。由感染引起的內毒素血癥(endotoxemia)或膿毒血癥為臨床上常見的一種全身炎癥反應綜合征,心肌損傷是其重要的病理學變化。心肌損傷而導致的心功能障礙成為膿毒血癥患者死亡的重要原因[1-2]。牛磺酸是(taurine, TAU)一種非蛋白含硫氨基酸,廣泛存在于各種動物體內,有許多重要的生物學功能,研究表明,牛磺酸有抗氧化及抗炎作用[3-4]。本研究旨在評價牛磺酸在內毒素誘導的心肌損傷中的心肌保護作用。
材 料 和 方 法
1 試劑
牛磺酸和LPS購自Sigma; SOD和MDA試劑盒購自南京建成生物工程研究所;TNF-α及IL-6 ELISA檢測試劑盒購自合肥博美生物工程有限公司;HO-1、TNF-α、IL-6、COX-2及NF-κB多克隆抗體購自上海生物工程有限公司。
2 動物分組及模型復制
雄性Sprague-Dawley (SD)大鼠30只,體重260~300 g,購自南京青龍山動物養殖場(許可證號:SCXK2009-0001)。大鼠自由飲水、進食,在1周的適應后,隨機分為3組:正常對照(control, CON)組、LPS模型組及TAU處理組,每組各10只。大鼠以戊巴比妥鈉(40 mg/kg)麻醉,正常對照組大鼠尾靜脈注射生理鹽水2 h后,腹腔注射生理鹽水;內毒素模型組大鼠尾靜脈注射生理鹽水2 h后,腹腔注射LPS(10 mg/kg);牛磺酸處理組大鼠尾靜脈注射牛磺酸(100 mg/kg)2 h后,腹腔注射LPS(10 mg/kg)。各組腹腔注射生理鹽水和LPS 6 h后,動脈采集血樣品,處死,取心肌組織。
3 抗氧化作用分析
血樣品于1 200×g離心分離血清,血清SOD活性以黃嘌呤氧化酶法檢測,血清MDA含量以硫代巴比妥酸比色法測定,操作過程嚴格按試劑盒操作說明進行。SOD活性以×103U/L表示,MDA含量表示為μmol/L。
4 血清炎癥因子檢測
血清中TNF-α和IL-6以商業試劑盒檢測,操作過程嚴格按試劑盒操作說明進行。血清TNF-α和IL-6濃度均表示為ng/L。
5 組織形態學觀察
取心肌置于10%中性甲醛中固定,石蠟包埋,切5 μm切片,以蘇木素-伊紅(hematoxylin and eosin,HE)染色,光學顯微鏡觀察形態結構,并拍照。
6 Western blot分析
取心肌0.2 mg于冰冷的PBS中洗去血跡,置入有2 mL冰冷的裂解液的勻漿器中,加20 μL新配苯甲基磺酰氟勻漿、裂解。裂解液在4 ℃下,以13 000 ×g轉速離心15 min。取含等量蛋白的裂解液以十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳進行分離后,轉至硝酸纖維素膜,取出膜以含5%脫脂奶粉TBST液封閉,加HO-1、TNF-α、IL-6、COX-2及NF-κB多克隆抗體,在4 ℃下孵育過夜,加堿性磷酸酶標記的Ⅱ抗孵育2 h后,洗膜后,DAB顯色。
7 統計學分析
數據用均數±標準差(mean±SD)表示,實驗結果采用SPSS 16.0軟件進行統計學分析,多組間相互比較采用單因素方差分析及SNK-q檢驗。以P<0.05 為差異有統計學意義。
結 果
1 牛磺酸對抗氧化作用的影響
與正常對照組比較,內毒素組大鼠血清抗氧化酶SOD活性明顯降低(P<0.01),脂質過氧化標志物MDA含量升高(P<0.01);與內毒素組比較,牛磺酸處理組大鼠血清SOD活性明顯升高(P<0.01),MDA含量明顯降低(P<0.01),見圖1。牛磺酸處理明顯提高SOD活性,降低MDA含量。
2 牛磺酸的抗炎作用
為評估牛磺酸的抗炎作用,檢測血清炎癥細胞因子TNF-α和IL-6的變化。結果表明,內毒素組大鼠血清炎癥細胞因子TNF-α和IL-6水平較對照組明顯升高(P<0.01),牛磺酸處理組大鼠血清TNF-α和IL-6水平較內毒素組明顯降低(P<0.01),提示牛磺酸可能有抑制內毒素誘導的炎癥細胞因子產生,具有抗炎作用,見圖2。
3 心肌形態學變化
組織學觀察顯示,內毒素組大鼠心肌有炎癥細胞浸潤,心肌纖維排列疏松且不規則,并伴有斷裂及空泡化出現;牛磺酸處理組大鼠心肌纖維排列較為緊密而有規則,見圖3(圖中箭頭所示為炎癥細胞浸潤)。

Figure 1.Effects of taurine on SOD activity and MDA content in serum. Mean±SD.n=10.**P<0.01vsCON;##P<0.01vsLPS.
圖1 牛磺酸對大鼠血清SOD活性和MDA含量的影響
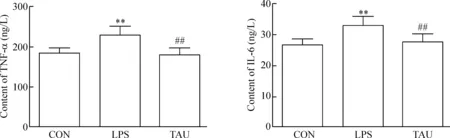
Figure 2. Effects of taurine on levels of TNF-α and IL-6 in serum. Mean±SD.n=10.**P<0.01vsCON;##P<0.01vsLPS.
圖2 牛磺酸對大鼠血清TNF-α和IL-6水平的影響

Figure 3. Effects of taurine on LPS-induced myocardial damage in rats (HE staining, ×400).
圖3 牛磺酸對心肌結構的影響
4 牛磺酸對心肌組織蛋白表達的影響
與正常對照組比較,內毒素組大鼠心肌組織HO-1表達明顯降低,p-NF-κB、COX-2、TNF-α和IL-6表達明顯升高(P<0.01);與內毒素組相比,牛磺酸處理組大鼠HO-1表達明顯升高,p-NF-κB、COX-2、TNF-α和IL-6表達明顯降低(P<0.01),見圖4。
討 論
由感染產生的大量內毒素進入血液而引起的內毒素血癥是臨床上非常常見的一種全身炎癥[5-6]。炎癥反應的瀑布式爆發累及多種器官,導致重要器官功能障礙,累及心臟而發生心功能衰竭而使病情惡化,病死率提高[7-8]。因此,提高其防治是醫學研究的重要課題。
大量研究表明,炎癥反應和炎癥細胞因子的釋放在內毒素引起的心肌損傷中起著非常重要的作用[9]。內毒素與細胞膜上Toll樣受體(Toll-like receptors,TLRs)結合,進而激活細胞內NF-κB信號通路,促進炎癥細胞因子轉錄,表達增加。NF-κB通過磷酸化而被激活,進一步上調COX-2的表達,COX-2可通過誘導前列腺素的產生參與炎癥及痛感[10]。炎癥細胞因子如TNF-α及IL-6等參與內毒素引起的器官損傷,TNF-α可直接損傷心肌纖維[11]。本研究顯示,內毒素處理大鼠血清及心肌炎癥細胞因子TNF-α及IL-6明顯升高,COX-2表達及NF-κB磷酸化水平提高,并且心肌有炎癥細胞浸潤。牛磺酸是一種內源性非蛋白氨基酸,研究證明其具有許多生理功能,如有免疫調節作用[12]。牛磺酸在體內可被轉化為牛磺酸氯胺,被認為是一種低毒的炎癥調節物[13]。我們的研究結果顯示,牛磺酸預處理明顯改善內毒素誘導的心肌形態學變化,降低內毒素誘導的炎性因子水平,并降低COX-2表達及NF-κB磷酸化水平,提示牛磺酸可通過抑制炎癥細胞因子轉錄信號,減少炎癥介質釋放而起抗炎作用。
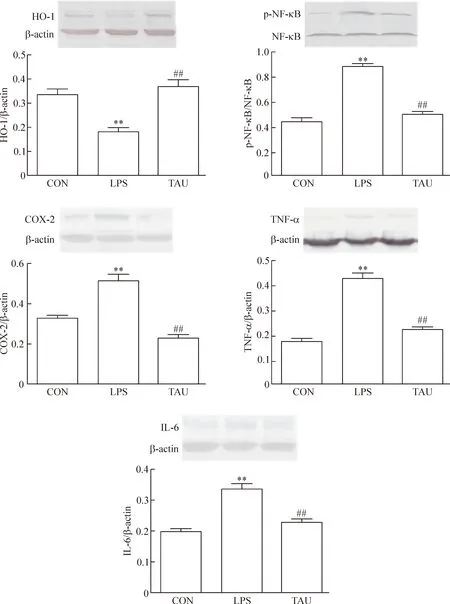
Figure 4. Effects of taurine on expression of HO-1, p-NF-κB, COX-2, TNF-α and IL-6 in myocardial tissues. Mean±SD.n=10.**P<0.01vsCON;##P<0.01vsLPS.
圖4 牛磺酸對大鼠心肌組織HO-1、p-NF-κB、COX-2、TNF-α和IL-6表達的影響
內毒素誘導的活性氧及自由基的釋放是其致器官損傷的重要環節。在內毒素血癥中,內毒素調控的巨噬細胞呼吸爆發釋放的活性氧及自由基激活NF-κB信號[14],進而調節炎癥細胞因子的表達。因此,提高機體的抗氧化作用,降低活性氧有利于對炎癥反應的調節及減輕組織損傷。研究證實,牛磺酸提高機體抗氧化酶,增強抗氧化作用。有研究顯示牛磺酸增加HO-1的表達[15]。HO-1是一種誘導型酶,催化血紅素轉化為一氧化碳(CO)、膽綠素及游離鐵離子,催化產物一氧化碳和膽綠素均有抗炎及抗氧化作用[16-17]。并有研究進一步證實HO-1/CO信號通過調控NF-κB/COX-2而抑制炎癥細胞因子釋放[18-19]。本研究的結果顯示,牛磺酸預處理提高SOD活性及HO-1的表達,并降低MDA的血清含量。提示牛磺酸通過提高抗氧化酶改善抗氧化作用。
綜上所述,牛磺酸預處理減輕內毒素所誘導的心肌損傷。結果提示其作用通過提高抗炎及抗氧化作用,其機制可能是牛磺酸誘導的HO-1/CO信號通過調控NF-κB/COX-2而發揮作用。關于其詳細機制尚需進一步的研究。
[1] Romero-Bermejo FJ, Ruiz-Bailen M, Gil-Cebrian J, et al. Sepsis-induced cardiomyopathy [J]. Curr Cardiol Rev, 2011, 7(3):163-183.
[2] 趙邦術, 劉 玲, 劉新偉, 等. 煙酰胺磷酸核糖轉移酶在內毒素致大鼠心肌損傷中的作用[J]. 中華麻醉學雜志,2014,34(6):750-752.
[3] Wang L, Zhao N, Zhang F, et al. Effect of taurine on leukocyte function [J]. Eur J Pharmacol, 2009, 616(1-3):275-280.
[4] Schaffer SW, Azuma J, Mozaffari M. Role of antioxidant activity of taurine in diabetes[J]. Can J Physiol Pharmacol, 2009, 87(2):91-99.
[5] Liu J, Zhao S, Tang J, et al. Advanced glycation end products and lipopolysaccharide synergistically stimulate proinflammatory cytokine/chemokine production in endothelial cells via activation of both mitogen-activated protein kinases and nuclear factor-κB[J]. FEBS J, 2009, 276(16):4598-4606.
[6] 李 攀, 趙祎博, 李小麗, 等. 內毒素耐受狀態小鼠對大腸埃希菌敏感性及促炎細胞因子水平變化的研究[J]. 中國臨床藥理學與治療學, 2015, 20(3):261-265.
[7] Zhao P, Turdi S, Dong F, et al. Cardiac-specific overexpression of insulin-like growth factor 1 (IGF-1) rescues lipopolysaccharide-induced cardiac dysfunction and activation of stress sign aling in murine cardiomyocytes[J].Shock, 2009, 32(1):100-107.
[8] 朱明慧, 黃禮兵, 朱 娟, 等. 參希膠囊對內毒素血癥小鼠心臟的保護作用[J]. 南京中醫藥大學學報,2015, 31(3):258-260.
[9] Baumgarten G, Knuefermann P, Nozaki N, et al.Invivoexpression of proinflammatory mediators in the adult heart after endotoxin administration: the role of Toll-like receptor-4[J]. J Infect Dis, 2001, 183(11):1617-1624.
[10]Williams JA, Shacter E. Regulation of macrophage cytokine production by prostaglandin E2. Distinct roles of cyclooxygenase-1 and -2[J]. J Biol Chem, 1997, 272(41): 25693-25699.
[11]Wang YY, Yu XH, Wang FQ, et al. Yohimbine promotes cardiac NE release and prevents LPS-induced cardiac dysfunction via blockade of presynaptic α2A-adrenergic receptor[J]. PLoS One, 2013, 8(5): e63622.
[12]Schuller-Levis GB, Park E. Taurine and its chloramine: modulators of immunity [J]. Neurochem Res, 2004, 29(1):117-126.
[13]Marcinkiewicz J, Kurnyta M, Biedroń R, et al. Anti-inflammatory effects of taurine derivatives (taurine chloramine, taurine bromamine, and taurolidine) are mediated by different mechanisms[J]. Adv Exp Med Biol, 2006, 583: 481-492.
[14]von Dessauer B, Bongain J, Molina V, et al. Oxidative stress as a novel target in pediatric sepsis management [J]. J Crit Care, 2011, 26(1):103.e1-103.e7.
[15]Wang GG, Li W, Lu XH, et al. Taurine attenuates oxidative stress and alleviates cardiac failure in type I diabetic rats [J]. Croat Med J, 2013, 54(2):171-179.
[16]Stocker R, Yamamoto Y, McDonagh AF, et al. Bilirubin is an antioxidant of possible physiological importance [J]. Science, 1987, 235(4792):1043-1046.
[17]Shih RH, Yang CM. Induction of heme oxygenase-1 atte-nuates lipopolysaccharide-induced cyclooxygenase-2 expression in mouse brain endothelial cells [J]. J Neuroinflammation, 2010, 7:86.
[18]Morse D, Pischke SE, Zhou Z, et al. Suppression of inflammatory cytokine production by carbon monoxide involves the JNK pathway and AP-1 [J]. J Biol Chem, 2003, 278(39):36993-36998.
[19]Sarady JK, Otterbein SL, Liu F, et al. Carbon monoxide modulates endotoxin-induced production of granulocyte macrophage colony-stimulating factor in macrophages [J]. Am J Respir Cell Mol Biol, 2002, 27(6):739-745.
(責任編輯: 陳妙玲, 羅 森)
Protective effects of taurine on LPS-induced myocardial damage in rats
TANG Wen-tian1, WANG Jing1, LIU Jun1, LU Xiao-hua2, WANG Guo-guang3, JIANG Yu-xin4
(1FirstDepartmentofCardiovascularInternalMedicine,WuhuFirstPeople’sHospital,Wuhu241000,China;2ExperimentalCenterforFunctionSubjects,3DepartmentofPathophysiology,4DepartmentofPhysiology,WannanMedicalCollege,Wuhu241002,China.E-mail: 13905533991@163.com)
AIM: To investigate the effects of taurine on lipopolysaccharide (LPS)-induced myocardial damage in rats. METHODS: Healthy male SD rats (n=30) were randomly divided into control group (CON), LPS model group (LPS) and taurine treatment group (TAU). The rats in CON group and LPS group were intravenously injected with normal saline, and the rats in TAU group were injected with taurine (100 mg/kg). After 2 h, the rats in LPS group and TAU group were intraperitoneally injected with LPS at 10 mg/kg, and the rats in CON group were injected with normal saline. Six hours after injection of LPS, the blood samples were collected for determination of superoxide dismutase (SOD) activity, malondialdehyde (MDA) content, and tumor necrosis factor α (TNF-α) and interleukin-6 (IL-6) levels. The myocardial tissues were processed for histological examination and the analysis of Western blot. RESULTS: Compared with CON group, LPS significantly reduced SOD activity in the serum and heme oxygenase 1 (HO-1) protein expression in the myocardial tissues, increased the serum content of MDA and levels of TNF-α and IL-6. LPS also significantly elevated the levels of TNF-α and IL-6, and up-regulated the cyclooxygenase-2 (COX-2) expression and phosphorylation of nuclear factor kappa B (NF-κB) in the myocardial tissues. Taurine pretreatment significantly elevated SOD activity and HO-1 protein expression level, decreased the levels of COX-2, TNF-α, IL-6 and phosphorylated NF-κB. Histological observation showed that taurine reduced inflammatory response in the myocardial tissue. CONCLUSION: Taurine attenuates LPS-induced myocardial damage in rats. The beneficial effects of taurine may be associated with its reduction of p-NF-κB/COX-2 signaling by activation of HO-1/CO.
Taurine; Lipopolysaccharides; Myocardial damage
1000- 4718(2017)01- 0123- 05
2016- 07- 25
2016- 10- 07
國家自然科學基金資助項目(No. 81172790)
R363.2
A
10.3969/j.issn.1000- 4718.2017.01.020
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 13905533991; E-mail: 13905533991@163.com

