沉默附睪P34H基因對小鼠精子P34H表達和精子透明質酸酶活性的影響*
馬曉萍, 高曉勤, 丁賢勝, 戴研平
(1貴州醫科大學組織胚胎學教研室,貴州 貴陽 550004; 2遵義醫藥高等專科學校組織胚胎學教研室,貴州 遵義 563006; 3六盤水市人民醫院病理科,貴州 六盤水 553000)
?
沉默附睪P34H基因對小鼠精子P34H表達和精子透明質酸酶活性的影響*
馬曉萍1, 2, 高曉勤2△, 丁賢勝3, 戴研平1
(1貴州醫科大學組織胚胎學教研室,貴州 貴陽 550004;2遵義醫藥高等專科學校組織胚胎學教研室,貴州 遵義 563006;3六盤水市人民醫院病理科,貴州 六盤水 553000)
目的: 通過慢病毒介導的RNA干擾(RNAi)敲低P34H表達,分析其對小鼠精子P34H表達和精子透明質酸酶(HYD)活性的影響。方法: 構建3種附睪精子P34H shRNA慢病毒表達載體GV-P34H-shRNA-1、GV-P34H-shRNA-2和GV-P34H-shRNA-3,提取陽性克隆質粒測序,轉染HEK293T細胞,生產慢病毒顆粒。將3種重組慢病毒及陰性對照病毒分別注入小鼠附睪中,用real-time PCR和Western blot法分別檢測其對P34H mRNA和蛋白的沉默效果。采用免疫熒光法觀察P34H蛋白在小鼠精子上的定位,改良透明質酸鈉-明膠底物膜法檢測小鼠精子HYD活性(HYD陽性反應率和HYD活性強度)。結果: 測序結果證實3種慢病毒載體均包裝成功。感染小鼠附睪后,P34H的mRNA及蛋白表達量均較陰性感染組和正常對照組明顯降低(P<0.05);其中以GV-P34H-shRNA-1作用最為顯著,精子P34H陽性表達率和HYD活性均較陰性感染組和正常對照組明顯降低(P<0.05),而陰性感染組和正常對照組相比差異無統計學顯著性。結論: 附睪P34H基因沉默可抑制小鼠附睪中精子P34H陽性表達率和HYD活性。
P34H; RNA干擾; 透明質酸酶
近年來,附睪生理學及生物化學研究越來越被學者們重視。附睪是哺乳動物精子成熟、獲得受精及運動能力、貯存和保護精子的場所;睪丸中的精子只有在通過附睪的過程中,與管腔微環境中特異表達的蛋白質不斷地相互作用,才能最終獲得前向運動能力、透明帶結合能力及受精能力[1]。P34H是由附睪上皮分泌并定位于精子頂體部位的精子表面蛋白,P34H能夠介導精子和透明帶的結合,并可作為精子成熟的標志物,而且低水平的附睪P34H蛋白與原發性男性不育相關[2]。
當精子獲能時,頂體釋放頂體酶水解卵子透明帶,能使精子順利地通過[3]。透明質酸酶(hyaluronidase, HYD)能夠溶解放射冠細胞外基質,使顆粒細胞松散,放射冠分解,并且還能水解透明帶表面精子尾部周圍一定區域,使得精子尾部能夠自由擺動,為精卵融合、形成受精卵創造條件[4]。各種原因引起透明質酸酶活性下降或影響精子獲能與發生頂體反應,均造成精子受精能力下降[5-6]。
RNA干擾(RNA interference,RNAi)作為一項可以高效地、特異地降解靶基因mRNA的實驗技術已經被廣泛應用于基因功能的研究,RNAi通過導入細胞的siRNA,降解同源mRNA,高效、特異性阻斷目的基因表達[7-8]。
目前對于干擾小鼠附睪P34H基因是否會對精子P34H陽性表達率和精子透明質酸酶活性產生影響尚未見相關報道。為此我們構建P34H的慢病毒shRNA表達載體轉染小鼠附睪,研究轉染后P34H的表達。通過實時熒光定量PCR和Western blot實驗篩選能明顯降低附睪P34H表達水平的RNA干擾載體,觀察敲低P34H表達后對小鼠精子P34H陽性表達率和精子透明質酸酶活性的影響,以探明P34H基因對小鼠生殖功能影響的分子機制,為進一步研究由精子成熟異常引起的不育癥提供實驗基礎和理論依據,也將為男性避孕藥的研制開發提供新的靶點和依據。
材 料 和 方 法
1 主要材料與試劑
慢病毒載體GV248購自上海吉凱基因化學公司;混合包裝載體質粒(pGag/Pol、pRev、pVSV2G)購自Genscript; HEK293T細胞為本課題組保存;大腸桿菌DH5α、限制性內切酶AgeI和EcoRI等均為TaKaRa產品;real-time PCR試劑盒、 cDNA逆轉錄試劑盒、Marker DL 2000限制性內切酶(BamHI/AgeI)、T4DNA連接酶、DNA聚合酶,質粒提取試劑盒、膠回收試劑盒及PCR產物回收試劑盒均購自QIAGEN;TRIzol購自Gibco;Lipofectamine 2000 購自Invitrogen;山羊抗P34H I抗、β-actin、過氧化物酶(horseradish peroxidase, HRP)標記的兔抗山羊IgG和熒光抗體Alexa Fluor? 647標記的驢抗羊IgG購自Abcam;5周齡的SPF級雄性NIH小鼠購于北京維通利華實驗動物技術有限公司。
2 主要方法
2.1 P34H-shRNA慢病毒干擾載體的構建 根據GenBank報道的人附睪特異P34H基因序列(GenBank: AF515625.1),并結合RNAi靶標選擇原則及網站預測評估,選擇了3個RNAi的靶標位點,分別為:(1)位于開放讀碼框(open reading frame, ORF)293~312 bp的5’-GGCCTTTGACAGATCCTTT-3’;(2)位于ORF 387~406 bp的5’-GCCATCGTGAATGTCTCCA-3’;(3)位于ORF 420~438 bp的5’-GCGGGCAGTAACTAACCAT-3’。根據預測出來的靶向P34H的siRNA靶向結合序列,以及GV248載體系統特點,每一個靶向序列設計2對互補的單鏈DNA,包括siRNA的正義鏈和反義鏈,選擇的酶切位點為AgeI和EcoRI,合成寡核苷酸正義鏈和反義鏈。siRNA-1正義鏈序列為 5’-CACCGGCCTTTGACAGATCCTTTTTCAAGACGAAAGGATCTGTC-AAAGGCCTTTTTTG-3’,反義鏈序列為5’-AGCTCAA-AAAAGGCCTTTGACAGATCCTTTCGTCTTGAAAAAG-GATCTGTCAAAGGCC-3’;siRNA-2正義鏈序列為5’-CACCGCCATCGTGAATGTCTCCATTCAAGACGTGGA-GACATTCACGATGGCTTTTTTG-3’,反義鏈序列為5’-AGCTCAAAAAAGCCATCGTGAATGTCTCCACGTCTTGAATGGAGACATTCACGATGGC-3’;siRNA-3正義鏈序列為5’-CACCGCGGGCAGTAACTAACCATTTCAAGACGATGGTTAGTTACTGCCCGCTTTTTT-G-3’,反義鏈序列為5’-AGCTCAAAAAAGCGGG-CAGTAACTAACCATCGTCTTGAAATGGTTAGTTACT-GCCCGC-3’。將這些單鏈DNA送至武漢巴菲爾生物公司,合成P34H純化的shRNA Oligo片段并設計合成陰性對照(negative control, NC)-shRNA (5’-TTCTCCGAACGTGTCACGT-3’)表達重組質粒標準品。將合成好的shRNA Oligo溶解并稀釋成終濃度100 μmol/L。應用PCR儀使正義鏈、反義鏈退火形成雙鏈,退火條件為: 95 ℃ 4 min, 72 ℃ 30 min(緩慢冷卻至4 ℃,即得到雙鏈目的DNA 片段)。用限制性內切酶AgeI和EcoRI,對慢病毒載體GV248進行雙酶切,得到的產物經瓊脂糖電泳分離、割膠回收和純化,將其與退火形成的RNAi寡核苷酸雙鏈在22 ℃水浴中進行連接反應。轉化DH5α,在含氨芐青霉素的LB培養板上37 ℃培養過夜。進行菌液PCR篩選陽性克隆,并測序鑒定(Invitrogen)。
2.2 慢病毒包裝與滴度測定 首先制備編碼慢病毒顆粒的重組病毒質粒及其混合包裝載體質粒,將4種質粒載體分別進行高純度無內毒素抽提,按Invitrogen的Lipofectamine 2000的使用說明進行HEK293T細胞轉染,轉染后8 h更換為完全培養基,培養48 h,收集含慢病毒顆粒的細胞上清液,對其濃縮得到高滴度的慢病毒濃縮液,最后在HEK293T細胞中根據病毒的預期滴度,對其進行倍比稀釋,測定和標定病毒滴度。制備的病毒滴度為 5×108TU/L。
2.3 慢病毒載體感染小鼠附睪組織 5 周齡的雄性 NIH 小鼠經腹腔注射戊巴比妥鈉麻醉后,剪開皮膚并暴露出附睪,按分組(正常對照組、GV-NC-shRNA陰性感染組、GV-P34H-shRNA-1感染組、GV-P34H-shRNA-2感染組及GV-P34H-shRNA-3感染組)將10 μL病毒液分別注射到雙側附睪。每組8只小鼠,模型處理完畢后送動物房常規飼養。2周后處死動物,迅速無菌切取附睪行下一步檢測。
2.4 Real-time PCR檢測各組P34H mRNA的表達量 提取各組附睪組織總RNA,測定RNA的濃度和純度,逆轉錄為cDNA,在real-time PCR 中作為模板。以real-time PCR檢測各組P34H mRNA的表達量。P34H的上游引物序列為5’-CCATAGCGTCTACTGCTCCA-3’,下游引物序列為 5’-CGGTTCAGCATAGTCTTGGC-3’,產物174 bp;β-actin的上游引物序列為5’-AGCGAGCATCCCCCAAAGTT-3’,下游引物序列為5’-GGGCACGAAGGCTCATCATT-3’,產物285 bp。引物由上海生工生物有限公司合成。PCR反應條件為:50 °C 2 min;95 °C 10 min; 95 °C 30 s、60 °C 30 s,共40 個循環。通過2-ΔΔCt法計算相對表達量。
2.5 Western blot實驗檢測各組 P34H蛋白的表達量 提取附睪組織總蛋白,取40 μg,經12% SDS-PAGE 分離,在200 mA下轉膜(PVDF膜) 70 min,5%脫脂奶粉封閉液中4 ℃過夜封閉,TBST洗膜3次。加P34H I抗(1∶1 000稀釋),4 ℃孵育過夜;次日用HRP標記的兔抗山羊IgG孵育2 h。TBST 輕搖洗膜后,ECL顯色。暗室曝光顯示特異的蛋白信號,依據ECL化學發光試劑盒操作說明進行顯影、定影。利用凝膠圖像分析系統對膠片進行分析。
2.6 精子標本處理和間接免疫熒光法 分離一側附睪尾部,放入預熱37 ℃PBS中剪碎,待精子游出,用上游法制備精子懸液,室溫下以600×g離心洗滌10 min,將沉淀物懸浮于BWW培養液中,調精子密度為2×109/L,于37 ℃、 5 % CO2培養箱中孵育獲能3 h。將PBS洗滌后的精液涂片,室溫干燥后,用2%多聚甲醛固定20 min,PBS洗滌后用5 % BSA(PBS 配制)在濕盒內封閉60 min,加 I 抗(山羊抗P34H I抗,1∶200稀釋),4 ℃過夜,PBS洗滌后加1∶200稀釋的 II 抗(Alexa Fluor?647標記的驢抗羊IgG),室溫下避光孵育2 h,PBS洗滌后封片。在激光掃描共聚焦顯微鏡下觀察并攝片,各組涂片在鏡下分別隨機選取數個視野攝片并計數精子P34H標記陽性率,每組計數200個精子。
2.7 透明質酸酶反應陽性率及活性強度 采用改良透明質酸鈉-明膠底物膜片[5],將上述已制備的精子懸浮液用PBS洗滌后涂于底物膜片上,放入37 ℃恒溫、恒濕箱中孵育3 h。終止孵育后,于光學顯微鏡下均勻選取每份精子孵育片的5、6個視野觀察200個精子的頭部,其周圍出現暈環者視為透明質酸酶陽性反應,計算精子透明質酸酶陽性率,并測量每個精子頭部暈環直徑的大小,計算平均反應直徑(μm),作為判斷透明質酸酶活性強度的指標。
3 統計學處理
使用SPSS 17.0軟件進行數據的統計學處理,實驗數據以均數±標準差(mean±SD)表示,多組間均數比較采用單因素方差分析,兩兩比較采用LSD檢驗,以P<0.05為差異有統計學意義。
結 果
1 GV-P34H-shRNA重組質粒的DNA的測序結果
將PCR陽性克隆進行DNA測序,結果與預期DNA序列相符(圖1),表明合成的P34H shRNA寡核苷酸鏈序列插入正確,說明DNA重組成功。
2 慢病毒干擾小鼠附睪P34H表達對P34H mRNA表達的影響
各組重組慢病毒顆粒感染小鼠附睪后,P34H-shRNA-1/2/3感染組P34H mRNA的表達水平均較正常對照組和NC-shRNA陰性感染組顯著降低(P<0.05);其中以P34H-shRNA-1組下調最為明顯;正常對照組和NC-shRNA陰性感染組中P34H mRNA的表達差異無統計學顯著性,見圖2。

Figure 1. The sequence analysis of GV-P34H-shRNA positive recombinant plasmid clones. A: P34H-shRNA-1 (5’-GGCCTTTGACAGATCCTTT-3’); B: P34H-shRNA-2 (5’-GCCATCGTGAATGTCTCCA-3’); C: P34H-shRNA-3 (5’-GCGGGCAGTAACTAACCAT-3’).
圖1 GV-P34H-shRNA重組質粒陽性克隆的DNA測序結果
3 慢病毒干擾小鼠附睪P34H表達對P34H蛋白表達的影響
各組重組慢病毒顆粒感染小鼠附睪后,P34H-shRNA-1/2/3感染組P34H 蛋白的表達水平均較正常對照組和NC-shRNA陰性感染組顯著降低(P<0.05);其中以P34H-shRNA-1組下調最為明顯;正常對照組和NC-shRNA陰性感染組中P34H蛋白的表達差異無統計學顯著性,見圖3。
4 慢病毒干擾小鼠附睪P34H表達對附睪精子P34H陽性表達率的影響
附睪頭部注射慢病毒后所有小鼠都存活。取附睪尾部精子在熒光顯微鏡下檢測,間接免疫熒光染色顯示精子P34H陽性表達為精子頂體部熒光分布均勻而明亮;而精子P34H缺失表達則為精子頂體部熒光強度較弱或無熒光。P34H-shRNA-1/2/3感染組小鼠精子P34H陽性表達率與正常對照組和NC-shRNA陰性感染組相比,均顯著降低(P<0.05);其中以P34H-shRNA-1組下降最為明顯;在正常對照組和NC-shRNA陰性感染組中差異無統計學顯著性,見圖4。
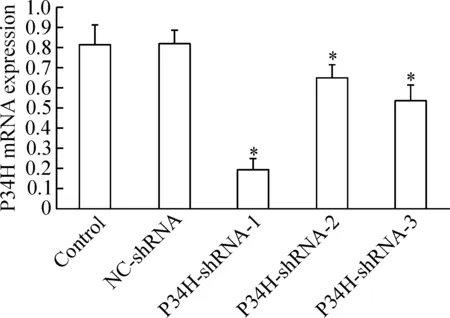
Figure 2. The mRNA levels of P34H in mouse epididymis after transfection with GV-P34H-shRNA were detected by real-time PCR. Mean±SD.n=3.*P<0.05vscontrol group.
圖2 GV-P34H-shRNA感染小鼠附睪組織對P34H mRNA表達的影響
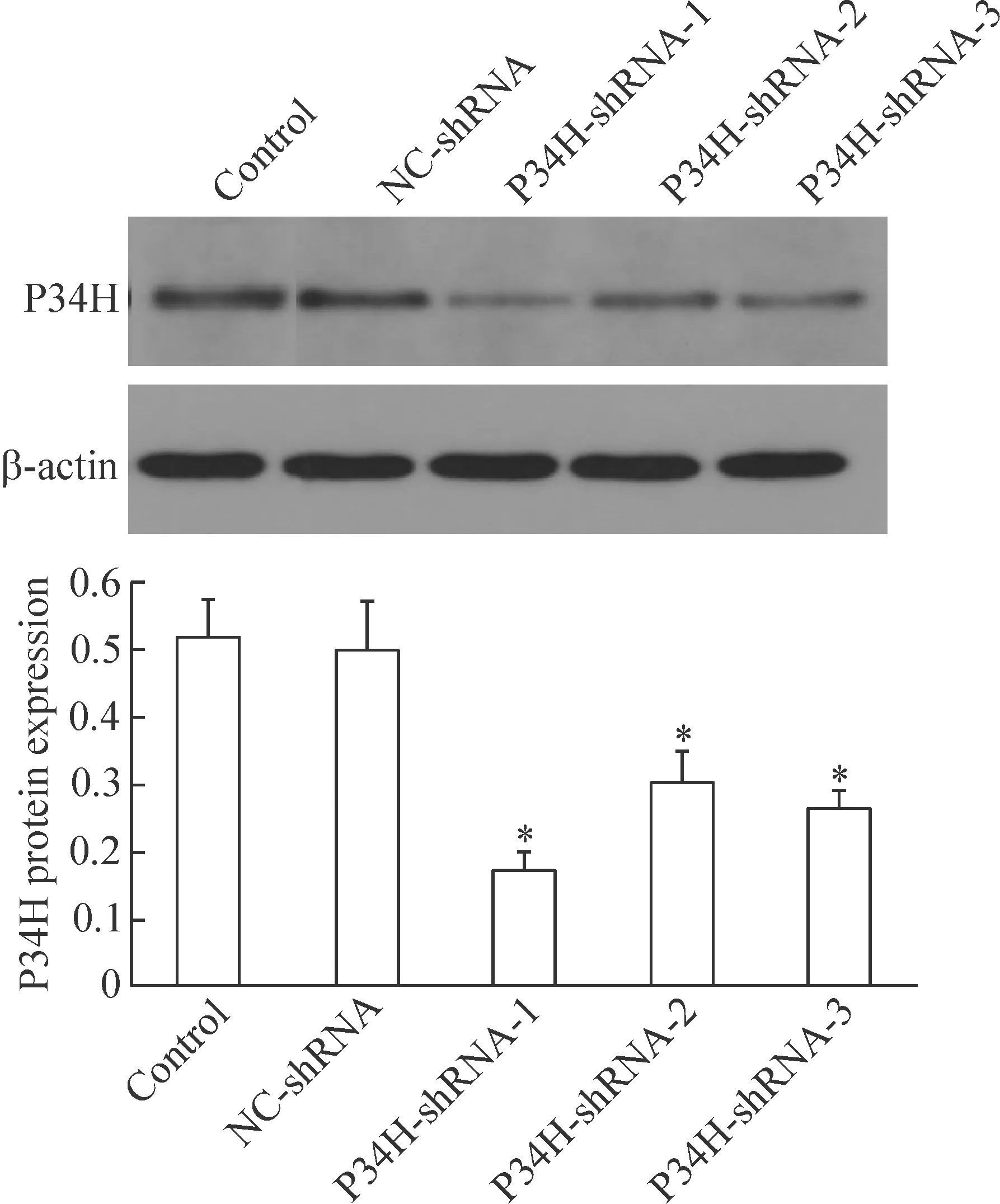
Figure 3. The protein levels of P34H in mouse epididymis after transfection with GV-P34H-shRNA were detected by Western blot. Mean±SD.n=3.*P<0.05vscontrol group.
圖3 GV-P34H-shRNA感染小鼠附睪組織對P34H 蛋白表達的影響
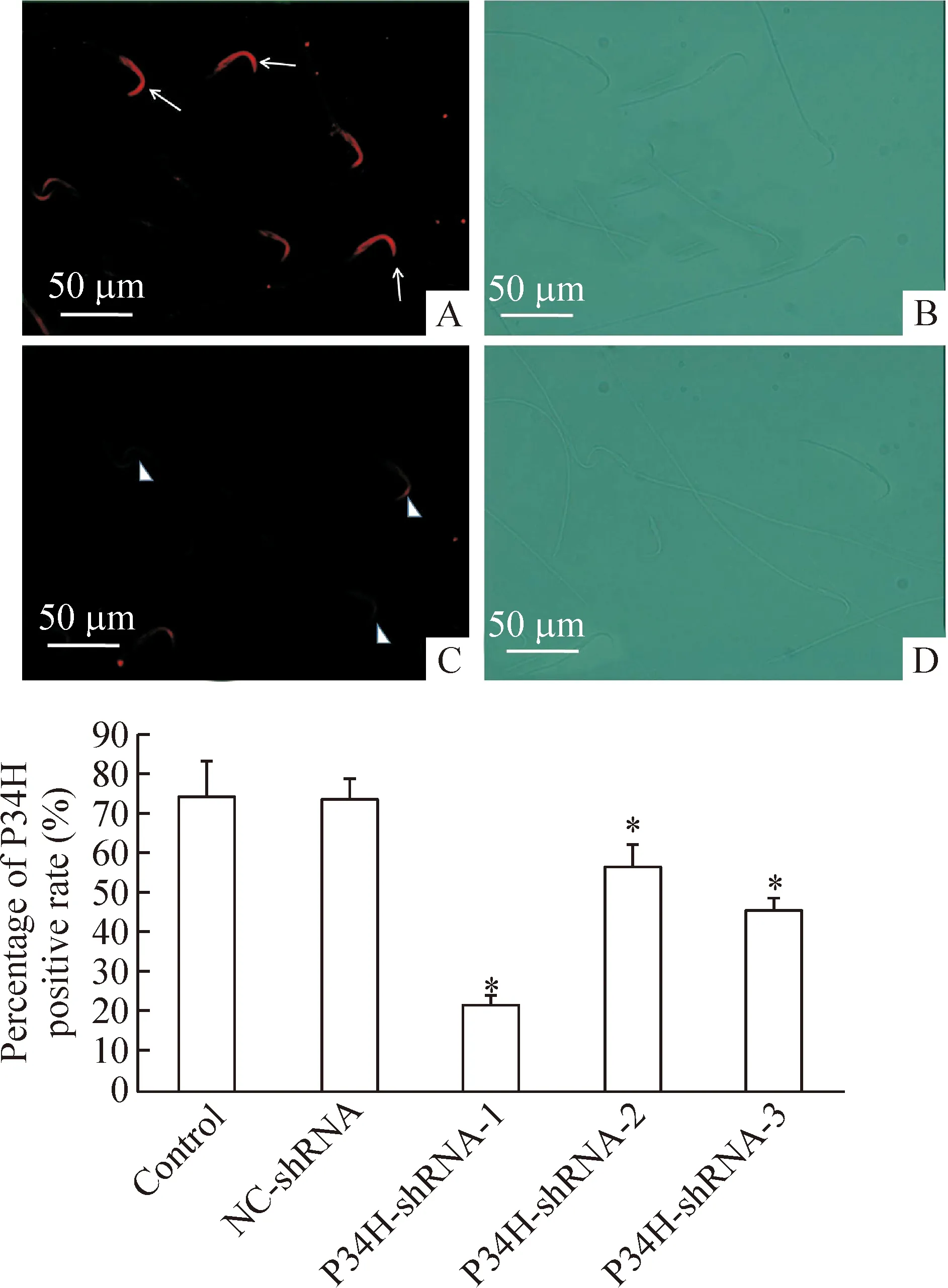
Figure 4.The percentage of P34H positive rate in mice sperm after transfection with GV-P34H-shRNA were detected by indirect immunofluorescent staining. A: positive localization of P34H in the sperm head ; B: corresponding figure A of DIC; C: lack of P34H expression in the sperm head; D: corresponding figure C of DIC.Mean±SD.n=3.*P<0.05vscontrol group.
圖4 GV-P34H-shRNA感染小鼠附睪組織對精子P34H陽性表達率的影響
5 慢病毒干擾小鼠附睪P34H表達對精子HYD活性的影響
取附睪尾部精子涂片后在光學顯微鏡下檢測,P34H-shRNA-1/ 2/ 3感染組小鼠精子HYD陽性反應率和活性強度與正常對照組和NC-shRNA陰性感染組相比,均顯著降低(P<0.05);小鼠精子HYD陽性反應率和活性強度在P34H-shRNA-1組下降最為明顯;在正常對照組和NC-shRNA陰性感染組中差異無統計學顯著性,見圖5。
討 論
精子運動能力的形成、頂體功能的完善、代謝類型的轉變、精卵的識別和融合等一系列程序化成熟功能的獲得都是在附睪微環境中完成的[9-10],附睪管腔微環境中將近80%的組分在附睪的頭部及體部組織合成,表明附睪頭部及體部特異表達的基因在精子成熟中發揮重要的作用[11]。附睪的主要功能是使精子獲得受精能力,而目前關于在附睪體部表達參與調控精子受精能力的基因還報道較少。為了探索P34H對小鼠精子功能的影響,我們在此采取RNAi技術在整體動物水平敲低P34H基因的表達,比較其對精子透明質酸酶活性的變化。

Figure 5. The HYD positive response rate and HYD activity intensity in mice sperm after transfection with GV-P34H-shRNA were detected by modified sodium hyaluronate gelatin membrane. A: control group; B: group with P34H-shRNA-1 transfection. Mean±SD.n=3.*P<0.05vscontrol group.
圖5 GV-P34H-shRNA感染小鼠附睪對HYD陽性反應率、HYD活性強度的影響
慢病毒載體系統能將攜帶的片段整合到宿主基因組產生持久穩定的表達,具有感染范圍廣且干擾效果高的特點,可以穩定表達siRNA并長時間抑制目的基因的表達,是一種理想的在整體動物水平研究目的基因功能的基因干擾載體系統[12]。本研究在此構建P34H的慢病毒干擾載體,在實驗中將慢病毒表達質粒GV-P34H-shRNA與混合包裝載體質粒共轉HEK293T細胞,包裝干擾P34H基因表達的慢病毒,在整體動物水平敲低P34H表達。將3個靶向干擾P34H表達的慢病毒干擾載體轉染小鼠附睪組織并分析各條備選序列的慢病毒載體的干擾效果。各靶序列對應的慢病毒載體都能特異地敲減靶器官P34H的mRNA表達、蛋白表達和精子頭部P34H的陽性表達率,其中,本實驗中P34H-shRNA-1敲減P34H的mRNA及蛋白表達效能最優。
本實驗結果顯示,P34H基因沉默各組中精子的HYD陽性反應率和活性強度明顯低于正常對照組。正常對照組的精子頭部出現明顯的暈環,數量較多、直徑較大,而P34H基因沉默組的精子頭部暈環數量減少,暈環的直徑變小。這些現象表明,沉默P34H基因對小鼠附睪精子HYD陽性反應率和活性強度有明顯抑制作用。精子頂體內透明質酸酶在受精過程中起著重要的作用,透明質酸酶活性低的精子人工授精成功率也較低[13]。因此,我們認為沉默P34H基因將會抑制小鼠精子HYD活性,進而影響精子和透明帶的結合,造成精子受精能力下降。
本研究結果顯示,P34H基因沉默可通過抑制精子頭部P34H陽性表達率和精子透明質酸酶活性來影響雄性小鼠的生殖功能。這一研究結果有助于探明引起不育的病因,為解決精子功能異常所引起的不育以及為P34H是否可以作為男性避孕疫苗候選分子提供基礎理論和實驗依據。
[1] 李世佳, 石 慧, 李建遠, 等. 附睪精子結合蛋白1在男性生殖中的研究進展[J]. 檢驗醫學與臨床, 2012, 9(19):2476-2478.
[2] Legare C, Thabet M, Heard S, et a1. Effect of vasectomy on P34H messenger ribonucleie acid expression along the human excurrent duct: are flection on the function of the human epididymis[J]. Biol Reprod, 2001, 64(2):720-727.
[3] Howes L, Jones R. Interactions between zona pellucida glycoproteins and sperm proacrosin/acrosin during fertilization[J]. J Reprod Immunol, 2002, 53(1-2):181-192.
[4] 鄭立宏, 楊 丹, 高曉勤. 精液中一氧化氮含量對精子頂體內透明質酸酶的影響[J]. 解剖學雜志, 2012, 35(6):718-720.
[5] 王 珂, 高曉勤, 劉鮮林. 改良固定底物膜法對精子頂體透明質酸酶檢測的研究[J]. 中華檢驗醫學雜志, 2007, 30(8):882-885.
[6] 馬曉萍, 高曉勤, 楊燕平, 等. 人精子頂體內頂體蛋白酶和透明質酸酶對男性生育力的影響[J]. 檢驗醫學, 2014, 29(3):258-261.
[7] 張新晨, 楊維良, 徐華鋒.小干擾RNA對胃癌細胞葡萄糖調節蛋白94表達的抑制作用[J].中華實驗外科雜志, 2007, 24(5):543-545.
[8] 張新晨, 楊維良, 徐華鋒.應用RNA干擾技術抑制PDE-5A-3基因在人陰莖海綿體平滑肌細胞表達[J].中華實驗外科雜志, 2006, 23(5):579-581.
[9] Dacheux JS, Gatti JL. Epididymal cell secretory activities and the role of proteins in boar sperm maturation[J]. Theriogenology, 2005, 63(2):319-341.
[10]盧 葦, 張曉燕, 張巧霞, 等. 5α-還原酶Ⅱ在附睪細胞系PC1和DC2中的表達特征[J]. 生殖與避孕, 2011, 31(1):6-9.
[11]Gatti JL, Castella S, Dacheux F, et al. Post- testicular sperm environment and fertility[J]. Anim Reprod Sci, 2004, 82-83:321-339.
[12]劉 悅, 郝玉娥, 詹軼群, 等. 人甘油激酶慢病毒干涉載體的構建和表達[J].南方醫科大學學報, 2012, 32(5): 614-617.
[13]Abduf Aziz M, Maclusky NJ. Hyaluronidase activity in human semen:correlation with fertilization[J]. Ferial Steral, 1995, 64(2):147-149.
(責任編輯: 陳妙玲, 余小慧)
Effects of epididymal P34H gene silencing on expression of P34H and activity of hyaluronidase in mouse sperm
MA Xiao-ping1, 2, GAO Xiao-qin2, DING Xian-sheng3, DAI Yan-ping1
(1DepartmentofHistologyandEmbryology,GuizhouMedicalUniversity,Guiyang550004,China;2DepartmentofHistologyandEmbryology,ZunyiMedicalandPharmaceuticalCollege,Zunyi563006,China;3DepartmentofPathology,TheFirstPeople’sHospitalofLiupanshui,Liupanshui553000,China.E-mail:gxq550301@163.com)
AIM: To investigate the effects ofP34Hgene silencing on the expression of P34H and activity of hyaluronidase (HYD) in mouse sperm.METHODS: The recombinant plasmid series of P34H targeted short hairpin RNA (shRNA) were constructed by GV248 plasmids vector. These recombinant plasmids were transformed into DH5α competent cells, and the plasmids were taken from DNA sequencing analysis. The HEK293T cells were co-transfected with shRNA and lentiviral packaging plasmids. The 3 kinds of recombinant lentiviruses and negative control lentiviruses were used to inject into the mouse epididymis and the expression of P34H at mRNA and protein levels was detected by real-time PCR and Western blot, respectively. The location of P34H protein on the mouse spermatozoa was determined by indirect immunofluorescent staining using P34H antibody. The positive rate and activity intensity of HYD was detected by modified sodium hyaluronate-gelatin membrane. RESULTS: DNA sequencing analysis confirmed that the 3 P34H-shRNA sequences were successfully inserted into the lentiviral vectors. P34H expression in epididymis tissue was significantly decreased at both mRNA and protein levels compared with those of the non-transfected and normal control vectors (P<0.05). The GV-P34H-shRNA-1 played a significant role in reducing the percentage of P34H positive rate and the activity of HYD in mouse sperm. The silencing effect did not significantly differ between the non-transfected and normal control vectors. CONCLUSION: Silencing ofP34Hsignificantly inhibits the percentage of P34H positive rate and the activity of hyaluronidase in mouse sperm.
P34H; RNA interference; Hyaluronidase
1000- 4718(2017)01- 0133- 06
2016- 06- 22
2016- 09- 21
貴州省科技計劃項目(黔科合LH字[2015]7567號); 貴州省科技創新人才團隊項目(黔科合人才團隊[2014]4005號)
R363
A
10.3969/j.issn.1000- 4718.2017.01.022
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 0851-28925881; E-mail: gxq550301@163.com

