PTH、細胞內鈣和CaSR在心肌損傷中的“三角關系”*
羅 星, 徐長慶
(哈爾濱醫科大學病理生理教研室,黑龍江 哈爾濱 150001)
?
·綜 述·
PTH、細胞內鈣和CaSR在心肌損傷中的“三角關系”*
羅 星, 徐長慶△
(哈爾濱醫科大學病理生理教研室,黑龍江 哈爾濱 150001)
甲狀旁腺激素; 細胞內鈣; 鈣敏感受體; 心肌損傷
甲狀旁腺激素 (parathyroid hormone, PTH) 是甲狀旁腺細胞分泌的調控機體鈣磷代謝的重要激素。近年來,PTH對于心肌的毒性作用開始受到人們關注。鈣敏感受體 (calcium-sensing receptor, CaSR) 是G蛋白偶聯家族成員之一,可以感受細胞外鈣濃度的細微變化,并通過多種途徑調節細胞內鈣濃度,進而控制PTH的分泌。CaSR在心肌細胞、腎小管上皮細胞和甲狀旁腺細胞等廣為表達。細胞內鈣作為第二信使,參與細胞的多種功能,諸如興奮-收縮偶聯、受精等過程。高濃度的PTH、細胞內鈣和高表達的CaSR,均與心肌細胞的損傷息息相關。
1 細胞內鈣與心肌損傷
細胞內鈣作為第二信使,在機體許多生理和病理過程涉及的細胞信號轉導中扮演了非常重要的角色。細胞內鈣穩態與細胞的生存、代謝和功能密切相關。心肌細胞內鈣來源于鈣離子通道介導的細胞外鈣內流和肌漿網 (sarcoplasmic reticulum, SR) 內鈣外流。細胞外鈣內流主要由電壓依賴型鈣離子通道 (voltage-dependent calcium channel, VDCC) 和受體操縱型鈣離子通道 (receptor-operated calcium channel, ROCC) 介導,前者主要受膜電位控制,后者取決于配體的性質。ROCC存在于細胞膜(例如α受體和β受體)和肌漿網[三磷酸肌醇 (inositol triphosphate, IP3) 受體和ryanodine受體]。心肌細胞內鈣主要存在于肌漿網(第一鈣庫)以及細胞漿和線粒體(第二鈣庫)中。肌漿網由IP3敏感池和IP3不敏感池組成,分別受IP3受體系統和ryanodine受體系統調控。鈣離子經過單個L型鈣通道引起的局部細胞內鈣增加稱為鈣小星 (Ca2+sparklet),后者誘發肌漿網上數個ryanodine受體同時開放,形成更高濃度的鈣火花 (calcium sparks)。鈣火花負責觸發心肌的興奮-收縮偶聯。
細胞內鈣超載是指細胞內游離鈣顯著增加,可激活多條心肌凋亡信號通路(例如線粒體凋亡通路,死亡受體凋亡通路和內質網應激凋亡通路),是各種心血管疾病細胞死亡的共同通路[1]。在小鼠心肌缺血-再灌注損傷中,損傷組心肌細胞細胞內游離鈣比正常組明顯升高。其機制可能是鈉鈣交換體反向轉運,大量鈣離子進入細胞漿;缺血時ATP供給不足,肌漿網鈣泵障礙,攝取鈣減少[2];還有實驗報道,細胞內鈣超載通過線粒體鈣離子單向轉運體引起線粒體細胞凋亡途徑,是缺血-再灌注損傷導致心肌死亡的主要原因[3]。線粒體通透性轉運孔 (mitochondrial permeability transition pore, MPTP)是存在于線粒體內膜表面的高導電性復合蛋白通道,目前發現MPTP主要組成成分有電壓依賴型陰離子通道 (voltage-dependent anion chancel, VDAC)、腺苷酸轉位蛋白 (adenine nucleotide translocator, ANT)和親環蛋白D (cyclophilin, Cyp-D)。Cyp-D的生理功能是保證蛋白質的準確折疊,并且Cyp-D上有Ca2+和ANT的結合位點,在線粒體鈣超載的情況下,Cyp-D先后與鈣離子和ANT結合,使得ANT構象發生改變,促進MPTP開放[4]。MPTP開放后跨膜電位下降,從而導致細胞色素C (cytochrome C, Cyt C) 和細胞凋亡誘發因子 (apoptosis-inducing factor, AIF) 的釋放[5]。釋放的Cyt C在胞質中與凋亡蛋白酶活化因子1 (apoptotic protease-activating factor 1, Apaf-1) 形成復合物,導致ATP的大量消耗并促進Apaf-1的聚合,其N端的CARD結構域與procaspase-9的CARD寡聚化,通過級聯反應,依次激活caspase-7和caspase-3,引起細胞凋亡[6]。線粒體外膜間隙釋放的AIF也可以直接活化caspase-3[7]。通過激活線粒體凋亡途徑誘發心肌細胞凋亡,是細胞內鈣超載導致心肌損傷的主要機制。
2 PTH與心肌損傷
PTH是尿毒癥血癥的重要心臟毒素,對心血管系統影響極大。血清PTH水平過高可導致心肌肥大、心臟損傷和血管鈣化,影響血壓甚至影響血糖和血脂[8]。血清PTH的正常值范圍為12~76 ng/L。文獻報道,慢性腎衰竭病人常伴有繼發性甲狀旁腺功能亢進,血清中PTH水平升高。Fujii等[9]的實驗發現,PTH>500 ng/L的慢性腎衰竭患者心室重量指數和室間隔厚度較PTH正常者顯著升高,說明高濃度PTH可促進心肌細胞肥大甚至損傷。Halapas等[10]在小鼠模型中發現,PTH相關蛋白(例如PTH1-34)同PTH一樣,可與PTH受體結合,進而參與心肌肥大和心肌損傷的過程。PTH升高時,血管緊張素Ⅱ (angiotensin II, Ang II) 隨之升高,后者通過調節許多原癌基因的表達,導致心肌細胞及心肌間質細胞增生和纖維化[11]。研究表明,PTH(或PTH相關蛋白)和Ang II均可與心肌細胞膜上各自相應的G蛋白偶聯受體結合,激活cAMP和PKC途徑,活化心肌細胞上L型鈣通道,使鈣內流增多,也可能導致心肌細胞線粒體上鈣離子單向交換體開放,引起細胞內和線粒體鈣超載,促進心肌肥大和細胞凋亡。亦有最新的研究顯示,心臟局部的腎素-血管緊張素系統也參加了鈣超載的發生[12]。心臟在代償期多呈向心性肥大,失代償時可發展為心衰。晚期繼發性甲狀旁腺亢進的病人,常伴發舒張期功能障礙[13]。最新研究表明,糖耐量也是PTH影響心肌代謝的一個重要方面。高PTH引起胰島B細胞中腺苷三磷酸水平升高,細胞內鈣濃度升高,減少胰島素分泌,糖耐量異常,導致心肌損害[14]。
臨床上,對于繼發性甲狀旁腺亢進患者,常采用甲狀旁腺切除術或者鈣三醇(維生素D3的代謝物)來治療,并取得較好效果。在甲狀旁腺切除術后,患者血鈣水平和血腦鈉肽水平明顯下降,左心室重量指數、左心室射血分數、收縮功能等均有明顯改善,但是內皮源型的舒張功能改善不大。
總之,PTH分泌異常對心肌的結構和功能有一定的影響,甚至導致心肌損傷。具體機制有待進一步研究。
3 CaSR與心肌損傷
CaSR是G蛋白偶聯受體C家族成員,廣泛存在心血管系統,在心肌細胞、血管平滑肌和血管內皮細胞都有表達,參與細胞內鈣穩態、心肌興奮-收縮偶聯、細胞基因表達和細胞凋亡的調控[15]。有人在大鼠和小鼠心肌缺血-再灌注 (ischemia-reperfusion, I/R) 損傷模型發現,心肌I/R可引起CaSR表達增加,激活磷脂酶C (phospholipase C, PLC),催化磷酯酰肌醇二磷酸 (phosphatidylinosital biphosphate, PIP2) 產生IP3和甘油二酯(diacylglycerol, DAG),IP3和DAG分別促使內質網上IP3受體鈣離子通道和質膜L型鈣通道開放,細胞內鈣超載,繼而誘導線粒體鈣離子單向轉運體 (mitochondrial calcium uniporter, MCU) 開放,線粒體膜電位下降,引起心肌細胞經線粒體途徑凋亡[16]。MCU本身與細胞內鈣親和力極低,但發生細胞內鈣超載后,高濃度的Ca2+與MCU的亞基MCU1的EF臂Ca2+結合域結合,協同開放MCU通道[17]。MCU開放后,鈣離子大量進入線粒體,抑制ATP的合成,使得心肌能量產生障礙;激活線粒體膜上磷脂酶,引起線粒體膜損傷;并在線粒體內形成磷酸鈣沉積,改變了線粒體膜的通透性,從而導致線粒體鈣超載引起心肌損傷[18]。國內研究者發現,用三氯化釓 (GdCl3) 激動CaSR后細胞外信號調節激酶 (extracellular signal-regulated kinase, ERK) 磷酸化和Bcl-2表達增加,而caspase-3表達也上調,細胞凋亡增加;使用酪氨酸蛋白激酶阻斷劑PD98059后,ERK磷酸化降低,Bcl-2表達減少,心肌凋亡增加。可見,CaSR促進ERK磷酸化與酪氨酸蛋白激酶有關,而且CaSR激活的促凋亡作用大于抑凋亡作用[14]。有人在動物實驗中觀察到,糖尿病心肌病模型組的心肌凋亡率較對照組顯著升高,但是加入CaSR阻斷劑NSP2390后,細胞凋亡率明顯下降[18]。此外,人們還觀察到,心肌I/R損傷大鼠和高位截癱受損小鼠,其心肌細胞上CaSR表達都顯著升高。可見,CaSR在心肌細胞凋亡中的作用,各家實驗結果不盡相同,需要進一步深入研究。有人發現,ATP敏感鉀通道開放劑預處理可抵抗心肌I/R損傷,同時使CaSR表達和細胞凋亡減少[19],提示ATP敏感鉀通道開放劑的心肌保護作用可能和CaSR的表達降低有關。Yang等[20]在細胞培養的研究中,同樣觀察到ATP敏感性鉀通道開放劑吡那地爾可減少缺氧復氧所致的CaSR表達和細胞凋亡增加。顯然,心肌細胞CaSR的表達和活性異常與心肌損傷關系密切。
4 PTH與CaSR
PTH與CaSR息息相關,都參與體內鈣穩態的調節。CaSR在甲狀旁腺和腎小管上均有表達,可感受細胞外鈣離子濃度的變化,繼而發揮不同的生理功能。CaSR調節甲狀旁腺激素分泌的具體機制尚不清楚,主要有2種假說。在細胞外鈣升高時,CaSR主要通過2條通路影響PTH分泌,其一是Gq蛋白激活引起肌醇磷脂集聚,其二是Gi蛋白激活導致ERK1/2磷酸化,二者均能抑制PTH的分泌[21]。位于3q21.1的CaSR基因突變會導致甲狀旁腺功能紊亂。失活突變可導致新生兒嚴重甲亢、繼發性甲亢和家族性低尿鈣高鈣血癥;激活突變則可導致低鈣血癥、巴氏綜合征和自身免疫性甲狀旁腺功能減退[22]。CaSR基因突變常呈劑量效應。例如單個CaSR基因的失活突變可引起輕微高鈣血癥,無明顯臨床癥狀,然而純合突變則可引起新生兒嚴重甲亢。失活突變的機制主要有:(1)CaSR受體在細胞內生物合成障礙或降解增加[23];(2)CaSR的細胞內生物合成及表達正常,但是向內質網轉運異常[24];(3)CaSR表達及轉運正常,但是對鈣離子等配體的結合力下降[25]。CaSR基因的失活突變,可引起原發性或繼發性甲狀旁腺亢進,進而對心肌產生毒性。針對CaSR這個靶點,采用CaSR激動劑可抑制PTH的釋放,減少心臟毒性等并發癥。Block等[26]用擬鈣劑西那卡塞(30~180 mg)對741例繼發性甲狀旁腺功能亢進患者進行治療,結果顯示西那卡塞治療組PTH下降43%(對照組上升9%),血鈣血磷明顯下降。國內研究人員分別對于36例繼發性甲狀旁腺患者進行維生素D3沖擊療法和西那卡塞療法,結果顯示2組鈣磷濃度和PTH都較對照組顯著下降,而且PTH在西那卡塞治療組下降比維生素D3組更為明顯[27]。從PTH作為心肌毒素的角度看,擬鈣劑確實可以保護心臟,但是缺少確切的臨床試驗驗證。反過來,PTH也會影響CaSR的激活。CaSR對于細胞外鈣極度敏感,當細胞外鈣超過1.3 mmol/L(正常血清游離鈣為1.0 mmol/L~1.25 mmol/L),CaSR激活,通過一系列信號傳導通路,發揮不同生物學效應。有研究顯示,PTH可升高細胞外鈣,從而激活細胞表面CaSR,活化細胞內MAPKK通路,促進細胞增殖[28]。但是,在心肌損傷方面,PTH是否也是經過相同的途徑升高細胞外鈣,再激活CaSR引起細胞內鈣超載,繼而導致細胞凋亡,這個假設尚沒有實驗來證實。如果該假說得到證實,CaSR有望成為未來治療甲狀旁腺功能亢進所致心肌損傷的新靶點。
5 PTH、細胞內鈣與心肌損傷
PTH主要生理功能是升高細胞外鈣和降低血磷。但是研究表明,PTH對細胞內鈣也有調節作用。趙衛紅等[29]將原代培養的小鼠心肌細胞,分別用PTH以及PTH和硝苯地平聯合處理,發現單純PTH處理組小鼠心肌細胞內游離鈣較對照組明顯升高,而且細胞凋亡率升高。而硝苯地平和PTH聯合處理組細胞內鈣和細胞凋亡率較單純PTH處理組有所降低,但仍比正常對照組高。加入硝苯地平后細胞內鈣離子和細胞凋亡率下降說明PTH通過G蛋白偶聯激活腺苷酸環化酶,開放細胞膜上電壓依賴型鈣通道,促進細胞內鈣超載;而和對照組比較,依然有較高細胞凋亡率,暗示還有其它途徑引起鈣超載和細胞凋亡。亦有研究顯示,鈣三醇也可以改善PTH引起的心肌細胞內鈣超載和心肌細胞凋亡[30]。
綜上所述,PTH、CaSR和細胞內鈣之間存在復雜而又緊密的關系。PTH可以間接激動CaSR,引起一系列的信號轉導通路的活化,而CaSR又可以抑制PTH的分泌。PTH可以升高細胞內游離鈣,發揮第二信使的正常生理功能;在病理狀態下,則可引起細胞內鈣超載。CaSR也可以通過G蛋白偶聯途徑,升高細胞內鈣,引起心肌凋亡。所以,PTH、CaSR和細胞內游離鈣之間形成一個互相影響的三角關系,最終以細胞內鈣超載為核心環節,導致心肌損傷。PTH是否可以通過升高細胞外鈣,間接激活CaSR,進而升高細胞內鈣,引起細胞內鈣超載,這一假想有待于通過實驗驗證。如果得到證實,將進一步揭示繼發性甲狀旁腺功能亢進心肌損傷的新機制(圖1)。
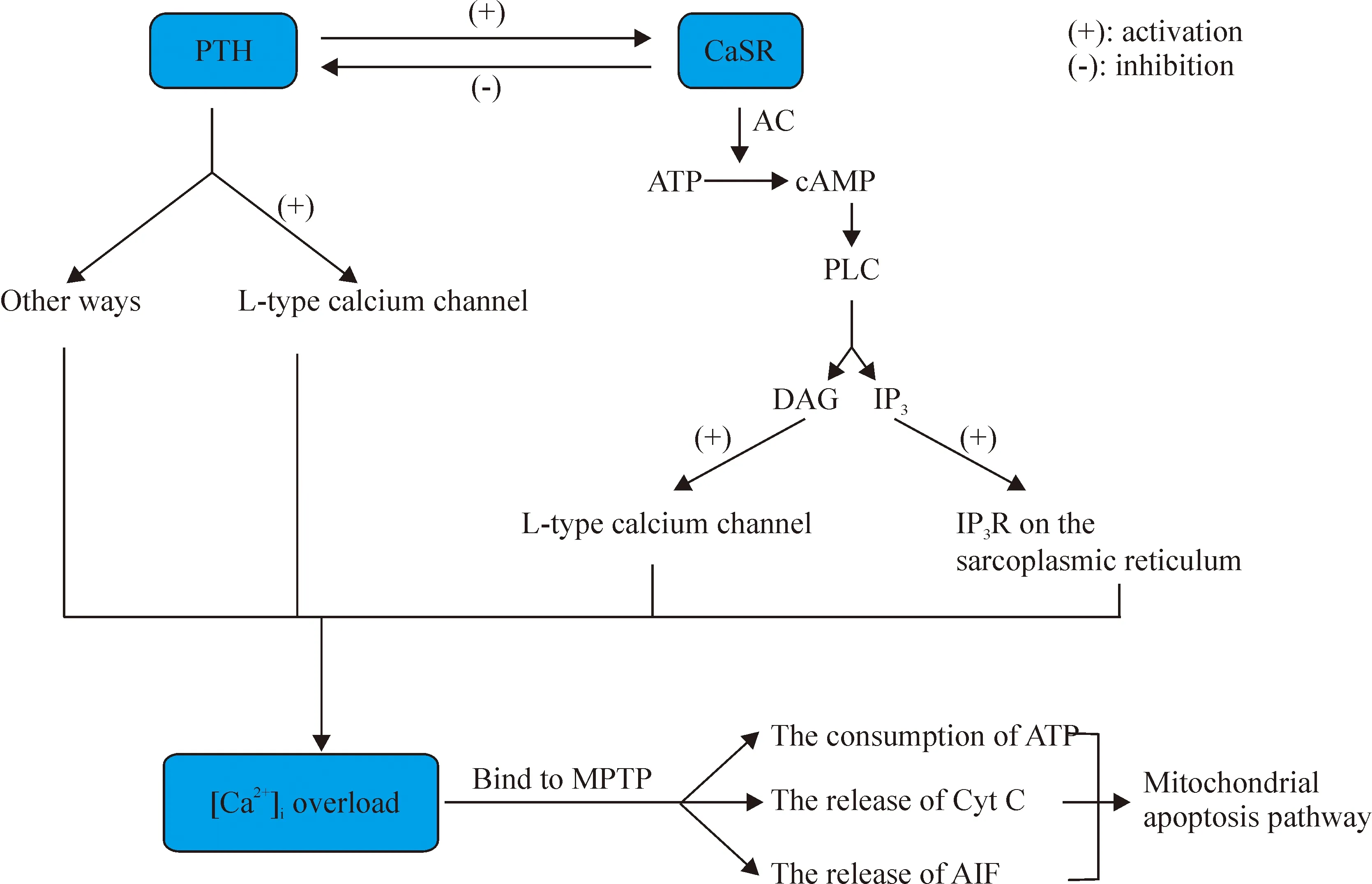
Figure 1.The triangle relationship of PTH, CaSR and intracellular calcium and their potential mechanism of apoptosis. PTH can activate CaSR by increasing the concentration of the extracellular calcium, while the activation of CaSR is able to inhibit the release of PTH in reverse. Moreover, excessive increase in PTH activates CaSR, which contributes to the opening of L-type calcium channel and IP3R calcium channel. Intracellular calcium overload caused by the opening of those channels is capable of inducing mitochondrial apoptosis pathway.
圖1 PTH、CaSR和細胞內鈣之間的潛在關系及其導致細胞凋亡的推測圖示
6 展望
隨著人們物質生活水平的提高和精神壓力的增加,慢性腎衰竭的主要病因糖尿病和高血壓病的發病率將越來越高。繼發性甲狀旁腺功能亢進誘發心肌損傷是慢性腎衰竭致死的主要原因。因此,進一步闡明甲狀旁腺亢進心肌病的機制顯得分外重要。對于PTH是否可以通過增加細胞外鈣間接激動CaSR進而引起細胞內鈣超載的這一假設,如果得到證實,將可能指導臨床用藥,給慢性腎衰竭患者帶來福音。
[1] Zimmerman AN, Hülsmann WC. Paradoxical influence of calcium ions on the permeability of the cell membranes of the isolated rat heart [J]. Nature, 1996, 211(5049):646-653.
[2] Sugishita K, Su Z, Li F, et al. Gender influences [Ca2+]iduring metabolic inhibition in myocytes overexpressing the Na+-Ca2+exchanger [J]. Circulation, 2001, 104(17):2101-2106.
[3] Zhao ZQ. Oxidative stress-elicited myocardial apoptosis during reperfusion[J]. Curr Opin Pharmacol, 2004, 4(2):159-165.
[4] Woodfield K, Rtmck A, Brdiczka D, et al. Direct de-monstration of a specific interaction between cyclophilin-D and the adenine nucleotide translocase confirms their role in the mitochondrial permeability transition[J]. Biochem J, 1998, 336(Pt 2): 287-290.
[5] He L, Pollens AT, Medrano CJ, et al. Lead and calcium produce rod photo receptor cell apoptosis by opening the mitochondrial permeability transition pore[J]. J Biol Chem, 2000, 275(16):12175-12184.
[6] Randon RB, Rohde LE, Comerlato L, et al. The role of secondary hyperparathyroidism in left ventricular hypertrophy of patients under chronic hemodialysis[J]. Braz J Med Biol Res, 2005, 38( 9):1409-1416.
[7] Ebisawa K, Kimura K, Nakayama T, et al. Cardiac electrophysiologic effects of parathyroid hormone in the guinea pig[J]. Heart Vessels, 1995, 10(3):128-137.
[8] Andersson P, Rydberg E, Willenheimer R. Primary hyperparathyroidism and heart disease: a review[J]. Eur Heart J, 2004, 25(20):1776-1787.
[9] Fujii H, Kim JI, Abe T, et al. Relationship between pa-rathyroid hormone and cardiac abnormalities in chronic dialysis patients[J]. Intern Med, 2007, 46(18):1507-1512.
[10]Halapas A, Diamanti-Kandarakis E, Kremastinos D, et al. The PTHrP/PTH.1-R bioregulation system in cardic hypertrophy: possible therapeutic implications[J]. In Vivo, 2006, 20(6B):837-844.
[11]朱甫祥, 馬麗英, 王孝銘, 等. 局部腎素血管緊張素系統在心肌細胞氧反常中的作用[J]. 中國病理生理雜志, 1997, 13(2):126-128.
[12]汪關煜, 錢 瑩, 朱 萍, 等. 慢性腎衰患者甲狀旁腺激素與左心室結構和功能的關系[J]. 腎臟病與透析腎移植雜志, 2001, 10(1):25-27.
[13]Khan S. Secondary hyperparathyroidism is associated with higher cost of care among chronic kidney disease patients with cardiovascular comorbidities[J]. Nephron Clin Pract, 2007, 105(4):c159-c164.
[14]H?rl WH. The clinical consequences of secondary hyperparathyroidism: focus on clinical outcomes[J]. Nephrol Dial Transplant, 2004, 19(Suppl 5):v2-v8.
[15]徐長慶, 張偉華. 心血管疾病鈣敏感受體的研究進展[J]. 中國病理生理雜志, 2010, 26(2):409-413.
[16]Lu FH, Tian Z, Zhang WH, et al. Calcium-sensing receptors regulate cardiomyocyte Ca2+signaling via sarcoplasmic reticulum-mitochondrion interface during hypoxia/reoxygenation[J]. J Biomed Sci, 2010, 17:50.
[17]徐 斌, 李 泱. 線粒體鈣單向轉運體及其蛋白相互作用的調控[J]. 中國病理生理雜志, 2015, 31(12):2291-2295.
[18]楊彥玲, 師養榮, 李建龍, 等. 心肌缺血再灌注損傷研究進展[J]. 心血管病研究進展, 2003, 24(2):116-121.
[19]Qi HP, Cao YG, Huang W, et al. Crucial role of cal-cium-sensing receptor activation in cardiac injury of diabetic rats[J]. PLoS One, 2013, 8(5):e65147.
[20]Yang I, Yu T. Prolonged donor heart preservation with pinacidil: the role of mitochondria and the mitochondrial adenosine triphosphate-sensitive potassium channel[J]. J Thorac Cardiovasc Surg, 2010, 139(4):1057-1063.
[21]王曉巍, 陳智勇, 朱化剛. 鈣敏感受體在甲狀旁腺功能亢進中的作用[J]. 國際外科學雜志, 2011, 38(5):339-342.
[22]Hannan FM, Thakker RV. Calcium-sensing receptor (CaSR) mutations and disorders of calcium, electrolyte and water metabolism[J]. Best Pract Res Clin Endocrinal Metab, 2013, 27(3):359-371.
[23]Pidasheva S, Canaff L, Simonds WF, et al. Impaired cotranslational processing of the calcium-sensing receptor due to signal peptide missense mutations in familial hypocalciuric hypercalcemia[J]. Hum Mol Genet, 2005, 14(12):1679-1690.
[24]Pidasheva S, Grant M, Cauaff L, et al. Calcium-sensing receptor dimerizes in the endoplasmic reticulum: bioche-mical and biophysical characterization of CASR mutants retained intracellularly[J]. Hum Mol Genet, 2006, 15(14):2200-2209.
[25]Zajiekova K, Vrbikova J, Canaff L, et al. Identification and functional characterization of a novel mutation in the calcium-sensing receptor gene in familial hypocalciuric hypercalcemia: modulation of clinical severity by vitamin D status[J]. J Clin Endocrinol Metab, 2007, 92(7):2616-2623.
[26]Block GA, Martin KJ, Francisco AL, et al. Cinacalcet for secondary hyperparathroidism in patients receiving hemodialysis[J]. N Engl J Med, 2004, 350(15):1516-1525.
[27]殷 勛. 鈣敏感受體激動劑治療維持甲狀旁腺功能亢進患者的臨床研究[J]. 中國民康醫學, 2016, 28(3):28-32.
[28]Miao D, He B, Lanske B, et al. Skeletal abnormalities inPth-null mice are influenced by dietary calcium[J]. Endocrinology, 2004, 145(4):2046-2053.
[29]趙衛紅, 王笑云, 張曉文. 甲狀旁腺素對大鼠心肌細胞內游離鈣和細胞凋亡的影響[J].中國藥理學通報, 2014, 19(7):826-835.
[30]趙衛紅, 王笑云, 張曉文. 鈣三醇和甲狀旁腺素對鼠心肌細胞凋亡的影響及機制[J].中國臨床康復, 2004, 8(24):5004-5005.
(責任編輯:林白霜, 羅 森)
Triangle relationship of PTH, intracellular calcium and CaSR in myocardial damage
LUO Xing, XU Chang-qing
(DepartmentofPathophysiology,HarbinMedicalUniversity,Harbin150001,China.E-mail:xucq45@126.com)
Parathyroid hormone (PTH) is an important hormone secreted by parathyroid cells, and regulates the metabolism of calcium and phosphorus in the body. In recent years, the toxic effect of PTH on myocardium has been reported. Calcium-sensing receptor (CaSR), a member of G protein-coupled receptor family, can feel the subtle change of extracellular calcium concentration and regulate intracellular calcium concentration through multifarious ways in order to control the secretion of PTH. The expression of CaSR is observed in parathyroid cells, renal tubular epithelial cells, myocardial cells, etc. Intracellular calcium, as a second messenger, participates in various cell functions, such as excitation-contraction coupling, fertilization and so on. The injury of myocardial cells is intimately linked with high concentrations of PTH and intracellular calcium, and high expression of CaSR.
Parathyroid hormone; Intracellular calcium; Calcium-sensing receptor; Myocardial damage
1000- 4718(2017)01- 0179- 05
2016- 06- 30
2016- 10- 28
國家自然科學基金資助項目(No.81270311)
R363
A
10.3969/j.issn.1000- 4718.2017.01.031
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 0451-86674548; E-mail: xucq45@126.com

