非生物誘導子茉莉酸甲酯和水楊酸對半夏懸浮細胞中生物堿代謝的影響
段永波 魯放 崔婷婷 趙豐蘭 滕井通 盛瑋 張愛民 薛建平
摘要:目的 研究非生物誘導子茉莉酸甲酯(MeJA)和水楊酸(SA)對半夏懸浮細胞系生物堿含量及相關酶活性的影響。方法 以葉柄來源的愈傷組織建立半夏懸浮細胞系,調查不同培養時間、MeJA和SA濃度對細胞中生物堿含量的影響,并分析生物堿合成相關酶(IMP脫氫酶、sAMP合成酶)的活性。結果 懸浮培養21 d時,懸浮細胞干重(DW)為培養前9倍,且生物堿總量為培養前3倍。MeJA和SA處理均能顯著促進生物堿在半夏懸浮細胞中累積。150 ?mol/L MeJA處理組生物堿含量為對照組3.6倍,達4.7 mg/g DW;50 ?mol/L SA處理使懸浮細胞生物堿含量達到對照組的2.5倍。100 ?mol/L MeJA和50 ?mol/L SA處理使IMP脫氫酶比活力分別為對照組3.0、3.7倍,150 ?mol/L MeJA和100 ?mol/L SA處理使sAMP合成酶比活力分別為對照組2.6、4.4倍。結論 添加適量外源誘導子MeJA和SA能促進半夏懸浮細胞中生物堿的累積。
關鍵詞:半夏;懸浮細胞;生物堿;茉莉酸甲酯;水楊酸
DOI:10.3969/j.issn.1005-5304.2017.01.021
中圖分類號:R282.6 文獻標識碼:A 文章編號:1005-5304(2017)01-0087-04
Effects of Abiotic Elicitors MeJA and SA on Alkaloids Accumulation and Related Enzymes Metabolism in Pinellia ternata Suspension Cell Cultures DUAN Yong-bo, LU Fang, CUI Ting-ting, ZHAO Feng-lan, TENG Jing-tong, SHENG Wei, ZHANG Ai-min, XUE Jian-ping (Key Laboratory of Resource Plant Biology of Anhui Province, College of Life Sciences, Huaibei Normal University, Huaibei 235000, China)
Abstract: Objective To study the effects of abiotic elicitors methyl jasmonate (MeJA) and salicylic acid (SA) on the alkaloids accumulation and related enzymes metabolism in Pinellia ternata suspension cell cultures. Methods Using the leaf petioles-derived suspension cell cultures as the study object, the culture duration, concentrations of MeJA and SA were determined to get the optimal alkaloids accumulation, and the activities of metabolic enzymes IMP dehydrogenase and sAMP synthase were also measured. Results A 9-fold of dried biomass and a 3-fold of alkaloids accumulation were observed in P. ternata suspension cell cultures after culture for 21 d. Both MeJA and SA could significantly promote the accumulation of alkaloids in P. ternata suspension cells. 150 ?mol/L MeJA enhanced alkaloids content (4.7 mg/g DW) by 3.6 folds in comparison with control group, whereas 50 ?mol/L SA showed a 2.5-fold increase. Meanwhile, 100 ?mol/L MeJA and 50 ?mol/L SA promoted the increase in IMP dehydrogenase activity by 3.0 and 3.7 fold respectively, and 150 ?mol/L MeJA and 100 ?mol/L SA showed the increase by 2.6 and 4.4 fold respectively. Conclusion Proper adding exogenous MeJA and SA can promote the accumulation of alkaloids in Pinellia ternata suspension cell cultures.
Key words: Pinellia ternata; suspension cell cultures; alkaloids; methyl jasmonate; salicylic acid
半夏Pinellia ternata(Thunb.)Breit.為天南星科
基金項目:國家自然科學基金(31501368、81573518);安徽省自然科學基金(1408085MC58、1608085MC52);安徽高校省級自然科學研究項目(KJ2016B016、KJ2015ZD35)
通訊作者:薛建平,E-mail:xuejp@163.com
多年生草本植物,其藥用功效最早記載于《神農本草經》。半夏以塊莖入藥,具有燥濕化痰、止咳鎮痛的作用,已成為我國最常用的十大中藥之一[1]。半夏富含生物堿、β-谷甾醇、多糖、揮發性油等,其中生物堿被視為其主要活性成分[2]。在半夏生物堿中,胡蘆巴堿含量常被作為半夏質量控制指示,肌苷則用作半夏的鑒別性成分[3-4]。
作為大宗中藥材,半夏年需求量達500~600萬kg,而野生和人工栽培產量僅能滿足1/3,市場缺口很大[5]。自然狀態下,半夏極少進行有性生殖,主要通過珠芽或塊莖進行營養繁殖,繁殖系數低[6]。長期過度采伐導致野生半夏資源瀕于枯竭,而人工栽培依然面臨高溫、干旱、病蟲害以及人工成本等多方面因素的影響,難以滿足半夏藥材的市場需求。
懸浮細胞可在人為控制條件下實現活性功能成分的生產,為解決藥用植物資源不足和成本控制提供了新途徑[7]。茉莉酸甲酯(MeJA)和水楊酸(SA)為重要的信號分子[8],常被用于植物次生代謝途徑研究。本研究以半夏懸浮細胞系為研究對象,考察外源MeJA和SA對生物堿合成和相關代謝酶活性的影響,以期為利用半夏懸浮細胞系生產生物堿提供依據。
1 儀器與試藥
YXQ-LS-50A立式壓力蒸汽滅菌器,上海博迅醫療生物儀器股份有限公司;HJH-C2112C超凈工作臺,上海智城分析儀器制造有限公司;QHZ-98B全溫度光照震蕩培養箱,太倉市華美生化儀器廠;BSA224S電子天平,賽多利斯科學儀器(北京)有限公司;752紫外可見分光光度計,上海菁華科技儀器有限公司;GZX-9240MBE電熱恒溫鼓風干燥箱,上海博迅醫療生物儀器股份有限公司;KQ-500超聲波清洗器,昆山市超聲儀器有限公司。
檸檬酸-檸檬酸鈉緩沖溶液(pH 5.4)、氯仿及溴麝草酚藍標準溶液,購自生工生物工程(上海)股份有限公司;6-芐氨基腺嘌呤(6-BA)、2,4-二氯苯氧乙酸(2,4-D)、6-糠氨基嘌呤(KT)、茉莉酸甲酯(MeJA)、水楊酸(SA)及鹽酸麻黃堿等試劑均為Sigma-Aldrich產品。試驗所用半夏植株采自淮北市龍脊山自然風景區(E-116°23′,N-34°14′),經薛建平教授鑒定為宿半夏Pinellia ternata(Thunb.)Breit。
2 方法與結果
2.1 半夏懸浮細胞體系構建
半夏愈傷組織誘導培養基為MS+3%蔗糖+2.0 mg/L 6-BA+2.0 mg/L 2,4-D+2.0 mg/L KT+0.65%瓊脂,pH 5.8;細胞懸浮培養基為MS+3%蔗糖+0.5 mg/L 6-BA+1.0 mg/L 2,4-D,pH 5.8[9]。愈傷組織誘導培養條件為25 ℃黑暗培養;懸浮細胞培養條件為(23±1)℃,光照周期為14 h/10 h光暗交替,光照強度為3000 lx。
取半夏葉柄置于0.1%氯化汞浸泡6 min,無菌水潤洗5次后剪成約1.0 cm長段,接種至愈傷誘導培養基,于25 ℃黑暗培養。3周后獲得愈傷組織,將所獲愈傷組織繼代培養3~5次。選取質地松脆的顆粒狀愈傷接種至液體培養基進行懸浮培養(100 r/min),每15 d更換新培養基,直至獲得穩定細胞系。將所獲細胞系在8 ℃低溫處理24 h,然后于25 ℃恢復培養36 h使細胞周期同步。之后在23 ℃培養9 d使同步化細胞進入對數生長期,獲得半夏懸浮細胞系。
2.2 鹽酸麻黃堿標準曲線的繪制
精密稱取10 mg鹽酸麻黃堿對照品溶解于氯仿中,定容至50 mL,搖勻,得0.20 mg/mL鹽酸麻黃堿對照品溶液。精密吸取0、1、2、3、4、5 mL至分液漏斗內,添加蒸餾水補至5 mL,分別精密加入5 mL檸檬酸-檸檬酸鈉緩沖溶液(pH 5.4)、10 mL氯仿及1 mL溴麝草酚藍標準溶液,充分振搖后靜置1 h,分取氯仿層,水層再用氯仿重復萃取2次,每次10 mL。合并氯仿層,60 ℃水浴回收至干,用氯仿溶解,定容至10 mL[10]。于414 nm波長處分別測定其吸光度。以鹽酸麻黃堿濃度(C)為橫坐標、吸光度(A)為縱坐標,求得標準曲線為A=0.062C-0.076 8,r2=0.996 0(n=5)。
2.3 生物堿含量測定
整個培養周期持續28 d,每隔7 d取樣,所獲樣品立即保存于-70 ℃冰箱供測試分析。將所收集懸浮細胞樣品于50 ℃干燥后研磨成粉。準確稱取0.1 g樣品粉末置于25 mL具塞試管中,加濃氨水0.5 mL潤濕,加氯仿10 mL后于4 ℃冷浸3 h;冰浴超聲提取1 h后過濾,殘渣以10 mL氯仿分3次(4、3、3 mL)洗滌;將濾液與洗液合并,回收氯仿至干,加入10 mL氯仿使其溶解并轉移至50 mL分液漏斗中,精密加入5 mL檸檬酸-檸檬酸鈉緩沖液(pH 5.4)和1 mL溴麝香草酚藍標準溶液,充分振搖后,靜置1 h。分取氯仿層,水層再用氯仿同法萃取2次,每次10 mL。合并氯仿層,回收至干,殘留物用氯仿溶解,置于10 mL容量瓶中,并用氯仿定容、搖勻,即得處理組溶液[11]。取待測溶液2.0 mL,用DU730 Beckman Coulter核酸蛋白分析儀測其吸光度,代入鹽酸麻黃堿標準曲線中,計算生物堿的含量。
2.4 培養時間對懸浮細胞系生物量和生物堿含量的影響
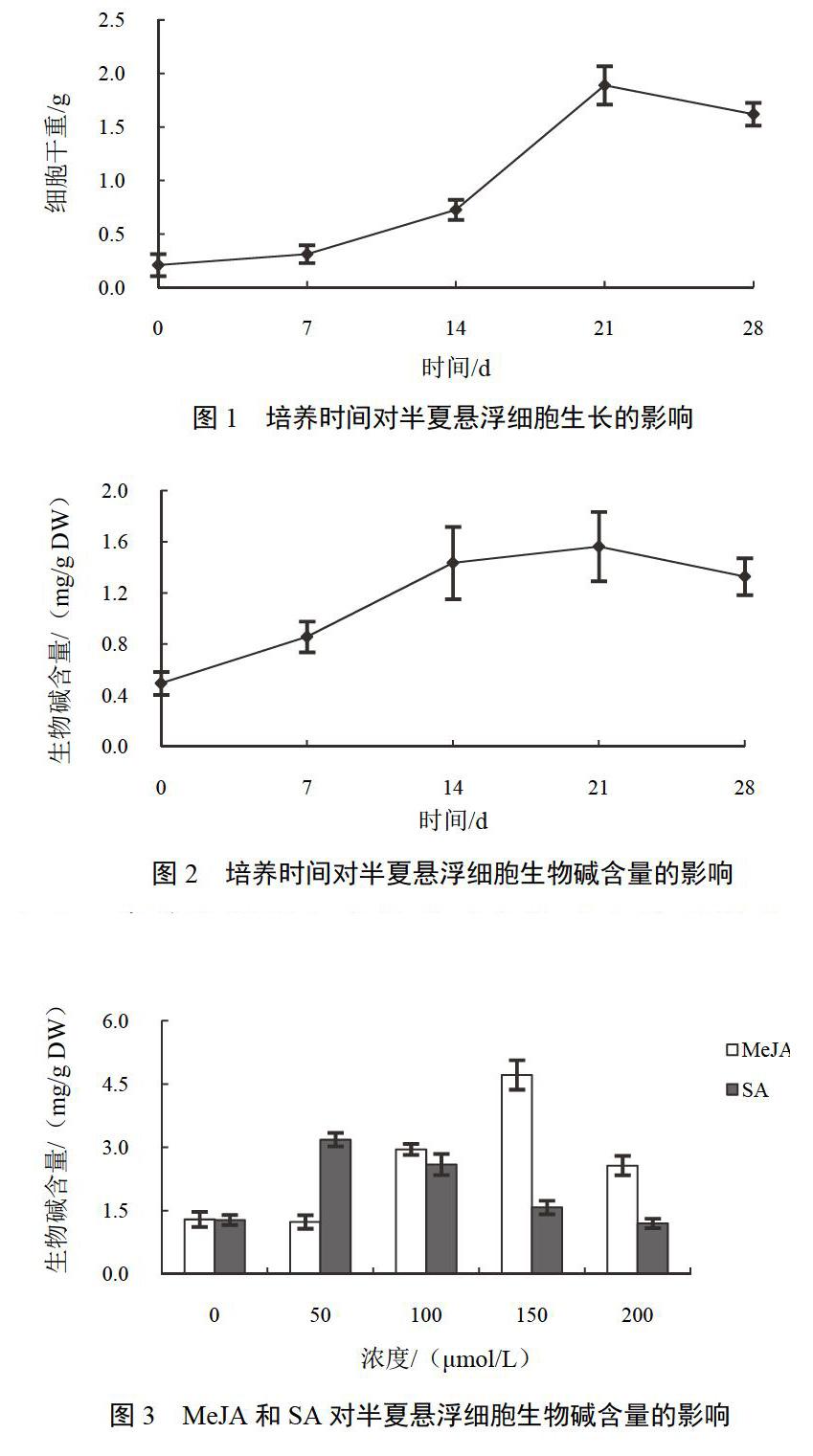
以半夏葉柄為外植體誘導愈傷組織,進行液體懸浮培養,獲得半夏懸浮細胞系。隨著培養時間延長,懸浮細胞干重總體呈現增長趨勢,在21 d時細胞干重為培養前9倍,之后有所下降(見圖1);生物堿含量在培養7 d內含量較低,到14 d時顯著增加,21 d時最高,達到1.56 mg/g DW,之后生物堿含量開始降低(見圖2)。當培養時間超過28 d后,懸浮細胞會逐漸變為褐色,開始壞死。根據細胞生物量和生物堿含量測定結果,選擇21 d作為懸浮細胞培養時間。
2.5 茉莉酸甲酯和水楊酸對生物堿含量的影響
試驗用MeJA和SA濃度均為0、50、100、150、200 ?mol/L。MeJA處理對半夏懸浮細胞系生物堿含量有顯著影響。除50 ?mol/L處理外,所試其他MeJA濃度均顯著促進半夏生物堿合成。以150 ?mol/L MeJA處理組最高,達到4.7 mg/g DW。150 ?mol/L MeJA處理組的生物堿含量為對照組的3.6倍。在SA處理中,50和100 ?mol/L可顯著提高半夏懸浮細胞系中生物堿的合成,更高濃度的SA則能促進生物堿的累積。50 ?mol/L SA處理組生物堿含量最高,為對照組的2.5倍。結果見圖3。
2.6 茉莉酸甲酯和水楊酸對IMP脫氫酶和sAMP合成酶活性的影響
在添加不同濃度MeJA或SA培養21 d后,測定半夏懸浮細胞中IMP脫氫酶和sAMP合成酶活性。取不同濃度外源激素的半夏懸浮培養細胞各1.0 g置于預冷的研缽中,加提取介質在冰浴中研磨勻漿,4 ℃、1000 r/min離心15 min,上清液為酶粗提取液。將上述酶提取液加入相應的酶反應液,每隔30 s讀取吸光度值。酶活性以比活力表示,定義為1 min內1 mg蛋白所能引起的吸光度值變化的1000倍[5]。
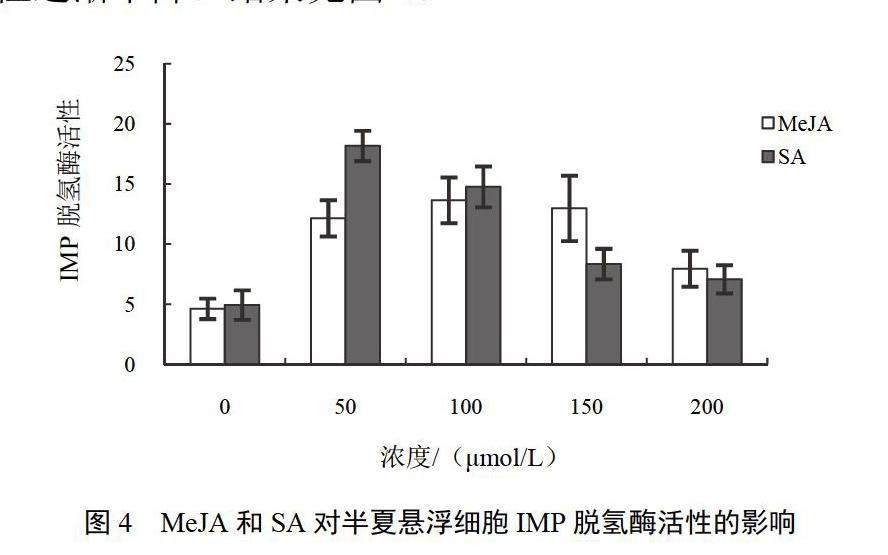
添加MeJA或SA均對IMP脫氫酶活性有顯著影響。50~150 ?mol/L MeJA為對照組IMP脫氫酶活性2.6~3.1倍,當MeJA濃度增加至200 ?mol/L時,酶活性有所下降;50 ?mol/L SA處理對IMP脫氫酶活性影響最大,酶活性為對照組3.7倍,隨濃度增加酶活性逐漸下降。結果見圖4。
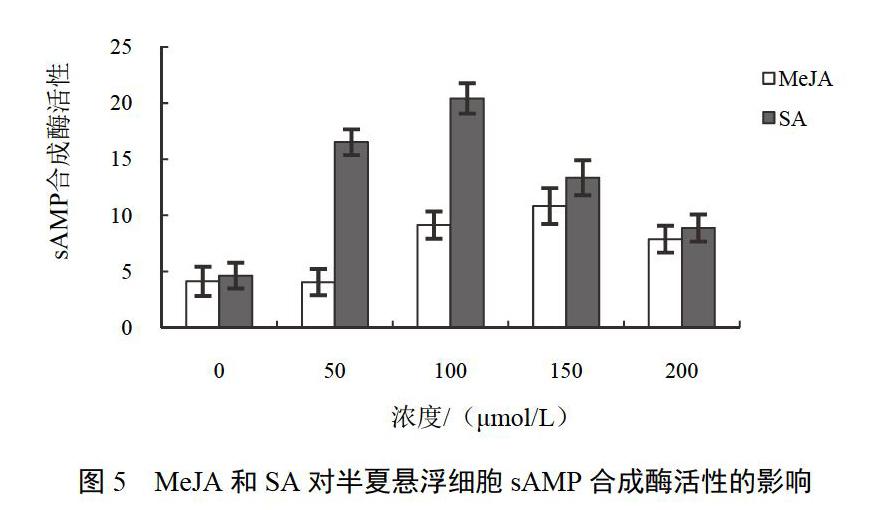
對于sAMP合成酶,50 ?mol/L MeJA對酶活性無顯著影響(P>0.05),而較高濃度的MeJA顯著提高酶活性(P<0.05)。100、150、200 ?mol/L MeJA分別為對照組sAMP合成酶活性2.2、2.6、1.9倍。在所測試SA濃度中,50~200 ?mol/L SA均顯著促進酶活性的升高,最高值出現在100 ?mol/L SA處理組,酶活性為對照組4.4倍,之后隨著SA濃度增加,酶活性逐漸下降,但至200 ?mol/L濃度時,sAMP合成酶活性依然顯著高于對照組。結果見圖5。
3 討論
生物堿為重要的次生代謝物,是許多藥用植物的主要活性成分。目前多種藥用植物細胞內生物堿合成及代謝規律逐步得以揭示,對于研究這些植物的藥用成分意義重大[12]。在諸多研究模式中,懸浮細胞系的應用極為廣泛[13-14],因其可為藥用成分的生產提供另一途徑,有助于解決藥用植物產量的缺口,獲得更高質量的產品,同時保護野生資源。
本研究以葉柄來源的愈傷組織建立半夏懸浮細胞系,考察不同培養時間、MeJA和SA濃度對細胞中生物堿含量的影響,并分析生物堿合成相關酶活性。
在懸浮培養21 d時,半夏懸浮細胞干重增加了9倍,懸浮細胞中生物堿總量為培養0 d時的3倍,與Zhao J等[15]報道長春花懸浮細胞培養增殖結果接近。生物堿作為一種重要的次生代謝產物,其合成通常在細胞培養后期進行。添加較低濃度MeJA或SA不會影響半夏懸浮細胞的增殖,這在麻花艽懸浮細胞培養中同樣得到驗證[16]。同時,培養3周左右通常需要更換新鮮培養基,以補充營養成分并減少壞死細胞對培養的影響。因此,確定懸浮細胞系培養時間為21 d用于不同誘導子對生物堿累積影響的研究。
MeJA或SA作為重要的誘導子已用于萜類化合物等生物堿的代謝研究[17]。本研究表明,MeJA或SA處理均能顯著促進生物堿在半夏懸浮細胞中累積。培養21 d后,150 ?mol/L MeJA處理組生物堿含量為對照組3.6倍,50 ?mol/L SA處理組懸浮細胞生物堿含量達到對照組的2.5倍。同時測定了生物堿中嘌呤核苷酸生物合成途徑中的關鍵酶IMP脫氫酶和sAMP合成酶活性的變化情況。添加MeJA或SA均能顯著提高二者的酶活性。100 ?mol/L MeJA、50 ?mol/L SA處理使IMP脫氫酶活性分別為對照組3.0、3.7倍,150 ?mol/L MeJA、100 ?mol/L SA處理使sAMP合成酶活性分別為對照組2.6、4.4倍。比較生物堿累積量及所測代謝酶活性變化情況發現,生物堿累積與所測代謝酶活性變化趨勢較一致,說明IMP脫氫酶及sAMP合成酶在半夏生物堿代謝中具有較為重要的作用。
參考文獻:
[1] 胡琴,陶詩順.半夏研究和開發最新進展及其思考[J].西南科技大學學報(自然科學版),2005,20(1):63-68.
[2] HAN M H, YANG X W, ZHANG M, et al. Phytochemical studies of the rhizome of Pinellia ternata and quantification of phenylpropanoids in commercial Pinellia rhizome by RP-LC[J]. Chromatographia,2006,64(11/12):647-653.
[3] 吳皓,李偉,張科衛,等.半夏藥材鑒別成分的研究[J].中國中藥雜志, 2003,28(9):836-839.
[4] 劉永紅.半夏塊莖與細胞培養體系的建立及主要生物堿的代謝調控研究[D].楊凌:西北農林科技大學,2010.
[5] 張瑾,談獻和.半夏資源研究進展[J].中國中醫藥信息雜志,2010, 17(5):104-106.
[6] 黃和平,聶久勝,黃鵬,等.中國半夏屬藥用資源研究概況[J].中國現代中藥,2014,16(3):258-261.
[7] COSTE A, VLASE L, HALMAGYI A, et al. Effects of plant growth regulators and elicitors on production of secondary metabolites in shoot cultures of Hypericum hirsutum and Hypericum maculatum[J]. Plant Cell Tiss Organ Cult,2011,106:279-288.
[8] HUSSAIN B, WAR A R, SHARMA H C. Jasmonic and salicylic acid-induced resistance in sorghum against the stem borer Chilo partellus[J]. Phytoparasitica,2014,42:99-108.
[9] 毛春娜,張愛民,薛建平,等.低溫處理對半夏懸浮培養細胞同步化的影響[J].中國中藥雜志,2011,36(8):959-962.
[10] 李西文,馬小軍,宋經元,等.半夏不同生長發育時期總生物堿含量動態變化的研究[J].中國中藥雜志,2006,31(8):687-688.
[11] 鄔浩杰.半夏總生物堿的含量測定[J].海峽藥學,2010,22(3):69-70,27.
[12] SCH?FER H, WINK M. Medicinally important secondary metabolites in recombinant microorganisms or plants:progress in alkaloid biosynthesis[J]. Biotechnol J,2009,4(12):1684-1703.
[13] ZHAO J L, ZHOU L G, WU J Y. Effects of biotic and abiotic elicitors on cell growth and tanshinone accumulation in Salvia miltiorrhiza cell cultures[J]. Appl Microbiol Biotechnol,2010, 87(1):137-144.
[14] San Miguel-Chavez R, Soto-Hernandez M, Ramos-Valdivia A C. Alkaloid production in elicited cell suspension cultures of Erythrina americana Miller[J]. Phytochemistry Rev,2007,6(1):167-173.
[15] ZHAO J, ZHU W H, HU Q. Improvement of indole alkaloid production in Catharanthus roseus cell cultures by osmotic shock[J]. Biotechnol Lett,2000,22:1227-1231.
[16] ZHAO Z J, SONG Y G, LIU Y L, et al. The effect of elicitors on oleanolic acid accumulation and expression of triterpenoid synthesis genes in Gentiana straminea[J]. Biol Plantarum,2013, 57(1):139-143.
[17] KANG S M, MIN J Y, KIM Y D, et al. Effects of methyl jasmonate and salicylic acid on the production of bilobalide and ginkgolides in cell cultures of Ginkgo biloba[J]. In vitro Cell Dev Plant, 2006,42:44-49.
(收稿日期:2016-01-31)
(修回日期:2016-03-02;編輯:陳靜)

