清溫消熱飲對小鼠LPS致炎模型血清中炎性因子的影響
趙嬋娟
(重慶三峽職業學院動物科技系,重慶 404155)
清溫消熱飲對小鼠LPS致炎模型血清中炎性因子的影響
趙嬋娟
(重慶三峽職業學院動物科技系,重慶 404155)
為了解促炎、抗炎細胞因子在小鼠LPS致炎模型中的動態變化,探討中藥方劑清溫消熱飲的抗炎治療作用,采用酶聯免疫法測定112例用LPS致小鼠急性炎癥模型治療過程中血清中促炎因子(TNF-α、IL-1β、PGE2)、抗炎因子(IL-10)含量。與LPS致小鼠急性炎癥模型組比較:清溫消熱飲組在18、24 h血清中IL-1β含量明顯降低,差異顯著(P<0.05);清溫消熱飲組在6、12、18 h血清中TNF-α含量明顯降低,6、18 h差異顯著(P<0.05),12 h差異極顯著(P<0.01);清溫消熱飲組血清中的PGE2含量均低于模型組,在6、18、24、36 h時血清中的PGE2含量明顯降低,差異極顯著(P<0.01);清溫消熱飲組在18、48 h血清中IL-10含量明顯升高,差異極顯著(P<0.01)。同時,清溫消熱飲組與地塞米松組在各時間段血清中TNF-α、IL-1β、IL-10、 PGE2含量無顯著差異(P>0.05)。結果表明,清溫消熱飲在急性炎癥模型中能有效降低血清促炎因子TNF-α、IL-1β、PGE2含量水平,提升抗炎因子(IL-10)含量水平以表現出明顯的抗炎作用。
炎性細胞因子;清溫消熱飲;小鼠;LPS致炎模型
清溫消熱飲方由清營湯改良,由石膏、知母、金銀花等多種藥物組成。在前期臨床使用中,表現出良好的抗炎鎮痛治療效果[1]。炎癥為醫學和獸醫學臨床常見病癥。1988年,Rinderkecht等提出了“炎癥介質學說”認為:白細胞釋放的大量細胞因子形成復雜的炎癥級聯反應,導致系統炎癥反應的發生。大量的研究表明,細胞因子(cytokines)包括TNF-α、IL-10、IL-1等在急性炎癥的發病過程中起到極其重要的作用。研究炎癥因子可作為評價預測炎癥嚴重程度的重要指標,因此,血清炎性細胞因子水平的變化可以在一定程度上反映藥物的治療效果。
為更進一步的研究清溫消熱飲抗炎鎮痛的藥效活性及作用機制,本試驗通過LPS誘導產生小鼠急性炎癥模型,研究該藥通過血清促炎因子(TNF-α、IL-1β、PGE2)、抗炎因子(IL-10)等介導抗炎作用的機制,為清溫消熱飲進一步研究奠定基礎。
1 材料
1.1 試驗動物 SPF級健康昆明系小鼠,體重18~22 g,雌雄各半,購自重慶市中藥研究院試驗動物研究所,許可證號:SCXK(渝)2015-0037。實驗動物適應環境飼養7 d,環境要求溫度(22±1)℃,相對濕度保持(55±5)%,飼養期間飲水、采食自由,所有條件均嚴格按照實驗動物相關要求執行。
1.2 藥物 清溫消熱飲方中石膏、知母、金銀花等中藥材購于重慶市萬州區全宏藥店,并經重慶三峽職業學院動物科技系中獸醫藥教研室具有中藥鑒定師資格的教師鑒定。按文獻方法制備試驗制劑:取石膏先行煎煮30 min,然后將知母、金銀花、甘草等藥混合,煎煮3次合并煎液,濃縮至500 mL。加4%明膠攪拌至無沉淀,4 ℃靜置24 h,過濾,取濾液。加無水乙醇使含醇量分別達65%,4 ℃靜置24 h,離心過濾,取濾液于旋轉蒸發儀中,揮發乙醇至無醇味。加無水乙醇使含醇量分別達75%、85%后,重復上述步驟。濾液加活性炭1.5 g,45 ℃,靜置30 min,過濾,調節pH值至7.0,定容至含生藥1 g/mL,高壓滅菌,4 ℃保存備用[2-3]。
1.3 主要試劑 地塞米松磷酸注射液(湖北天藥藥業,批號:51409222)規格5 mg/ml、脂多糖(LPS,Sigma公司,美國,批號:201506),小鼠TNF-α、IL-1β、IL-10、 PGE2試劑盒購于上海酶聯生物科技有限公司(批號:201510)。
2 方法
2.1 LPS致小鼠急性炎癥模型 112只SPF小鼠隨機分成4個組,即陰性對照組、炎癥模型組(以下簡稱模型組)、清溫消熱飲組、地塞米松組。模型組、清溫消熱飲組、地塞米松對照組按照0.2 mL/10 g體重進行腹腔注射LPS劑量,陰性對照組腹腔注射等量的滅菌生理鹽水。造模后:給藥組按照0.1 mL/10 g采用灌胃給藥,在0 h、4 h進行兩次灌服;陰性對照組和模型組以滅菌蒸餾水(等容積)灌服。
2.2 樣本采集及處理 分別于致炎后6、12、18、24、32、64、72 h,采用摘眼球取血,血樣室溫放置30 min后3000 r/min離心10 min, 分離血清,-20 ℃保存備用。按照試劑盒說明的方法檢測血清TNF-α、IL-1β、IL-10、 PGE2含量水平。
2.3 統計學分析 采用SPSS19.0統計軟件進行數據處理,計量資料以X±S表示,組間比較采用t檢驗。
3 結果
3.1 清溫消熱飲對LPS致急性炎癥模型小鼠血清中TNF-α含量水平的影響 根據試驗結果可以得出造模后各組中小鼠血清中TNF-α含量均有不同程度的升高。模型組12 h時達到峰值,與陰性對照組比較差異極顯著(P<0.01),隨后含量逐步降低。與模型組比較,清溫消熱飲組、地塞米松組在各時間點血清中的TNF-α含量均低于模型組,在6、18 h時清溫消熱飲組血清中的TNF-α含量顯著低于模型組(P<0.05)在12 h時清溫消熱飲組血清中的TNF-α含量極顯著低于模型組(P<0.01),清溫消熱飲組與地塞米松組在各時間段血清中TNF-α含量無顯著差異(P>0.05)。結果詳見表1。
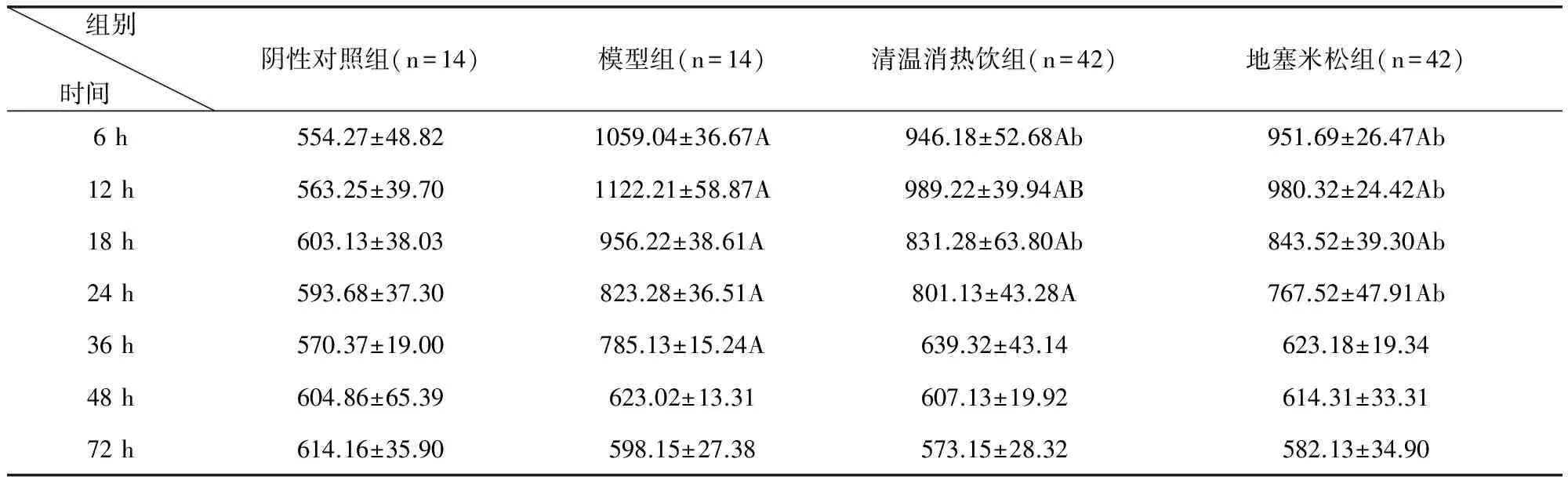
表1 清溫消熱飲對LPS致急性炎癥模型小鼠血清TNF-α含量水平的影響 單位:ng/L
與陰性對照組比較A(P<0.01)、a(P<0.05)與模型組比較B(p<0.01)、b(p<0.05)
3.2 清溫消熱飲對LPS致急性炎癥模型小鼠血清中IL-1β含量水平的影響 根據試驗結果可以得出造模后各組中小鼠血清中IL-1β含量均有不同程度的升高。與模型組比較,清溫消熱飲組血清中IL-1β含量均低于模型組,12 h差異極顯著(P<0.01),18、24 h差異顯著(P<0.05)。清溫消熱飲組和地塞米松組各時間段血清中IL-1β含量無顯著差異(P>0.05)。結果詳見表2。
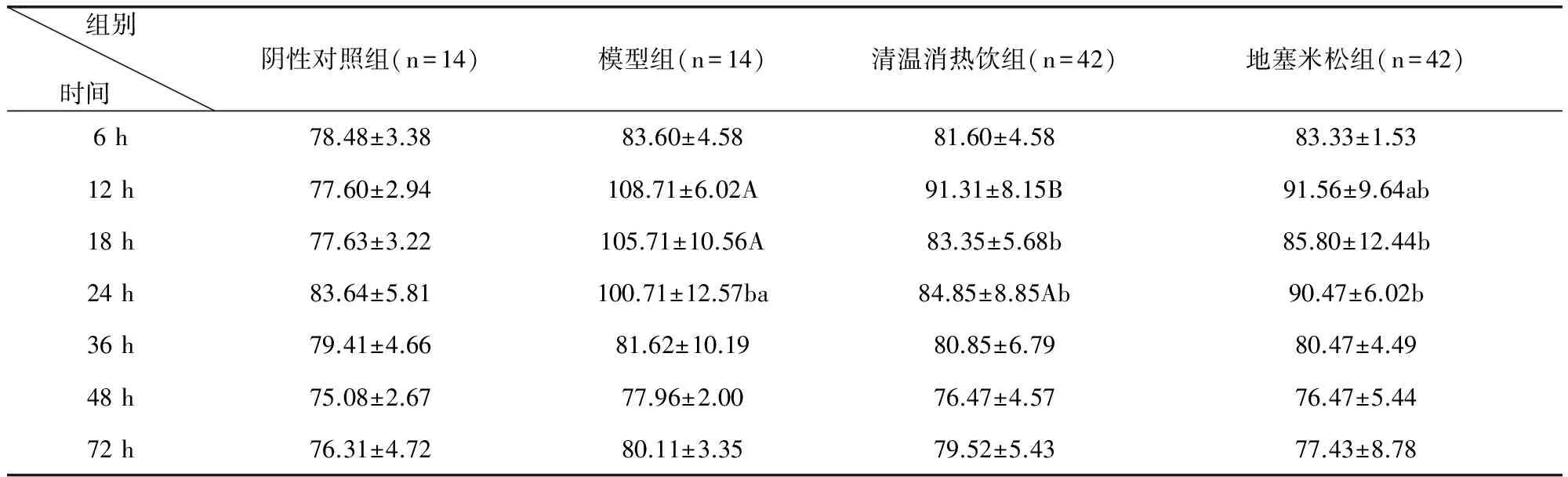
表2 清溫消熱飲對LPS致急性炎癥模型小鼠血清IL-1β含量水平的影響 單位:ng/L
與陰性對照組比較A(p<0.01)、a(p<0.05)與模型組比較B(p<0.01)、b(p<0.05)
3.3 清溫消熱飲對LPS致急性炎癥模型小鼠血清中PGE2含量水平的影響 根據試驗結果可以得出造模后各組中小鼠血清中PGE2含量均有不同程度的升高18 h時達到峰值,與陰性對照組比較差異極顯著(P<0.01)。與模型組比較,清溫消熱飲組、地塞米松組在6、18、24、36 h時血清中的PGE2含量均低于模型組(P<0.01)。清溫消熱飲組與地塞米松組在各時間段血清中PGE2含量無顯著差異(P>0.05)。結果詳見表3。
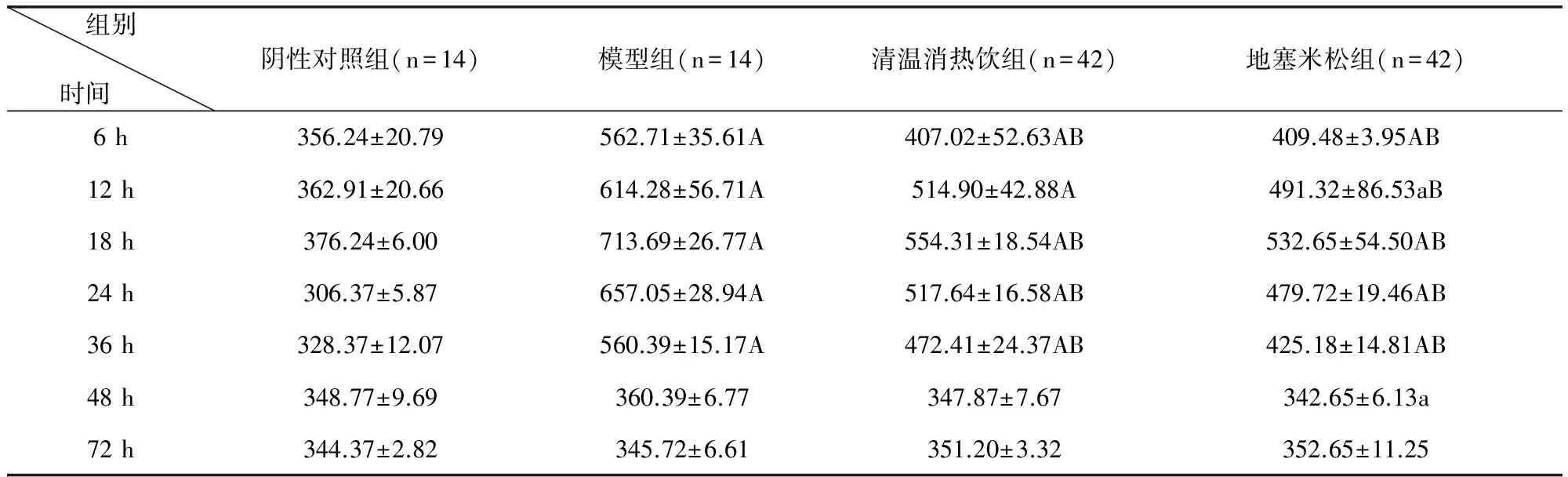
表3 清溫消熱飲對LPS致急性炎癥模型小鼠血清中PGE2含量水平的影響 單位:ng/L
與陰性對照組比較A(P<0.01)、a(P<0.05)與模型組比較B(P<0.01)、b(P<0.05)
3.4 清溫消熱飲對LPS致急性炎癥模型小鼠血清中IL-10含量水平的影響 根據試驗結果可以得出造模后各組中小鼠血清中IL-10含量均有不同程度的升高,極顯著高于陰性對照組(P<0.01)。與模型組比較,清溫消熱飲組、地塞米松組在各時間點血清中的TNF-α含量均高于模型組,在18 h、48 h時清溫消熱飲組血清中的IL-10含量極顯著高于模型組(P<0.01),清溫消熱飲組與地塞米松組在各時間段血清中IL-10含量無顯著差異(P>0.05)。結果詳見表4。
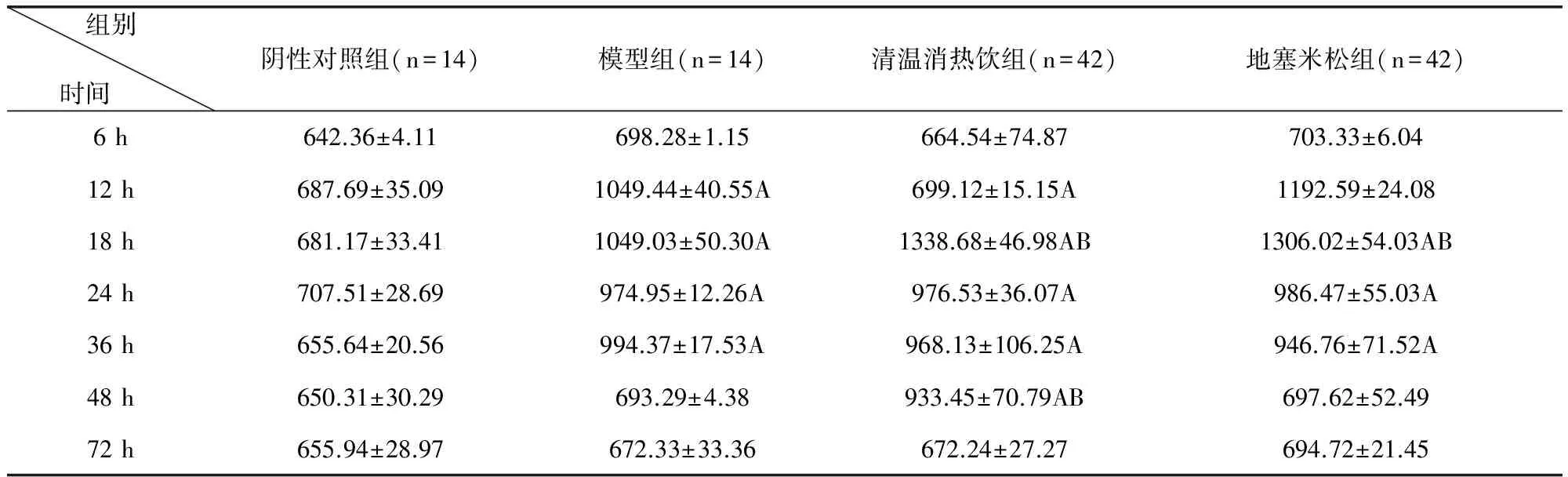
表4 清溫消熱飲對LPS致急性炎癥模型小鼠血清中IL-10含量水平的影響 單位:pg/mL
與陰性對照組比較A(P<0.01)、a(P<0.05)與模型組比較B(P<0.01)、b(P<0.05)
4 討論
現代醫學研究證明,LPS(革蘭氏陰性菌細胞壁主要成分)對機體具有毒害作用,其釋放進入血液達到一定濃度可導致急性炎癥反應的發生,可以通過與Toll樣受體(TLR4)結合激活炎癥信號通路,誘導研究體內釋放大量細胞因子和細胞介質在炎癥反應過程中大量的表達,如IL-1β、TNF-α以及次一級的炎癥介質PGE2等的合成和釋放。TNF-α在炎癥反應發生時即開始分泌,其作用在于激活其他細胞因子的級聯,低濃度時則可誘導炎癥反應[4]。IL-1β主要由單核巨噬細胞產生的一種促炎細胞因子,參與多種細胞生物學功能,包括細胞的增殖、分化和凋亡等。在炎癥開始反應期為主要的促炎因子,能較早的生成并介導組織病理損傷過程,激活細胞產生前列腺素等以及誘導IL-6等其他炎癥介質的產生,具備進一步誘發、放大炎癥反應的作用[5]。整個過程中,抗炎介質、促炎介質兩者水平失衡為炎癥發生、發展和加劇的重要因素。故為了防止過度的炎癥反應,機體在大量促炎介質釋放的同時,也會伴隨產生多種抗炎介質。IL-10能有效抑制抑制巨噬細胞、單核細胞的抗原呈遞作用,從而起到抑制促炎細胞因子的產生以及降低血清中炎性細胞因子的水平,通過抑制免疫細胞炎性細胞因子的產生而達到抗炎作用[6-8]。前列腺素E2(PGE2)作為一種免疫調節劑,具有對IL-10、TNF-α、IL-1β等炎癥因子的調節作用[9]。本研究發現,灌服清瘟消熱飲后,小鼠血清中TNF-α在6、12、18 h含量顯著降低;IL-1β在12、18、24 h含量顯著降低;PGE2在18、24、36 h含量顯著降低;IL-10在18、48 h含量顯著升高,表現出一定的抗炎效果。
通過長期、多角度的研究發現,中藥抗炎作用的藥理活性包含了多途徑的抗炎作用。周永學等[10]發現石膏能顯著降低甘酵母誘導大鼠發熱模型中大鼠下丘腦中PGE2的含量。Lu等[11]發現知母苷BⅡ可以在mRNA和蛋白質水平上減少炎性細胞因子IL-1β、TNF-α、IL-6的生成,且呈現劑量依賴性,表現出很好的抗炎效果。張羅修等[12]通過試驗發現丹參素能顯著抑制巨噬細胞在酵母多糖誘導下合成的PGE2。OK-Hwa等[13]證實金銀花中的木犀草素(Luteolin)能夠通過NF-kB和MAPKs激活途徑抑制 TNF-α、IL-8、IL-6等促炎細胞介質的釋放。
利用LPS致小鼠急性炎癥模型是目前評價或篩選抗炎藥物活性作用的經典急性滲出性炎癥模型,主要表現為局部的充血、水腫及滲出等病理反應過程[14-15],該模型在新藥評價中應用較為廣泛[16]。本研究通過建立LPS致小鼠急性炎癥模型研究清溫消熱飲對急性炎癥反應的干預影響,通過對試驗小鼠血清中的TNF-α、IL-1β、IL-10以及PGE2水平變化來了解其作用機制。試驗結果證明,清溫消熱飲可降低TNF-α、IL-1β和PGE2水平,促進IL-10的釋放,即通過對促炎細胞因子的合成與釋放,促進抗炎因子的釋放過程來達到抑制過度炎癥反應,從而起到抗炎作用。
中獸藥創新研究務必在傳統中獸藥的理論指導下選擇藥物,通過建立動物病理模型、細胞損傷模型等方法來闡釋中藥的作用機理[17]。試驗是根據清溫消熱飲對LPS致炎小鼠血清中的部分抗炎、致炎因子的含量變化,闡述抗炎的作用機理,對于中藥通過什么通路影響血清中的抗炎、致炎因子的含量變化還有待于進一步的研究。
[1] 趙嬋娟.清溫消熱飲治療豬高熱綜合征的隨機臨床對照試驗[J].黑龍江畜牧獸醫.2016(02):126-128.
[2] 趙嬋娟.中藥清溫消熱飲的抗炎鎮痛活性研究[J].中國獸藥雜志.2016.50(04):41-44.
[3] 楊明.中藥藥劑學[M].9版.北京:中國中醫藥出版社,2012
[4] 張馨方,王強松,崔元璐,等.痹祺膠囊提取物對RAW264.7細胞模型的抗炎作用[J].中成藥,2014,3(1):26.
[5] 莫瓊.白芍對LPS膿毒血癥小鼠血清中部分炎癥因子含量的影響[D].西南大學,2014:54-55.
[6] 牟宜雙,周黎明,熊堯,等.小兒解表顆粒解熱鎮痛抗炎作用研究[J].中藥藥理與臨床,2014.30(5):121-125.
[7] 陳建糧,李曉玫.王海燕,等.白細胞介素IL-10的免疫調節作用研究進展,腎臟病與透析腎移植雜志,1998:7(2):147-151.[8] 范祖森,曹容華,孫汶生,等.IL-10對大鼠佐劑性關節炎的治療及免疫機理探討.山東醫科大學學報,1996:34(3):194-197.
[9] 李勁節,藍升紅,周麗萍,等.前列腺素E2對急性壞死性胰腺炎大鼠IL-10、TNF-α及IL-1β的調控和對肺壞死組織損傷的影響[J].肝膽胰外科雜志,2002.14(2):85-88.[10]周永學,李敏,唐志書,等.中藥石膏及其主要成份解熱抗炎作用及機制研究[J].陜西中醫學院學報.2012.35(5):74-76.
[11]Lu W Q,Qiu Y,Li T J,etal.Timosaponin B-Ⅱinhibits pro-inflammatory cytokine induction by lipopolysaccharide in BV2 ceels[J].Arch Pharm rex.2009.32(9):1301-1308.
[12]張羅修,王夢,錢蕓,等.丹參素、黃芩甙對大鼠腹腔巨噬細胞產生PGE2及TXB2的影響[J].中藥藥理與臨床,1990,6(4):31-34.
[13]Ok H K,Jang G C,Jong H L,etal. Luteolin isolated from the flowers of Lonicera japonica suppresses Inflammstory mediator release by blocking NF-kB and MAPAKs actication pathways in NMC-I cells[J].moleecules.2010.15(4):385-3982013;150(3) :1071-1079.
[14]魏偉,吳希美,李元建.藥理實驗方法學[M ].4版.北京:人民衛生出版社,2010:742.
[15]萬春平,彭江云,李玲玉,等.蠲痹顆粒抗炎作用及機制的研究[J].中國實驗方劑學雜志,2014(5)117-121.
[16]肖百全,朱少璇,楊威,等.角叉菜膠致大鼠足趾腫脹模型探討及其機制研究[J].中國實用醫藥,2008.8(23):63-65.
[17]陳希,穆祥,許劍琴.抗菌中藥篩選思路的解析及實踐[J].中國獸藥雜志,2016,50(2):1-6.
(編輯:陳希)
Effect of a Traditional Chinese Prescription Drug Qingwen Xiaore Yin on Serum Inflammatory Factors in LPS-induced Inflammatory Model
ZHAO Chan-juan
(DepartmentofAnimalScienceandTechnology,ChongqingThreeGorgesPolytechnicCollege,Chongqing404155,China)
This work aims to investigate the dynamic changes of pro-inflammatory and anti-inflammatory cytokines in LPS-induced inflammatory models in mice and explore the anti-inflammatory effect of a traditional Chinese prescription drug named Qingwen Xiaore Yin. ELISA was used to detect the contents of serum pro-inflammatory cytokines (TNF-α, IL-1β, PGE2) and anti-inflammatory cytokines (IL-10) in 112 acute inflammatory models in mice induced by LPS. Compared to LPS-induced acute inflammatory model group, the contents of pro-inflammatory cytokines in the serum of Qingwen Xiaore Yin group dramatically decreased. Specifically, IL-1β decreased at 18 and 24 h (P<0.05), TNF-α decreased at 6 h (P<0.05), 12 h (P<0.01) and 18 h (P<0.05), while PGE2 decreased at 6, 12 and 18 h (P<0.01). On the contrary, the content of serum IL-10 in the Qingwen Xiaore Yin group significantly increased at 6, 18, 24 h, and 36 h (P<0.01). Additionally, no significant difference was observed on the contents of TNF-α, IL-1β, IL-10, and PGE2 between the Qingwen Xiaore Yin group and the dexamethasone group (P>0.05). Qingwen Xiaore Yin can effectively decrease the levels of serum pro-inflammatory cytokines and enhance the level of anti-inflammatory factor in the acute inflammatory models, thus demonstrating recognizable anti-inflammatory effect.
inflammatory cytokines; Qingwen Xiaore Yin; mice; LPS-induced inflammatory model
重慶市市教委科技項目(KJ1503408);萬州區區科委科技項目(201501023)
趙嬋娟,碩士,講師,執業獸醫師,從事中獸醫學及動物藥學臨床方面研究。E-mail:zhaochanjuan@qq.com
2016-11-02
A
1002-1280 (2017) 01-0041-05
S853.74

