大豆胰蛋白酶抑制劑的制備及性質
程芬芬,劉 春,楊曉泉*
(華南理工大學食品科學與工程學院食物蛋白工程研究中心,廣東 廣州 510640)
大豆胰蛋白酶抑制劑的制備及性質
程芬芬,劉 春,楊曉泉*
(華南理工大學食品科學與工程學院食物蛋白工程研究中心,廣東 廣州 510640)
采用硫酸鈉鹽析法從大豆乳清廢水中選擇性回收大豆胰蛋白酶抑制劑(soybean trypsin inhibitor,STI),且以商品化的Kunitz型胰蛋白酶抑制劑(soybean Kunitz trypsin inhibitor,KTI)為對照表征STI的理化性質和界面性質。結果表明,STI提取優化條件為:乳清溶液固形物含量13%、pH 4、加鹽量9 g/100 mL,此條件下STI的得率為20.54%;十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳圖譜顯示,其主要成分為KTI,以苯甲酰-DL-精氨酸-p-硝基酰替苯胺鹽酸鹽為底物的胰蛋白酶抑制活力為2 135.00 TIU/mg,且具有良好的溫度和pH值穩定性(80 ℃加熱30 min后仍保持73.19%的抑制活力,在pH 2~11范圍內抑制活力無明顯變化);傅里葉變換紅外光譜和圓二色性結果顯示,其與KTI(Sigma T9218)的結構類似,二級結構主要是β-折疊和無規卷曲;界面性質數據表明,STI分子能很快吸附到氣水界面形成高彈性界面,從而使其具有良好的起泡性和泡沫穩定性。因此,簡單的硫酸鈉鹽析法是大規模制備高純度且功能性質良好的STI的有效方法,所獲得的STI在醫藥及功能性食品領域有潛在的應用價值。
大豆乳清廢水;鹽析法;胰蛋白酶抑制劑;理化性質;界面性質
大豆分離蛋白生產過程中會產生大量的乳清廢水,因其化學需氧量和生化需氧量值高,直接排放會造成嚴重的環境污染,現代工業通常利用好氧或者厭氧的方法對廢水進行消化處理,使其達到污水排放標準后排放,這種處理方法不僅需要一定的運行成本,而且造成了資源浪費,無法利用乳清廢水中的多種生物活性物質。大豆乳清蛋白(soybean whey proteins,SWP)是大豆乳清廢水中的酸溶蛋白,占大豆蛋白的10%左右,主要成分是脂肪氧化酶(102 kD)、β-淀粉酶(61.7 kD)、大豆凝集素(33 kD)、Kunitz型胰蛋白酶抑制劑(soybean Kunitz trypsin inhibitor,KTI,20 kD)和Bowman-Birk型胰蛋白酶抑制劑(Bowman-Birk inhibitor,BBI,7.9 kD)[1]。大豆胰蛋白酶抑制劑(soybean trypsin inhibitor,STI)是大豆中的主要抗營養因子,因此最初對其抗營養特性進行了廣泛的研究,但后來越來越多的證據表明這類蛋白質有特殊的生物活性如抗致癌、抗炎等功能,在功能食品和醫藥等領域具有廣泛的應用前景[2]。
對于胰蛋白酶抑制劑的分離工作,目前實驗室水平有水浸、酸提、鹽析等方法,再用純化效率較高的色譜法進一步純化,且多為2 種以上的色譜法結合使用,如離子色譜與排阻色譜結合,或離子色譜與親和色譜相結合等。利用胰蛋白酶固定于色譜柱的填料中,制成親和色譜柱,利用這種固定化酶技術可實現對胰蛋白酶抑制劑的一步式純化[3-4]。但由于成本高、得率低,現階段這種純化方法尚未得到廣泛應用。
鹽析法是一種經典且可放大的蛋白質分級分離技術,該法流程簡單、成本低廉,其原理是蛋白質在高濃度的鹽溶液中,隨著鹽濃度的逐漸增加,蛋白質表面的水化膜被破壞,溶解度下降而從溶液中沉淀析出。由于不同蛋白質的溶解度各異,因而可利用不同濃度的鹽溶液來沉淀分離各種蛋白質。鹽析法條件溫和、操作簡便,無需特定的儀器設備,是沉淀蛋白質經常使用的方法。已有一些研究利用鹽析法來提取胰蛋白酶抑制劑,但都是胰蛋白酶抑制劑的粗提取,得到的胰蛋白酶抑制劑純度不高,需要進一步純化。
STI是一種具有特殊生物活性的蛋白質,進一步研究其理化性質及界面性質非常重要。近年來,對胰蛋白酶抑制劑的理化性質報道較多,許多研究表明,胰蛋白酶抑制劑對熱、酸環境相對穩定。Chaudhary等[5]利用圓二色光譜分析了胰蛋白酶抑制劑的熱穩定性,Donovan等[6]則利用差示掃描熱量法探究了STI的熱穩定性。Bueno等[7]研究了茯苓胰蛋白酶抑制劑,發現其有很好的溫度穩定性及pH值耐受性。迄今,有少量報道涉及胰蛋白酶抑制劑的乳化性質和泡沫性質,但鮮見胰蛋白酶抑制劑在氣水界面的吸附動力學和界面黏彈性方面的報道,而蛋白質降低表面張力的能力及其在界面上的穩定性與乳液/泡沫的形成能力和穩定性密切相關[8]。通常,蛋白質通過在油水/氣水界面上的吸附來降低界面自由能,在液滴表面形成具有一定強度的凝膠化界面層來維持乳液/泡沫的穩定性。
本實驗旨在利用工藝簡單、成本低廉的鹽析法來分離出純度高、性質優良的STI,研究其溫度及pH值穩定性和二級結構等理化性質,并采用動態滴形分析法結合振蕩滴技術,研究STI在氣水界面的吸附特性和黏彈特性,分析其界面性質與泡沫性質的相關性,以期為STI的進一步利用提供理論參考。
1 材料與方法
1.1 材料與試劑
低溫脫脂大豆粕 山東新嘉華股份有限公司;苯甲酰-DL-精氨酸-p-硝基酰替苯胺鹽酸鹽(Nα-benzoyl-DL-arginine 4-nitroanilide hydrochloride,BAPNA)、胰蛋白酶(1∶250,酶活力>250 NFU/mg)、KTI(T9128)美國Sigma公司;標準分子質量蛋白 上海升正生物技術有限公司;其他試劑均為國產分析純。
1.2 儀器與設備
EL204精密電子天平 德國Sartorious公司;Brion 3 STAR精密pH計 美國Thermo公司;薄膜蒸發儀 日本EYELA東京理化器械株式會社;2WAJ 阿貝折光儀 上海索光光電技術有限公司;CR22G高速冷凍離心機 日本Hitachi公司;UV-2450分光光度計 日本Shimadzu公司;DELTA冷凍干燥機 德國Christ公司;Mini-Sub Cell電泳槽、電泳儀 美國Bio-Rad公司;OCA20視頻光學接觸角測量儀 德國Dataphysics公司;VERTEX 70紅外光譜儀 德國Bruker公司;MOS450旋光儀 法國BioLogic公司;杜馬斯定氮儀 法國Elementar公司。
1.3 方法
1.3.1 回收大豆乳清中胰蛋白酶抑制劑
1.3.1.1 大豆乳清廢水的制備
將脫脂豆粕與水按1∶10(m/V)的比例混合,在室溫(25±2)℃條件下攪拌30 min。離心后除去不溶性物質后,用HCl溶液調節上清液至pH 4.5以沉淀酸不溶性蛋白,得到的上清液即為大豆乳清廢水。
1.3.1.2 鹽析法回收大豆乳清中胰蛋白酶抑制劑
用薄膜蒸發儀將大豆乳清廢水濃縮到特定濃度,用阿貝折光儀估算濃縮液中的固形物含量,根據固形物含量向濃縮乳清中添加特定量的鹽,并將濃縮液的pH值調至特定值,冷藏(4 ℃)過夜,然后離心回收酸性條件下析出的凝集沉淀物。流程圖見圖1。
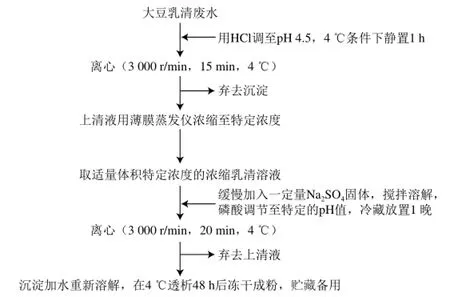
圖1 鹽析法回收胰蛋白酶抑制劑流程圖Fig.1 Flow chart for STI preparation by salting out method
1.3.1.3 鹽析條件優化
根據鹽析的基本原理,對鹽析時乳清溶液的pH值、加鹽量和固形物含量3 個因素進行優化。鹽析時,一般鹽析液的pH值越接近蛋白的等電點,蛋白越易于沉淀析出,大豆兩種主要的胰蛋白酶抑制劑KTI和BBI的等電點分別為4.5和4.2,所以固定鹽析液的pH值為4對加鹽量和乳清固形物含量進行優化。1)加鹽量對鹽析效果的影響:固定鹽析液的固形物含量為13%(質量分數),加鹽量分別設為乳清溶液的1、3、6、9、14 g/100 mL;2)乳清的固形物含量對鹽析效果的影響:固定鹽析液的加鹽量為9 g/100 mL,乳清的固形物含量分別設為5%、9%、13%、17%和21%。3)pH值對鹽析效果的影響:固定乳清的固形物含量為13%,加鹽量為乳清溶液質量的9 g/100 mL,鹽析液的pH值設為2、3、4、5、6共5 個梯度;每個單因素試驗重復3 次。
1.3.2 蛋白質含量的測定
回收得到的STI的蛋白質含量采用杜馬斯定氮法[9]測定。
1.3.3 十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳鑒定分離效果和蛋白組分純度分析
十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析采用Laemmli[10]的方法,采用不連續垂直板狀凝膠電泳。凝膠厚度1 mm,濃縮膠質量濃度為5 g/100 mL,分離膠質量濃度為12 g/100 mL。每個樣品槽中加入10 μg樣品,于恒流下進行電泳,樣品在濃縮膠中電流為10 mA,進入分離膠后電流調為20 mA。電泳結束后將凝膠置于考馬斯亮藍R-250的染色液中染色45 min,之后使用甲醇-乙酸脫色液(甲醇-乙酸-水體積比為1∶1∶8)進行脫色。
1.3.4 胰蛋白酶抑制劑活力的測定
胰蛋白酶抑制劑的測定主要有熒光法、BAPNA法和苯甲酰-L-精氨酸乙酯法,其中BAPNA法是美國化學協會推薦的方法。本實驗STI活力的測定參照Gogoi等[11]的操作方法,并稍作修改,采用10 mL體系的BAPNA法測定胰蛋白酶抑制劑的抑制活力[11-12]。
1.3.4.1 試劑配制
0.04 g/100 mL BAPNA溶液:稱取BAPNA 40 mg溶于1 mL二甲亞砜中,并將Tris-HCl緩沖溶液預熱至37 ℃作為溶劑將上述試劑稀釋至100 mL,當天使用;0.01 g/100 mL胰蛋白酶溶液:稱取胰蛋白酶10 mg,轉移至100 mL容量瓶中,用0.001 mol/L HCl溶解定容,置于4 ℃冰箱,可存儲5 d;體積分數30%醋酸溶液:30 mL冰醋酸蒸餾水稀釋至100 mL。
1.3.4.2 胰蛋白酶抑制劑活力測定
樣品空白和試劑空白:分別將2.00 mL樣品稀釋液和2.00 mL蒸餾水加入10 mL試管中。在37 ℃條件下保溫10 min,各加入5.00 mL BAPNA溶液,混合后在37 ℃條件下保溫10 min,分別加入1.00 mL 30%醋酸溶液中止反應,混合均勻后各加入2.00 mL胰蛋白酶溶液。
樣品和標準:分別吸取2.00 mL去離子水(作標準)和2.00 mL稀釋液于10 mL試管內,加入5.00 mL BAPNA溶液后在37 ℃條件下保溫10 min,加入2.00 mL胰蛋白酶溶液,然后在水浴中保溫10 min,再加1 mL 30%醋酸溶液中止反應。
每個樣品設3 個重復,每個重復設兩個平行反應,以3 個重復的平均測定結果以±s表示樣品中胰蛋白酶抑制劑的活力。胰蛋白酶抑制劑活力單位(TIU)的定義:在410 nm波長處的吸光度減少0.01時為1 個胰蛋白酶活力抑制單位。
式中:A0、A1、A2分別為空白溶液、樣品溶液、標準溶液在410 nm 波長處的吸光度;N為稀釋倍數;m為樣品質量/mg。
1.3.5 胰蛋白酶抑制劑的理化性質測定
1.3.5.1 STI的溫度穩定性
配制1 g/100 mL STI溶液,調節pH值至7,分別置于40、60、80、100 ℃水浴鍋中,加熱30 min后,冷卻至室溫,BAPNA法測定STI的剩余活力,每個樣品重復3 次,每次2 個平行。作出STI剩余活力與溫度的關系曲線圖,分析溫度對STI活力的影響。以KTI(Sigma T9128)作對照。
1.3.5.2 STI的pH值穩定性
配制1 g/100 mL STI溶解于pH 2、3、4、5、6、7、8、9、10、11的廣泛pH值緩沖液中,室溫條件下保溫30 min后,立即調節pH值至7,BAPNA法測定STI剩余活力,每個樣品重復3 次,每次2 個平行。作出STI剩余活力與pH值的關系曲線圖,分析不同pH值對STI活力的影響。以KTI(Sigma T9128)作對照。
1.3.5.3 STI的傅里葉變換紅外光譜分析
將凍干樣品置于干燥器內用P2O5充分干燥,稱取樣品1 mg,與100 mg溴化鉀研磨混勻壓片測定紅外光譜。在數據采集期間,為了減少水蒸汽紅外光譜吸收的干擾,持續用干燥的N2淋洗測量室。在與樣品測定完全相同的條件下在室溫敞開狀態收集空氣背景。Bruker VERTEX 70光譜儀測定在波數范圍為4 000~400 cm-1的吸收光譜,分辨率4 cm-1,環境溫度25 ℃[13]。以KTI(Sigma T9128)作對照。
1.3.5.4 STI的圓二色性分析
用法國BioLogc公司的MOS450旋光儀測定STI的遠紫外圓二色性(circular dichroism,CD)分析。樣品溶于pH 7的10 mmol/L磷酸鈉緩沖液中至蛋白質量濃度0.1 mg/mL,將樣品注入0.2 cm厚的比色皿中,比色皿光徑1 mm,分辨率0.2 nm,在25 ℃和連續充氮的條件下,進入遠紫外區域(190~250 nm)進行掃描,速率20 nm/min,光譜間隔0.1 nm,3 次累積,利用CD Pro軟件中的CDSSTR軟件分析光譜估算STI二級結構中α-螺旋、β-折疊、β-轉角和無規卷曲所占比率[13-14]。以KTI(Sigma T9128)作對照。
1.3.6 胰蛋白酶抑制劑界面性質的測定
1.3.6.1 界面張力的測定
采用動態滴形分析法檢測氣水界面上的界面張力(γ)隨吸附時間(t)的變化。測系統為OCA20視頻光學接觸角儀,實驗時,將1 g/100 mL STI溶液置于注射器中,靜置至樣品溫度平衡,由電動注射單元通過毛細管推入樣液,在針尖上形成15 μL的液滴。視頻攝像系統立即采集液滴的外形圖像,檢測界面張力隨吸附時間的變化[15-16]。測定時間為10 000 s。在檢測過程中,應避免外界振動干擾測量。以KTI(Sigma T9128)作對照。
1.3.6.2 界面膜擴張流變性質的測定
采用動態滴形分析結合振蕩滴技術,研究天STI在氣水界面上的界面擴張彈性模量(Ed)隨吸附時間(t)的變化,詳見王金梅[17]方法。檢測系統為帶有ODG20P振蕩發生器的OCA20視頻光學接觸角測量系統。實驗時,將連接在毛細管上的不銹鋼針(外徑1.65 mm、內徑1.19 mm)插入玻璃槽內。將1 g/100 mL STI溶液置于注射器中,靜置至樣品溫度平衡,由電動注射單元通過毛細管推入樣液,在針尖上形成 10 μL的液滴,液滴形成以后,使用振蕩發生器對其施以周期性正弦振蕩,液滴的表面積(A)發生微小變化(擴張應變),此時視頻攝像系統采集液滴外形圖象,然后由系統軟件進行圖象分析。以KTI(Sigma T9128)作對照。
1.3.6.3 泡沫性質的測定
將STI在分散在10 mmol/L磷酸鹽緩沖液中至質量濃度為1 g/100 mL,調節pH值至7,取溶液體積15 mL置于直徑4 cm的帶刻度玻璃管中,剪切攪拌器攪打1 min,立即記錄每分鐘泡沫體積的變化,并拍照記錄,觀察泡沫在容器中變化情況,作泡沫體積隨時間的變化曲線[18-19]。取KTI(Sigma T9128)作對照。
2 結果與分析
2.1 鹽析法選擇性回收胰蛋白酶抑制劑
2.1.1 加鹽量對鹽析效果的影響
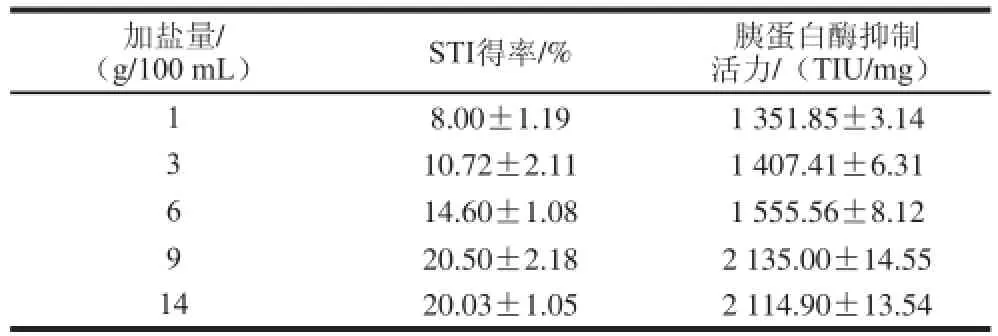
表1 不同加鹽量時STI的得率及胰蛋白酶抑制活力Table1 The yield and trypsin inhibitory activity of STI with addition of different amounts of sodium sulfate
由表1可知,隨著加鹽量的增加STI得率呈增加的趨勢,在加鹽量為9 g/100 mL時最大,但與加鹽量為14 g/100 mL時差別不明顯;胰蛋白酶抑制劑的抑制活力在加鹽量為9 g/100 mL時達到最大;不同加鹽量時SDSPAGE圖(圖2)顯示不同梯度的加鹽量提取出的產品均含有胰蛋白酶抑制劑,但是1、3、6 g/100 mL條帶中除了胰蛋白酶抑制劑還有很多其他的雜蛋白,9 g/100 mL和14 g/100 mL中胰蛋白酶抑制劑的純度較高,差異不大,為了節約成本,選擇加鹽量為乳清溶液固形物含量的9 g/100 mL時最好。綜上分析,選擇加鹽量為9 g/100 mL。
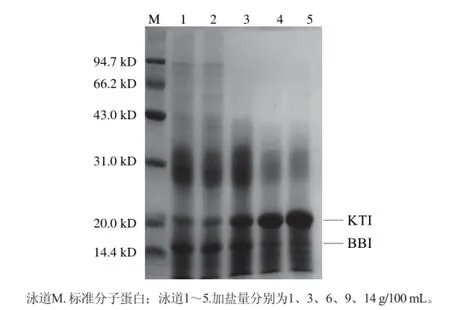
圖2 不同加鹽量時STI的SDS-PAGE圖Fig.2 SDS-PSGE analysis of STI salted out with different salt concentrations
2.1.2 乳清的固形物含量對鹽析效果的影響
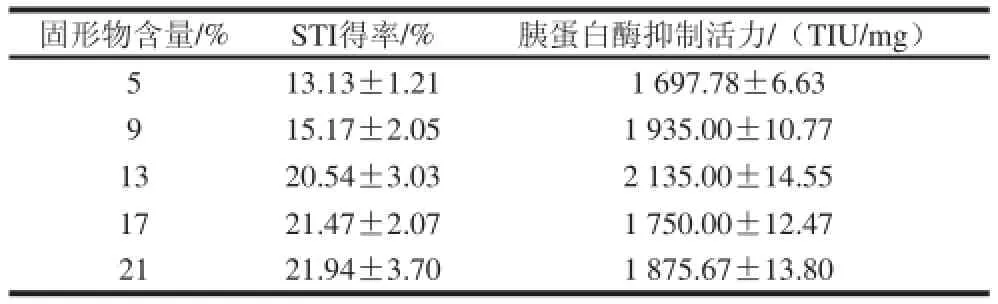
表2 不同固形物含量時STI的得率及胰蛋白酶抑制活力Table2 The yield and trypsin inhibitory activity of STI from soybean whey with different solid contents
由表2可知,隨著乳清溶液固形物含量的增加STI得率呈上升趨勢,在固形物含量為21%時達到最大;胰蛋白酶抑制活力隨著固形物含量的增加先增大后降低,在固形物含量13%時達到最大;不同固形物含量所得到的SDS-PAGE圖見圖3,各樣品的產物均有胰蛋白酶抑制劑的條帶,且雜蛋白的含量均較少,但是比較而言,固形物含量為13%時純度最高,分離效果最好。綜上分析,在固形物含量為13%時,得率較高,胰蛋白酶抑制劑活力最大。
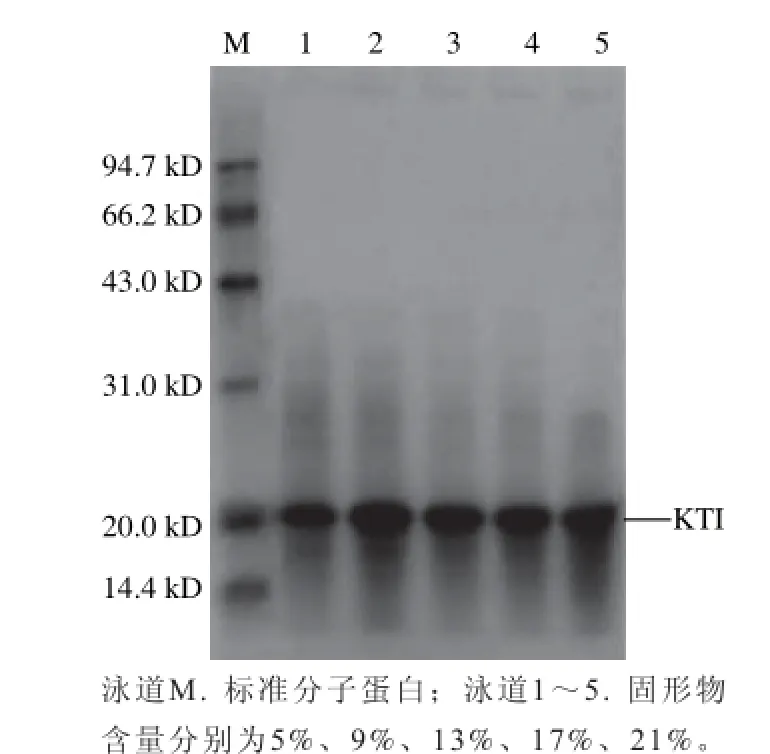
圖3 不同固形物含量時STI的SDS-PAGE圖Fig.3 SDS-PSGE analysis of STI from soybean whey with different solid contents
2.1.3 pH值對鹽析效果的影響
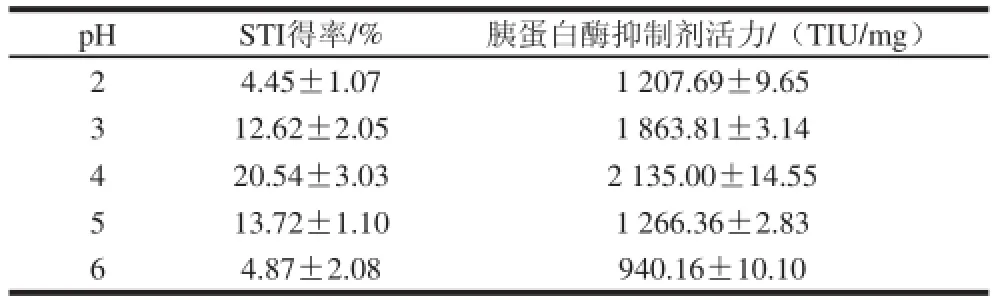
表3 不同pH值時STI的得率及胰蛋白酶抑制活力Table3 The yield and trypsin inhibitory activity of STI salted out at differenntt ppHH
由表3可知,STI得率在pH 4時達到最大,胰蛋白酶抑制活力在pH值梯度間差異顯著,在pH 4抑制活力達到最大;不同pH值所得到組分的SDS-PAGE圖見圖4。各pH值條件下均有胰蛋白酶抑制劑的條帶,但是pH 2、3、5、6條帶中除了胰蛋白酶抑制劑還有很多其他的雜蛋白,如凝集素、β-淀粉酶、脂氧酶等,根據該電泳圖可知,在pH 4時胰蛋白酶抑制劑濃縮物的純度最高。綜上分析,蛋白質在等電點附近時,蛋白質的溶解度最小而容易沉淀出來,STI得率及以胰蛋白酶抑制活力均最高,因此鹽析時應將pH值調節在目的蛋白質的等電點附近,即pH 4最好。
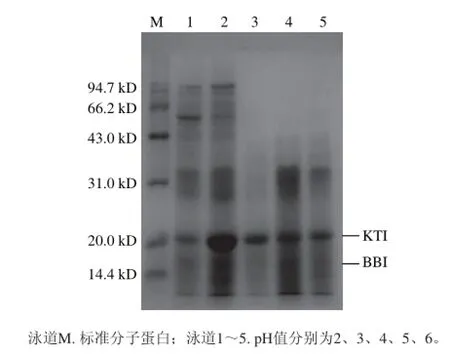
圖4 不同pH值時STI的SDS-PAGE圖Fig.4 SDS-PSGE analysis of STI salted out at different pH
2.1.4 優化實驗結果

圖5 STI和KTI(Sigma T9128)的SDS-PAGE圖譜Fig.5 SDS-PSGE analysis of STI and KTI (Sigma T9128)
綜合單因素試驗結果,確定出最佳的鹽析工藝為:鹽析的pH 4、乳清溶液固形物含量13%、加鹽量9 g/100 mL時,STI的得率最高,為20.54%(基于乳清溶液的固形物含量),蛋白質含量為88.5%。回收得到的STI胰蛋白酶抑制活力為2 135.00 TIU/mg,SDS-PAGE圖譜如圖5所示。可知STI的胰蛋白酶抑制活力略高于標準品KTI(Sigma T9128,1 935.50 TIU/mg),而原料SWP(冷凍干燥)的胰蛋白酶抑制活力只有12.30 TIU/mg。由圖5可知,提取出的STI主要成分是KTI,只含有微量的BBI,幾乎不含其他蛋白質,純度較高,而KTI(Sigma T9128)中除了KTI和BBI之外,還有少量的雜蛋白。所以,通過簡單的鹽析法,可以得到純度高、胰蛋白酶抑制活力高的胰蛋白酶抑制劑。
2.2 胰蛋白酶抑制劑的理化性質
2.2.1 溫度對STI抑制活力的影響
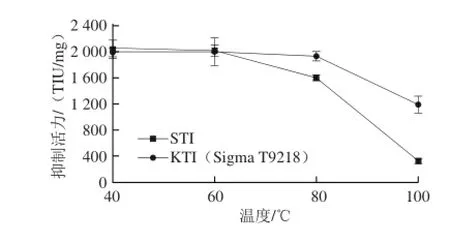
圖6 STI和KTI(Sigma T9128)的溫度穩定曲線Fig.6 Temperature stability prof i les of STI and KTI (Sigma T9128)
鹽析法提取出的STI溫度穩定性如圖6所示,隨著溫度的升高,STI的抑制活力有所下降,加熱溫度大于80 ℃后,STI的抑制活力急劇下降,說明80 ℃以上的加熱溫度對STI具有明顯的失活作用,STI在40~80 ℃的范圍內均保持較高的活力,在80 ℃加熱30 min,STI仍然能保持73.19%的抑制活力;與對照KTI(Sigma T9128)相比,在溫度低于80 ℃時,兩者具有相似的溫度穩定性,但當溫度大于80 ℃時,KTI(Sigma T9128)的溫度穩定性優于鹽提STI。
2.2.2 pH值對STI抑制活力的影響
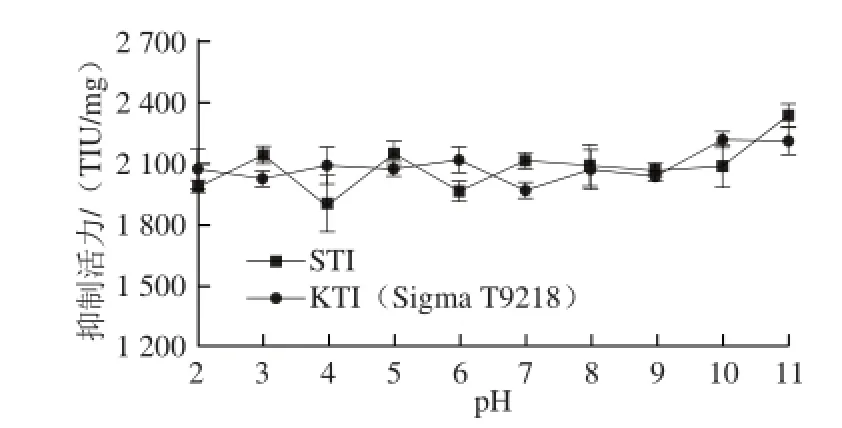
圖7 STI和KTI(Sigma T9128)的pH值穩定曲線Fig.7 pH Stability prof i les of STI and KTI (Sigma T9128)
pH值對STI抑制活力的影響如圖7所示,隨著pH值的變化,STI的抑制活力沒有明顯的變化,與KTI(Sigma T9128)類似,說明STI具有較好的pH值穩定性。這一結果與已有文獻報道相似。Macedo等[20]報道野生月桂印加豆胰蛋白酶抑制劑的抑制活力在pH 2~10范圍內沒有明顯區別。Batista等[21]對青皮象耳豆胰蛋白酶抑制劑(EcTI)pH穩定性的研究也證明了這一結論。
2.2.3 傅里葉變換紅外光譜分析
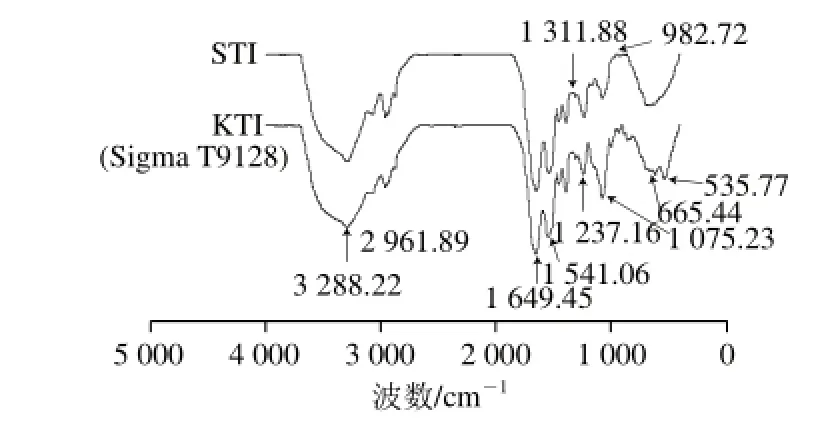
圖8 STI和KTI(Sigma T9128)的傅里葉變換紅外光譜圖Fig.8 FTIR spectra of STI and KTI (Sigma T9128)
由STI和KTI(Sigma T9128)的紅外光譜圖可知(圖8),STI的光譜相對于KTI(Sigma T9128)來說變化不大。在酰胺Ⅰ帶中,1 649.45 cm-1處有明顯的峰,說明分子中存在無規卷曲結構,在酰胺Ⅰ帶的1 651~1 660、1 661~1 700 cm-1和酰胺Ⅲ帶的1 290~1 300、1 265~1 295 cm-1處沒有峰,說明分子中可能沒有或者含有少量的α-螺旋及β-轉角結構;酰胺Ⅲ帶的1 250~1 220 cm-1處有明顯的峰,說明有β-折疊的存在[22-23]。所以,STI和KTI(Sigma T9128)分子主要的結構可能是β-折疊和無規卷曲。
2.2.4 CD分析

圖9 STI和KTI(Sigma T9128)的CD譜圖Fig.9 Circular dichroism spectra of STI and KTI (Sigma T9128)
CD是表征蛋白質分子二級結構經典且常用的方法[5],STI和KTI(Sigma T9128)的CD譜圖如圖9所示,STI和KTI(Sigma T9128)二級結構(α-螺旋、β-折疊、β-轉角和無規卷曲)的組成比例如表4所示。從圖9可以看出,STI和KTI(Sigma T9128)均在200 nm附近有單一吸收負峰。從表4可以看出,α-螺旋的比例都很低,而β-折疊和無規卷曲的比例較高,說明胰蛋白酶抑制劑蛋白分子結構可能主要是以β-折疊和無規卷曲為主的二級結構,這與FTIR的結果相對應。黃惠華等[24]用遠紫外CD對STI進行分析,發現STI和BBI的單一吸收負峰在200 nm波長處,其二級結構由22.5%的β-折疊、16.5%的β-轉角和61.4%無規卷曲組成,也是以β-折疊和無規卷曲為主的二級結構。

表4 CDSSTR計算出的STI、KTI(Sigma T9128)的二級結構含量Table4 Secondary structure contents of STI and KTI calculated by CDSSTR program %
2.3 胰蛋白酶抑制劑的界面性質
2.3.1 動態界面張力
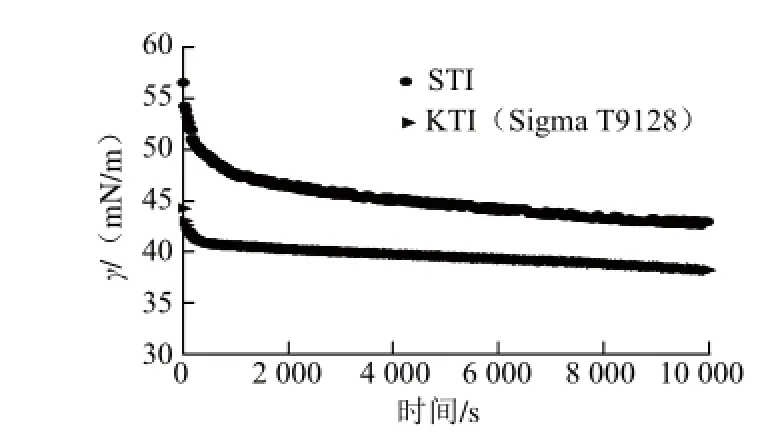
圖10 STI和KTI(Sigma T9128)溶液氣水界面的表面張力(γ)隨時間的變化Fig.10 Surface tension (γ) as a function of time for STI and KTI (Sigma T9128) at the air-water interface
圖10 為STI和KTI(Sigma T9128)溶液氣水界面的表面張力(γ)隨吸附時間的變化,表面張力隨著吸附時間的延長而逐漸減小,這與表面活性物質在界面上的吸附密切相關。在吸附初期,表面張力快速下降,說明蛋白質快速吸附到界面上,形成了較穩定的網絡層,隨后,表面張力趨于穩定[25]。由圖可知KTI(Sigma T9128)的表面張力小于鹽提STI,說明KTI(Sigma T9128)更容易吸附到界面上,可能的原因是鹽提KTI中還有一小部分為非蛋白的成分,從而導致相同濃度的樣品,STI中的蛋白濃度要略小一些,最終吸附到界面上的蛋白與KTI(Sigma T9128)相比也要少一些。
2.3.2 界面膜擴張流變性質
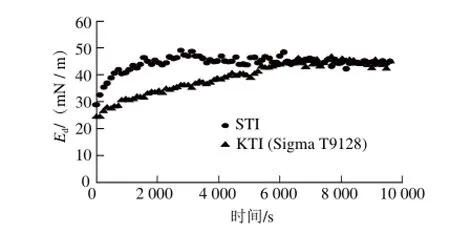
圖11 STI和KTI(Sigma T9128)彈性模量(Ed)隨時間的變化Fig.11 Time-dependent dilatational elasticity (Ed) for adsorbed layers formed from STI and KTI (Sigma T9128) at the air-water interface
圖11為STI和KTI(Sigma T9128)吸附過程中彈性模量(Ed)隨吸附時間的動態變化。對STI和KTI(Sigma T9128),Ed隨著吸附時間的延長而逐漸增加,主要是因為蛋白質吸附和強的分子間相互作用和界面的構象變化,彈性模量大表示強的界面網絡的形成[26-27]。氣水界面的吸附初期,STI相比較于KTI(Sigma T9128)呈現了較高的Ed值,表示蛋白快速向界面擴散和吸附,形成了更為穩定的界面網絡,但最終兩者的彈性模量相近,均達到約45.00 mN/m。
2.3.3 STI的泡沫性質
蛋白質穩定泡沫主要是通過在泡沫表面形成高彈性網絡來實現的[28-29],STI是大豆乳清蛋白中的主要成分,同大豆乳清蛋白相似,具有較好的起泡能力(有大于3 倍的體積膨脹率)和長時間的穩泡能力[30]。STI和KTI(Sigma T9128)起泡性和泡沫穩定性如圖12所示,圖13為泡沫在不同時間的泡沫體積圖,顯示在15 min后泡沫沒有明顯的粗化與聚結,在90 min時,STI泡沫體積仍有其初始體積的2/3,優于KTI(Sigma T9128)的泡沫穩定性。表明鹽提STI具有較好的泡沫性質。這些結果與表面張力及彈性模量隨時間變化的結果相符。

圖12 STI和KTI(Sigma T9128)的泡沫性質Fig.12 Foaming properties of STI and KTI (Sigma T9128)

圖13 不同時間的STI和KTI(Sigma T9128)泡沫體積圖Fig.13 Bubble volume of STI and KTI (Sigma T9128) at different time points
3 結 論
本實驗通過優化后的硫酸鈉鹽析法獲得了較高純度的STI,其主要成分是胰蛋白酶抑制劑KTI。以商業化的KTI(Sigma T9128)為對照,鹽析法獲得的STI具有與KTI(Sigma T9128)相似的分子結構、溫度穩定性和pH值穩定性;具有較好的界面性質和泡沫性質。鹽析法回收胰蛋白酶抑制劑的工藝簡單、成本低廉,是一種大規模制備高純度且功能性質良好的STI的有效方法,所獲得的STI在醫藥及功能性食品領域有潛在的應用價值。
[1] LI Xingfei, DONG Die, HUA Yufei, et al. Soybean whey protein/ chitosan complex behavior and selective recovery of Kunitz trypsin inhibitor[J]. Journal of Agricultural and Food Chemistry, 2014, 62(29):7279-7286. DOI:10.1021/jf501904g.
[2] KOBAYASHI H. Prevention of cancer and inf l ammation by soybean protease inhibitors[J]. Frontiers in Bioscience, 2013, 5: 966-973. DOI:10.2741/E676.
[3] DURANTI M, BARBIROLI A, SCARAFONI A, et al. One-step purif i cation of Kunitz soybean trypsin inhibitor[J]. Protein Expression and Purification, 2003, 30(2): 167-170. DOI:10.1016/S1046-5928(03)00106-2.
[4] PAIVA P M G, SOUZA A F, OLIVA M L V, et al. Isolation of a trypsin inhibitor from Echinodorus paniculatus seeds by affinity chromatography on immobilized Cratylia mollis isolectins[J]. Bioresource Technology, 2003, 88(1): 75-79. DOI:10.1016/S0960-8524(02)00272-9.
[5] CHAUDHARY N S, SHEE C A, AHMAD F, et al. Purification and characterization of a trypsin inhibitor from Putranjiva roxburghii seeds[J]. Phytochemistry, 2008, 69(11): 2120-2126. DOI:10.1016/ j.phytochem.2008.05.002.
[6] DONOVAN J W, BEARDSLEE R A. Heat stabilization produced by protein-protein association. A differential scanning calorimetric study of the heat denaturation of the trypsin-soybean trypsin inhibitor and trypsin-ovomucoid complexes[J]. Journal of Biological Chemistry, 1975, 250(6): 1966-1971.
[7] BUENO N R, FRITZ H, AUERSWALD E A, et al. Primary structure of Dioclea glabra trypsin inhibitor, DgTI, a Bowman-Birk inhibitor[J]. Biochemical and Biophysical Research Communications, 1999, 261(3): 838-843. DOI:10.1006/bbrc.1999.1099.
[8] RUíZ-HENESTROSA V P, SáNCHEZ C C, ESCOBAR M D M Y, et al. Interfacial and foaming characteristics of soy globulins as a function of pH and ionic strength[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2007, 309(1/2/3): 202-215. DOI:10.1016/j.colsurfa.2007.01.030.
[9] 袁楊. 食物蛋白與殼聚糖相互作用及其在食品體系的應用研究[D].廣州: 華南理工大學, 2014: 32-33.
[10] LAEMMLI U K. Cleavage of structural proteins during assembly of head of bacteriophage-T4[J]. Nature, 1970, 227: 680-685. DOI:10.1038/227680a0.
[11] GOGOI R N U K. Reduction in trypsin inhibitor activity in jatropha cake by chemical, thermal and radiation treatment[J]. Research Journal of Chemical Sciences, 2014, 1(4): 17-19.
[12] LIU K, MARKAKIS P. An improved colorimetric method for determining antitryptic activity in soybean products[J]. Cereal Chemistry, 1989, 66(5): 415-422.
[13] ZOU Yuan, GUO Jian, YIN Shouwei, et al. Pickering emulsion gels prepared by hydrogen-bonded zein/tannic acid complex colloidal particles[J]. Journal of Agricultural & Food Chemistry, 2015, 63(33):7405-7414. DOI:10.1021/acs.jafc.5b03113.
[14] HASNI I, BOURASSA P, HAMDANI S, et al. Interaction of milk αand β-caseins with tea polyphenols[J]. Progress in Brain Research, 2011, 126(6): 630-639. DOI:10.1016/j.foodchem.2010.11.087.
[15] LIU Chun, CHENG Fenfen, SUN Yingen, et al. Structure-function relationship of a novel PR-5 protein with antimicrobial activity from soy hulls[J]. Journal of Agricultural and Food Chemistry, 2016, 64(4):948-959. DOI:10.1021/acs.jafc.5b04771.
[16] KANAKIS C D, HASNI I, BOURASSA P, et al. Milk β-lactoglobulin complexes with tea polyphenols[J]. Food Chemistry, 2011, 127(3):1046-1055. DOI:10.1016/j.foodchem.2011.01.079.
[17] 王金梅. 大豆蛋白熱聚集行為及界面、乳化性質研究[D]. 廣州: 華南理工大學, 2012: 44-58.
[18] WAN Zhili, WANG Liying, WANG Jinmei, et al. Synergistic foaming and surface properties of a weakly interacting mixture of soy glycinin and biosurfactant stevioside[J]. Journal of Agricultural and Food Chemistry, 2014, 62(28): 6834-6843. DOI:10.1021/jf502027u.
[19] MURRAY B S. Stabilization of bubbles and foams[J]. Current Opinion in Colloid & Interface Science, 2007, 12(Suppl 4/5): 232-241. DOI:10.1016/j.cocis.2007.07.009.
[20] MACEDO M L R, VIVIANE A G, FREIRE M D G A, et al. Characterization of a Kunitz trypsin inhibitor with a single disulf i de bridge from seeds of Inga laurina (SW.) Willd[J]. Phytochemistry, 2007, 68(8): 1104-1111. DOI:10.1016/j.phytochem.2007.01.024.
[21] BATISTA I F C, NONATO M C, BONFADINI M R, et al. Preliminary crystallographic studies of EcTI, a serine proteinase inhibitor from Enterolobium contortisiliquum seeds[J]. Acta Crystallographica, 2001, 57(4): 602-604. DOI:10.1107/S0907444901001810.
[22] 何建川, 邵陽, 張波. 蛋白質和變性蛋白質二級結構的FTIR分析進展[J]. 化學研究與應用, 2012, 24(8): 1176-1180. DOI:10.3969/ j.issn.1004-1656.2012.08.002.
[23] 張秋會, 黃現青, 李苗云, 等. 傅里葉紅外光譜法研究肌肉蛋白質的二級結構[J]. 食品與發酵工業, 2015, 41(10): 247-251. DOI:10.13995/j.cnki.11-1802/ts.201510045.
[24] 黃惠華, 粱漢華, 郭乾初. 兩種大豆胰蛋白酶抑制劑的抑制活性及二級結構分析比較[J]. 食品科學, 2005, 26(3): 46-49. DOI:10.3321/ j.issn:1002-6630.2005.03.005.
[25] ASGHARE, AMIR K, NORTON, et al. Interfacial and foaming characterisation of mixed protein-starch particle systems for food-foam applications[J]. Food Hydrocolloids, 2016, 53: 311-319. DOI:10.1016/ j.foodhyd.2015.09.007.
[26] WAN Zhili, YANG Xiaoquan, SAGIS L M. Non-linear surface dilatational rheology and foaming behavior of protein and protein fi brillar aggregates in the presence of natural surfactan[J]. Langmuir, 2016, 32(15): 3679-3690. DOI:10.1021/acs.langmuir.6b00446.
[27] CAO Chong, ZHANG Lu, ZHANG Xiaoxi, et al. Effect of gum arabic on the surface tension and surface dilational rheology of trisiloxane surfactant[J]. Food Hydrocolloids, 2013, 30(1): 456-462. DOI:10.1016/ j.foodhyd.2012.07.006.
[28] WAN Zhili, WANG Liying, WANG Jinmei, et al. Synergistic interfacial properties of soy protein-stevioside mixtures: relationship to emulsion stability[J]. Food Hydrocolloids, 2014, 39(39): 127-135. DOI:10.1016/j.foodhyd.2014.01.007.
[29] TAMM F, SAUER G, SCAMPICCHIO M, et al. Pendant drop tensiometry for the evaluation of the foaming properties of milkderived proteins[J]. Food Hydrocolloids, 2012, 27(2): 371-377. DOI:10.1016/j.foodhyd.2011.10.01.
[30] SORGENTINI D A, WAGNER J R. Comparative study of foaming properties of whey and isolate soybean proteins[J]. Food Research International, 2002, 35(8): 721-729. DOI:10.1016/S0963-9969(02)00067-4.
Preparation and Properties of Soybean Trypsin Inhibitor
CHENG Fenfen, LIU Chun, YANG Xiaoquan*
(Research and Development Center of Food Proteins, College of Food Science and Engineering, South China University of Technology, Guangzhou 510640, China)
Sodium sulfate salting out was employed to selectively recover soybean trypsin inhibitor (STI) from soybean whey waste. The recovery conditions were optimized, and the physicochemical and interfacial properties of STI were evaluated. The results indicated that the yield of STI was 20.54% under optimal conditions: concentration of soybean whey to a solid content of 13%, adjustment to pH 4, and addition of 9 g/100 mL sodium sulfate. The main component of STI was Kunitz trypsin inhibitor (KTI, 20.1 kD) as indicated by SDS-PAGE analysis. The trypsin inhibitor activity towards Nα-benzoyl-DL-arginine 4-nitroanilide hydrochloride (BAPNA) of STI was 2 135.00 TIU/mg at pH 7. It was stable in a broad pH range from 2.0 to 11.0 and at a temperature up to 80 ℃. The inhibitory activity (73.19%) was still maintained at a high level after heating at 80 ℃ for 30 min. The FTIR and CD spectra showed that the structure of STI was highly similar to that of the commercial KTI (Sigma T9128). The dynamic surface tension and surface dilatational parameters of STI showed that the STI molecules could be quickly adsorbed to the interface to form a high elastic network and hence favorable foaming capacity and foaming stability. These fi ndings suggest that the salting out method could be used as an effective strategy to prepare high-purity STI from soybean whey, and STI would emerge as a promising molecule for functional foods and medical applications because it exhibits excellent temperature and pH stability and high bioactivity.
soybean whey wastewater; salting out method; trypsin inhibitor; physicochemical properties; interfacial properties
10.7506/spkx1002-6630-201703007
S565.1
A
1002-6630(2017)03-0037-08
程芬芬, 劉春, 楊曉泉. 大豆胰蛋白酶抑制劑的制備及性質[J]. 食品科學, 2017, 38(3): 37-44. DOI:10.7506/spkx1002-6630-201703007. http://www.spkx.net.cn
CHENG Fenfen, LIU Chun, YANG Xiaoquan. Preparation and properties of soybean trypsin inhibitor[J]. Food Science, 2017, 38(3): 37-44. (in Chinese with English abstract)
10.7506/spkx1002-6630-201703007. http://www.spkx.net.cn
2016-03-24
國家高技術研究發展計劃(863計劃)項目(2013AA102208-3);公益性行業(農業)科研專項(201303071);糧食公益性行業科研專項(201313005)
程芬芬(1990—),女,碩士,研究方向為蛋白質化學與工程。E-mail:251015021@qq.com
*通信作者:楊曉泉(1965—),男,教授,博士,研究方向為蛋白質化學與工程。E-mail:fexqyang@scut.edu.cn

