饑餓對不同性別大黃魚肌肉營養成分的影響研究
劉陽陽,劉 峰,樓 寶,呂小康,馬 濤
(1.浙江海洋大學海洋科學與技術學院,浙江舟山 316022;2.浙江海洋大學海洋與漁業研究所,浙江省海洋水產研究所,浙江省海水增養殖重點實驗室,浙江舟山 316021)
大黃魚Larimichthys crocea,隸屬于鱸形目Perciformes、石首魚科Sciaenide,分布于黃海、東海、南海等區域[1],是我國“四大海產”之一,具有非常重要的經濟價值。大黃魚營養豐富,深受人們的喜愛。隨著大黃魚人工養殖業的快速發展,大黃魚肌肉品質急劇下降,出現肉質松軟、口感差以及脂肪含量過高等不良性狀[2],因此,改善大黃魚肉質成為推進大黃魚養殖業發展的重要途徑。投喂策略作為改善魚類肉質的一個重要手段,已經在生產實踐中得到積極而廣泛的應用[3],其中一個重要的措施是在養殖魚上市前,對其進行一段時間的禁食處理,促使其清空腸道,獲得更高新鮮度的魚產品[4-5],以其優質的品質贏得消費者青睞。通過適當的禁食處理,可以切斷外源性營養物質的補充,有效減少機體內脂肪積累,從而緩解因脂肪過高而呈現的出肉率低、質地松軟等癥狀[6-7]。此外,通過禁食實現饑餓脅迫會影響魚類生理生化過程及行為特征等,如銀鯧Pampus argenteus幼魚受到饑餓脅迫時,體質量和肥滿度會顯著下降[8];海擬鯉Rutilus rutilus caspicus在饑餓脅迫條件下體內蛋白酶、淀粉酶以及脂肪酶的活性降低[9];太平洋鮭Oncorhynchus spp[10]、吉富羅非魚Oreochromis niloticus[11]、虹鱒Oncorhynchus mykiss[12]受到饑餓脅迫時,其體內脂肪和蛋白質含量均出現一定程度的降低。肌肉中各營養成分的組成及含量與肌肉品質密切相關,因此,探究饑餓脅迫對魚類肌肉營養成分的影響對于通過適當的禁食處理提高魚類的肌肉品質有重要指導意義。
目前,對于大黃魚的研究主要集中在基礎生物學和種質資源狀況[13-14]等方面,饑餓對大黃魚的影響雖然已有一些報道,如徐浩等[15]研究發現低溫和饑餓會顯著提高大黃魚血清中蛋白質產物和脂類物質;張振宇等[16]研究發現大黃魚粗脂肪含量隨著禁食時間的延長而持續降低。但是,關于禁食對達到上市規格的不同性別大黃魚肌肉品質的影響尚未見報道。因此,本研究以即將上市的不同性別大黃魚為研究對象,在自然海區養殖條件下,通過不同程度的禁食處理,探討饑餓對不同性別大黃魚的影響,為獲得高品質大黃魚提供更加詳實的數據資料。
1 材料與方法
1.1 實驗時間和條件
實驗于2016年10月中旬在舟山登步島近岸海水養殖網箱中進行,所用網箱為3 m×3 m×3 m規格2.5目的尼龍材質無結網箱。實驗過程中海區水溫從27℃逐漸降低到15℃,海水鹽度26~28,水流速度約1.5~2.0 m/s。
1.2 實驗魚及實驗設計
實驗大黃魚為同一海區網箱養殖群體,隨機選取400 g左右體質健壯的養殖大黃魚600尾,隨機分為2組,每組3個平行,每個平行100尾,養殖于6個相鄰的網箱中,實驗開始前暫養7 d,每天2次飽食投喂。所用配合顆粒飼料為魚寶7#(產自日本林兼產業株式會社),主要組成為:粗蛋白56%、粗灰分18%、粗脂肪9.0%、粗纖維4.0%、總磷1.0%、鈣1.5%。。實驗開始時,對照組正常投喂,實驗組停止投喂,實驗持續60 d。分別于實驗開始的0、20、40、60 d對實驗組和對照組各取樣60尾,每個平行20尾,測量體質量,解剖觀察性腺判定其性別后取其背部肌肉,-80℃低溫保存,備用。
1.3 營養成分測定
肌肉常規營養成分采用AOAC(1995)中的方法測定。粗蛋白含量測定采用凱氏定氮法;粗脂肪含量測定采用索氏抽提法;粗灰分含量測定采用550℃馬弗爐灼燒法;氨基酸測定采用氨基酸自動分析儀;脂肪酸含量測定采用氣相色譜法。
1.4 數據分析
按照如下公式計算各營養成分含量在實驗組與同期對照組之間的變化率:
變化率(%)=(實驗組含量-對照組含量)/對照組含量×100
實驗數據用SPSS19.0軟件進行統計分析,采用獨立樣本T檢驗方法分析雌雄樣本之間、實驗組與對照組之間差異顯著性,對不同取樣時間營養成分含量進行單因素方差分析(One-way ANOVA),多重比較采用Duncan’s法。實驗結果用平均值±標準誤(Mean±SE)表示。
2 結果
2.1 實驗魚取樣數量及生長指標
對各取樣時期,對照組和實驗組中取樣數量進行了計數,結果列于表1。實驗過程中實驗魚體質量的分析結果列于表2。由表2可知,隨著禁食時間的延長,雌性和雄性大黃魚體質量均顯著降低(雌魚從467.25±26.35 g 下降至 330.58±15.90 g,雄魚從 363.23±17.82 g 下降至 310.67±13.52 g)。禁食 0~40 d,雌性大黃魚體質量與其對照組差異不顯著,禁食至60 d時顯著小于對照組(變化率-17.66%);雄性大黃魚在禁食20 d時,其體質量已經顯著小于同期對照組(變化率-18.64%),由此得知,禁食過程中,雌性大黃魚體質量下降速度小于雄性。
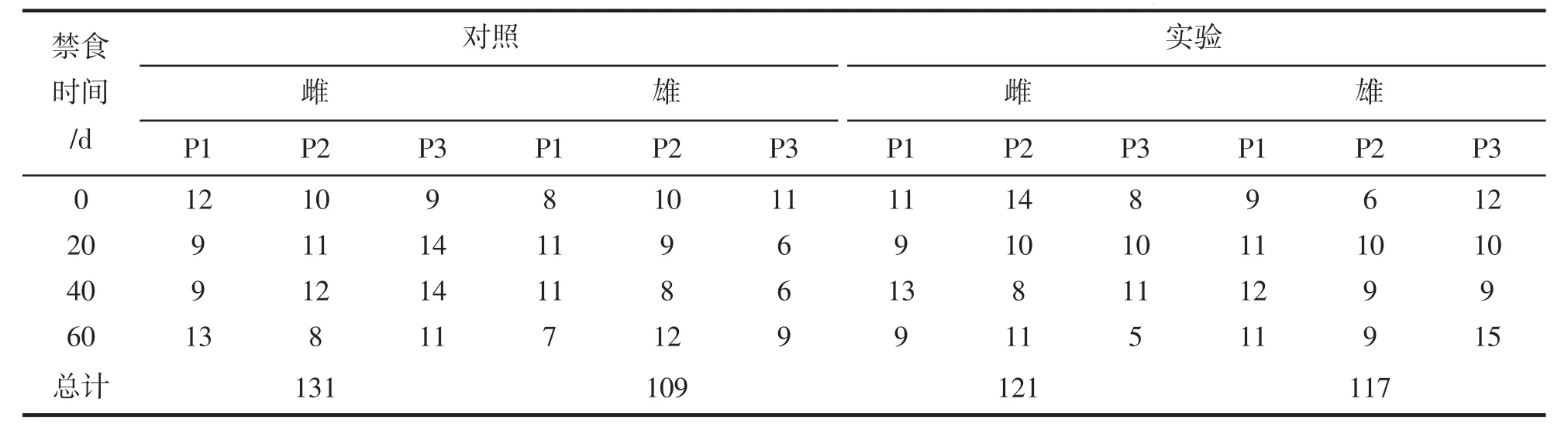
表1 各個時間點取樣數量匯總Tab.1 Summarized of the number at each sampling time point
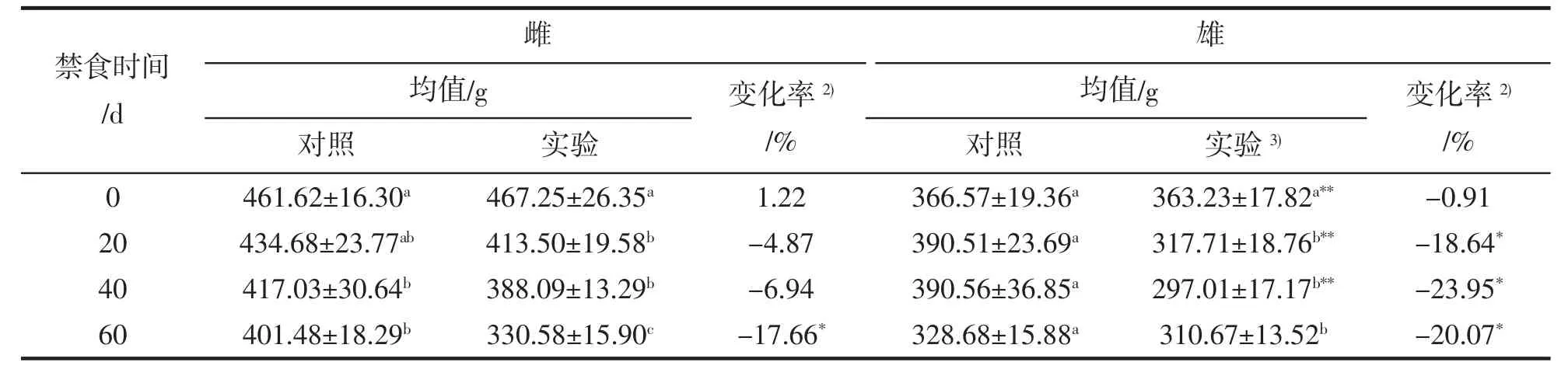
表2 禁食對大黃魚體質量的影響分析1)Tab.2 Effective analysis of fasting on body weight of large yellow croaker
2.2 常規營養成分分析
大黃魚背肌的常規營養成分分析結果見表3。由表3可知,禁食對雌性和雄性大黃魚肌肉中粗脂肪、粗蛋白及粗灰分含量具有較大影響。其中,隨著禁食時間的延長,雌性和雄性大黃魚粗脂肪含量均發生了顯著變化。雌性大黃魚背肌中粗脂肪含量禁食20 d顯著降低16.39%,繼續禁食至40 d降低19.98%;雄性的粗脂肪含量在禁食早期與對照組差異不顯著,經過60 d的禁食后顯著降低29.35%。由此可知,在不同禁食時期雌性大黃魚粗脂肪含量的變化幅度大于雄性。此外,粗脂肪含量在實驗開始時未表現出顯著的雌雄差異,但是禁食后差異顯著。
粗蛋白含量隨著禁食時間的延長在雌性和雄性大黃魚中均發生顯著變化。與同期對照組相比,雌魚禁食20、40、60 d粗蛋白含量顯著升高8.34%,5.17%和8.49%;雄魚在禁食至60 d時粗蛋白含量顯著升高19.44%,而在此之前變化不顯著。與同期對照組相比,雌性大黃魚粗灰分含量在禁食40 d時顯著降低24.17%,而雄性中在禁食60 d時顯著升高40.38%。同樣,粗灰分含量在實驗初始即表現出顯著的雌雄差異,但是在禁食20 d的和60 d時雌雄之間差異不顯著。
粗脂肪和粗蛋白的比較發現,雌性禁食20 d和40 d時粗脂肪含量顯著降低,而粗蛋白含量顯著升高;雄性在禁食早期粗脂肪和粗蛋白含量均未發生顯著變化,直到60 d時粗脂肪含量顯著降低、粗蛋白含量顯著升高,由此可知,禁食過程中,大黃魚首先分解利用體內脂肪,在脂肪消耗到一定程度后開始利用蛋白質供能。
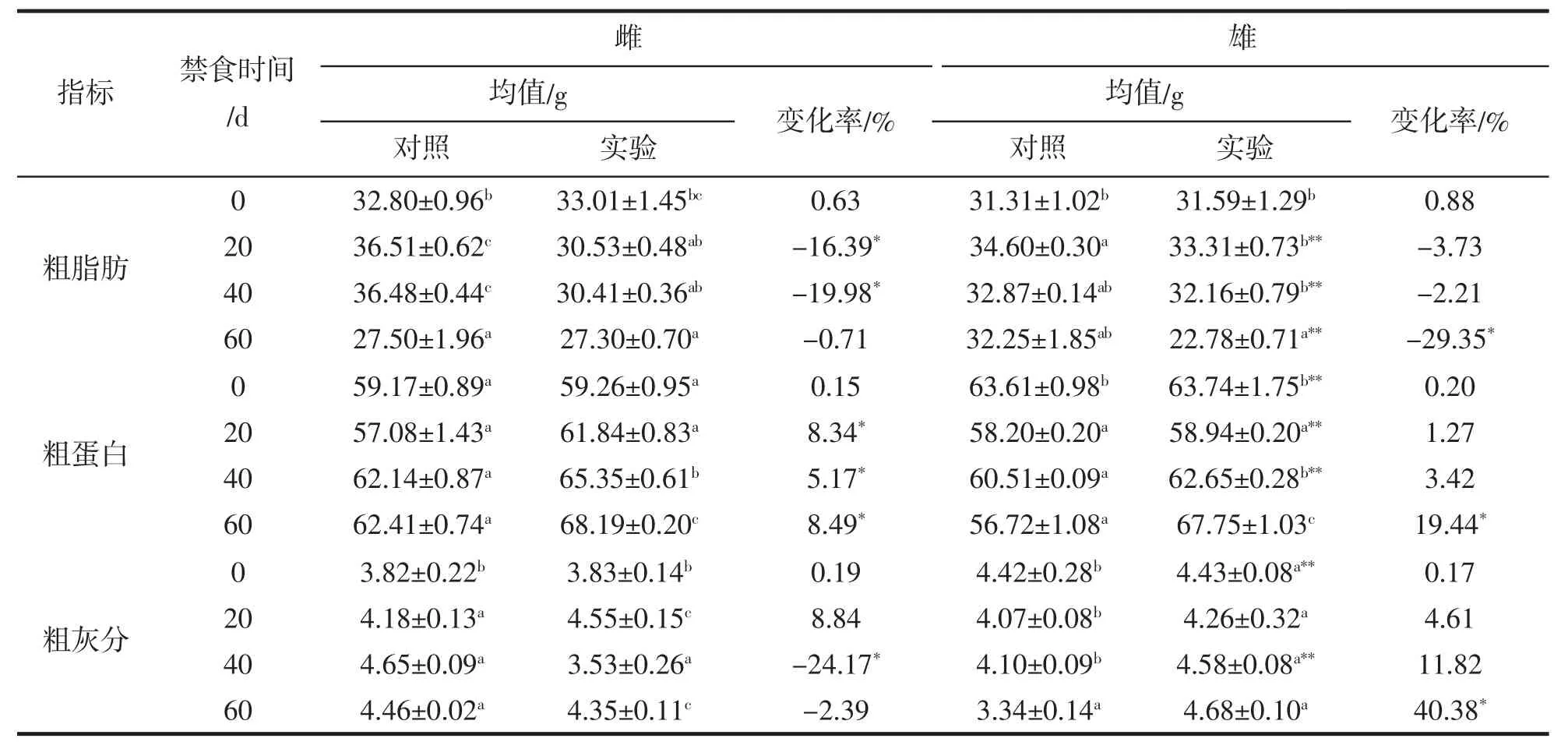
表3 禁食對大黃魚肌肉中生化組成成分的影響(干物質基礎)%Tab.3 Effects of fasting on the biochemical composition of muscle in L.crocea (based on dry matter)%
2.3 氨基酸組成
本研究分析了7種必需氨基酸(蘇氨酸、纈氨酸、蛋氨酸、異亮氨酸、亮氨酸、苯丙氨酸和賴氨酸),結果列于表4。由表4可知,雌性和雄性大黃魚肌肉中必需氨基酸含量在不同禁食處理組之間差異顯著,說明禁食對大黃魚背肌中必需氨基酸含量同樣具有較大影響。禁食20 d時,雌性中除蛋氨酸之外的6種必需氨基酸含量均顯著低于其同期對照組,變化率在-16.17%~-17.58%之間;而雄性中,除了蛋氨酸之外的6種必需氨基酸含量雖然出現一定程度的降低(變化率:-2.54~-5.44%),但是與對照組差異不顯著。禁食40 d時,雌性和雄性大黃魚中所有必需氨基酸含量與對照組差異不顯著。禁食60 d時,除了雌性中的蛋氨酸,其余必需氨基酸含量在雌性和雄性大黃魚中均顯著增加。
蛋氨酸與其他氨基酸含量變化情況存在較大差異,雌性的6種必需氨基酸在經過禁食20 d時的顯著降低之后,緩慢回升,至40 d時其含量稍微高于同期對照組,而蛋氨酸在禁食20 d時并沒有顯著降低,與其余必需氨基酸變化不同,禁食至40 d時仍然表現為低于同期對照組,同樣與其他必需氨基酸不同,推測可能是雌魚中蛋氨酸含量變化滯后于其他幾種必需氨基酸。雄性中蛋氨酸含量變化情況與雌魚存在一定差異,禁食20 d蛋氨酸含量表現為增加(35.44%),與其他必需氨基酸含量變化正好相反,推測可能是在20 d的禁食過程中,雄魚背肌中蛋氨酸含量迅速下降并進行緩慢回升,到20 d時已經回升到高于其同期對照組的水平。雌雄差異性分析得知,實驗初始時,雌性大黃魚背肌中必需氨基酸含量顯著高于雄性,禁食處理后必需氨基酸含量在雌雄魚之間發生了較大變化:禁食20 d時,雌性中只有亮氨酸含量顯著高于雄性;禁食40 d時,雌性中有蘇氨酸、異亮氨酸和賴氨酸含量均顯著高于雄性;禁食60 d時,雌雄之間所有必需氨基酸含量差異不顯著。
對非必需氨基酸含量的分析表明,9種非必需氨基酸含量在不同禁食處理組中存在顯著差異(雌性中的組氨酸除外),其變化情況與必需氨基酸類似(表5)。雌性中9種非必需氨基酸含量在禁食20 d時均表現為顯著降低(14.80%~17.59%),禁食40 d時變化不顯著,而禁食60 d時顯著增加(42.22%~64.89%)。雄魚的9種非必需氨基酸含量在禁食20 d和40 d時,均未發生顯著變化;禁食60 d時,顯著增加(33.51%~79.75%)。雌雄比較得知,實驗初始時9種非必需氨基酸在雌性中的含量顯著高于雄性,禁食40 d后,僅有絲氨酸含量仍然顯著高于雄性,其余非必需氨基酸在雌雄性之間均無顯著差異。
2.4 脂肪酸組成
本研究還進行了禁食對脂肪酸含量的影響分析,結果列于表6。與同期對照組相比,禁食20 d時,雌性中SFA和MUFA含量輕微升高,而PUFA含量顯著降低6.28%,說明PUFA被消耗利用;雄性中SFA和PUFA含量輕微升高,而MUFA含量一定程度降低,說明此時利用MUFA。禁食40 d時,雌性中SFA和MUFA含量輕微下降,而PUFA含量有所升高;雄性中SFA含量顯著增加4.44%,而MUFA和PUFA含量稍有降低。禁食60 d時,雌性中SFA和MUFA含量降低,其中MUFA變化顯著(-4.52%),PUFA含量顯著增加11.91%,說明此時MUFA被消耗利用,導致PUFA含量相對增加;雄性中SFA含量有所增加,MUFA和PUFA含量均有不同程度降低。
禁食20 d時,雌性大黃魚背肌中∑n-3PUFA、∑n-6PUFA和∑n-9PUFA含量均降低,其中∑n-6PUFA變化顯著(-19.26%);雄性中,∑n-3PUFA含量增加,而∑n-6PUFA和∑n-9PUFA含量稍有下降。禁食40 d時,雌性和雄性中∑n-3PUFA含量均增加,而∑n-6PUFA和∑n-9PUFA含量降低。禁食60 d時,雌性中SFA和∑n-6PUFA含量增加,而∑n-9PUFA含量稍有降低;雄魚中∑n-3PUFA和∑n-9PUFA含量降低,而∑n-6PUFA含量增加。上述結果表明,雌雄大黃魚饑餓條件下利用PUFA組分的先后順序均為:∑n-6PUFA>∑n-9PUFA>∑n-3PUFA。此外,雌性和雄性大黃魚中的DHA含量在禁食20 d時分別顯著增加3.65%和7.97%,由此可知,一定程度的禁食處理可以增加DHA的含量,獲得高品質的大黃魚。
脂肪酸組分含量的比較發現,禁食早期(0~20 d)EPA、DHA和∑n-3PUFA含量在雌雄魚之間差異顯著,表現為雄性高于雌性,但是隨著禁食時間的延長,雌雄之間的差異變為不顯著。PUFA和∑n-6PUFA含量在實驗初始(0 d)時,雌雄之間差異不顯著,但是分別在禁食20 d和40 d時,表現出顯著差異,繼續禁食再次變為差異不顯著。∑n-9MUFA含量在實驗初始(0 d)時表現出顯著的雌雄差異,但是禁食開始后,變為差異不顯著,由此可知,不同脂肪酸組分在雌雄之間的差異性因禁食時間的不同而發生變化。
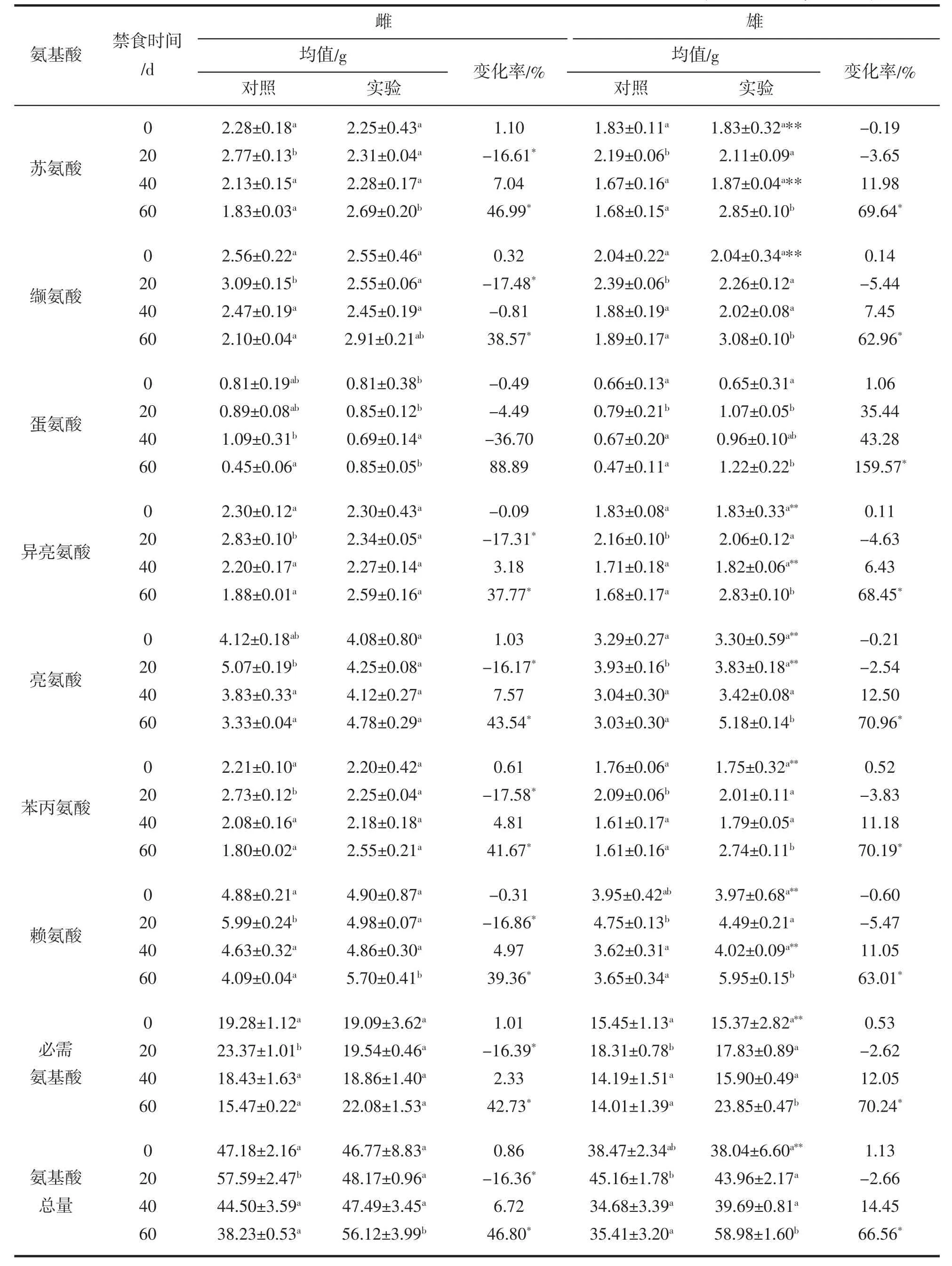
表4 禁食對大黃魚肌肉中必須氨基酸組分含量的影響(干物質基礎)%Tab.4 Effects of fasting on the essential amino acids of muscle in L.crocea (based on dry matter)%
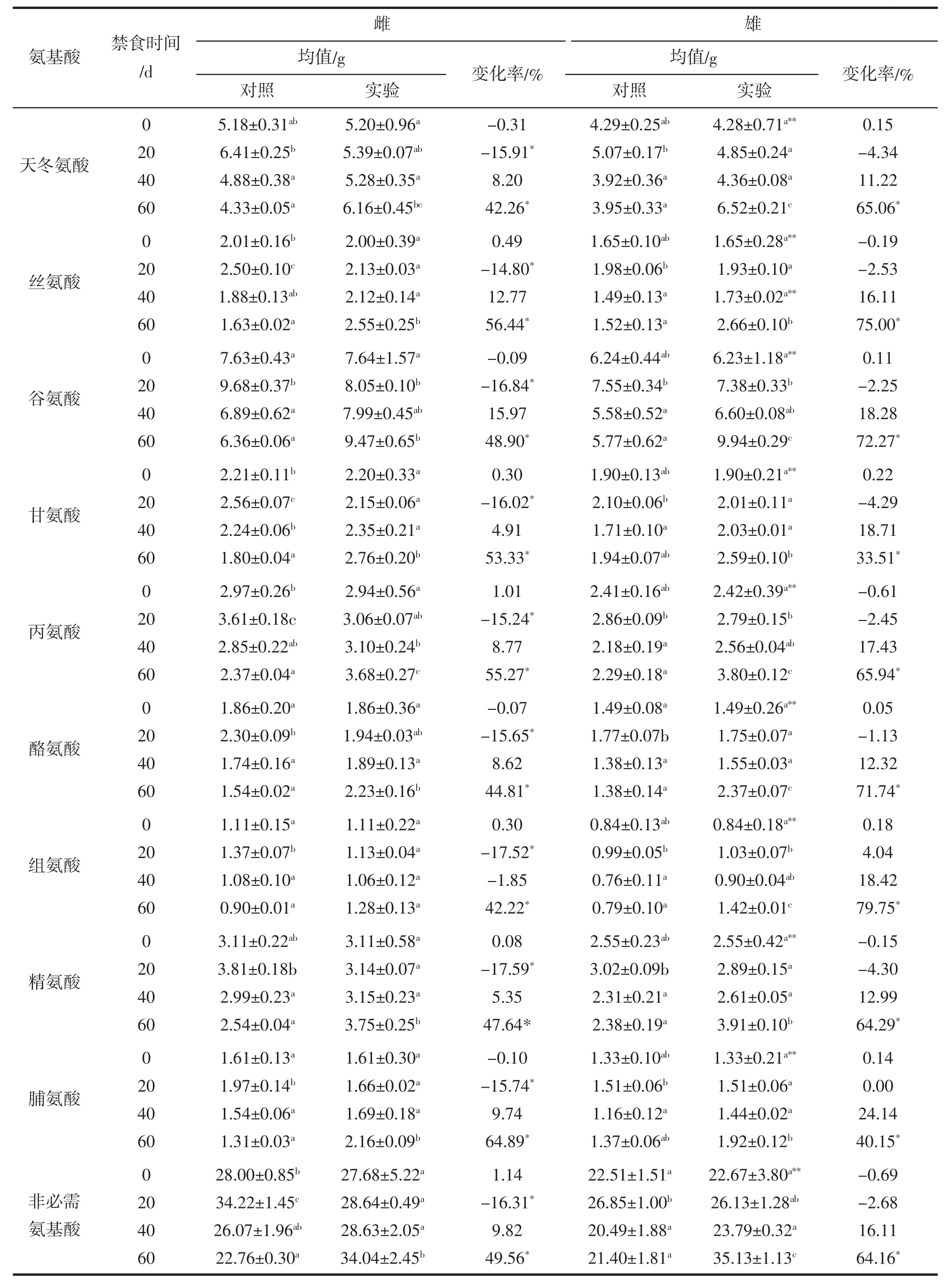
表5 禁食對大黃魚肌肉中非必須氨基酸組分含量的影響(干物質基礎)%Tab.5 Effects of fasting on the non-essential amino acids of muscle in L.crocea (based on dry matter)%
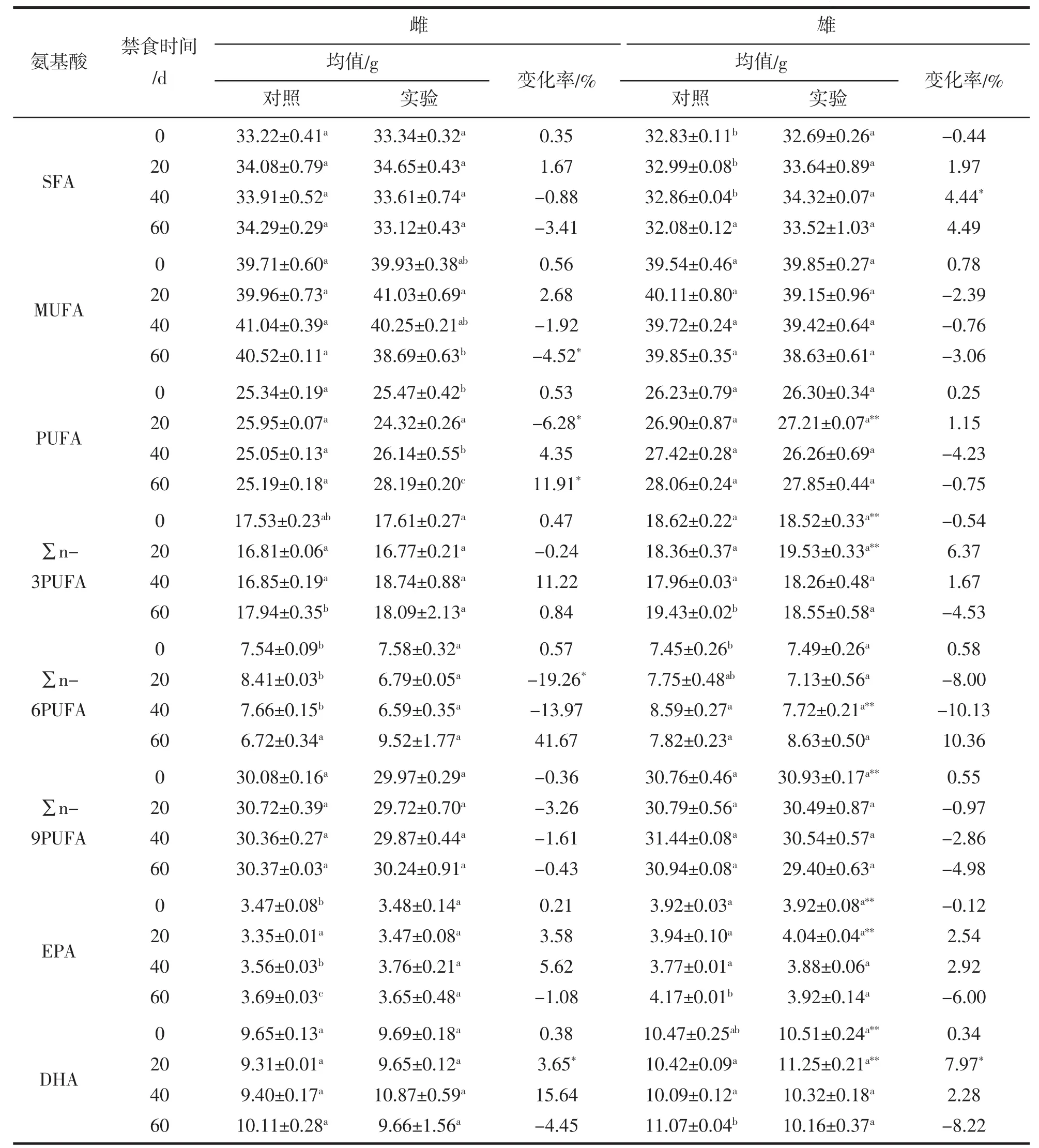
表6 禁食對大黃魚肌肉中脂肪酸組分含量的影響(干物質基礎)%Tab.6 Effects of fasting on the fatty acids of muscle in L.crocea (based on dry matter)%
3 討論
3.1 不同處理組大黃魚肌肉常規營養成分分析
饑餓狀態下的魚類,通過內源性代謝消耗自身的營養成分滿足生長代謝所需[17],不同的魚類利用自身營養成分的先后順序有一定差異,常見的為首先利用脂肪,待脂肪大量消耗之后開始利用蛋白質,如南方鲇 Silurus meridionalis[18]、泥鰍 Misgurnus anguillillcaudatu[19]、刀鱭 Coilia nasus[20]和美國紅魚 Sciaenops ocel latus[21];另外一種是先利用蛋白質,然后利用脂肪,如鮭鱒魚類[22]。本次研究中,禁食20 d的大黃魚粗脂肪含量下降,禁食40 d時粗蛋白含量下降,繼續禁食達到60 d時,脂肪含量又出現明顯降低。由此可知,大黃魚成魚在饑餓早期主要分解利用脂肪提供能量,隨著脂肪大量消耗,開始利用蛋白質供能,隨后由于一些蛋白質作為功能性物質需要保留,此時將再次分解利用脂肪。此結果與上述的第一類相符合,即魚類在禁食初期主要以脂肪作為能量來源,只有在脂肪被大量消耗后,蛋白質才作為能源物質[23-24]。
3.2 饑餓對大黃魚肌肉氨基酸的影響
饑餓對魚體內氨基酸的影響研究已有一些報道,如點帶石斑魚Epinephelus malabaricus饑餓10 d后肌肉中氨基酸總量和必需氨基酸總量顯著降低[25];鮸魚Miichthys miiuy饑餓期間氨基酸總量和必需氨基酸總量均呈一定的下降趨勢[26];遮目魚Chanos chanos在饑餓60 d時,組氨酸、天冬氨酸、脯氨酸含量和氨基酸總量顯著下降[27]。說明魚類受到饑餓脅迫時,可以將氨基酸轉化成其他物質提供能量[28]。本研究分析的16種氨基酸中,除了蛋氨酸之外,雌性和雄性大黃魚中15種氨基酸含量及氨基酸總量在禁食20 d時均降低,其中雌性降低顯著,表明雌性在禁食早期體內氨基酸被大量消耗利用,相比較而言雄性被利用較少,說明氨基酸的利用在雌雄魚之間存在一定差異。本次研究結果與上述已有報道相類似,即在饑餓條件下,氨基酸被分解供能。本次研究還得出,禁食60 d的雌性和雄性大黃魚肌肉中氨基酸組分含量均顯著升高,所以通過一定強度的禁食處理可以改變氨基酸組分的含量,進而改善大黃魚肌肉品質。
3.3 饑餓對大黃魚肌肉脂肪酸的影響
已有報道指出不同魚類在饑餓期間對脂肪酸的利用情況不同,如虹鱒Oncorhynchus mykiss[29]、錦鯉Cyprinus carpio[30]、匙吻鱘Polyodon spathula[31]以及斑點叉尾鮰Ictalurus punctatus[32]等在饑餓期間SFA和MUFA含量顯著下降,PUFA含量上升。在饑餓狀態下,非洲胡子鲇Clarias gariepinus體內SFA含量下降,MUFA和PUFA含量均上升[33];瓦氏黃顙魚Pelteobagrus vachelli肌肉中的MUFA含量顯著下降,而PUFA含量顯著上升[34]。本次研究中,大黃魚在饑餓狀態下,雌性體內PUFA最先被利用,而SFA最后利用,此結果與張振宇等[16]研究大黃魚的報道結果相似,但是雄性個體內MUFA最先被利用,由此表明,區分性別進行研究非常有必要。饑餓狀態下,機體利用PUFA組分的先后順序也因魚種而異,鮸魚[26]、金頭鯛Sparus aurata[37]和胭脂魚Myxocyprinus asiaticus[38]等在饑餓狀態下對體內PUFA的利用順序為:∑n-6PUFA>∑n-9MUFA>∑n-3PUFA;而大鰭鱯為:∑n-9PUFA>∑n-3 PUFA>∑n-6 PUFA[39]。本次研究得出,饑餓期間,大黃魚雌性和雄性利用PUFA的順序基本一致,均為:∑n-6PUFA>∑n-9MUFA>∑n-3PUFA,此研究結果與鮸魚和金頭鯛相一致,但是與張振宇等關于∑n-3PUFA的報道結果有所差異,可能原因是禁食時間不同及采用的實驗魚規格不同。
此外,雌雄魚肌肉中DHA含量在禁食20 d時顯著高于同期對照組,而EPA變化不顯著,此結果與林黑著等[40]研究斜帶石斑魚Epinephelus coioides所得結果有一定差異,可能是由魚種、規格及養殖環境差異所致。DHA具有軟化血管、健腦益智、改善視力的功效,因此通過一定程度的禁食處理獲得高DHA含量的大黃魚將帶來更大的經濟價值。本研究發現EPA、DHA和∑n-3PUFA含量在禁食早期(0~20 d)有顯著的雌雄差異,但是隨著禁食時間的延長,雌雄差異變為不顯著。∑n-6PUFA和PUFA含量在實驗初始(0 d)時,雌雄差異不顯著,但是經過禁食之后變為差異顯著。由此可知,適當的饑餓處理可以改變脂肪酸在雌雄大黃魚肌肉中的相對含量,因此,對大黃魚進行禁食處理時,需要對雌魚和雄魚進行區別對待,這一研究結果對于通過適當的禁食處理改善大黃魚肌肉品質具有較大的指導意義。
[1]朱元鼎,伍漢霖.福建魚類志(下卷)[M].福州:福建科技出版社,1985:101-136.
[2]顏孫安,姚清華,林香信,等.不同養殖模式大黃魚肌肉營養成分比較[J].福建農業學報,2015,30(8):736-744.
[3]ANDERSEN H J,OKSBJERG N,YOUNG J F,et al.Feeding and meat quality-A future approach[J].Meat Science,2005,70(3):543-554.
[4]GINéS R,PALICIO M,ZAMORANO M J,et al.Starvation before slaughtering as a tool to keep freshness attributes in gilthead sea bream (Sparus aurata)[J].Aquaculture International,2002,10(5):379-389.
[5]李海燕,朱曉鳴,韓 冬,等.上市前限喂對池塘養殖異育銀鯽生長及品質的影響[J].水生生物學報,2014,38(3):525-532.
[6]THAKUR DP,MORIOKA K,ITOH Y,et al.Influence of muscle biochemical constituents on the meat texture of cultured yellowtail(Seriola quinqueradiata)at different anatomical locations[J].Journal of the Science of Food and Agriculture,2002,82(13):1 541-1 550.
[7]THAKUR D P,MORIOKA K,ITOH Y,et al.Lipid composition and deposition of cultured yellowtail Seriola quinqueradiata muscle at different anatomical locations in relation to meat texture[J].Fisheries Science,2003,69(3):487-494.
[8]王騰飛,郭曉鴿,谷江穩,等.饑餓及過量投喂下銀鯧幼魚形態學指標及體成分變化[J].海洋學研究,2015,33(4):83-89.
[9]ABOLFATHI M,HAJIMORADLOO A,GHORBANI R,et al.Effect of starvation and refeeding on digestive enzyme activities in juvenile roach,Rutilus rutilus caspicus[J].Comp Biochem Physiol A Mol Integr Physiol,2012,161(2):166-173.
[10]陳 斌,馮 健,吳 彬,等.饑餓對太平洋鮭(Oncorhynchus spp.)魚體脂肪與脂肪酸的影響[J].海洋與湖沼,2012,43(6):1 247-1 253.
[11]田 娟,涂 瑋,曾令兵,等.饑餓和再投喂期間尼羅羅非魚生長、血清生化指標和肝胰臟生長激素、類胰島素生長因子-I和胰島素mRNA表達豐度的變化[J].水產學報,2012,36(6):900-907.
[12]BASTROP R,JüRSS K,WACKE R.Biochemical parameters as a measure of food availability and growth in immature rainbow trout(Oncorhynchus mykiss)[J].Comparative Biochemistry and Physiology,1992,102(1):151-161.
[13]姜建湖,閆家強,竺俊全,等.大黃魚精子的超低溫凍存及細胞結構損傷的檢測[J].農業生物技術學報,2011,19(4):725-733.
[14]張其永,洪萬樹,楊圣云,等.大黃魚地理種群劃分的探討[J].漁業信息與戰略,2011,26(2):3-8.
[15]徐 浩,張東玲,陳慶凱,等.低溫下饑餓脅迫對大黃魚血清生化指標的影響[J].生物技術通報,2015,31(6):195-199.
[16]張振宇,王秋榮,葉 坤,等.禁食對養殖大黃魚體成分、肌肉脂肪酸組成和血清生化指標的影響[J].水產學報,2016,40(9):1 440-1 450.
[17]龍章強,彭士明,陳立僑,等.饑餓與再投喂對黑鯛幼魚體質量變化、生化組成及肝臟消化酶活性的影響[J].中國水產科學,2008,15(4):606-614.
[18]謝小軍,鄧 利,張 波.饑餓對魚類生理生態學影響的研究進展[J].水生生物學報,1998,22(2):181-188.
[19]吳立新,蔡 勛,陳 煒.饑餓和再喂食對泥鰍生化組成的影響[J].生態學雜志,2006,25(1):101-104.
[20]金 鑫,徐鋼春,杜富寬,等.饑餓脅迫對刀鱭形體、體成分及血液生化指標的影響[J].動物學雜志,2014,49(6):897-903.
[21]姜志強,賈澤梅,韓延波.美國紅魚繼饑餓后的補償生長及其機制[J].水產學報,2002,26(1):67-72.
[22]MOMMSEN T P,FRENCH C J,HOCHACHKA P W.Sites and patterns of protein and amino acid utilization during the spawning migration of salmon[J].Canadian Journal of Zoology,2011,58(10):1 785-1 799.
[23]WHYTE J N C,ENGLAR J R,CARSWELL B L,et al.Influence of starvation and subsequent feeding on body composition and energy reserves in the Prawn Pandalus platyceros[J].Canadian Journal of Fisheries&Aquatic Sciences,1986,43(43):1 142-1 148.
[24]CALOW P.On the regulatory nature of individual growth:some observations from freshwater snails[J].Journal of Zoology,1973,170(4):415-428.
[25]陳 波,柳敏海,施兆鴻,等.饑餓和再投飼對點帶石斑魚幼魚脂肪酸和氨基酸組成的影響[J].上海海洋大學學報,2008,17(6):674-679.
[26]柳敏海,羅海忠,傅榮兵,等.短期饑餓脅迫對鮸魚生化組成、脂肪酸和氨基酸組成的影響[J].水生生物學報,2009,33(2):230-235.
[27]SHIAU C Y,PONG Y P,CHIOU T K,et al.Effect of starvation on free histidine and amino acids in white muscle of milkfish Chanos chanos[J].Comp Biochem Physiol B Biochem Mol Biol,2001,128(3):501-506.
[28]張 濤,平洪領,史會來,等.周期性饑餓再投喂對曼氏無針烏賊(Sepiella japonica)幼體生長、體組成及氨基酸和脂肪酸的影響[J].海洋與湖沼,2017,48(1):190-197.
[29]KIESSLING A,JOHANSSON L,STOREBAKKEN T.Effects of reduced feed ration levels on fat content and fatty acid composition in white and red muscle from rainbow trout[J].Aquaculture,1989,79(1/4):169-175.
[30]MURATA H,Higashi T.Selective utilization of fatty acid as energy source in carp[J].Nihon Suisan Gakkaishi,1980,46(11):1 333-1 338.
[31]聶文強,李 婧,吉 紅,等.匙吻鱘稚魚攝食節律與饑餓對其體脂肪酸組成的影響[J].水產科學,2017,36(1):36-41.
[32]譚肖英,羅 智,王為民,等.饑餓對小規格斑點叉尾鮰體重及魚體生化組成的影響[J].水生生物學報,2009,33(1):39-45.
[33]ZAMAL H,OLLEVIER F.Effect of feeding and lack of food on the growth,gross biochemical and fatty acid composition of juvenile catfish[J].Journal of Fish Biology,1995,46(3):404-414.
[34]覃川杰,邵 婷,楊潔萍,等.饑餓脅迫對瓦氏黃顙魚脂肪代謝的影響[J].水生生物學報,2015,39(1):58-65.
[35]DOBSON S H,HOLMES R M.Compensatory growth in the rainbow trout,Salmo gairdneri Richardson[J].Journal of Fish Biology,1984,25(6):649-656.
[36]KIM M K,LOVELL R T.Effect of restricted feeding regimens on compensatory weight gain and body tissue changes in channel catfish Ictalurus punctatus in ponds[J].Aquaculture,1995,135(4):285-293.
[37]KOVEN W M,KISSIL G W,TANDLER A.Lipid and n-3 requirement of Sparus aurata,larvae during starvation and feeding[J].Aquaculture,1989,79(1/4):185-191.
[38]王 川,郭海燕,李秀明,等.延遲首次投喂對胭脂魚仔魚氨基酸和脂肪酸的影響[J].水產學報,2015,39(1):75-87.
[39]馬 珊,姜海波,姚俊杰.短期饑餓對大鰭鱯生化組成、氨基酸和脂肪酸組成的影響[J].水生態學雜志,2010,31(2):61-65.
[40]林黑著,劉永堅,何建國,等.饑餓對斜帶石斑魚肝臟和肌肉脂肪酸組成的影響[J].南方水產科學,2006,2(4):1-6.

