FK506對人肝HL-7702細胞中Akt表達的影響
李浩言,張雪梅,安 軍,張韶峰,王宏宇,高 飛,馬永華,徐 春
FK506對人肝HL-7702細胞中Akt表達的影響
李浩言,張雪梅,安 軍,張韶峰,王宏宇,高 飛,馬永華,徐 春
目的觀察他克莫司(FK506)對人肝HL-7702細胞系胰島素信號通路關鍵位點Akt表達的影響,以探究FK506誘導血糖升高的分子機制。方法 選用處于對數生長期的人肝HL-7702細胞系,分為3個處理組和1個對照組。處理組分別用不同濃度的FK506(0.1、1、5 mg/L)處理24 h,對照組用等量培養基培養24 h。采用蛋白質免疫印跡法(western blot)檢測各組Akt蛋白的表達量及其磷酸化水平,同時采用蛋白磷酸酶2A(protein phosphatase 2A, PP2A)活性測定試劑盒測定PP2A活性。結果各組Akt的表達水平及磷酸化位點p-Akt(Ser473)水平無明顯變化,另一磷酸化位點p-Akt(Thr308)水平(F=5.657,P=0.022)差異有統計學意義;當FK506 濃度為5 mg/L時與對照組相比顯著升高,差異有統計學意義(P=0.037),隨著FK506濃度的升高,PP2A活性有一定程度升高,但差異無統計學意義(F=0.857,P=0.501)。結論FK506引起HL-7702細胞中Akt磷酸化水平升高,這一變化可能與PP2A無關。
Akt;他克莫司;胰島素抵抗;器官移植后糖尿病
他克莫司(FK506)是一種鈣調神經磷酸酶抑制劑,用于預防器官移植術后急性排斥反應,可有效提高移植物的存活率[1]。然而,與其相關的副作用如移植后糖尿病(post-transplantation diabetes mellitus,PTDM)嚴重影響移植物的功能。臨床研究顯示,FK506比環孢素A更易導致糖尿病[2,3],其誘導糖尿病發生的機制尚不清楚。最近研究發現,鈣調神經磷酸酶對于葡萄糖促進胰島素基因轉錄具有關鍵作用[4],作為鈣調神經磷酸酶抑制劑,FK506抑制胰島素基因的轉錄,損傷胰島β-細胞。實驗發現FK506可致胰島素抵抗[5],研究FK506對胰島素信號傳導分子的影響將有助于揭示其增加胰島素抵抗的機制。
Akt又稱蛋白激酶B(protein kinase B,PkB),包括蘇氨酸磷酸化位點308(Thr308)和絲氨酸磷酸化位點473(Ser473)兩個位點,是胰島素信號傳導通路關鍵分子。胰島素可激活PI3K-Akt-mTORC信號通路,促進葡萄糖轉運蛋白4(glucose transporter 4,GLUT4)的轉位,增加骨骼肌及脂肪細胞的葡萄糖攝取,激活糖原合成相關酶,抑制肝糖輸出[6]。該信號通路的損傷可能是胰島素抵抗發生的關鍵[7]。蛋白磷酸酶2A(Proteinphosphatase 2A,PP2A)是真核生物廣泛存在的絲氨酸/蘇氨酸蛋白磷酸酶。Akt作為PP2A的主要底物,可被其去磷酸化而失去活性。本研究選擇胰島素信號傳導通路的關鍵分子Akt,觀察不同濃度的FK506對HL-7702細胞中Akt表達量及磷酸化水平的影響,并觀察其對PP2A酶活性的影響,以探究其導致胰島素抵抗的分子機制。
1 材料與方法
1.1 材料
1.1.1 實驗細胞 人肝細胞系HL-7702細胞株,購自上海中科院細胞所,培養條件:10%胎牛血清(fetal bovine serum,FBS)的RPMI1640培養基于37℃、5%CO2的濕化培養箱中培養。
1.1.2 儀器及耗材 FBS購自杭州四季青生物工程有限公司;RPMI1640培養基購自英國Gibco公司;CO2恒溫細胞培養箱購自美國ThermoForma公司;FK506粉購自美國Cell Signaling Technology公司;二甲基亞砜(dimethyl sulfoxide,DMSO)購自美國Ameresco公司;兔來源p-Akt(Thr308)單克隆抗體,兔來源p-Akt(Ser473)單克隆抗體,兔來源Akt單克隆抗體,辣根過氧化物酶(horseradish peroxidase,HRP)標記抗鼠/兔IgG均購自美國Cell Signaling Technology公司。鼠來源actin單克隆抗體,購自美國Abcam公司;脫脂奶粉購自上海碧迪醫療器械有限公司;PP2A 酶活性測定試劑盒購自美國Millipore公司;化學發光凝膠成像系統購自美國Aplegen公司;Synergy HT酶標儀購自美國Bio-Tek公司;其他常用試劑為進口或國產分析純。
1.2 方法
1.2.1 細胞分組及處理 10 mg FK506粉溶于250 μl DMSO中,混勻,制備成40 mg/L母液,分裝后儲存于-20℃。人肝細胞系HL-7702細胞株培養至對數生長期,按5×105/ml的密度均勻接種于60 mm培養皿上,隨機分為處理組(n=3)和對照組(n=1)。37℃、5%CO2的濕化培養箱中培養24 h后,處理組分別更換FK506終濃度為0.1、1、5 mg/L等量含10%FBS的RPMI1640培養基(各處理組DMSO終濃度< 0.1%,故忽略不計),對照組用等量含10%FBS的RPMI1640培養基培養。所有細胞于37℃、5%CO2濕化培養箱中繼續培養24 h。
1.2.2 蛋白質免疫印跡法(western blot)分析Akt的表達量及其磷酸化水平 各組細胞培養24 h后,棄掉培養液,用預冷的PBS洗一遍。每組細胞加入適量RIPA裂解液(內含終濃度為1 mmol/L的苯甲基磺酰氟、氟化鈉、正釩酸鈉),4℃放置15 min。充分裂解后,收集裂解液至離心管中,16 000×g離心20 min。收集上清液,BCA(bicinchonininc acid)法測定蛋白濃度并分裝。制備8%分離膠和5%濃縮膠(十二烷基硫酸鈉-聚丙烯酰胺凝膠,SDS-PAGE),等量蛋白與4×上樣緩沖液混合,沸水中加熱5 min至蛋白變性。蛋白上樣,電泳。而后于100 V電壓下將蛋白轉至硝化纖維膜上。將膜用含5%脫脂奶粉的封閉液孵育3 h,而后孵育一抗,4℃過夜。TBST(Tris-HCl緩沖鹽溶液加Tween 20)洗膜3次,每次5 min,室溫下孵育二抗1 h。再次用TBST洗膜3次,每次5 min。用化學發光凝膠成像系統進行檢測,用Image J軟件進行灰度分析。
1.2.3 PP2A活性檢測 參照PP2A 酶活性測定試劑盒說明書,步驟:各處理組細胞培養24 h后棄去培養基,用預冷的自配Ser/Thr Assay Buffer漂洗一次細胞,加入適量細胞裂解液,4℃,15 min后收集蛋白裂解液,期間每隔5 min用手指輕彈一次。15 min后10 000×g,4℃,離心10 min。取上清,BCA法測蛋白濃度并稀釋至相同濃度。取400 μg蛋白樣品,加入4 μg Anti-PP2A,C subunit,clone 1D6,40 μl Protein A agarose,4℃旋轉孵育2 h。1000×g,4℃離心并收集瓊脂糖珠,自配Ser/Thr Assay Buffer洗兩次,試劑盒自帶Ser/Thr Assay Buffer洗一次。棄上清,加入20 μl 試劑盒自帶Ser/Thr Assay Buffer和60 μl底物肽,30℃震蕩孵育10 min。離心,收集上清,在96孔板中分別加入25 μl。每孔加入100 μl Malachite Green顯色,室溫放置15 min。酶標儀于650 nm波長測定光密度(optical density,OD)值。根據磷標準曲線將吸光度折算成磷濃度以計算酶活性,并得出相對酶活性。所有實驗均重復3次以上。
1.4 統計學處理 使用SPSS 17.0軟件對數據進行統計分析。計量資料以表示。各組數據間的顯著性檢驗采用單因素方差分析,以P<0.05為差異有統計學意義。
2 結 果
2.1 HL-7702細胞Akt的表達量及其磷酸化水平 經western blot檢測對照組及不同濃度FK506處理細胞內Akt表達量及其磷酸化水平,結果Akt表達量(F=0.449,P=0.725)及磷酸化位點P-Akt(Ser473)水平(F=2.795,P=0.109)無明顯變化。另一磷酸化位點P-Akt(Thr308)水平(F=5.657,P=0.022)差異有統計學意義,進一步兩兩比較顯示,與對照組相比,FK506在濃度為5 mg/L時P-Akt(Thr308)水平顯著升高,差異顯著具有統計學意義(P=0.037,圖1)。
2.2 HL-7702細胞的PP2A活性 PP2A活性(用相對值表示)在對照組為1,FK506濃度為0.1 mg/L時為1.1601,FK506濃度為1 mg/L時為1.1067,FK506濃度為5 mg/L時為1.1556。由圖2可知,隨著FK506濃度的提高,PP2A酶活性有一定升高趨勢,但差異無統計學意義(F=0.857,P=0.501)。
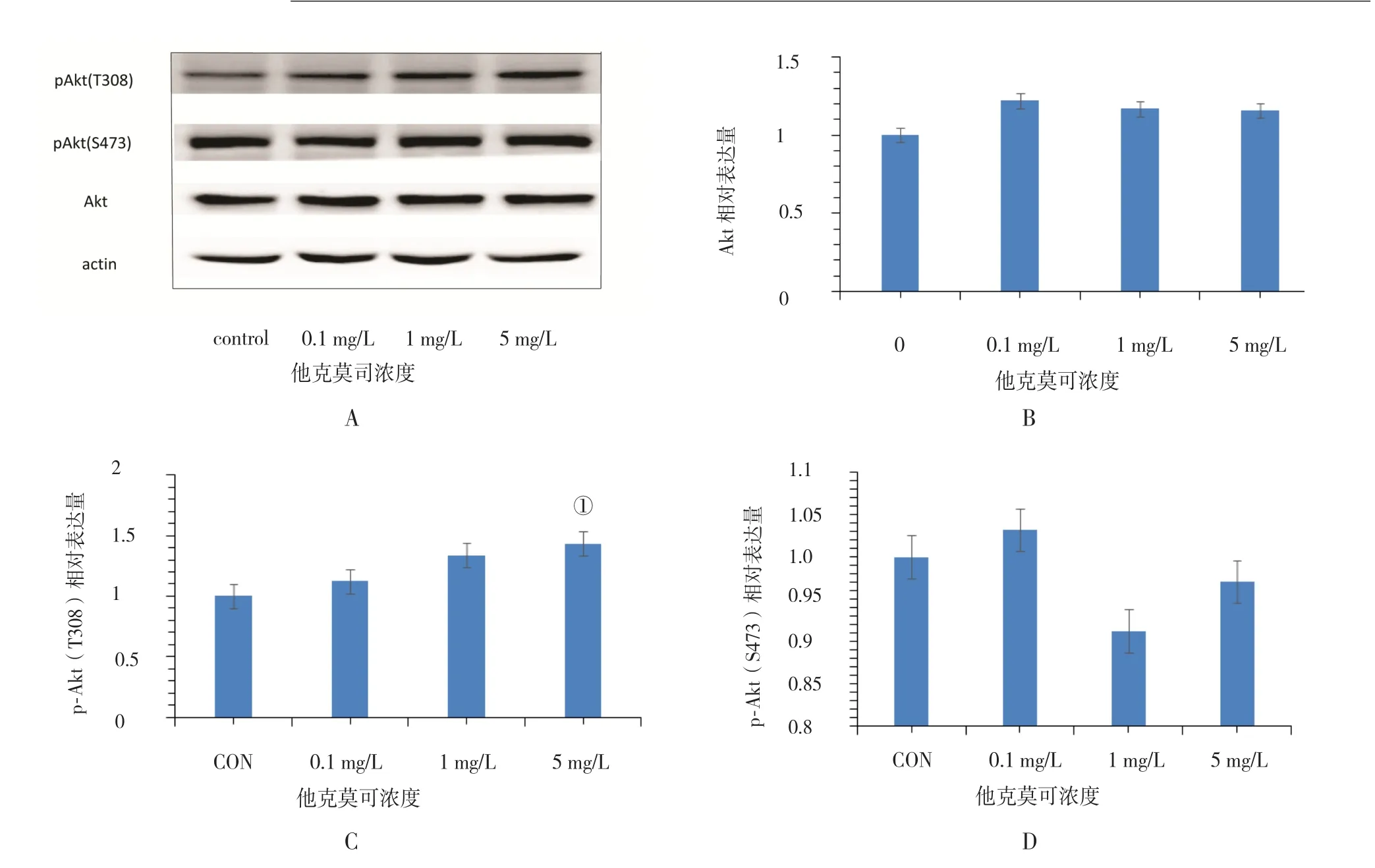
圖1 不同濃度FK506處理HL-7702細胞的Akt磷酸化水平變化(pAkt/Akt)
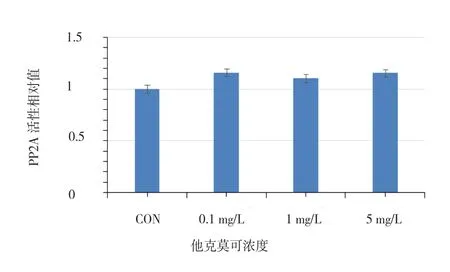
圖2 不同濃度FK506處理HL-7702細胞的PP2A酶活性變化
3 討 論
器官移植是目前終末期器官功能衰竭患者最有效的治療方法。以FK506為代表的鈣調神經磷酸酶抑制劑是預防器官移植術后急性排斥反應的主要藥物。然而,應用該藥所導致的一系列并發癥嚴重影響著器官移植術后移植物存活率和患者的生活質量。PTDM是其中發病率較高,容易導致心腦血管疾病的一種。PTDM的高危因素包括人種、高齡、超重、糖尿病家族史、病毒感染及應用免疫抑制劑等[8],因此免疫抑制劑的劑量和時間的個體化原則是目前預防高危移植后患者發生糖尿病的可行方法,并且免疫抑制劑所導致的血糖升高機制成為目前研究的重點,對鈣調磷酸酶抑制劑誘導血糖升高的機制的研究不僅為預防PTDM的發生提供理論基礎,也可為2型糖尿病發病機制的探索開辟新路徑。
目前,關于FK506誘導血糖升高的機制主要有胰島素分泌不足和胰島素抵抗兩方面。之前的臨床研究發現PTDM患者同時存在β細胞功能減退及胰島素抵抗,且與2型糖尿病患者相比,其β細胞功能減退更為嚴重[9]。動物實驗顯示,FK506可導致大鼠胰島細胞損傷及胰島素抵抗,其升糖作用具有時間依賴性和劑量依賴性,同時具有可逆性,停藥后可逆轉血糖升高[10]。
本研究用不同濃度FK506作用于人肝HL-7702細胞24 h,結果顯示:FK506對Akt的總表達量無影響,但是Akt的Thr308位點磷酸化水平呈濃度依賴性升高,即FK506可誘導人肝HL-7702細胞Akt的磷酸化,激活Akt。最近的研究顯示Akt在糖脂代謝中發揮重要作用:Akt是肝細胞合成甘油三酯的重要信號分子,Akt的缺失導致肝細胞合成甘油三酯障礙,Akt的過度激活則會增加甘油三酯的合成,發生高甘油三酯血癥,促進胰島素抵抗,所以肝細胞中正常胰島素信號通路的傳遞是保證糖脂代謝正常的前提[11]。2型糖尿病患者長期處于高胰島素血癥[12],導致肝細胞胰島素信號通路的過度激活,甘油三酯合成增加;高胰島素血癥同時導致多臟器細胞的胰島素信號通路過度激活,這也是糖尿病腎病、動脈粥樣硬化甚至腫瘤發生的重要因素[13-15]。FK506引起肝細胞Akt的激活,可能是器官移植后服用FK506患者發生糖尿病的一種機制。
PP2A是真核生物廣泛存在的絲氨酸/蘇氨酸(Ser/ Thr)蛋白磷酸酶。可通過對底物的去磷酸化作用參與多種細胞調節Akt是PP2A的底物之一,Akt磷酸化主要受PP2A的調節,抑制PP2A的活性可促進Akt的磷酸化。本研究觀察到HL-7702細胞經不同濃度的FK506處理后,PP2A的酶活性無改變,據此筆者認為,由FK506所誘導的Akt的磷酸化可能與PP2A無關,另有其他磷酸酶或激酶參與,但這一結論需要進一步研究。
總之,本研究發現FK506促進胰島素信號通路關鍵分子Akt在人肝細胞中的磷酸化,導致Akt激活。Akt的激活促進肝細胞合成甘油三酯,造成高脂血癥,可能是FK506導致胰島素抵抗,甚至血糖升高的機制之一。然而,肝細胞胰島素信號通路中包含眾多位點,本研究僅針對Akt做了相關檢測,對于闡述PTDM的發病機制具有較大的局限性,今后將進一步檢測其他關鍵位點,以完善FK506導致PTDM的發病機制。
[1]Li C J, Li L. Tacrolimus in preventing transplant rejection in Chinese patients-optimizing use [J]. Drug Des Devel Ther, 2015, 9(3): 473-485. DOI: 10.2147/DDDT. S41349.
[2]Liu J Y, Song M, Guo M, et al. Tacrolimus versus cyclosporine as primary immunosuppressant after renal transplantation: a meta-analysis and economics evaluation [J]. Am J Ther, 2016, 23(3): e1720-e1724. DOI: 10.1097/MJT.0000000000000186.
[3]Song J L, Gao W, Zhong Y, et al. Minimizing tacrolimus decreases the risk of new-onset diabetes mellitus after liver transplantation [J]. World J Gastroenterol, 2016, 22(6): 2133-2141. DOI: 10.3748/wjg.v22.i6.2133.
[4]Oetjen E, Baun D, Beimesche S, et al. Inhibition of human insulin gene transcription by the immunosuppressive drugs cyclosporin a and tacrolimus in primary, mature islets of transgenic mice [J]. Mol Pharmacol, 2003, 63(6): 1289-1295. DOI: https://DOI.org/10.1124/mol.63.6.1289.
[5]Larsen J L, Bennett R G, Burkman T, et al. Tacrolimus and sirolimus cause insulin resistance in normal sprague dawley rats [J]. Transplantation, 2006, 82(4): 466-470. DOI: 10.1097/01.tp.0000229384.22217.15.
[6]Li Z W, Sun F, Zhang Y H, et al. Tacrolimus induces insulin resistance and increases the glucose absorption in the jejunum: a potential mechanismof the diabetogenic effects [J]. PLoS One, 2015, 10(11): e0143405. DOI: 10.1371/journal.pone.0143405.
[7]Gonzalez E, McGraw T E. The Akt kinases: isoform specificity in metabolism and cancer [J]. Cell Cycle, 2009, 8(16):2502-2508. DOI: 10.4161/cc.8.16.9335 .
[8]Hers I, Vincent E E, Tavaré J M. Akt signalling in health and disease [J]. Cell Signal, 2011, 23(10): 1515-1527. DOI: 10.1016/j.cellsig.2011.05.004.
[9]王文君,徐 春,牛玉堅,等. 肝移植術后胰島素敏感性和胰島β細胞功能的改變[J]. 中國糖尿病雜志, 2012, 20(2): 133-135. DOI: 10.3969/j.issn.1006-6187.2012.02.014.
[10]王文君,牛玉堅,徐 春,等. 肝移植后糖尿病與2 型糖尿病的胰島素分泌特點比較[J/CD]. 中華臨床醫師雜志(電子版), 2012, 6(17):5259-5261. DOI: 10.3877/ cma.j.issn.1674-0785.2012.17.061.
[11]Xu C, Niu Y J, Liu X J, et al. Tacrolimus reversibly reduces insulin secretion, induces insulin resistance, and causes islet cell damage in rats [J]. Int J Clini Pharmacol Ther, 2014, 52(7) : 620-627. DOI: 10.5414/CP202090.
[12]Haber E P, Procópio J, Carvalho C R, et al. New insights into fatty acid modulation of pancreatic beta-cell function [J]. Int Rev Cytol, 2006, 248: 1-41. DOI: 10.1016/S0074-7696(06)48001-3.
[13]Abeyrathna P, Su Y. The critical role of Akt in cardiovascular function [J]. Vascul Pharmacol, 2015, 74: 38-48. DOI:10.1016/j.vph.2015.05.008.
[14]Yu H, Littlewood T, Bennett M. Akt isoforms in vascular disease [J]. Vascul Pharmacol, 2015, 71: 57-64. DOI: 10.1016/j.vph.2015.03.003.
[15]Lan A, Du J. Potential role of Akt signaling in chronic kidney disease [J]. Nephrol Dial Transplant, 2015, 30(3): 385-394. DOI: 10.1093/ndt/gfu196.
(2017-01-01收稿2017-01-25修回)
(本文編輯 付 輝)
Effects of tacrolimus on the expression of Akt in human hepatocytes line HL-7702
LI Haoyan, ZHANG Xuemei, AN Jun, ZHANG Shaofeng, WANG Hongyu, GAO Fei, MA Yonghua, and XU Chun.
Department of Endocrinology, General Hospital of Chinese People's Armed Police Force, Beijing 100039, China
Corresponding author: XU Chun, E-mail: wjxuchun@sohu.com
ObjectiveThe study aimed to investigate the effects of tacrolimus (FK506) on the expression of Akt, a key site of insulin signalling pathway in human hepatocytes line (HL-7702), thereby exploring the molecular mechanisms of hyperglycemia induced by FK506.MethodsHL-7702 cells in logarithmic growth phase were selected and divided into three treatment groups and one control group. The three treatment groups were respectively treated with different concentrations of FK506 (0.1, 1, 5 mg/L) for 24 hours, the control group was cultured for 24 hours with equal amount of medium. The expression of Akt protein and its phosphorylation level were detected by western blot, and the activity of protein phosphatase 2A (PP2A) was measured by means of PP2A kit.ResultsThe expression of Akt and the level of phosphorylation of Akt (Ser473) had no significant change in each group, the difference of the other phosphotylation of Akt (T308) was statistically significant (F=5.657, P=0.022) among all the groups; The treatment group with the concentration of tacrolimus 5 mg/L was significantly higher as compared to the control group (P=0.037); With the increase of FK506 concentration, the PP2A activity was increased to a certain degree, but the difference was not statistically significant (F=0.857, P=0.501).ConclusionsFK506 can increase the phosphorylation level of Akt in HL-7702, which may not be related to PP2A.
Akt; tacrolimus; insulin resistance; post-transplantation diabetes mellitus
R587.1
10.13919/j.issn.2095-6274.2017.03.007
武警總醫院科研項目(WZ20130104)
100039 北京,武警總醫院內分泌科
徐 春,E-mail:wjxuchun@sohu.com

