蘆葦蒸汽爆破加酶水解制備低聚木糖的條件優化
孟煜+唐婉瑩+韓士群
摘要:為探索蘆葦資源化利用──生成低聚木糖的方法,采用蒸汽爆破預處理蘆葦秸稈再輔以酶解制取低聚木糖的方式,分別考察不同壓力下直接爆破及加堿處理爆破的汽爆效果,同時探究最佳預處理物料制備低聚木糖的酶解條件。研究結果表明,蒸汽爆破可以有效破壞蘆葦纖維形態,加堿爆破的蘆葦纖維斷裂更為明顯;加堿爆破后還原糖、可溶性總糖、低聚木糖溶出量較低,但木聚糖的含量相對較高,更為適合低聚木糖的生產。選取加堿爆破蘆葦原料生產低聚木糖的最佳酶解條件為固液比1 g ∶10 mL、溫度45 ℃、pH值4.8、加酶量5%(占蘆葦干物質量比)、酶解時間 24 h,所得低聚木糖可達蘆葦干物質量的14.0%;在最佳酶解條件下,得到的低聚木糖主要成分為木二糖,在24 h達到最大值,占蘆葦干物質量的12.3%;同時還含有少量的木三糖,含量在18 h達到最大值,可達到蘆葦干物質量的1.7%。
關鍵詞:蘆葦;資源化利用;蒸汽爆破;酶解;低聚木糖
中圖分類號:S564+.201 文獻標志碼:A
文章編號:1002-1302(2016)11-0445-05
我國目前擁有大量蘆葦資源,太湖就有超過100 km的岸線生長蘆葦。據王丹等報道,太湖濕地整個生長季,蘆葦地上生物量最大值能達到2 219.46 g/m2。但絕大部分蘆葦收割后無處利用被肆意堆放,或者被大量焚燒,造成嚴重的環境問題[1]。相關研究表明,蘆葦中主要成分為棕纖維素和木質素,木聚糖能占到棕纖維素含量的30%左右,可作為低聚木糖的生產原料[2]。眾多學者都進行了制備低聚木糖的研究,許曉燕等進行了從花生殼中制取低聚木糖的相關研究[3],段永忠等探究了利用甘蔗渣制取低聚木糖的方法[4],王遠等從麥麩中成功得到了低聚木糖[5],但是關于利用蘆葦原料制取低聚木糖的方法還未見相關報道。
關于從農林植物中提取木聚糖的研究,Sasaka提出用直接高溫蒸煮提取法來制取木聚糖提取液,但其中副反應較多,提取液中還原糖與總糖之比較低,不利于低聚木糖的生產[6];劉寶亮等采用稀堿溶液浸泡或者同時將浸泡液升高到一定溫度來提取木聚糖,但此方法需要耐腐蝕的設備,還需要解決堿水廢液污染環境的問題,生產成本較高[7];邵佩蘭等采用稀酸溶液一定溫度預浸后高溫蒸煮的方式來制取木聚糖[8],但是酸法提取也存在較大缺點,副反應較多,不易于控制調節反應程度,易產生糠醛等雜質,不利于產品后續精制提純。蒸汽爆破能在不添加多余化學藥品的情況下將木聚糖從從植物纖維中有效分離出來,大大提高酶解制取低聚木糖的效率[9]。目前,蒸汽爆破處理結合酶法[10-14]生產低聚木糖是研究的重點。
本研究采用蒸汽爆破預處理提取木聚糖的方法,以爆破后蘆葦秸稈為原料,使用渣液混合加酶水解的方法生產低聚木糖,對蒸汽爆破預處理條件及水解相關參數進行研究,以還原糖量、可溶性總糖量、水解率、平均聚合度(DP)來綜合評價酶解過程。在此基礎上,結合高效液相色譜來準確分析酶解液中低聚木糖含量,為蘆葦工業化利用提供技術依據。
1 材料與方法
1.1 試驗材料
蘆葦原料來自于蘇州太湖,自然條件下風干,粉碎至 3~8 cm;酶解原料:蘆葦在一定壓力下蒸汽爆破所得;內切木聚糖酶,南京奧多福尼生物科技有限公司,酶活為6.0×104 U/g;木糖標準品,上海晶純生化科技股份有限公司;木二糖、木三糖標準品,日本和光純藥工業株式公社;其他試劑均為國產分析純。
1.2 主要儀器
自制蒸汽爆破設備,主要由蒸汽發生器、汽爆罐和接收器組成;S-4800透射電鏡(SEM),賽默飛世爾科技公司;722N可見分光光度計,上海科學精密儀器有限公司;高效液相色譜儀(配備2414示差折光檢測器),Waters科技有限公司。
1.3 試驗方法
1.3.1 蘆葦蒸汽爆破處理
將經過粉碎的蘆葦秸稈連續加入到自制蒸汽爆破機中,在一定壓力的蒸汽爆破機中維壓 15 min 后瞬間泄壓出料,所得爆破物料經烘干處理后備用。
1.3.2 蘆葦蒸汽爆破酶解液制備
將蒸汽爆破后烘干的蘆葦樣品經植物粉碎機粉碎,過100目篩,按對應于汽爆蘆葦不同的料液比加入去離子水,用檸檬酸-磷酸二氫鈉緩沖液調節pH值,然后加入一定量的內切木聚糖酶(以相對于絕干蘆葦的質量百分比計)在一定溫度的水浴鍋中進行酶解反應。酶解一段時間后,沸水浴15 min滅酶,待冷卻后經布氏漏斗抽濾并洗滌濾餅3次,把所得液體轉移至100 mL容量瓶中并定容至刻度,得到蘆葦酶解液。
1.3.3 酶水解因素條件篩選
選取固液比、溫度、初始pH值、加酶量、酶解時間5個因素,通過測定還原性糖、總糖、低聚木糖含量及計算水解率、聚合度(DP)來確定最佳酶解條件。
1.3.3.1 固液比
在固定加酶量5%(相對于蘆葦干物質量)、pH值5.0、溫度50 ℃、酶解時間24 h酶解條件下,研究固液比分別為1 ∶8、1 ∶9、1 ∶10、1 ∶11、1 ∶12(g ∶mL)對酶解效果的影響。
1.3.3.2 溫度
在固定固液比1 g ∶10 mL、加酶量5%、pH值5.0、酶解時間24 h條件下,研究溫度分別為35、40、45、50、55 ℃對酶解效果的影響。
1.3.3.3 初始pH值
將固液比固定為1 g ∶10 mL、加酶量5%、溫度固定為50 ℃、酶解時間24 h,分別考察pH值分別為4.4、4.6、4.8、5.0、5.2對酶解效果的影響。
1.3.3.4 加酶量
保持固液比1 g∶10 mL、pH值5.0、溫度50 ℃、酶解時間24 h,研究加酶量分別為1%、3%、5%、7%對酶解效果的影響。
1.3.3.5 酶解時間
在保持固液比1 g ∶10 mL、pH值5.0、溫度50 ℃、加酶量5%的條件下,研究酶解時間分別為6、12、18、20、24、26、28 h對酶解效果的影響。
1.4 分析方法
1.4.1 蘆葦汽爆物料掃描電鏡分析
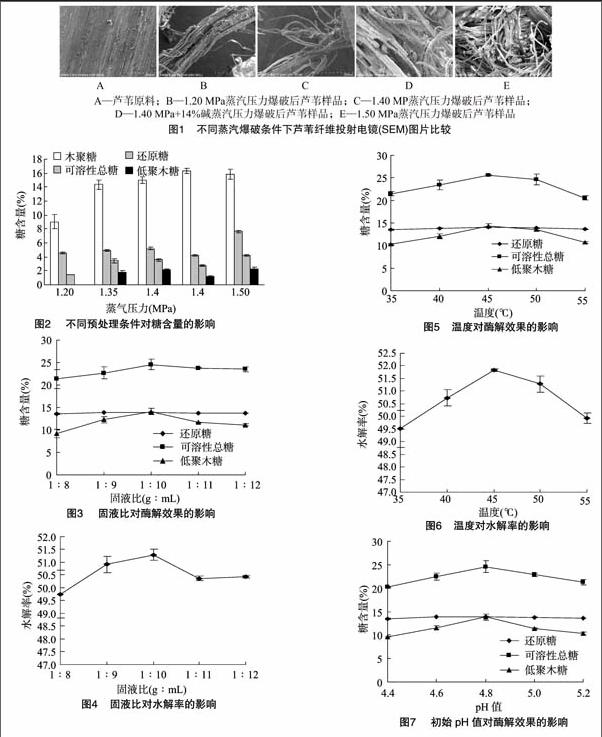
將汽爆條件分別為 1.20、1.35、1.40、1.50、1.40 MPa加14%堿下爆破得到的蘆葦物料干燥后進行掃描電鏡分析。
1.4.2 木聚糖含量測定
地衣酚-鹽酸法[15]測定木聚糖含量。
1.4.3 酶解液中還原糖(RS)含量測定
3,5-二硝基水楊酸比色法(DNS法)[16]測定還原糖含量(以木糖計)。
1.4.4 酶解液中可溶性總糖(TS)含量測定
苯酚-硫酸法[17-18]測定可溶性總糖含量。
1.4.5 水解率、平均聚合度(DP)的計算
水解率=不同反應時間樣品還原糖量初始樣品總糖含量-初始還原糖量×100%;
平均聚合度(DP)=提取液可溶性總糖含量提取液還原糖含量×100%(用玉米芯等作物含有的木聚糖來制取低聚木糖時,最佳聚合度一般控制在1.7~1.8[19])。
1.4.6 低聚木糖含量測定
高效液相色譜法[20](HPLC)色譜條件:色譜柱:SHODEX UGAR KS-802,300 mm×8 mm×6 μm;流動相:高純水;柱溫:80 ℃;示差檢測器溫度:water2414檢測器,溫度50 ℃;流速:0.8 mL/min;進樣量:10 μL。
[BT1+*5]2 結果與分析
2.1 不同汽爆條件對蘆葦纖維及糖溶出的影響
從圖1-A可以看出,未經任何處理的蘆葦原料纖維致密緊實,表面排列較有規律。通過圖1-A與圖1-B、圖1-C、圖1-D、圖1-E的圖片對比可以發現,經過蒸汽爆破預處理后,蘆葦纖維由原先較為平整光滑變為多處出現斷裂,參差不齊;通過圖1-B、圖1-C、圖1-E的圖片對比還可以發現,爆破蒸汽壓力從1.20 MPa增加至1.50 MPa,蘆葦纖維斷裂程度越來越深;同時,通過圖1-C、圖1-D圖片對比可以發現,在相同壓力1.40 MPa條件下,加堿爆破后蘆葦纖維斷裂程度更加明顯。
不同汽爆預處理測定物料中木聚糖、可溶性總糖、還原性糖、低聚木糖含量見圖2。隨著蒸汽爆破壓力從1.20 MPa增大至1.50 MPa,還原糖、可溶性總糖、低聚木糖、木聚糖含量都隨之增加。同時,還可以發現1.40 MPa加堿爆破后還原糖、可溶性總糖含量較低,但加堿爆破可以得到更多的游離木聚糖,達16.03%,更有利于后續酶解產生低聚木糖。
2.2 爆破蘆葦物料酶水解條件
2.2.1 固液比
從圖3可以看出,隨著固液比的增加,總糖、低聚木糖含量都是先增加后下降,還原性糖雖然在增加,但不太明顯,這可能是由于低聚木糖酶優先水解長鏈木聚糖,產生木四糖、木五糖或者更長鏈的木聚糖。從圖4可以看出,隨著固液比的增加,水解率先增大后減小,在固液比1 g ∶10 mL時達到最大值,為51.28%,此時聚合度(DP)達到1.7,在最佳生產低聚木糖范圍內。綜上所述,選擇固液比1 g ∶10 mL作為最佳酶解條件。
2.2.2 酶解溫度
從圖5、圖6可以看出,可溶性總糖、還原糖、低聚木糖含量和水解率均隨溫度升高表現先升高后降低的趨勢,當溫度達到45 ℃時達到峰值,分別為 25.56%、14.04%、20.08%、51.84%,聚合度在45 ℃時達到1.8,在最佳生產低聚木糖的范圍內。因此,45 ℃是最佳的酶解溫度。
2.2.3 酶解液pH值
從圖7、圖8可以看出,還原糖、可溶性總糖、低聚木糖的含量及水解率的數值均隨初始pH值升高表現先升高后降低的趨勢,當反應體系初始pH值為4.8時數值達到峰值,分別為24.59%、13.92%、19.00%、51.28%,在45 ℃時聚合度為1.8,也在最佳生產低聚木糖的聚合度范圍內。因此,pH值為4.8是最佳初始條件。
2.2.4 加酶量
從圖9、圖10可以看出,隨著加酶量的增加,還原糖、總糖、低聚木糖含量都在上升,當加酶量從5%增至7%時,可溶性總糖含量略有增加,還原糖含量反而有所下降, 同時低聚木糖含量也略有下降。水解率也隨著加酶量的增加而上升,當加酶量為7%時水解率比5%有所下降。因此,5%為合適的酶添加量。
2.2.5 酶解時間的影響
從圖11、圖12可以看出,隨著酶解時間的延長,還原糖、總糖、低聚木糖含量在持續增加,三者都在酶解時間為24 h時達到最大值,此時的聚合度為1.7,在適合生產低聚木糖的聚合度范圍內,24 h以后總糖、還原糖含量基本沒有增加,低聚木糖含量反而有所下降,這可能是低聚木糖水解成單糖,這不利于低聚木糖的生產,因此,24 h是最佳的酶解時間。
選取最佳酶解條件即固液比1 g ∶10 mL、溫度50 ℃、初始pH值4.8、加酶量5%、酶水解時間24 h為優化條件進行試驗,測定酶解液中糖含量,結果還原糖含量為 3.51 mg/mL,可溶性總糖含量為6.39 mg/mL,此時平均聚合度為1.8,在最佳生產低聚木糖的DP范圍內;同時采用HPLC分析酶解液中各物質組分,圖譜結果見圖13,酶解液中低聚木糖含有較多木二糖和少量木三糖, 分別占樣品含量的 12.3%、1.7%,低聚木糖的含量占蘆葦干物質量的14.0%,占可溶性總糖含量的54.9%。
2.3 最佳酶解條件下時間對低聚木糖各組分的影響
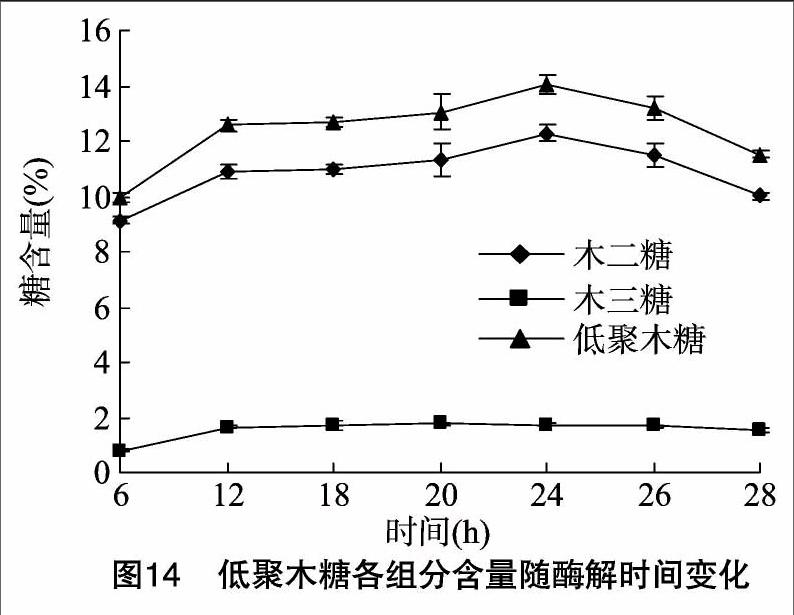
選取最佳酶解條件pH值4.8、加酶量5%、固液比 1 g ∶10 mL、酶解溫度50 ℃,時間選取6、12、18、20、24、26、28 h 7個時段,采用高效液相色譜法分別測定低聚木糖各組分的含量(圖14)。從圖14可以看出,蘆葦物料蒸汽爆破加酶水解后得到的低聚木糖中只含有木二糖、木三糖,木二糖含量遠高于木三糖,表明此酶解方法較適合生產單一低聚木糖——木二糖。
木二糖含量隨著酶解時間延長,表現先增加后減少,在24 h時達到最大值,占干物質量的14.05%,24 h后含量下降;木三糖含量比木二糖含量少,在12 h基本達到最大值,從12~24 h增加了0.13%,24 h后含量緩慢下降。低聚木糖只含有木二糖和木三糖,低聚木糖的含量就是二者之和。低聚木糖含量在24 h時達到最大值,占干物質量的14.05%。
3 討論與結論
低聚木糖是一種具有優異生理學性能和高附加值的新興功能性低聚糖產品,目前,已廣泛應用于醫藥、功能性食品、飼料添加劑等方面[21-23]。楊瑞金等采用干法和濕法蒸煮處理玉米芯連渣一起酶解生產低聚木糖[24],李里特等以蒸汽噴爆法預處理玉米芯得到的汽爆液生產低聚木糖[25]。本研究使用廢棄蘆葦秸稈為原料生產低聚木糖,不僅使生產低聚木糖的原料范圍更加寬闊,而且大大節約了成本。
蒸汽爆破的目的是將物料半纖維素中的木聚糖盡可能與其他物質分開,部分水解游離出來,使之能充分地與木聚糖酶接觸,提高酶解的效率與產物收率[25]。試驗結果表明,蒸汽爆破可以有效破壞蘆葦物料表面形態特征,更有利于與酶進行接觸。傳統酶法制備低聚木糖一般先用堿將木聚糖提取出來然后酶法水解,需要消耗原料干質量60%~120%的堿和較長的提取時間,同時還會產生大量堿液[26-27]。堿性汽爆相比于一般預處理方式更有利于生產低聚木糖,蘆葦物料在堿的作用下木聚糖側鏈乙酰基斷裂,木聚糖以大分子的形式游離出來,因此產生游離單糖較少,更有利于酶解。本研究中選用14%的用堿量進行蒸汽爆破,只需消耗 15 min,爆出物料廢液較少,在最佳條件(固液比1 g ∶10 mL、溫度45 ℃、pH值4.8、加酶量5%、酶解時間24 h)下酶解后,低聚木糖得率能達到14.0%,且低聚木糖中主要含有木二糖,占干物質量的12.3%,還含有少量木三糖,占干物質量的1.7%。本試驗還在此基礎上研究了酶解后低聚木糖單一組分含量隨時間的變化規律,為生產單一組分低聚木糖提供了依據,填補了同類研究的空白。
參考文獻:
[1]王 丹,張銀龍,龐 博,等. 蘇州太湖濕地蘆葦生物量與水深的動態特征研究[J]. 環境污染與防治,2010,32(7):49-54.
[2]唐艷軍,劉秉鉞,李友明,等. 蘆葦化學成分及其化學機械漿性能研究[J]. 林產化學與工業,2006,26(2):69-73.
[3]許曉燕,陳復生,郭東權,等. 酶解花生殼制備低聚木糖的研究[J]. 食品與發酵工業,2007,33(9):118-120.
[4]段永忠,高正卿,黃遵錫,等. 甘蔗渣酶法制備低聚木糖的研究[J]. 甘蔗糖業,2010(3):34-38.
[5]王 遠,歐仕益. 利用麥麩制備低聚木糖的研究[J]. 湖南農業大學學報:自然科學版,2009,35(4):441-445.
[6]吳 彬,馬正智,周 偉,等. 從稻殼中提取制備低聚木糖研究進展[J]. 中國食品添加劑,2009(增刊1):94-100.[HJ1.85mm]
[7]劉寶亮,方桂珍. 從稻殼中提取木聚糖的研究[J]. 林產化學與工業,2005,25(增刊1):121-124.
[8]邵佩蘭,朱曉紅,徐 明,等. 用蒸煮法從玉米芯中提取木聚糖的研究[J]. 寧夏農學院學報,2002,23(1):37-38.
[9]陳洪章. 蒸汽爆破技術的研究[M]. 北京:北京工業出版社,2007:15-16.
[10]Emmel A,Mathias A L,Wypych F,et al. Fractionation of eucalyptus grandis chips by dilute acid-catalysed steam explosion[J]. Bioresource Technology,2003,86(2):105-115.
[11]de Menezes C R,Silva I S,Pavarina E C,et al. Production of xylooligosaccharides from enzymatic hydrolysis of xylan by the white-rot fungi Pleurotus[J]. International Biodeterioration,2009,63(6):673-678.
[12]薛業敏,毛忠貴,邵蔚藍. 利用玉米芯木聚糖酶法制備低聚木糖的研究[J]. 中國釀造,2003(6):7-9.
[13]王東美,劉桂艷,李 春,等. 響應面法優化酶解蒸汽爆破玉米芯產木糖[J]. 林產化學與工業,2010,30(5):76-80.
[14]江正強,陳思思,陶文沂. 以Bacillus pumlis木聚糖酶水解玉米芯制備木寡糖[J]. 食品與發酵工業,2004,30(5):5-9.
[15]Fernei W R,Kin H K. The simultaneous determination of pentoseand hexosein mixtures of sugars[J]. Analyst,1953,78:80-83.
[16]趙 凱,許鵬舉,谷廣燁. DNS法測定還原糖含量的研究[J]. 食品科學,2008,29(8):534-536.
[17]張惟杰. 糖復合物生化研究技術[M]. 杭州:浙江大學出版社,1999:11-12.
[18]Dubois M,Gilles K A,Hamilton J K,et al. Colorimetric method for determination og sugars and related substances[J]. Analytical Chemistry,1956,28(3):350-356.
[19]楊書艷,徐春梅,鄔敏辰. 用玉米芯酸酶法制備低聚木糖的研究[J]. 安徽農業科學,2007,35(12):3651-3653.
[20]何國亮,肖 琳. 低聚木糖的含量測定及方法比較[J]. 食品科技,2007(10):146-149.
[21]周玉恒,陳海珊,蔡愛華,等. 蒸汽爆破對甘蔗葉酶法制備低聚木糖的影響[J]. 食品與發酵工業,2011,32(2):94-97.
[22]李平蘭,江志杰,馬長偉. 長壽老人源雙歧桿菌優良菌株的篩選[J]. 微生物學通報,2005,32(3):7-12.
[23]Donkor O N,Henriksson A,Vasiljievic T,et al. Effect of acidification on the acitivity of probiotics in youghurt during cold storage[J]. International Dairy Jorunal,2006,16(10):1181-1189.
[24]朱 靜,嚴自正. 微生物產生的木聚糖酶的功能和應用[J]. 生物工程學報,1996,12(4):375-378.
[25]李里特,艾志錄,江正強,等. 橄欖綠鏈霉菌E-86產木聚糖酶水解玉米芯汽爆液生產低聚木糖[J]. 食品科學,2004,25(8):87-90.
[26]丁勝華,歐仕益,趙 健,等. 利用蔗渣制備低聚木糖的工藝[J]. 食品研究與開發,2010,31(4):23-27.
[27]Wang Y H,Zhang J C. A novel hybrid process,enhanced by ultrasonication,for xylan extraction from corncobs and hydrolysis of xylan to xylose by xylanase[J]. Journal of Food Engineering,2006,77(1):140-145.

