植物隱花色素及其分子調控機制
王紅霞+郝建梅+丁謙+張一卉+李景娟+高建偉

摘要:藍光受體隱花色素(cryptochrome)對植物生長發育有重要的調節作用,其調節反應主要有去黃化、抑制下胚軸伸長、刺激子葉伸展、促使葉綠體發育、調節光周期、調節生物鐘、促進保衛細胞發育、調節氣孔開度和調控基因表達等。本文概述了近年來植物藍光受體隱花色素及其分子調控機制方面的研究進展。
關鍵詞:植物;隱花色素;分子調控;研究進展
中圖分類號:S184文獻標識號:A文章編號:1001-4942(2017)03-0148-06
AbstractCryptochrome is the blue-light receptor which mediates light regulation in the growth and development of plants, including de-etiolation, inhibition of hypocotyl elongation, stimulation of cotyledon extension, promotion of chloroplast development, photoperiodic control, regulation of circadian clock, stimulation of guard cell development, regulation of stomata opening and gene expression. Here, we summarized the research progresses of plant cryptochromes and their molecular regulation mechanism.
Key wordsPlants; Cryptochrome; Molecular regulation; Research progress
光是影響植物生長發育的一個重要環境因素,它不僅是光合作用的能量來源,同時也是生長發育的信號來源。植物通過光受體介導的光信號轉導途徑來調控自身的生長發育。到目前為止,植物中發現的光受體有兩類:一類是紅光/遠紅光受體光敏色素(phytochrome,PHY),一類是藍光/近紫外光受體隱花色素 (crytochrome,CRY) 和向光素(phototropin,PHOT)。其中藍光受體CRY是重要的光受體,參與調控光形態建成、開花時間、生物節律性、氣孔開放和氣孔發育等重要生理過程[1]。本文將重點綜述近年來在隱花色素功能及其與其它光信號轉導因子相互作用的分子調控機制方面的研究進展。
1隱花色素的結構
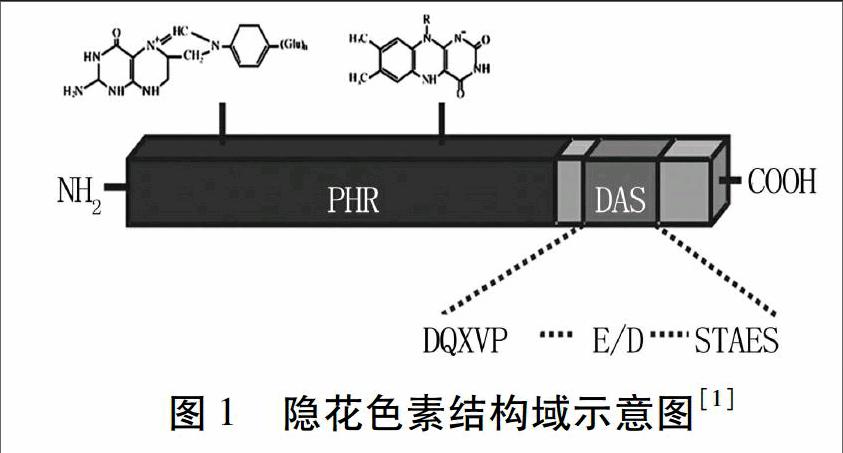
隱花色素包含2個重要結構域(圖1):N端PHR(photolyase-homologous region)結構域,包含500個殘基;C端CCE(cryptochrome C-terminal extension)結構域,具有不同的長度[2-5]。隱花色素與DNA光裂合酶(photolyase)在氨基酸序列、發色團成分以及各自光依賴型的生物化學活性方面都有相似性,但是隱花色素沒有DNA 修復活性[6-9]。
PHR結構域是隱花色素綁定發色團的結構域,它具有與DNA光裂合酶相類似的序列[10]。擬南芥CRY1、CRY2蛋白PHR結構域與FAD(flavin adenine dinucleotide,黃素腺嘌呤二核苷酸)以非共價閉合的方式進行綁定[11-13]。許多與FAD綁定相關的殘基無論是在擬南芥還是人類的隱花色素中都很保守。相反,隱花色素中與葉酸或DNA綁定相關的光裂合酶相似結構域較不保守[6,14,15]。擬南芥CRY1蛋白PHR結構域具有與之功能相適應的特點[3,6]:(1)含3個色氨酸殘基,它們參與光誘導相關的從蛋白表面到FAD的電子傳遞活動;(2)連接環Cys-190與α/β結構域的Cys-80形成一個二硫鍵,參與光誘導的CRY蛋白構象變化;(3)CRY1-PHR結構域與ATP相連接,對擬南芥CRY1蛋白磷酸化有重要作用;(4)CRY1-PHR表面主要含有陰離子,不與DNA結合,因此CRY1蛋白不具有DNA修復的功能。CRY1-PHR表面靜電位與蛋白磷酸化、帶陰電荷的CCE結構域形成靜電排斥,從而引起光誘導下的構象變化。
植物隱花色素CCE結構域具有特異的序列。除衣藻(Chlamydomonas reinhardtii)外,地錢、苔蘚、蕨類直至被子植物的隱花色素CCE結構域都含有DAS(DQXVP-Acidic-STAESSS)[10]。
2隱花色素的生物學功能
目前,人們主要利用擬南芥、水稻等模式植物,通過觀察其基因缺失突變體、基因過表達植株與野生型之間的差異來研究隱花色素的生物學功能。本文根據近年來發表的相關研究結果,將植物隱花色素的生物學功能進行歸納整理,結果見表1[1, 16-29]。
3隱花色素與其它光信號轉導蛋白的互作及其調控機制隱花色素在調控植物生長發育的過程中,與蛋白激酶、泛素連接酶等多種蛋白因子相互作用,共同完成藍光信號轉導的生物學功能。
3.1光敏色素
光敏色素A(phyA)是第一個被發現的與隱花色素相互作用的蛋白[1]。在紅光和遠紅光下,phyA在體內促進隱花色素磷酸化,而CRY蛋白調控幼苗發育的主要生理活動僅在藍光下發生,所以受phyA影響的CRY1蛋白磷酸化反應不是CRY1調控幼苗發育的主要信號轉導機制。CRY2蛋白能與phyB相互作用,這種相互作用影響CRY2蛋白的信號轉導,調控植物的開花時間。phyB還能通過影響CRY1-COP1的互作來調節相關基因的表達,從而抑制植物下胚軸生長[30,31]。
3.2ZTL蛋白
擬南芥含有兩種LOV結構域類型的藍光受體[1]:(1)向光素(photo1和photo2),控制各種向光反應;(2)F-box/Kelch重復蛋白、ZTL(ZEITLUPE)等蛋白,調節生物鐘組分蛋白的降解。ZTL蛋白能與CRY1和phyB在酵母雜交、體外pull-down試驗中相互作用,調節生物鐘和開花時間。
3.3COP1蛋白
COP1蛋白是一種E3連接酶,在植物光形態建成反應和光受體信號轉導過程中起調控作用。
(1)COP1蛋白與CRY蛋白相互作用,參與藍光信號轉導。將隱花色素CCE結構域或CCE結構域的一部分與GUS(β-glucuronidase)報告基因相融合,導入野生型擬南芥中過量表達,轉基因植株與cop1功能缺失突變體相比,表型變化相似,高于80%的基因表達變化也相似[1]。OsCRY1是水稻的藍光受體,有兩個拷貝(OsCRY1a和OsCRY1b)。OsCRY1b的C端可以與OsCOP1互作,同時兩者在細胞中定位在同一位置,說明OsCRY1與OsCOP1直接互作從而介導藍光的信號傳導(http://www.ricedata.cn/gene/list/951.htm)。
(2)CRY蛋白與COP1蛋白以直接或間接的方式相互作用來抑制COP1蛋白的E3連接酶活性,調節其它受光調節蛋白的降解,從而影響植物的生長。COP1蛋白能調控多種蛋白的降解,包括HY5/HYH、LAF1、HFR1、CRY2、phyA、CO和GI等蛋白[1]。
(3)SPA1蛋白參與隱花色素對COP1蛋白的調控。SPA1是COP1的正調控因子,隱花色素與SPA1蛋白相互作用,抑制了藍光下依賴于COP1的轉錄蛋白的降解。Lian等[31]發現擬南芥隱花色素CRY1、CRY2在藍光下均能直接與SPA1相互作用,黑暗下不能與SPA1相互作用。CRY1和CRY2與SPA1在擬南芥原生質體和洋蔥表皮細胞核內均發生共定位。免疫共沉淀(Co-IP)試驗證明,擬南芥CRY1與SPA1只能在藍光下產生相互作用,而在黑暗處理、紅光和遠紅光下都不能產生相互作用。通過對cry1/spa1/spa2/spa3/spa4五突變體、cry2/spa1/spa2/spa3和cry2/spa1/spa3/spa4四突變體的遺傳分析,發現SPA1、SPA2、SPA3和SPA4在遺傳上位于CRY1和CRY2的下游調控光形態建成、氣孔發育和光周期開花時間。藍光誘導的CRY1-SPA1互作能抑制COP1與SPA1的結合,促進COP1-SPA1復合體解離,導致COP1活性下降,其底物HY5蛋白積累增多,最終促進光形態建成。Zuo等[32]證實擬南芥CRY2與COP1互作蛋白SPA1發生了依賴于藍光的直接相互作用。SPA1在藍光照射條件下可抑制開花時間調控因子CONSTANS(CO)的COP1蛋白質水解,藍光依賴的CRY2-SPA1互作促進CRY2-COP1互作。
3.4CIB1蛋白
CIB1蛋白(CRY-interacting bHLH1)是一種bHLH蛋白,能促進植物開花,其功能依賴于隱花色素。CRY2蛋白在藍光下抑制CO蛋白的降解,從而調節植物開花,這種調控作用受CRY2對COP1調節的影響。近年來的研究結果表明,CRY2蛋白與CIB1蛋白相互作用直接調節FT(成花素)的表達;也可以與COP1、CO等蛋白形成復雜的蛋白復合體,共同調控植物開花。CRY2-COP1-CO-FT和CRY2-CIB1-FT的信號轉導途徑相交匯[33]。
3.5PIF蛋白
轉錄因子PIF(phytochrome interacting factor)是一種bHLH蛋白。以往研究表明,黑暗中PIF蛋白活性高,能促進細胞伸長相關基因的表達,引起下胚軸伸長;在紅光/遠紅光下,光敏色素與PIF結合,促進PIF蛋白的降解,進而解除了PIF促進細胞伸長的作用。2016年初,美國索克研究所(Salk Institute for Biological Studies)的Joanne Chory實驗室、中國科學院上海生命科學研究院的劉宏濤實驗室分別在《細胞》、《美國科學院院報》上公布了各自新的研究結果:藍光也通過PIF來調控植物下胚軸伸長[34-36]。
Casal等[34]發現,低光照度藍光照射下,植物藍光受體隱花色素(CRY1/CRY2)能與轉錄因子PIF直接結合,調控PIF的蛋白活性。借助多種突變體,包括pif4、pif5、pif7、pif1/pif3/pif4/pif5、cry1、cry1/pif4和cry1/pif4/pif5突變體,研究了PIF在低光照度藍光下的生物學功能,結果表明:在低光照度藍光照射下,PIF4、PIF5作用于隱花色素下游基因,介導擬南芥下胚軸伸長生長。通過免疫印跡(immunolotting)、免疫共沉淀(co-immunoprecipitation)試驗證明了PIF4和PIF5能直接與CRY1、CRY2相互作用。轉錄組分析結果表明,pif4/pif5突變體差異表達的基因主要與細胞壁修飾、細胞壁發生、細胞生長密切關聯。PIF4/PIF5與CRY2處于同一個基因組位點,CRY2能與PIF4/PIF5的轉錄因子結合來調控低光照度藍光下擬南芥下胚軸伸長生長。以上結果說明,低光照度藍光下,隱花色素能直接與PIF相互作用來調控植物的生長發育。
Ma等[35]發現,藍光抑制溫度升高引起的下胚軸伸長,這一過程依賴于CRY1。CRY1對溫度響應至關重要,cry1缺失突變體對溫度升高敏感,下胚軸伸長顯著;CRY1過表達,轉基因植株對溫度變化不敏感。在藍光照射下,CRY1與PIF4結合能調控PIF4在高溫條件下的轉錄活性,增強生長素合成基因YUC8的表達,促進生長素合成及下胚軸伸長。CRY1和PIF4能直接結合到YUC8等基因的啟動子上,快速調控基因表達。由于PIF4也是光敏色素phyB的受體,所以可以得出結論:PIF4是藍光、紅光/遠紅光和溫度信號轉導途徑交互作用的關鍵節點,藍光、紅光/遠紅光和溫度可以使用同一個PIF4實現功能整合,協同調控植物生長發育。
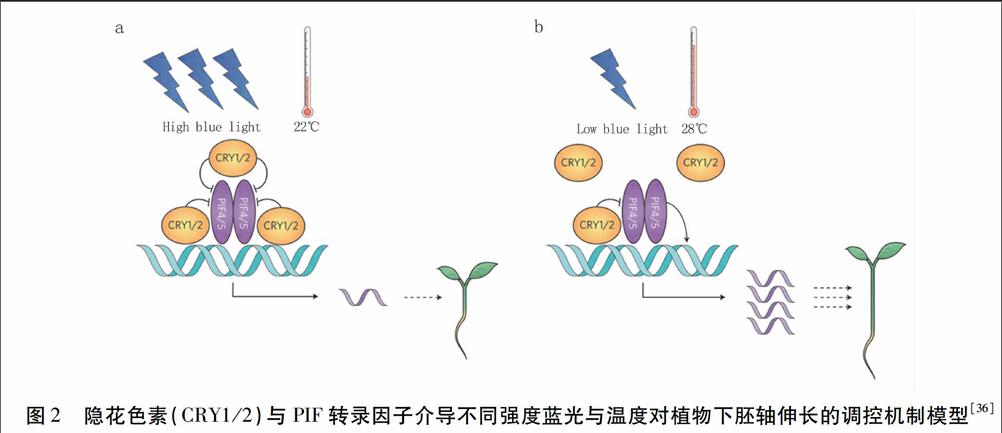
綜合上述兩實驗室的研究結果,得出以下結論:低光照度藍光下,隱花色素與PIF之間的互作主要調控細胞壁合成相關基因的表達;而在高溫下,隱花色素與PIF之間的互作主要調控生長素合成相關基因的表達。因此,隱花色素與PIF之間的互作,在不同環境條件下最后的信號輸出方式是有差異的。為此,Zhu等[36]提出了隱花色素與PIF互作模型:高強度藍光照射或正常溫度條件下,隱花色素與PIF之間的蛋白相互作用強,隱花色素抑制PIF的轉錄因子活性從而抑制下游基因表達,使植物表現為縮短的下胚軸;而在低藍光照度或高溫條件下,隱花色素與PIF之間的蛋白相互作用變弱,從而提高了PIF活性激活下游基因表達,促進下胚軸伸長(見圖2)。
4問題與前景
自1993年首次發現隱花色素以來,人們在植物隱花色素結構、生物學功能、光激發及信號轉導調控機制研究方面取得長足進展[17,37-38]。但是,仍有很多問題亟待人們去解答,如CRY3的生理功能是什么?如何利用隱花色素晶體研究其光誘導下的構象變化機制?依賴藍光的隱花色素蛋白磷酸化/脫磷酸化、泛酸化作用機制是什么?伴隨著對上述問題研究的不斷深入,人們將會從根本上揭示隱花色素對光信號轉導的分子調控機制。
參考文獻:
[1]Yu X, Liu H, Klejnot J, et al. The cryptochrome blue light receptors [J].The Arabidopsis Book, 2010, 8:e0135.
[2]Lin C. Blue light receptors and signal transduction [J]. The Plant Cell, 2002,14: 207-225.
[3]Yu X, Shalitin D, Liu X, et al. Derepression of the NC80 motif is critical for the photoactivation of Arabidopsis CRY2 [J]. Proc. Natl. Acad. Sci. USA, 2007, 104(17): 7289-7294.
[4]Yang H Q, Wu Y J, Tang R H, et al. The C termini of Arabidopsis cryptochromes mediate a constitutive light response [J]. Cell, 2000, 103(5): 815-827.
[5]Rosenfeldt G, Viana R M, Mootz H D, et al. Chemically induced and light-independent cryptochrome photoreceptor activation [J]. Mol. Plant, 2008, 1(1):4-14.
[6]Brautigam C A, Smith B S, Ma Z, et al. Structure of the photolyase-like domain of cryptochrome 1 from Arabidopsis thaliana [J]. Proc. Natl. Acad. Sci. USA, 2004, 101(33):12142-12147.
[7]Klar T, Pokorny R, Moldt J, et al. Cryptochrome 3 from Arabidopsis thaliana: structural and functional analysis of its complex with a folate light antenna [J]. J. Mol. Biol., 2007, 366(3): 954-964.
[8]Pokorny R, Klar T, Hennecke U, et al. Recognition and repair of UV lesions in loop structures of duplex DNA by DASH-type cryptochrome [J]. Proc. Natl. Acad. Sci. USA, 2008, 105(52): 21023-21027.
[9]Hitomi K, DiTacchio L, Arvai A S, et al. Functional motifs in the (6-4) photolyase crystal structure make a comparative framework for DNA repair photolyases and clock cryptochromes [J]. Proc. Natl. Acad. Sci. USA, 2009, 106(17): 6962-6967.
[10]Lin C, Shalitin D. Cryptochrome structure and signal transduction [J]. Annu. Rev. Plant Biol., 2003, 54(1): 469-496.
[11]Malhotra K, Kim S T, Batschauer A, et al. Putative blue-light photoreceptors from Arabidopsis thaliana and Sinapis alba with a high degree of sequence homology to DNA photolyase contain the two photolyase cofactors but lack DNA repair activity [J]. Biochemistry, 1995, 34(20): 6892-6899.
[12]Banerjee R, Schleicher E, Meier S, et al. The signaling state of Arabidopsis cryptochrome 2 contains flavin semiquinone [J]. J. Biol. Chem., 2007, 282(20): 14916-14922.
[13]Bouly J P, Schleicher E, Dionisio-Sese M, et al. Cryptochrome blue light photoreceptors are activated through interconversion of flavin redox states [J]. J. Biol. Chem., 2007, 282(13): 9383-9391.
[14]Lin C, Robertson D E, Ahmad M, et al. Association of flavin adenine dinucleotide with the Arabidopsis blue light receptor CRY1 [J]. Science, 1995, 269(5226): 968-970.
[15]Berndt A, Kottke T, Breitkreuz H, et al. A novel photoreaction mechanism for the circadian blue light photoreceptor Drosophila cryptochrome [J]. J. Biol. Chem., 2007, 282(17): 13011-13021.
[16]Koornneef M, Rolff E, Spruit C J P. Genetic control of light-inhibited hypocotyl elongation in Arabidopsis thaliana (L.) Heynh [J]. Z. Pflanzenphysiol. Bd.,1980, 100(2): 147-160.
[17]Ahmad M, Cashmore A R. HY4 gene of A. thaliana encodes a protein with characteristics of a blue-light photoreceptor [J]. Nature, 1993, 366(6451): 162-166.
[18]Ahmad M, Lin C, Cashmore A R. Mutations throughout an Arabidopsis blue-light photoreceptor impair blue-light-responsive anthocyanin accumulation and inhibition of hypocotyl elongation [J]. Plant J., 1995, 8(5): 653-658.
[19]Lin C, Ahmad M, Cashmore A R. Arabidopsis cryptochrome 1 is a soluble protein mediating blue light-dependent regulation of plant growth and development [J]. Plant J., 1996, 10(5): 893-902.
[20]Lin C, Ahmad M, Gordon D, et al. Expression of an Arabidopsis cryptochrome gene in transgenic tobacco results in hypersensitivity to blue, UV-A, and green light [J]. Proc. Natl. Acad. Sci. USA, 1995, 92(18): 8423-8427.
[21]Mockler T C, Guo H, Yang H, et al. Antagonistic actions of Arabidopsis cryptochromes and phytochrome B in the regulation of floral induction [J]. Development,1999,126(10):2073-2082.
[22]Ahmad M, Grancher N, Heil M, et al. Action spectrum for cryptochrome-dependent hypocotyl growth inhibition in Arabidopsis [J]. Plant Physiol., 2002, 129(2): 774-785.
[23]Blum D E, Neff M M, Van Volkenburgh E. Light-stimulated cotyledon expansion in blu3 and hy4 mutants of Arabidopsis thaliana [J]. Plant Physiol., 1994, 105(4): 1433-1436.
[24]Lin C, Yang H, Guo H, et al. Enhancement of blue-light sensitivity of Arabidopsis seedlings by a blue light receptor cryptochrome 2 [J]. Proc. Natl. Acad. Sci. USA, 1998, 95(5): 2686-2690.
[25]Ma L, Li J, Qu L, et al. Light control of Arabidopsis development entails coordinated regulation of genome expression and cellular pathways [J]. The Plant Cell,2001,13(12):2589-2607.
[26]Nagashima A, Hanaoka M, Shikanai T, et al. The multiple-stress responsive plastid sigma factor, SIG5, directs activation of the psbD blue light-responsive promoter (BLRP) in Arabidopsis thaliana[J]. Plant Cell Physiol.,2004,45(4):357-368.
[27]Guo H, Yang H, Mockler T C, et al. Regulation of flowering time by Arabidopsis photoreceptors [J]. Science, 1998, 279(5355): 1360-1363.
[28]Mao J, Zhang Y C, Sang Y, et al. A role for Arabidopsis cryptochromes and COP1 in the regulation of stomatal opening [J]. Proc. Natl. Acad. Sci. USA, 2005, 102(34): 12270-12275.
[29]Kang C Y, Lian H L, Wang F F, et al. Cryptochromes, phytochromes, and COP1 regulate light-controlled stomatal development in Arabidopsis[J]. The Plant Cell, 2009, 21(9): 2624-2641.
[30]Strasser B, Sanchez-Lamas M, Yanovsky M J, et al. Arabidopsis thaliana life without phytochromes [J]. Proc. Natl. Acad. Sci. USA, 2010, 107(10): 4776-4781.
[31]Lian H L, He S B, Zhang Y C, et al. Blue-light dependent interaction of cryptochrome 1 with SPA1 defines a dynamic signaling mechanism [J]. Genes Dev., 2011, 25(10): 1023-1028.
[32]Zuo Z Z, Liu H T, Liu B, et al. Blue light-dependent interaction of CRY2 with SPA1 regulates COP1 activity and floral initiation in Arabidopsis [J]. Curr. Biol., 2011, 21(10): 841-847.
[33]Liu H T, Wang Q, Liu Y W, et al. Arabidopsis CRY2 and ZTL mediate blue-light regulation of the transcription factor CIB1 by distinct mechanisms [J]. Proc. Natl. Acad. Sci. USA, 2013, 110(43): 17582-17587.
[34]Casal J J. Photoreceptor signaling networks in plant responses to shade [J]. Annu. Rev. Plant Biol., 2013, 64(1): 403-427.
[35]Ma D B, Li X, Guo Y X, et al. Cryptochrome 1 interacts with PIF4 to regulate high temperature-mediated hypocotyl elongation in response to blue light [J]. Proc. Natl. Acad. Sci. USA, 2016, 113(1): 224-229.
[36]Zhu Z Q, Lin C T. Photomorphogenesis: when blue meets red [J]. Nature Plant, 2016, 2(2):16019.
[37]Li L,Li X,Liu Y W, et al. Flowering responses to light and temperature [J]. Sci. China Life Sci.,2015, 59(4): 403-408.
[38]Liu Y W, Li X, Liu H T, et al. Multiple bHLH proteins form heterodimers to mediate CRY2-dependent regulation of flowering-time in Arabidopsis[J]. PLoS Genet., 2013, 9(10): e1003861.

