低聚果糖對青春雙歧桿菌生物膜形成的影響①
孫亦心,李 蕊,劉銘珠,薛冰冰,劉思聰,王春敏
(1.佳木斯大學臨床醫(yī)學院,黑龍江 佳木斯 154007;2.佳木斯大學基礎(chǔ)醫(yī)學院微生物教研室,黑龍江 佳木斯 154007)
低聚果糖對青春雙歧桿菌生物膜形成的影響①
孫亦心1,李 蕊1,劉銘珠1,薛冰冰1,劉思聰1,王春敏2
(1.佳木斯大學臨床醫(yī)學院,黑龍江 佳木斯 154007;2.佳木斯大學基礎(chǔ)醫(yī)學院微生物教研室,黑龍江 佳木斯 154007)
目的:探討低聚果糖對益生菌制劑來源的青春雙歧桿菌生物膜形成的影響。方法:采用微量板法和置片法培養(yǎng)青春雙歧桿菌生物膜,應用結(jié)晶紫染色法及活菌計數(shù)法檢測青春雙歧桿菌生物膜。結(jié)果:低聚果糖可使青春雙歧桿菌生物膜形成時間提前24h。結(jié)論:應用益生菌制劑聯(lián)合低聚果糖可提高其生理功能。
青春雙歧桿菌;低聚果糖;生物膜
細菌生物膜是指一種或數(shù)種細菌生長過程中為適應生存環(huán)境,通過分泌胞外多糖和凝膠狀黏液,使細菌相互黏連而形成的膜狀物。是一種與游離狀態(tài)細菌相對應的存在形式[1,2]。細菌生物膜廣泛存在于含水和潮濕的各種表面上,如牙齒上的菌斑,醫(yī)療器械甚至病理狀態(tài)下的人體組織器官,據(jù)專家估計幾乎所有的細菌在一定的條件下都可以形成生物膜[3,4]。致病菌生物膜一旦形成,就具有了極強的耐藥性,如在介入性醫(yī)療器械使用過程中形成菌膜,一般的抗生素和消毒劑很難穿透生物膜的胞外脂多糖基質(zhì)層,為醫(yī)院感染埋下隱患且可成為臨床器械相關(guān)型感染的來源。因此,目前國內(nèi)外對生物膜的研究主要集中在致病菌和環(huán)境微生物的生物膜形成規(guī)律、耐藥機制和清除方法。而對益生菌的生物膜研究較少。本文對益生菌制劑來源的青春雙歧桿菌的生物膜形成能力及添加低聚果糖對其的影響進行初步探討。
1 材料和方法
1.1 材料和儀器
青春雙歧桿菌來源于市售的益生菌制劑-麗珠腸樂復蘇后的純培養(yǎng);低聚果糖,市售;TPY液體培養(yǎng)基(廣東環(huán)凱生物有限公司);1%的結(jié)晶紫溶液;脫脂處理后的滅菌蓋玻片;96孔細胞培養(yǎng)板;KQ-100DA型臺式超聲清洗器(張家港市圣凱電器有限公司);DNM-9606酶標分析儀(北京普朗)。
1.2 方法
1.2.1 青春雙歧桿菌的復蘇、鑒定及培養(yǎng):無菌取麗珠腸樂放入雙歧桿菌復蘇液中復蘇,然后通過革蘭染色及生化鑒定,符合青春雙歧桿菌后,一部分用TPY液體培養(yǎng)基厭氧培養(yǎng)(A菌液),一部分在TPY液體培養(yǎng)基中加入0.5%低聚果糖后厭氧培養(yǎng) (B菌液)。
1.2.2 96孔微量板法培養(yǎng)細菌生物膜及結(jié)晶紫染色法檢測細菌生物膜:調(diào)整A、B菌液的細菌濃度為106cfu/mL后,取200μL上述菌液分別加入96孔板上,每個標本3孔,空白對照孔則加入TPY液體培養(yǎng)基和含有低聚果糖的TPY液體培養(yǎng)基,培養(yǎng)期間每隔24h更換培養(yǎng)液1次,培養(yǎng)結(jié)束后倒出培養(yǎng)基,用滅菌蒸餾水清洗小孔,洗去游離細胞,加入200μL1%結(jié)晶紫作用30min,用蒸餾水漂洗后加入200μL95%的乙醇,溶解附著于生物膜上的染料,所得有色溶液用酶標儀測定590nm處的OD值(D值),以未接種的TPY液體培養(yǎng)基和含有低聚果糖的TPY液體培養(yǎng)基分別做空白對照(Dc值),細菌形成生物膜能力判斷方法:無生物膜形成能力D≤Dc;弱生物膜形成能力Dc
1.2.3 置片法培養(yǎng)細菌生物膜及超聲活菌計數(shù)法檢測細菌生物膜: 用15mm×15mm的蓋玻片,經(jīng)脫脂處理后再用磷酸鹽緩沖液清洗干凈,自然晾干滅菌后分別放入無菌培養(yǎng)皿中分別加入25~30mL含有106cfu/mL青春雙歧桿菌的A菌液和B菌液 ,在37℃下分別厭氧培養(yǎng)24h、48h、60h及72h后,無菌取出培養(yǎng)的蓋玻片放入帶蓋子的無菌玻璃瓶中,每個玻璃瓶中放入20mL無菌生理鹽水,經(jīng)一定功率超聲8min后,取1mL放入無菌平皿內(nèi),然后倒入40℃左右的BS培養(yǎng)基15~20mL進行活菌計數(shù)。
1.3 統(tǒng)計學方法
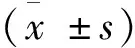
2 結(jié)果
2.1 結(jié)晶紫染色法定量分析細菌生物膜形成能力
青春雙歧桿菌在A、B兩種培養(yǎng)液內(nèi)分別厭氧培養(yǎng)24h、48h、60h及72h后,A培養(yǎng)液內(nèi)48h才可見弱的生物膜形成能力,60~72h可見中等生物膜形成能力,且60~72h細菌生物膜形成能力無差異;而在B培養(yǎng)液內(nèi)24h就可見弱的生物膜形成能力,48~72h均可見中等生物膜形成能力,且48~72h細菌生物膜形成能力無差異。見表1。
2.2 超聲活菌計數(shù)法檢測細菌生物膜內(nèi)的活菌數(shù)
青春雙歧桿菌在A、B兩種培養(yǎng)液內(nèi)分別厭氧培養(yǎng)24h、48h、60h及72h后,超聲8min后經(jīng)活菌計數(shù)法檢測細菌生物膜內(nèi)的活菌數(shù)。見表2。

表1 結(jié)晶紫染色法定量分析細菌生物膜形成能力的比較±s)
注:*與A培養(yǎng)液Dc值相比(P<0.05);#與A培養(yǎng)液24h相比(P<0.05);△與A培養(yǎng)液48h相比(P>0.05);☆與B培養(yǎng)液Dc值相比(P<0.05);○與B培養(yǎng)液24h相比(P<0.05);※與B培養(yǎng)液48h相比(P>0.05)。

表2 超聲活菌計數(shù)法檢測細菌生物膜內(nèi)的活菌數(shù)±s,cfu/mL)
注:*與A培養(yǎng)液24h相比(P<0.05);#與A培養(yǎng)液48h相比(P<0.05);☆與A培養(yǎng)液24h相比(P<0.05);△與B培養(yǎng)液24h相比(P<0.05)。
3 討論
青春雙歧桿菌為腸道的主要厭氧益生菌,在維持腸道維生態(tài)平衡方面起著重要作用。在人體內(nèi)具有抗腸道細菌感染、抗衰老、抗腫瘤和提高腸黏膜免疫等多方面的生理功能[5~7]。而發(fā)揮上述功能的最基礎(chǔ)機制就是菌群屏障的作用。因此,益生菌制劑在預防和輔助治療腹瀉、炎癥性腸病等疾病中發(fā)揮了重要作用。另外,各種低聚糖類的益生元制劑由于可以特異促進益生菌生長,并較益生菌容易儲存等優(yōu)點也已被廣泛應用。
生物膜是眾多細菌適應外界環(huán)境的一種群體生活方式。由于生物膜復雜的結(jié)構(gòu)特點,使其較單一個體更能適應其所生存的環(huán)境。有研究表明某些雙歧桿菌在生長繁殖過程中可形成生物膜 。且不同來源的雙歧桿菌形成生物膜的能力不同并易受培養(yǎng)基成分等因素的影響[8,9]。因此,本實驗對臨床常用的益生菌制劑-麗珠腸樂來源的青春雙歧桿菌形成生物膜的能力進行初步探討,發(fā)現(xiàn)青春雙歧桿菌在TPY培養(yǎng)液中48h才開始有弱的生物膜形成能力,而在含低聚果糖的TPY培養(yǎng)液中24h就開始有弱的生物膜形成能力,說明低聚果糖可以特異增加雙歧桿菌數(shù)量的同時還可以促進雙歧桿菌生物膜的形成。但該雙歧桿菌與大多數(shù)致病菌12h就可形成生物膜的報道不相符且無論培養(yǎng)液內(nèi)是否添加低聚果糖,該益生菌來源的青春雙歧桿菌均未檢測到強的生物膜形成能力。其原因除與不同菌種遺傳因素及自身生理特點有關(guān)外,還與生活環(huán)境中氧含量有關(guān)。
雙歧桿菌等益生菌是腸道的優(yōu)勢菌群,大量雙歧桿菌吸附于腸黏膜表面形成生物膜,并通過與其它厭氧菌共生形成菌群屏障,通過營養(yǎng)占位、分泌有機酸及過氧化氫、刺激腸黏膜免疫細胞增生和增加SIgA數(shù)量等作用抑制致病菌的黏附、生長,維護腸道健康。其種類和數(shù)量越多說明腸道微生態(tài)環(huán)境越好,腸道微生態(tài)處于平衡狀態(tài),腸道功能越健康。因此,與致病菌形成生物膜意義不同的是益生菌在消化道形成生物膜對機體是有益的,是益生菌發(fā)揮菌群屏障和免疫屏障的基礎(chǔ)。本實驗的青春雙歧桿菌來源于臨床常用的益生菌制劑,說明該益生菌不但通過增加益生菌的數(shù)量發(fā)揮調(diào)節(jié)腸道微生態(tài)平衡的作用,而且還可能通過自身形成生物膜或與其他益生菌共生形成生物膜來發(fā)揮菌群屏障作用,但從該菌在實驗中形成生物膜的時間來看,提示我們臨床應用含雙歧桿菌的益生菌制劑時,最好聯(lián)合應用低聚果糖類的益生元,盡快使服用的益生菌在腸黏膜形成生物膜,使菌群屏障和免疫屏障的作用充分得以發(fā)揮。
[1]戚韓英 ,汪文斌,鄭昱,等.生物膜形成機理及影響因素探討[J].微生物學通報,2013,40(4):677-685
[2]賈文祥.微生物生物膜研究的新進展[J]. 微生物學免疫學進展,2012,40(5):1-9
[3]ParsekMR,SinghPK.Bacterialbiofilms:anemerginglinktodiseasepathogenesis[J].AnnuRevMicrobiol,2003,57 (suppl16):677-701
[4]李京寶,韓峰,于文功.細菌生物膜研究技術(shù)[J].微生物學報,2007,47(3):558-561
[5]王立生,潘令嘉,施理,等.雙歧桿菌的完整肽聚糖對LPS激活裸鼠腹腔巨噬細胞功能的影響[J].中華微生物學與免疫學雜志,2000,20(1):4-6
[6]AnnukH,ShchepetovaJ,KullisaarE,etal.Characterizationofintestinallactobacilliasputativeprobioticcandidates[J].JApplMicrobiol,2003,94(3):403-412
[7]王亞洲,王明坤.腸內(nèi)營養(yǎng)加入雙歧因子及雙歧桿菌對燙傷大鼠機體免疫力及炎癥反應的影響[J].黑龍江醫(yī)藥科學,2011,34(2):30-31
[8]徐文生,張艷艷,黃漫清,等.雙歧桿菌在不同材料上形成生物膜的研究[J].中國食品學報,2011,11(3):50-57
[9]徐文生,張艷艷,黃漫清,等.環(huán)境因素對長雙歧桿菌CICC6069生物膜生產(chǎn)的影響[J].中國食品學報,2012,12(4):36-42
黑龍江省大學生創(chuàng)新創(chuàng)業(yè)訓練計劃項目,編號:2014xj09。
孫亦心(1994~)女,黑龍江密山人,在讀本科學生。
王春敏(1966~)女,黑龍江密山人,碩士,教授,碩士研究生導師。E-mail:wangchunmin66@126.com。
R
A
1008-0104(2017)01-0042-02
2015-11-17)

