二維斑點追蹤成像評價QRS時限對射血分數正常的左束支傳導阻滯患者左心室功能及同步性的影響
李光源,馬春燕,王永槐,李 陽,關正宇,金炫佚,楊 軍
(中國醫科大學附屬第一醫院心血管超聲科,遼寧 沈陽 110001)
二維斑點追蹤成像評價QRS時限對射血分數正常的左束支傳導阻滯患者左心室功能及同步性的影響
李光源,馬春燕*,王永槐,李 陽,關正宇,金炫佚,楊 軍
(中國醫科大學附屬第一醫院心血管超聲科,遼寧 沈陽 110001)
目的 探討二維斑點追蹤成像(STE)評估左心室射血分數(LVEF)正常的完全性左束支傳導阻滯(CLBBB)患者不同QRS時限下左心室收縮、舒張功能及同步性的價值。方法 收集LVEF正常的CLBBB患者44例,根據QRS時限分為寬QRS組(QRS>150 ms)和窄QRS組(120 ms≤QRS≤150 ms);另選30名健康體檢者作為對照組。對各組均行常規超聲心動圖及STE檢查。測量并計算左心室整體、室間隔、左心室側壁縱向峰值應變(LS-G、LS-Sept、LS-Lat)、左心室18節段心肌縱向應變達峰時間的標準差(SDt)及左心室舒張功能指標(EDT、E/A、E/e')等。結果 寬QRS組和窄QRS組SDt均大于對照組(P均<0.01),寬QRS組SDt大于窄QRS組(P<0.05)。寬QRS組LVEF和LS-G均小于對照組和窄QRS組(P均<0.05),窄QRS組與對照組間差異無統計學意義(P均>0.05)。寬QRS組和窄QRS組LS-Sept均小于對照組(P均<0.01),寬QRS組LS-Sept小于窄QRS組(P<0.01)。窄QRS組LS-Lat大于對照組和寬QRS組(P均<0.05),寬QRS組與對照組間差異無統計學意義(P>0.05)。寬QRS組和窄QRS組的E/A和EDT均小于對照組(P均<0.05),E/e'大于對照組(P均<0.05);寬QRS組與窄QRS組間,EDT、E/A、E/e'差異均無統計學意義(P均>0.05)。結論 寬QRS的LVEF正常的CLBBB患者左心室收縮、舒張功能及收縮同步性減低,而窄QRS患者左心室收縮功能無明顯減低。
束支傳導阻滯;QRS時限;心室功能,左;超聲心動描記術;應變
完全性左束支傳導阻滯(complete left bundle branch block, CLBBB)是一種電傳導障礙性心律失常,由于左心室延遲激活,導致QRS時限延長,進而可導致心肌機械運動不同步、心臟重構,甚至發展為慢性心力衰竭(chronic heart failure, CHF)。CLBBB患者的預后不盡相同,目前影響預后的因素尚不明確。多中心研究[1-2]表明,CHF合并CLBBB患者的QRS時限是心臟再同步化治療(cardiac resynchronization therapy, CRT)有效應答率的獨立預測因子,但QRS時限對左心室射血分數(left ventricular ejection fraction, LVEF)正常的CLBBB患者左心室功能及同步性是否有影響亦不明確。本研究采用二維斑點追蹤成像(speckle tracking echocardiography, STE)評價LVEF正常的CLBBB患者不同QRS時限下的左心室功能及同步性。
1 資料與方法
1.1一般資料 收集2015年4月—2016年4月于在我院接受常規超聲心動圖及STE檢查的LVEF正常的CLBBB患者44例(病例組),男17例,女27例,年齡29~80歲,平均(58.3±11.2)歲。入選標準:①心電圖QRS時限≥120 ms,在V1、V2導聯呈QS或rS型,在V5、V6、I和aVL導聯QRS波群中部有切跡或頓挫[3];②超聲心動圖LVEF≥52%(男性)或LVEF≥54%(女性)[4]。排除標準:合并高血壓、冠心病、糖尿病、先天性心臟病、瓣膜病、心房顫動、Ⅲ度房室傳導阻滯、肝腎功能不全、超聲心動圖圖像顯示欠佳等。根據標準12導聯心電圖檢查QRS時限,將CLBBB患者分為寬QRS組(QRS>150 ms,n=26)和窄QRS組(120 ms≤QRS≤150 ms,n=18)。同期從我院體檢中心接受常規超聲心動圖及STE檢查的體檢人群中篩選年齡、性別匹配的健康人30名作為對照組。各組臨床資料見表1。
1.2儀器與方法 采用GE Vivid 7型超聲診斷儀,M4S探頭,頻率1.7~3.3 MHz。對各組均行常規超聲心動圖及STE檢查。檢查時囑患者取左側臥位,連接體表心電圖。采集二尖瓣血流頻譜、組織多普勒成像(tissue doppler imaging, TDI)數據及胸骨旁左心室長軸、左心室短軸3切面及心尖3切面動態二維圖像。均采集連續3個心動周期,存盤以備分析,所有測值均取3個心動周期的平均值。
常規超聲心動圖檢測指標包括[5]:左心房收縮末內徑(left atrial end-systolic dimension, LAD)、左心室舒張末內徑(left ventricular end-diastolic dimension, LVEDD)、LVEF。
左心室舒張功能指標包括:二尖瓣口舒張早期和舒張晚期血流速度(E峰和A峰)、E峰減速時間(mitral E wave deceleration time, EDT)、二尖瓣環運動速度(mitral annulus velocity, e'),計算E/A及E/e'比值。
通過EchoPAC 11.2工作站對左心室縱向應變指標進行分析,觀察左心室心尖3切面圖像,于收縮末期手動勾畫左心室心內膜邊界,軟件自動生成ROI,手動調整ROI寬度,使其與左心室心肌厚度一致,軟件自動逐幀追蹤左心室心肌運動。測量左心室各縱向應變指標,包括:反映左心室整體收縮功能的左心室整體縱向應變(left ventricle global longitudinal strain, LS-G);反映室間隔收縮功能的四腔心及三腔心6個節段室間隔整體縱向應變(septal global longitudinal strain, LS-Sept);反映左心室側壁收縮功能的左心室側壁3個節段峰值縱向應變(left ventricle lateral wall global longitudinal strain, LS-Lat)。
計算左心室18節段心肌縱向峰值應變達峰時間標準差(standared deviation of left ventricle 18 segments peak strain time, SDt),分析左心室收縮同步性。
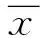
2 結果
通過STE技術共檢測心肌1 332段,追蹤成功1 248段,追蹤成功率93.69%(1 248/1 332)。與對照組比較,病例組LAD、LVEDD、SDt增大,LVEF、LS-G、LS-Sept減小;E/A及EDT減小,而E/e'增大,差異均有統計學意義(P均<0.05),見表2。
2.1左心室收縮同步性比較 寬QRS組及窄QRS組SDt均大于對照組(P均<0.01),且寬QRS組SDt大于窄QRS組(P<0.05),見表3。
2.2左心室收縮功能比較 寬QRS組LVEF和LS-G均小于對照組和窄QRS組(P均<0.05),窄QRS組與對照組LVEF和LS-G差異均無統計學意義(P均>0.05),見表3、圖1。
2.3左心室局部功能比較 寬QRS組和窄QRS組LS-Sept均小于對照組(P均<0.01),且寬QRS組LS-Sept小于窄QRS組(P<0.01)。窄QRS組LS-Lat大于對照組和寬QRS組(P均<0.05),寬QRS組與對照組LS-Lat差異無統計學意義(P>0.05),見表3。
2.4左心室舒張功能比較 與對照組比較,寬QRS組和窄QRS組E/A及EDT均減小(P均<0.05),E/e'增大(P均<0.05)。寬QRS組與窄QRS組EDT、E/A及E/e'差異均無統計學意義(P均>0.05),見表3。
3 討論
CLBBB是一種電傳導障礙性心律失常,由于電激動在左希氏束、左束支主干、左束支分支或左心室蒲肯野纖維接點處發生傳導中斷或延遲,導致左心室電傳導的延遲及不同步,進而可使左心室喪失正常的收縮同步性,甚至可引起左心室功能的惡化[6-7]。部分CLBBB患者LVEF減低,而另一部分患者LVEF正常。目前CLBBB患者預后的影響因素尚不明確,找出其預后影響因素對判斷病情和指導治療均具有重要意義。
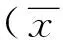
表1 各組臨床資料比較±s)
注:*:與對照組比較,P<0.01;#:與窄QRS組比較,P<0.01
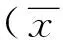
表2 病例組與對照組左心室功能及同步性比較±s)
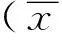
表3 窄QRS組、寬QRS組、對照組左心室功能及同步性比較±s)
注:與對照組比較,*:P<0.05,**:P<0.01;與窄QRS組比較,#:P<0.05,##:P<0.01

圖1 左心室收縮峰值縱向應變曲線圖 A.窄QRS組CLBBB患者,LS-G為-21.52%; B.寬QRS組CLBBB患者,LS-G為-14.39%; C.對照組,LS-G為-22.25%
合并CLBBB的CHF是CRT的適應證[8],QRS時限已被多中心臨床試驗證實為預測CRT反應有效性的因素[9],但QRS時限對LVEF正常的CLBBB患者的影響尚不明確。本研究假設不同QRS時限的CLBBB患者左心室功能及同步性的變化不同,因而參考CRT的適應證[8]將LVEF正常的CLBBB患者分為寬QRS組(QRS>150 ms)和窄QRS組(120 ms≤QRS≤150 ms),探討QRS時限是否是影響CLBBB左心室功能及收縮同步性的因素。應用STE技術可準確評價左心室整體及局部心肌的收縮功能及同步性,并已在臨床廣泛應用[10]。故本研究采用STE技術評價QRS時限對LVEF正常的CLBBB患者左心室功能及收縮同步性的影響。
本研究結果顯示寬QRS組及窄QRS組SDt均大于對照組(P均<0.01),寬QRS組SDt大于窄QRS組(P<0.05),表明CLBBB患者均存在左心室收縮同步性減低,且寬QRS較窄QRS的CLBBB患者減低更明顯,提示CLBBB患者隨QRS時限的延長不同步越顯著。
本研究中,只有寬QRS組左心室整體收縮功能減低,LVEF及LS-G均小于對照組及窄QRS組 (P均<0.05);而窄QRS組左心室整體收縮功能無明顯改變,與對照組相比LVEF及LS-G差異均無統計學意義(P均>0.05),提示寬QRS的CLBBB患者可能預后不良,傾向于發展為CHF。臨床應對這部分患者密切關注,長期隨訪。
發生CLBBB時,由于其電機械的不同步,導致心室間及左心室內壓力梯度異常,進而導致室間隔兩側壓力梯度不平衡,使室間隔產生類似抖動樣運動,同時CLBBB亦可導致室間隔灌注減低,從而引起室間隔收縮功能減低。此外,左心室壓力梯度的異常可使側壁運動代償增強。本研究結果也證實CLBBB患者室間隔收縮功能減低,且寬QRS的CLBBB患者減低更為顯著,寬QRS組和窄QRS組LS-Sept均小于對照組(P均<0.01),且寬QRS組LS-Sept小于窄QRS組(P<0.01)。此外,窄QRS的CLBBB患者左心室側壁收縮功能代償性增強,而寬QRS的CLBBB患者側壁收縮功能則無明顯改變,窄QRS組LS-Lat大于對照組和寬QRS組(P均<0.05),而寬QRS組與對照組LS-Lat差異無統計學意義(P>0.05)。最終導致寬QRS的CLBBB患者左心室整體收縮功能減低,而窄QRS患者則無明顯減低。此外,本研究還顯示CLBBB患者左心室舒張功能減低,寬QRS組和窄QRS組E/A及EDT均小于對照組(P均<0.05),E/e'大于對照組(P均<0.05)。
心電圖QRS時限為左心室除極過程,當發生CLBBB時,患者左心室電激活順序發生改變,導致左心室部分室壁發生延遲激活,左心室電機械收縮不同步,QRS時限的延長。左心室收縮的不同步性導致其等容收縮期及等容舒張期延長,而射血時間及充盈時間縮短,左心室無效泵功能增加,左心室回心血量及排血量下降,從而可影響左心室收縮及舒張功能,QRS時限越長,心室功能受到影響越嚴重。
本研究具有一定的局限性,未進行長期的隨訪,需在今后的研究中進一步完善。
總之,LVEF正常的CLBBB患者存在左心室收縮同步性減低,且寬QRS的CLBBB患者(QRS>150 ms)左心室收縮功能減低,提示QRS時限可能是導致CLBBB患者預后不良的主要因素,臨床對寬QRS的CLBBB患者需長期密切隨訪。
[1] Risum N, Strauss D, Sogaard P, et al. Left bundle-branch block: The relationship between electrocardiogram electrical activation and echocardiography mechanical contraction. Am Heart J, 2013,166(2):340-348.
[2] Brignole M, Auricchio A, Baron-Esquivias G, et al. 2013 ESC guidelines on cardiac pacing and cardiac resynchronization therapy: The task force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Europace, 2013,15(8):1070-1118.
[3] Surawicz B, Childers R, Deal BJ, et al. AHA/ACCF/HRS recommendations for the standardization and interpretation of the electrocardiogram: PartⅢ. Intraventricular conduction disturbances: A scientific statement from the American Heart Association Electrocardiography and Arrhythmias Committee, Council on Clinical Cardiology; the American College of Cardiology Foundation; and the Heart Rhythm Society. Endorsed by the International Society for Computerized Electrocardiology. J Am Coll Cardiol, 2009,53(11):976-981.
[4] Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: An update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr, 2015,28(1):1-39.
[5] Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: An update from the American Society of Echocardiography and the European Assocication of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging, 2015,16(3):233-270.
[6] Breithardt G, Breithardt OA. Left bundle branch block, an old-new entity. J Cardiovasc Transl Res, 2012,5(2):107-116.
[7] Dhingra R, Pencina MJ, Wang TJ, et al. Electrocardiographic QRS duration and the risk of congestive heart failure: The Framingham Heart Study. Hypertension, 2006,47(5):861-867.
[8] Cohen MI. Heart Failure Summit Review: Cardiac re-synchronisation therapy in the failing heart. Cardiol Young, 2015,25(Suppl 2):124-130.
[9] Deniz A, ?zmen ?, AktaH, et al. Electrocardiographic markers of left ventricular systolic dysfunction in patients with left bundle branch block. Kardiol Pol, 2016,74(1):25-31.
[10] 馬春燕,李楠,劉爽,等.二維斑點追蹤檢測心肌跨壁應變梯度在非ST段抬高型心肌梗死中的應用.中國醫學影像技術,2013,29(2):217-220.
Application of real-time three-dimensional transthoracic echocardiography in patients with functional mitral regurgitation
DONGJuan,KANGChunsong*,WANGHuan,MIAOJunwang,XUEJiping,YANGQingmei
(TheThirdDepartmentofUltrasound,ShanxiAcademyofMedicalsciences,DayiHospitalofShanxiMedicalUniversity,Taiyuan030032,China)
Objective To investigate the structural and functional changes of mitral valve in patients with functional mitral regurgitation (FMR) by real-time three-dimensional transthoracic echocardiography (RT-3D-TTE). Methods RT-3D-TTE were performed on 70 patients with at least moderate mitral regurgitation (FMR group; including 35 cases of ischemic cardiomyopathy [ICM] subgroup and 35 cases of dilated cardiomyopathy [DCM] subgroup) and 30 normal controls (control group). The mitral valve parameters were analyzed by TomTec assessment software to detect dynamic changing pattern of mitral valve size and shape during cardiac systole. The differences of parameters between control group and FMR group were compared. The parameters included mitral annulus structural parameters: Anterior-posterior (AP), anterolateral-po-steromedial (AL-PM), sphericity (SPI; SPI=AP/AL-PM), annular circumference (AC), commissural diameter (CD), nonplanarity angle (NPA), annular height (AH), tenting height (TH), tenting volume (TV), three-dimensional annular area (AA3D); dynamic parameters: Maximum annular displacement (ADmax), maximum annular displacement velocity (ADVmax). Results The mitral valve parameters present phasic variation law in FMR group. Compared with control group, AH, ADmaxand ADVmaxwere smaller and the other parameters were larger than those in FMR group (allP<0.05). Compared with control group, AH, ADmaxand ADVmaxwere smaller and the other parameters were larger than those in both ICM subgroup and DCM subgroup (allP<0.05). Compared with ICM subgroup, AH was smaller in DCM subgroup (P<0.05), there was no statistical difference in ADmaxand ADVmaxbetween ICM subgroup and DCM subgroup (P>0.05), the rest parameters were greater in DCM group (allP<0.05). Conclusion RT-3D-TTE can be used to quantitatively assess the structural and functional changes of mitral valve in patients with FMR and provide a reference for the clinical treatment of FMR.
Echocardiography; Three-dimensional; Mitral valve insufficiency
10.13929/j.1003-3289.201608126
R541; R540.45
A
1003-3289(2017)03-0325-05
董娟(1978—),女,山西運城人,碩士,主治醫師。研究方向:心血管超聲診斷。E-mail: dongjuan545@163.com
康春松,山西醫學科學院 山西醫科大學附屬大醫院超聲科,030032。E-mail: kangchunsong2005@sina.com
2016-08-03
2016-11-28

