基于醫學影像學的3D打印技術在心血管疾病診療中的應用現狀及研究進展
宋宏寧,郭瑞強
(武漢大學人民醫院超聲影像科,湖北 武漢 430060)
基于醫學影像學的3D打印技術在心血管疾病診療中的應用現狀及研究進展
宋宏寧,郭瑞強*
(武漢大學人民醫院超聲影像科,湖北 武漢 430060)
3D打印技術作為一種快速成型技術,近年來在心血管領域應用廣泛。3D打印模型的制作有多種方式,不同的成型方式有各自的優缺點。在先天性心臟病、心臟瓣膜病、大血管病變、心律失常的診療過程中3D打印發揮著重要的作用。本文基于醫學影像學的3D打印技術在心血管疾病診療中的應用現狀和研究進展進行綜述。
3D打印;心血管疾病;醫學影像學
3D打印技術是近年來興起的一項快速成型技術,其優勢為快速、可定制化、可重復性。在心血管疾病的個體化診療過程中,3D打印技術正在發揮日益重要的作用。本文對3D打印技術在心血管疾病中的應用現狀和研究進展進行綜述。
1 3D打印技術簡介及實現過程
3D打印技術是一種快速成型技術,也被稱為疊加制造(additive manufacturing, AM),其定義為將未成型的材料疊加至已成型的固態材料表面從而制造出一個立體的空間模型。3D打印技術應用于醫療領域可以追溯到20世紀90年代初[1]。最近幾年,隨著材料學和工程學的進步,才獲得較快的發展。
醫學3D打印模型的獲取基于符合醫學數字成像和通信(digital imaging and communications in medicine, DICOM)的圖像,實現心血管3D打印主要有以下步驟(圖1):①醫學影像圖像數據的獲取;②圖像處理,提取ROI,分離出需要重建和打印的部分,該過程被稱為分割;③將容積數據轉化為3D打印識別的三角網格模型;④將數字模型輸入3D打印機進行打印。
1.1 心血管3D打印的影像數據源 準確可靠的影像學數據是獲得精確3D打印模型的基礎。目前臨床常用的心臟影像學檢查包括CT、心臟磁共振(cardiac magnetic resonance, CMR)和超聲心動圖檢查。
CT作為常用的心血管檢查方式,具有較高的空間分辨率和密度分辨率,在多數臨床研究中為心臟模型獲得的數據源。由于心臟由肌肉及結締組織構成,其內部密度差異在CT平掃的條件下很難清晰顯示,采用CT血管造影可以增強心內結構的顯示。在造影模式下,CT圖像高密度顯示的內容為心臟腔室及血管,因而CT是心腔與血管結構3D打印的首選數據來源,但并非所有心臟結構或所有患者均適合使用心臟CT作為源數據,在心臟軟組織或心臟瓣膜的顯示中,CMR較心臟CT有一定的優勢[2]。同時,隨著超聲心動圖技術的發展,經胸及經食管三維超聲心動圖的空間分辨率和時間分辨率顯著提高,三維超聲心動圖也被證實可以作為3D打印的可靠來源[3]。
由于心臟是一個結構相對復雜的器官,使用單一數據源可能并不能獲取心臟復雜的解剖信息全貌。最新的研究[4-5]中,使用多種數據源進行融合成像并進行3D打印,顯著提高了心臟內復雜解剖細節的顯示效果,為結構性心臟病介入及手術治療術前準備提供了更全面的信息。
1.2 醫學3D圖像的分割與處理 分割是將用于3D打印的ROI從圖像中分離出來的圖像后處理過程,精確地分割是獲得準確模型的基礎。通過特定的軟件可對醫學DICOM圖像進行分割,常用的數據處理軟件包括Mimics、OsriX、MeshLab等[6-8]。
閾值分割是3D圖像分割最重要的方法,通過設定特定的密度閾值,保留圖像中特定密度閾值范圍的信息,同時去除密度范圍以外的圖像內容[7]。在心臟CT血管造影圖像中,設定分割閾值為對比劑密度可以快速地分離心臟、大血管及冠狀動脈。閾值分割決定ROI的范圍,因而閾值的確定是決定分割精確度的重要因素。由于不同患者不同時相心臟密度值均有差別,因而需針對每一患者進行個體化閾值分割。在閾值分割不能完全分離的區域,同時需要輔助交互式分割等方法進行心血管圖像的進一步處理。分割后的圖像需進一步經過網格生成獲得容積圖像表面模型,進而獲得可以被打印機識別的數據格式。目前最常用的3D打印數據格式為標準鑲嵌語言(standard tessellation language, STL)數據格式[9]。
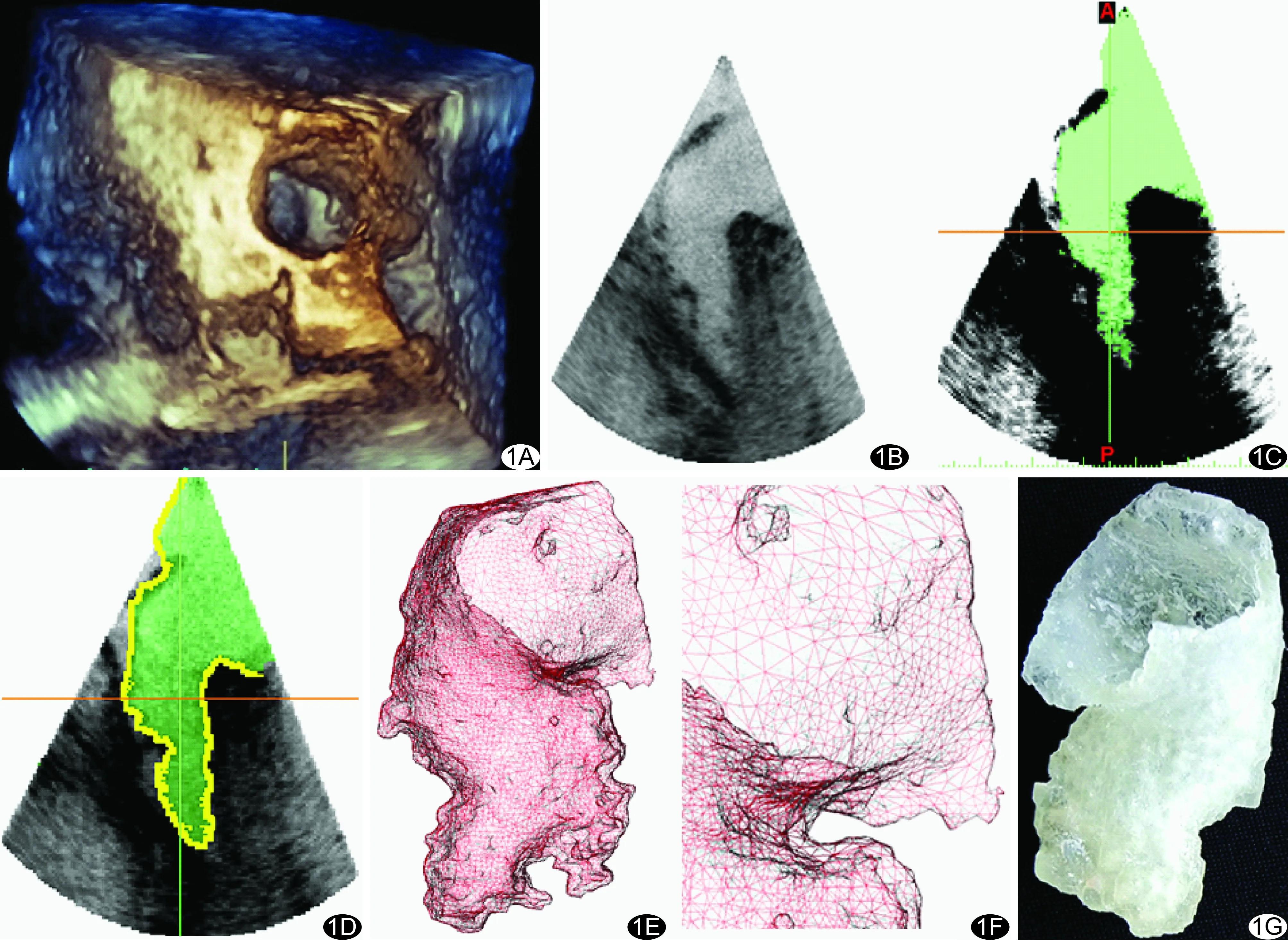
圖1 基于超聲心動圖的3D打印模型獲取步驟 A.獲取超聲DICOM圖像; B、C.閾值分割; D.圖像后處理; E、F.網格生成; G.生成3D打印模型
1.3 3D打印模型的制作及打印方式 3D打印模型的制作一般經過3個步驟:模型獲取、3D打印及打印后處理。打印機將獲取的3D數字模型分割為多層2D圖像,類似計算機斷層掃描的顯示方式,然后使用3D打印機逐層成型,進而獲得空間立體的3D打印模型。3D打印模型的材質及成型方法有多種,現階段常用于醫學領域的打印方式主要有以下幾種。
(1)熔融沉積成型(fused deposition modeling, FDM):將熱熔材質加熱到液態,通過計算機控制的擠壓噴頭噴涂建造每層模型,通過每層材質的堆積建立空間立體模型。目前,FDM是最廣泛應用的3D打印方式,通過調整加熱溫度和噴頭的參數,可以使用多種材質進行打印。但FDM存在打印精度較低,材質耐熱性差,對于軟性材質打印效果不佳的缺點。
(2)選擇性激光燒結(selective laser sintering, SLS):是使用紅外激光器作能源,將粉末狀材料有選擇地進行燒結,逐層進行,最終獲取立體打印模型的一種AM方法。SLS工藝簡單,材料選擇范圍廣,成本較低,且可用柔性材質打印,但其精度一般,設備昂貴,且打印過程中有環境污染的危害[10]。
(3)光固化快速成型(stereolithography, SLA):使用液態光敏樹脂進行快速成型,這種材料在激光照射下可快速凝為固體。使用計算機控制激光對液態光敏樹脂表面進行照射,同時液體容器逐漸下降,在已經成型的固體表面繼續凝結,進而獲得空間立體模型[11]。SLA可以快速精確地獲取3D打印模型,但光敏樹脂種類較少,成本很高,強度一般,無法完成較大體積模型的快速成型。
(4)聚合物噴射成型(PolyJet):是目前軟性材料快速成型的主要方法之一,與SLA相似,同樣使用光敏樹脂進行成型,但PolyJet使用噴頭將光敏樹脂和支撐聚合物同時噴射到工作臺,再使用紫外線照射,完全凝固后再噴涂下一層。由于支撐材料的存在,光敏樹脂可以在完全不受力的狀態下凝固成型,對于軟性材料的支持較其他打印方式具有很大優勢。
(5)生物材料打印:使用細胞或其他生物活性的材質進行打印,并使用特殊的黏合劑進行粘連,最終實現具有生物活性的組織、器官的快速成型。這種打印方式尚處于實驗室研究階段,與臨床應用尚有一段距離[12-15]。
由于以上打印方式各具特點,針對特定的臨床需求可使用不同的打印技術進行快速成型。
2 3D打印在心血管診療中的應用現狀
3D打印最初應用于臨床是對復雜心血管病變進行體外再現,使外科或介入醫師更直觀地了解心臟及大血管結構的病變,從而進行更充分的術前準備。隨著技術的發展,3D打印在心血管診療中正在發揮更多的作用,包括臨床訓練、醫學教育、個性化診療方案的制定甚至直接參與疾病的治療過程。
2.1 先天性心臟病 復雜先天性心臟病的術前準備需要對心臟解剖結構的準確評估。以往心外科醫師主要通過超聲和其他影像學文字描述了解心臟病變情況,即使通過CT容積再現或3D超聲圖像也很難將解剖信息完全傳達給心外科醫師。同時,一些解剖畸形本身就難以描述[16],需更為準確形象的表達方式。3D打印模型可使外科醫師接觸到完整的影像學數據,且并不需要額外的學習時間,可極大地提高外科醫師術前對心臟解剖結構的認知。
CT、超聲和MR均可獲取心臟解剖結構,根據不同需求和研究對象可使用不同的影像學方法。2006年,Noecker等[17]應用CT數據采集11例嬰幼兒的心臟3D數據,并進行3D打印,成功獲取了所有患兒的心臟腔室模型,證實了心臟數據3D打印的可行性。2008年Kim等[18]對4例結構性心臟病患者進行3D打印,通過CT數據獲得心臟模型,成功實現了房間隔缺損、室間隔缺損、人工瓣周邊漏及主動脈假性動脈瘤的體外重建模型。在模型中進行模擬操作,實現了個性化治療方案的制定。
Greil等[2]采用多排心臟CT和CMR對5例先天性心臟病患者進行心臟掃描并使用SLA方法獲得高分辨率3D打印模型,證實CMR可以與CT一樣獲得滿意的3D模型。同時,SLA 3D打印的精度(約0.15 mm)高于MDCT及MR的掃描精度,其打印過程不會降低影像學成像的精度,獲得打印成品的測量誤差為(0.27±0.76)mm,可以實現對影像學數據的空間再現。
超聲心動圖是診斷先天性心臟病最常用的工具,對心內結構的顯示有較大優勢。隨著三維超聲心動圖(three dimensional echocardiography, 3DE)的發展,超聲圖像分辨率提高,經胸及經食管3DE開始成為心臟3D打印的數據來源。Olivieri等[3]對9例先天性心臟病患者進行3DE掃描重建,獲得3D打印模型,證實基于超聲的3D打印模型的誤差小于1 mm。
由于心臟是一個組織結構復雜的器官,不同影像學對不同組織結構的顯示各有優勢。Gosnell等[4]使用心臟CT和3DE對心腔血池和瓣膜分別成像,并通過軟件后處理進行拼接處理,獲得了心臟融合成像的模型,CT具有較高的密度分辨率和空間分辨率,而3DE對心內軟組織及瓣膜的顯示更有優勢。在先天性心臟病診療中使用多種影像技術進行拼接成像進行3D打印,將對完整心臟結構的顯示提供更有指導意義的臨床資料。
2.2 心臟瓣膜病 隨著心臟瓣膜修復手術技術和瓣膜介入治療的發展,術前準確評估心臟瓣膜的病變部位和程度對選擇合理的治療方式日益重要。3D打印在心臟瓣膜疾病的評估和治療中也發揮著重要作用。
房室瓣的3D模型重建多采用3DE作為數據源,Mahmood等[19]使用經后處理的二尖瓣圖像成功重建了正常二尖瓣、二尖瓣狹窄及二尖瓣脫垂時的二尖瓣空間模型,對二尖瓣修復提供了重要的依據。Witschey等[20]使用經食管3DE對4例不同二尖瓣病變的患者進行三維重建,獲得了滿意的二尖瓣空間形態模型。二尖瓣裝置包括瓣膜、瓣環、腱索等,對二尖瓣瓣環的準確評估是二尖瓣外科手術的重要依據。Owais等[21]使用三維超聲心動圖及3D打印技術獲得了二尖瓣瓣環的立體模型,達到了快速、準確、形象地評估二尖瓣瓣環的目的。
經導管主動脈瓣置入術(transcatheter aortic valve implantation, TAVI)是治療主動脈瓣病變尤其是高齡患者主動脈瓣關閉不全的重要方法。TAVI創傷小、恢復快,但易出現瓣周漏等并發癥,需進行充分的術前準備和術中監測[22]。由于TAVI需評估主動脈瓣、主動脈竇及升主動脈情況,心臟CT血管造影是最適合的3D打印數據源。Ripley等[23]使用基于心臟CT的主動脈根部數據獲得3D打印模型,在模型中植入主動脈瓣并進行周邊漏評估,證實在術前可使用3D打印技術對TAVI術后并發癥進行一定程度的預測,進而可優化手術進程、減少并發癥的發生。Fujita等[24]對1例病情復雜的TAVI患者術前進行主動脈根部3D打印重建,在模型中進行模擬導管操作及影像學顯像,證實對該患者可以進行TAVI手術,從而規避了可能存在的風險。
基于3D打印的成型方式,細胞、組織均可以作為打印材料進行快速成型。生物學材料的優勢在于可以最大程度地再現正常生理狀態下心臟瓣膜的結構和功能,因此快速成型的人工生物瓣膜是3D打印研究的熱點。使用3D打印獲得支架并在表面進行細胞培養或直接使用細胞進行AM成型均可獲得具有一定形態功能的心臟瓣膜結構。Yamanami等[25-26]使用快速成型技術基于硅膠材料制作的主動脈瓣閥門樣裝置已經成功植入家兔體內,并具有類似生物主動脈瓣的功能,Kishimoto等[27]使用結締組織制作的無支架心臟瓣膜結構植入山羊體內也被證實存在理論上的可行性。但所有生物打印的研究均處于實驗室階段,距臨床應用仍有較長一段距離。
2.3 大血管疾病 3D打印技術對于復雜主動脈疾病也具有重要的指導意義。Schmauss等[28]報道1例罕見的主動脈瘤手術,主動脈擴張由升主動脈延伸至降主動脈,采用3D打印技術獲得了主動脈全程的三維模型,最終決定使用主動脈弓部血管置換及降主動脈支架的手術方式,并最終取得成功。Sodian等[29]應用3D打印模型定制了一種線圈栓塞裝置,成功地通過介入治療封堵1例主動脈弓置換患者的手術縫合部位的殘余漏。在主動脈夾層、腹主動脈瘤等各種大血管疾病的個性化治療中,3D打印也起到了重要的作用。由于CT血管造影在空間分辨率和密度分辨率的優勢,在大血管疾病3D打印中,CT是最主要的數據源[30-31]。
2.4 心律失常 心律失常患者雖然一般不涉及心臟結構異常,但3D打印仍有一定的作用,Bauch等[32]基于CT成像獲得了心臟希氏束的空間形態,從而達到優化起搏器電極位點的作用。在心房顫動患者中,3D打印發揮著更為重要的作用。由于心房顫動,左心耳內易形成血栓導致腦卒中及其他部位栓塞[33-34]。因而經導管左心耳封堵是防止心房顫動并發癥的重要方法。左心耳形態結構復雜多變,對左心耳形態進行準確評估是手術順利進行的保障。基于心臟CT或3D TEE可獲得左心耳的3D打印模型,對模型進行空間形態評估和封堵器模擬釋放有助于確定術中使用封堵器大小、型號以及封堵方案的制定[35-36]。
3 3D打印的局限性
雖然3D打印在心血管疾病診療中的作用日益凸顯,但關于3D打印的作用,仍存有爭論。Mathur等[37]指出,3D打印模型基于影像學數據獲得,然而打印模型的獲取過程需要經過多個后處理步驟,每一步后處理環節均可能導致最終成型的模型與原始數據差別增大。而使用未經處理的圖像數據則很難獲得滿意的模型。同時3D打印自身仍存在一些的缺陷,如3D打印材料的物理性狀無法完全模擬心肌硬度等。由于心臟是一個不斷運動的器官,如何使用靜態的模型準確模擬動態的心臟仍是3D打印在心血管應用的局限。
在工藝時間和打印成本方面,2013年Tam等[38]報道打印一個腹主動脈瘤的經濟成本為200~500美元,加上前期檢查耗時約10 h。隨著技術的發展和普及,3D打印的物料成本已有極大的減低,但建造一個精度較高的模型仍需花費較多的人力、物力。而打印出的模型除用于“觀看”和術前演練外還有何種潛在臨床價值,需進一步探討。
4 3D打印的發展趨勢與展望
3D打印技術由于其快速直觀的特點,可以在心血管疾病的術前準備中起重要的作用。隨著技術的發展,這一作用將會進一步加強。隨著影像學技術和材料科學技術的發展,心血管3D打印的精度和仿真程度將會不斷提高。因此,3D打印在術前模擬仿真程度會有巨大的進步,同時隨著虛擬現實和增強現實技術的日益完善,有望與3D打印技術相結合,在心臟手術模擬及教學過程中將會發揮更重要的作用。生物3D打印是目前研究的熱點,且已經實現了部分瓣膜、血管及心肌組織的生物打印[39-40],雖然與臨床應用仍有一段距離,但隨著生物工程技術的發展,材料學、生物學、計算機科學等多學科的交叉合作,生物3D打印獲得的組織器官必將應用于心血管疾病的治療過程。
[1] Sachs E, Cima M, Cornie J, et al. Three-dimensional printing: The physics and implications of additive manufacturing. CIRP Ann-Manuf Technol, 1993,42:257-260.
[2] Greil GF, Wolf I, Kuettner A, et al. Stereolithographic reproduction of complex cardiac morphology based on high spatial resolution imaging. Clin Res Cardiol, 2007,96(3):176-185.
[3] Olivieri LJ, Krieger A, Loke YH, et al. Three-dimensional printing of intracardiac defects from three-dimensional echocardiographic images: Feasibility and relative accuracy. J Am Soc Echocardiogr, 2015,28(4):392-397.
[4] Gosnell J, Pietila T, Samuel BP et al. Integration of computed tomography and three-dimensional echocardiography for hybrid three-dimensional printing in congenital heart disease. J Digit Imaging, 2016,29(6):665-669.
[5] Kurup HK, Samuel BP, Vettukattil JJ. Hybrid 3D printing: A game-changer in personalized cardiac medicine? Expert Rev Cardiovasc Ther, 2015,13(12):1281-1284.
[6] Olszewski R. Three-dimensional rapid prototyping models in cranio-maxillofacial surgery: Systematic review and new clinical applications. Proc Belg R AcadMed, 2013:43-77.
[7] Rosset A, Spadola L, Ratib O. OsiriX: An open-source software for navigating in multidimensional DICOM images. J Digit Imaging, 2004,17(3):205-216.
[8] Cignoni P, Cignoni P, Callieri M, et al. MeshLab: An open-source mesh processing tool. Salerno: Eurographics Italian Chapter Conference, 2008:129-136.
[10] Liu YF, Xu LW, Zhu HY, et al. Technical procedures for template-guided surgery for mandibular reconstruction based on digital design and manufacturing. Biomed Eng Online, 2014, 13:63.
[11] Niikura T, Sugimoto M, Lee SY, et al. Tactile surgical navigation system for complex acetabular fracture surgery. Orthopedics, 2014,37(4):237-242.
[12] Mironov V, Boland T, Trusk T, et al. Organ printing: Computer-aided jet-based 3D tissue engineering. Trends Biotechnol, 2003,21(4):157-161.
[13] Fedorovich NE, Alblas J, Hennink WE, et al. Organ printing: the future of bone regeneration? Trends Biotechnol, 2011,29(12):601-606.
[14] Mironov V, Kasyanov V, Markwald RR. Organ printing: From bioprinter to organ biofabrication line. Curr Opin Biotechnol, 2011,22(5):667-673.
[15] Orlando G, Wood KJ, De Coppi P, et al. Regenerative medicine as applied to general surgery. Ann Surg, 2012,255(5):867-880.
[16] Van Praagh R, Van Praagh S. Morphologic anatomy//Fyler DC. Nadas' pediatric cardiology. Philadelphia: Hanley & Belfus, 1992:17-26.
[17] Noecker AM, Chen JF, Zhou Q, et al. Development of patient-specific three-dimensional pediatric cardiac models. ASAIO J, 2006,52(3):349-353.
[18] Kim MS, Hansgen AR, Wink O, et al. Rapid prototyping: A new tool in understanding and treating structural heart disease. Circulation, 2008,117(18):2388-2394.
[19] Mahmood F, Owais K, Taylor C, et al. Three-dimensional printing of mitral valve using echocardiographic data. JACC Cardiovasc Imaging, 2015,8(2):227-229.
[20] Witschey WR, Pouch AM, McGarvey JR, et al. Three-dimensional ultrasound-derived physical mitral valve modeling. Ann Thorac Surg, 2014,98(2):691-694.
[21] Owais K, Pal A, Matyal R, et al. Three-dimensional printing of the mitral annulus using echocardiographic data: Science fiction or in the operating room next door? J Cardiothorac Vasc Anesth, 2014,28(5):1393-1396.
[22] Kapadia SR, Leon MB, Makkar PR, et al. 5-year outcomes of transcatheter aortic valve replacement compared with standard treatment for patients with inoperable aortic stenosis (PARTNER 1): A randomised controlled trial. Lancet, 2015,385(9986):2485-2491.
[23] Ripley B, Kelil T, Cheezum MK, et al. 3D printing based on cardiac CT assists anatomic visualization prior to transcatheter aortic valve replacement. J Cardiovasc Comput Tomogr, 2016,10(1):28-36.
[24] Fujita T, Saito N, Minakata K, et al. Transfemoral transcatheter aortic valve implantation in the presence of a mechanical mitral valve prosthesis using a dedicated TAVI guidewire: Utility of a patient-specific three-dimensional heart model. Cardiovasc Interv Ther, 2016 Aug 27. [Epub ahead of print]
[25] Yamanami M, Yahata Y, Tajikawa T, et al. Preparation of in-vivo tissue-engineered valved conduit with the sinus of Valsalva (type Ⅳ biovalve). J Artif Organs, 2010,13(2):106-112.
[26] Yamanami M, Yahata Y, Uechi M, et al. Development of a completely autologous valved conduit with the sinus of Valsalva using in-body tissue architecture technology: A pilot study in pulmonary valve replacement in a beagle model. Circulation, 2010,122(11 Suppl):S100-S106.
[27] Kishimoto S, Takewa Y, Nakayama Y, et al. Sutureless aortic valve replacement using a novel autologous tissue heart valve with stent (stent biovalve): Proof of concept. J Artif Organs, 2015,18(2):185-190
[28] Schmauss D, Juchem G, Weber S, et al. Three-dimensional printing for perioperative planning of complex aortic arch surgery. Ann Thorac Surg, 2014,97(6):2160-2163.
[29] Sodian R, Schmauss D, Schmitz C, et al. 3-dimensional printing of models to create custom-made devices for coil embolization of an anastomotic leak after aortic arch replacement. Ann Thorac Surg, 2009, 88(3):974-978.
[30] Dickinson KJ, Matsumoto J, Cassivi SD, et al. Individualizing management of complex esophageal pathology using three-dimensional printed models. Ann Thorac Surg, 2015,100(2):692-697.
[31] Tam MD, Laycock SD, Brown JR, et al. 3D printing of an aortic aneurysm to facilitate decision making and device selection for endovascular aneurysm repair in complex neck anatomy. J Endovasc Ther, 2013,20(6):863-867.
[32] Bauch T, Vijayaraman P, Dandamudi G, et al. Three-dimensional printing for in vivo visualization of his bundle pacing leads. Am J Cardiol, 2015,116(3):485-486.
[33] Landmesser U, Holmes DR Jr. Left atrial appendage closure: A percutaneous transcatheter approach for stroke prevention in atrial fibrillation. Eur Heart J, 2012,33(6):698-704
[34] Faletra FF, Pedrazzini G, Pasotti E, et al. 3D TEE during catheter-based interventions. JACC Cardiovasc Imaging, 2014,7(3):292-308.
[35] Otton JM, Spina R, Sulas R, et al. Left atrial appendage closure guided by personalized 3D-printed cardiac reconstruction. JACC Cardiovasc Interv, 2015,8(7):1004-1006
[36] 宋宏寧,周青,鄧傾,等.基于三維經食管超聲的3D打印模型指導左心耳封堵的可行性研究.中華超聲影像學雜志,2016,25(4):294-299
[37] Mathur M, Patil P, Bove A. The role of 3D printing in structural heart disease: All that glitters is not gold. JACC Cardiovasc Imaging, 2015,8(8):987-988.
[38] Tam MD, Laycock SD, Brown JR, et al. 3D printing of an aortic aneurysm to facilitate decision making and device selection for endovascular aneurysm repair in complex neck anatomy. Endovasc Ther, 2013,20(6):863-867.
[39] Gao Q, He Y, Fu JZ, et al. Coaxial nozzle-assisted 3D bioprinting with built-in microchannels for nutrients delivery. Biomaterials, 2015,61:203-215.
[40] Gaetani R, Doevendans PA, Metz CH, et al. Cardiac tissue engineering using tissue printing technology and human cardiac progenitor cells. Biomaterials, 2012,33(6):1782-1790.
R445
A
1003-3289(2017)03-0375-06

