保腎沖劑對系膜增生性腎小球腎炎大鼠腎組織內質網應激相關蛋白葡萄糖調節蛋白78表達的影響※
賈秀琴 楊繼紅 李映紅 郭文鵬 李利民 楊 敏
(廣東省深圳市第二人民醫院中西醫結合研究所,廣東 深圳 518035)
保腎沖劑對系膜增生性腎小球腎炎大鼠腎組織內質網應激相關蛋白葡萄糖調節蛋白78表達的影響※
賈秀琴 楊繼紅1李映紅 郭文鵬2李利民 楊 敏
(廣東省深圳市第二人民醫院中西醫結合研究所,廣東 深圳 518035)
目的 觀察保腎沖劑對系膜增生性腎小球腎炎(MsPGN)大鼠腎臟的保護作用及內質網應激(ERS)相關蛋白葡萄糖調節蛋白78(GRP78)表達的影響,探討其作用機制。方法 將21只雄性SD大鼠隨機分為造模組(14只)及空白對照組(7只)。造模組大鼠予尾靜脈注射抗大鼠胸腺細胞抗血清(ATS)建立MsPGN模型,造模成功后再隨機分為模型組及中藥組,每組7只。中藥組給予保腎沖劑藥液灌胃,空白對照組和模型組予等容積0.9%氯化鈉注射液灌胃,連續14周。實驗結束后,觀察比較各組大鼠治療前后24 h尿蛋白定量(24 h UTP)及血肌酐(Cr)水平變化,并檢測大鼠腎組織內GRP78蛋白及基因表達水平情況。結果 治療前中藥組及模型組大鼠24 h UTP及Cr水平均明顯高于空白對照組(P<0.05),治療后中藥組大鼠24 h UTP及Cr水平較模型組均明顯降低(P<0.05);模型組及中藥組大鼠治療后GRP78蛋白及基因表達水平IOD值均明顯高于空白對照組(P<0.05),但中藥組大鼠治療后GRP78蛋白及基因表達水平IOD值均低于模型組(P<0.05)。結論 MsPGN大鼠腎臟組織GRP78表達增高,提示ERS可能參與其腎臟損害過程,而中藥保腎沖劑對MsPGN模型大鼠腎臟具有一定的保護作用,可減輕大鼠腎功能損害,降低大鼠24 h UTP及Cr水平,降低GRP78蛋白及基因表達水平,從而起到治療作用,且抑制ERS相關蛋白GRP78的過度表達可能是其減輕腎功能損害的重要作用機制靶點之一。
腎小球腎炎,膜增生性;動物,實驗;大鼠;中藥療法
系膜增生性腎小球腎炎(mesangial proliferative glomerulonephritis,MsPGN)是原發性腎小球疾病中最常見的腎小球病變,是我國相關患者導致終末期腎病的主要原因之一,因此對MsPGN的研究倍受關注[1-3]。目前,MsPGN的發病機制尚不完全明確,近年來越來越多的研究證實,內質網應激(endoplasmic reticulum stress,ERS)在許多疾病的發生發展過程中具有重要作用,過強或者過長時間的ERS都可引起細胞凋亡[4-6],而腎臟細胞中具有發達的內質網,慢性腎炎狀態下ERS激活的刺激因素大大增加,所以ERS與慢性腎炎腎損害的關系值得探討[7]。本研究擬通過建立大鼠MsPGN模型,觀察中藥保腎沖劑對MsPGN模型大鼠的治療作用,并通過測定大鼠24 h尿蛋白定量(24h UTP)、血肌酐(Cr)及ERS標志分子——葡萄糖調節蛋白78(GRP78)[8]水平變化,探討其可能的作用機制。
1 材料與方法
1.1 動物 2個月齡清潔級SD雄性大鼠21只,體質量(200±10)g,由湖北省實驗動物研究中心提供,實驗動物生產許可證號:SCXK(鄂)2015-0018。實驗期間自由飲水,室溫20~24 ℃,相對濕度40~50%。
1.2 藥物 保腎沖劑由生地黃、山藥、山茱萸、澤瀉、黨參、黃芪、丹參、白花蛇舌草、黃柏、茯苓、益母草及甘草等藥物組成,所有中藥材均購自廣東省深圳市北京同仁堂藥店,常規水煎,濃縮成含原藥材1.962 g/mL,4 ℃冷藏保存備用。抗大鼠胸腺細胞抗血清(ATS)的制備:取4~6周齡大鼠胸腺細胞,純化為單胸腺細胞,調整細胞水平至5×107/L,成為單胸腺細胞懸液,與完全福氏佐劑做1∶2體積混合,按每只5×107/L個細胞量將胸腺細胞多點皮下注射免疫新西蘭兔,然后每隔2周按每只家兔1×107/L細胞經耳靜脈直接注射加強免疫,共加強免疫3次,末次免疫1周后,間接免疫熒光測ATS的效價結果為1∶2 000時,表明ATS制備成功。第7周采血,4 ℃冷藏析出血清,并經大鼠新鮮紅細胞及肝細胞吸附,分裝后于-20 ℃保存,使用時56 ℃水浴30 min滅活補體。
1.3 試劑與儀器
1.3.1 試劑 尿蛋白定量測試盒,南京建成生物工程研究所提供;GRP78抗體,武漢維諾賽生物技術有限公司提供。
1.3.2 儀器 微型高速離心機,美國Labnet公司;電熱恒溫培養箱,日本ASONE株式會社;全自動酶標儀,美國Thermo Fisher Scientific公司;RM 2016輪轉式切片機,德國Leica公司;BX53型生物顯微鏡,日本奧林巴斯株式會社;ABI7900型實時熒光定量PCR儀,北京東勝創新生物科技有限公司。
1.4 實驗方法
1.4.1 造模 全部大鼠購回后適應性喂養1周,并檢測尿蛋白定性(-)后,隨機分為造模組(14只)及空白對照組(7只)。造模組大鼠予尾靜脈注射ATS 1 mL/100 g,1周1次,共注射4次。注射結束1 d后查大鼠尿蛋白,如尿蛋白(+++)即可判定為模型成功。空白對照組大鼠正常飼養。
1.4.2 分組及給藥 將14只造模組大鼠隨機分為中藥組及模型組,各7只。中藥組給予保腎沖劑藥液灌胃2 mL/只,每日1次,連用14周。空白對照組及模型組予等容積0.9%氯化鈉注射液灌胃,每日1次,連用14周。
1.5 觀察指標及方法
1.5.1 腎臟病理檢查 各組大鼠均在實驗第14周末采集留取血液標本后,用3%戊巴比妥鈉(20 mg/kg)腹腔內注射麻醉后處死,并迅速切取左腎,去掉被膜,置于質量分數0.04多聚甲醛固定,進行蘇木精-伊紅(HE)法染色,并在光鏡下觀察腎臟形態學改變。
1.5.2 24 h UTP及Cr檢測 各組大鼠造模治療前1 d及造模治療14周后收集24 h尿液,進行24 h UTP測定。在造模治療前1 d及造模治療14周后經股動脈取血,采用全自動生化分析儀檢測血Cr水平變化。
1.5.3 GRP78蛋白表達 采用蛋白質免疫印跡(Western Blot)觀察各組大鼠腎組織GRP78蛋白表達水平。取大鼠腎組織碎塊80 mg加400 μL單去污劑裂解液于勻漿器中勻漿,置冰上,重復碾至盡量碎,裂解30 min后,將裂解液移至1.5 mL離心管中,4 ℃以12 000 r/min離心5 min,取上清分裝于0.5 mL離心管中并置于-20 ℃保存。將制備好的蛋白樣品加入5%及10%凝膠中電泳,轉膜,5%脫脂奶粉封閉2 h,加入一抗(1∶2 000),4 ℃孵育過夜,TBST洗滌緩沖液洗膜(5 min×6次),加入二抗(1∶50 000),37 ℃搖床孵育2 h,TBST洗滌緩沖液洗膜(5 min×6次),電化學發光(ECL)顯影。蛋白條帶采用Bandscan軟件進行分析,將GRP78 的積分光密度(IOD)值與所對應樣品的β-actin IOD值進行比較,分析GRP78蛋白表達水平。
1.5.4 GRP78基因表達 采用逆轉錄-聚合酶鏈反應(RT-PCR)觀察各組大鼠腎臟GRP78基因表達水平。取-80 ℃冰箱中保存的新鮮冰凍腎組織,加入1 mL總RNA抽提試劑(Trizo),用勻漿器研磨成漿,移至無核糖核酸酶(RNase)的1.5 mL EP管中,裂解10 min。加入200 μL氯仿,混勻后室溫放置5 min。4 ℃以12 000 r/min離心15 min。轉移上層水相(約400 μL)于另一新1.5 mL EP管中,加入400 μL異丙醇,混勻后室溫靜置10 min。離心后棄上清,加入無RNase的75%乙醇1 mL,混勻后再離心。棄上清,空氣中干燥RNA沉淀5~10 min后溶于20 μL焦碳酸二乙酯(DEPC)水中。將總RNA放于-80 ℃冰箱內保存以備用。以提取的RNA為模板合成cDNA,反應體系:總RNA 2.322 μg,Oligo (dT) 15(10 μM) 2 μL,以DEPC水補足容積到8.5 μL,85 ℃水浴5 min,置于冰上。加入5×Hiscript Buffer 4 μL,2.5 mM脫氧核糖核苷三磷酸(dNTP)4 μL,Hiscript逆轉錄酶1 μL,核糖核酸酶抑制因子(Ribonuclease Inhibitor) 0.5 μL,總體積為20 μL,25 ℃水浴5 min,50 ℃水浴15 min,85 ℃水浴5 min后置于冰上10 min,-20 ℃保存備用。引物合成委托北京擎科新業生物技術有限公司完成。GRP78 (195 bp)包括正義鏈5'-ACGACCCCTGACAAAAGACA-3'和反義鏈5'-GTCAGGCGGTTTTGGTCATT-3',β-actin (240bp)包括正義鏈5'-CACGATGGAGGGGCCGGACTCATC-3'和反義鏈5'-TAAAGACCTCTATGCCAACACAGT-3'。以cDNA為模板進行PCR擴增,反應體系見表1。蛋白表達條帶采用Bandscan軟件進行分析,將GRP78 mRNA的IOD值分別與所對應樣品的β-actin的IOD值進行比較,分析其表達水平。

表1 RT-PCR反應體系
2 結 果
2.1 各組大鼠治療后腎組織GRP78蛋白及基因表達水平IOD值比較 見表2。

表2 各組大鼠治療后腎組織GRP78蛋白
與空白對照組比較,*P<0.05;與模型組比較,△P<0.05
由表2可見,模型組及中藥組大鼠治療后GRP78蛋白及基因表達水平IOD值均高于空白對照組,比較差異均有統計學意義(P<0.05);中藥組大鼠治療后GRP78蛋白及基因表達水平IOD值均低于模型組,比較差異均有統計學意義(P<0.05)。
2.2 各組大鼠治療后腎臟形態學比較 模型組大鼠腎小球彌漫肥大,腎小球內系膜細胞和基質增多,基底膜增厚,腎小球囊腔狹窄,可見有包氏囊粘連,腎小管上皮細胞腫脹,部分腎小管萎縮或擴張,部分腎小管腔內可見粉染無結構物,部分腎小管上皮細胞基底膜增厚,腎間質有炎性細胞浸潤,小葉間動脈管壁輕度增厚。中藥組大鼠部分腎小球肥大,腎小球內系膜細胞和基質輕度增多,基底膜輕度增厚,部分腎小球囊腔輕度狹窄,部分腎小管上皮細胞基底膜輕度增厚,腎間質小灶狀炎性細胞浸潤,小血管未見明顯異常。空白對照組大鼠腎組織結構無異常。表明模型組大鼠腎組織發生明顯病理損害,中藥組大鼠腎臟病理損害有一定程度減輕,見圖1。
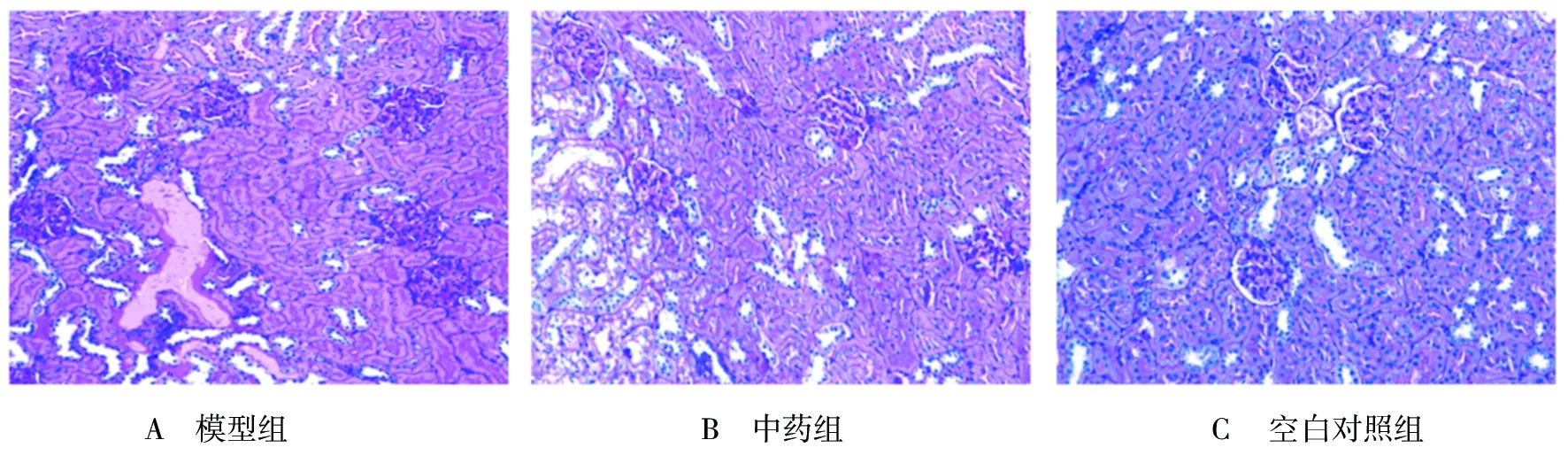
圖1 各組大鼠腎臟病理組織檢查結果(HE×200)
2.3 各組大鼠治療前后24 h UTP 及Cr水平變化比較 見表3。
表3 各組大鼠治療前后24 h UTP 及Cr水平變化比較
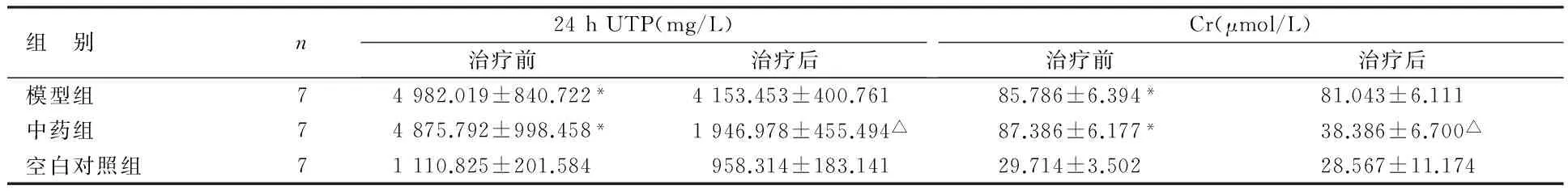
組 別n24hUTP(mg/L)治療前治療后Cr(μmol/L)治療前治療后模型組74982.019±840.722*4153.453±400.76185.786±6.394*81.043±6.111中藥組74875.792±998.458*1946.978±455.494△87.386±6.177*38.386±6.700△空白對照組71110.825±201.584958.314±183.14129.714±3.50228.567±11.174
與空白對照組治療前比較,*P<0.05;與模型組治療后比較,△P<0.05
由表3可見,治療前,中藥組及模型組大鼠24 h UTP及Cr水平均高于空白對照組,比較差異均有統計學意義(P<0.05);治療后,中藥組大鼠24 h UTP及Cr水平均低于模型組,比較差異均有統計學意義(P<0.05)。
3 討 論
MsPGN病變可導致腎小球硬化并最終出現腎衰竭,嚴重影響患者健康,并產生高額的醫療費用,目前對其發病機制的認識尚不完全,近年來越來越多的研究證實,ERS在其發生發展中發揮著重要作用[9]。ERS作為機體自身的一種內源性保護防御機制,是細胞對外界刺激因素的適應性反應,在維持細胞生存或細胞凋亡平衡中具有重要作用,一定程度的內質網應激反應可以激活內質網分子伴侶等保護因子的表達,保護細胞抵抗應激[10]。但是反應過強或持續時間過長即可引起細胞功能失調,甚至細胞死亡等病理現象,故ERS具有重要的生理及病理意義。腎臟細胞具有發達的內質網,從腎臟細胞的結構和功能分析,腎臟具有發生ERS的條件和基礎。目前關于ERS與慢性腎炎腎損害的具體實驗證據尚不充分,針對ERS及其信號傳導通路在腎臟疾病發病中的作用進行研究,可能為尋找腎臟疾病新的防治靶點提供新思路和新方向[11]。
GRP78是內質網一種特異的分子伴侶,屬于熱休克蛋白70家族,是內質網穩態的感受器,在檢測內質網中未折疊蛋白質的聚集和ERS的激活過程中發揮重要作用。GRP78在應激狀態下可通過解離調節ERS相關跨膜信號感受器活性,被廣泛認為是ERS激活的標志分子[12],GRP78表達異常可明顯加重ERS引起的細胞損傷[13],高血糖、蛋白尿等引起的腎實質細胞凋亡中均有ESR的參與[14]。本實驗結果顯示,與空白對照組比較,模型組GRP78蛋白及基因表達水平IOD值均明顯升高(P<0.05),病理觀察結果也顯示模型組大鼠腎臟呈現腎小球彌漫肥大,腎小球內系膜細胞和基質增多,基底膜增厚,腎小球囊腔狹窄,可見有包氏囊粘連,腎小管上皮細胞腫脹,腎間質有炎性細胞浸潤,小葉間動脈管壁輕度增厚,可以判斷模型組出現了MsPGN的病理改變。
MsPGN屬中醫學腰痛、水腫等范疇,本病病情表現復雜,病程冗長,其病機特點多為本虛標實,虛實夾雜。本虛表現以脾腎氣陰兩虛、腎絡空虛為主,標實主要表現為濕熱、瘀血、濁毒郁滯腎絡,正虛與邪實互為因果相互影響[15]。保腎沖劑正是針對本病腎絡空虛、瘀濁阻滯病機,采用六味地黃湯加減而成。方中生地黃、山茱萸滋補肝腎;黨參、黃芪、茯苓、澤瀉補益脾腎,利水消腫;山藥補脾澀精固腎;白花蛇舌草解毒化濁;丹參活血化瘀;黃柏滋陰清熱燥濕;益母草活血利水;甘草和中解毒。諸藥合用,共奏益氣養陰、活血祛濁通絡之功[16]。本實驗結果顯示,與模型組比較,中藥組腎組織病理變化明顯輕于模型組,中藥組治療后24 h UTP及Cr水平均低于模型組(P<0.05),GRP78蛋白及基因表達水平也明顯低于模型組(P<0.05)。
本研究結果表明,MsPGN大鼠腎臟組織GRP78表達增高,提示ERS可能參與其腎臟損害過程,而中藥保腎沖劑對MsPGN模型大鼠腎臟具有一定的保護作用,可減輕大鼠腎功能損害,降低大鼠24 h UTP及Cr水平,降低GRP78蛋白及基因表達水平,從而起到治療作用,且抑制ERS相關蛋白GRP78的過度表達可能是其減輕腎功能損害的重要作用機制靶點之一。
[1] Iwano M, Neilson EG. Mechanisms of tubulointerstitial fibrosis[J]. Curr Opin Nephrol Hypertens, 2004, 13(3): 279-284.
[2] 姚樹桐,楊娜娜,宋國華,等.輕度氧化低密度脂蛋白對巨噬細胞內質網應激的誘導作用及其信號通路[J].中國動脈硬化雜志,2011,19(3):242.
[3] He H, Xu J, Xu Y, et al. Cardioprotective effects of saponins from Panax japonicus on acute myocardial ischemia against oxidative stress-triggered damage and cardiac cell death in rats[J]. J Ethnopharmacol, 2012, 140(1): 73-82.
[4] Yadav UC, Ramana KV, Srivastava SK. Aldose reductase inhibition suppresses airway inflammation[J]. Chem Biol Interact, 2011,191(1-3):339-345.
[5] 周玉榮,邊云飛,李茂蓮,等.不同濃度血管緊張素(1-7)對心肌肥厚所致內質網應激損傷的保護作用[J].中國動脈硬化雜志,2011,19(1):44-48.
[6] 嚴冬梅,李敏軍,劉友平,等.內質網應激下肝癌細胞Akt和ERK通路間的cross-talk研究[J].中國現代醫學雜志,2011,21(20):2361-2364.
[7] 賈秀琴,張曉麗,陳嫚茵,等.慢性腎小球腎炎腎絡-內質網應激相關性探討[J].現代中西醫結合雜志,2013,22(24):2706-2707.
[8] 郭寧寧,裴麗娜,都健,等.葡萄糖調節蛋白78mRNA在高脂喂養大鼠肝臟中的表達和意義[J].中國現代醫學雜志,2010,20(23):3539-3542.
[9] 吳小瑋,何婭妮,丁涵露,等.慢性腎病患者腎小管上皮細胞內質網應激與細胞凋亡的關系[J].第三軍醫大學學報,2008,30(11):1010-1013.
[10] Lim JC, Lim SK, Park MJ, et al. Cannabinoid receptor 1 mediates high glucose-induced apoptosis via endoplasmic reticulum stress in primary cultured rat mesangial cells[J]. Am J Physiol Renal Physiol, 2011, 301(1): F179-F188.
[11] Lindenmeyer MT, Rastaldi MP, Ikehata M, et al. Proteinuria and hyperglycemia induce endoplasmic reticulum stress[J]. J Am Soc Nephrol, 2008, 19(11): 2225-2236.
[12] Gonzalez-Gronow M, Selim MA, Papalas J, et al. GRP78: a multifunctional receptor on the cell surface[J]. Antioxid Redox Signal, 2009, 11(9): 2299-2306.
[13] Kimura K, Jin H, Ogawa M, et al. Dysfunction of the ER chaperone BiP accelerates the renal tubular injury[J]. Biochem Biophys Res Commun, 2008, 366(4): 1048-1053.
[14] Cybulsky AV. Endoplasmic reticulum stress in proteinuric kidney disease[J]. Kidney Int, 2010, 77(3): 187-193.
[15] 陳志強,范煥芳,韓琳,等.腎絡通對系膜增生性腎炎大鼠腎小球Col-Ⅳ、FN表達的影響[J].中國老年學雜志,2008,28(23):2312-2313.
[16] 賈秀琴,吳正治,李映紅,等.保腎沖劑治療慢性腎炎絡病機制探微[J].深圳中西醫結合雜志,2016,26(5):27-28.
(本文編輯:石 康)
Effects of Protect-kidney granules on the expression of ERS-related glucose regulation protein-78 in kidney of mesangial proliferative glomerulonephritis rats
JIAXiuqin*,YANGJihong,LIYinghong,etal.
*InstituteofIntegratedTraditionalChineseandWesternMedicine,SecondPeople'sHospitalinShenzhenCity,Guangdong,Shenzhen518035
Objective To observe the effects of Protect-renal granules on the protection of kidney in rats with mesangial proliferative glomerulonephritis(MsPGN)and the expression of endoplasmic reticulum stress (ERS) related glucose regulation protein-78 (GRP78), and to explore its action mechanism. Methods 21 male SD rats were randomly divided into modeling group (n=14) and blank control group (n=7). MsPGN models were established by the tail vein injection of anti-rat thymocyte serum(ATS)in modeling group. Rats with successful modeling were randomly divided into model group and traditional Chinese medicine(TCM) group, 7 rats in each group. The TCM group received Protect-kidney granules by gavage, the blank and model group were received 0.9% sodium chloride injection by gavage at the same volume, continuously taking for 14 weeks. After the experiment, the changes of the 24 hour urine protein quantification(24h UTP)and serum creatinine(Cr)before and after treatment were observed in each group. The expressions of protein and genes of GRP78 in rats' kidney were measured. Results The levels of 24h UTP and Cr before treatment in TCM and model group were obviously higher than blank control group (P<0.05). The levels of 24 h UTP and Cr after treatment in TCM group were significantly lower than model group (P<0.05). The immediate oxygen demand (IOD) of protein and gene expressions of GRP78 after treatment in model and TCM group were obviously higher than blank control group (P<0.05), but the IOD after treatment in TCM group was obviously lower than model (P<0.05).Conclusion The increased expression of GRP78 in MsPGN rats'kidney tissue indicate that ESR may participate in the pathogenesis of kidney damage, while the Protect-renal granules has certain protection of MsPGN, can reduce kidney damage, decrease the levels of 24 h UTP and Cr, and down-regulated expression of protein and gene of GRP78, thus play a therapeutic role, and to suppress the overexpression of ERS-related protein GRP78 may be one of the target spot of kidney renal damage.
Glomerulonephritis; Membrane proliferative; Animals; Experiment; Rats; Traditional Chinese medicine therapy
10.3969/j.issn.1002-2619.2017.01.027
※ 項目來源:深圳市科技創新委員會2014年市科技研發資金知識創新計劃(編號:JCYJ20140414170821241)
賈秀琴(1962—),女,主任醫師,學士。從事中西醫結合腎臟病臨床及基礎研究。
R285.5;R692.31
A
1002-2619(2017)01-0104-05
2016-11-22)
1 廣東省深圳市第二人民醫院兒科,廣東 深圳 518035
2 廣東省深圳市第二人民醫院中心實驗室,廣東 深圳 518035

