胃超高分化腺癌與胃黏膜高級別上皮內瘤變的鑒別診斷(附三例報告)
夏靖媛,紀小龍
胃超高分化腺癌與胃黏膜高級別上皮內瘤變的鑒別診斷(附三例報告)
夏靖媛,紀小龍
目的 探討胃超高分化腺癌的病理組織學特征及鑒別診斷要點。方法 回顧性分析胃超高分化腺癌3例的病理資料,總結與胃黏膜高級別上皮內瘤變的鑒別要點。結果 本組2例因腹脹、反酸就診;1例因間斷腹部不適伴反酸、胃灼熱就診。在外院均行胃鏡檢查及黏膜活組織病理檢查,診斷為胃黏膜高級別上皮內瘤變和黏膜慢性炎。經我科會診后均確診為胃高分化腺癌,分別行部分胃切除術或內鏡下黏膜剝離術,術后病理再次證實診斷。后均定期隨訪,未見復發。結論 胃超高分化腺癌臨床表現無特異性,組織細胞學表現與高級別上皮內瘤變相似,結合胃鏡檢查結果,仔細觀察組織學結構特征及免疫組織化學染色是避免誤診的關鍵。
胃腫瘤;腺癌;誤診;高級別上皮內瘤變;活組織檢查,針吸
我國胃癌死亡率居惡性腫瘤第3位[1-2],其死亡率較高的原因之一是早期診斷率只有10%~20%[3]。目前胃癌的診斷主要通過胃鏡活組織病理檢查(活檢),其中80%的胃癌為腺癌[4-5]。胃中低分化腺癌因組織結構和細胞異型性較大,病理檢查易診斷;部分病理科醫生對胃高分化腺癌認識不足,不易做出正確診斷[6-7],尤其是對分化極好的腺癌,即顯微鏡下呈良性表現但有侵襲行為的腫瘤,更是缺乏認識,誤診率高[8-9]。近期我院會診3例胃超高分化腺癌,初期病理診斷均誤診,現報告如下,以提高病理科醫師對胃高分化腺癌的認識,減少誤診。
1 病例資料
【例1】 男,72歲。因出現胃脹、反酸,癥狀加重3個月在當地醫院就診。胃鏡檢查示:胃竇大彎側及后壁有一2.5 cm×2.0 cm大小的病變,白光下觀察見局部黏膜凹陷,凹陷內見凸凹不平微隆起,發紅,沖洗后有少量滲血;窄帶成像內鏡(NBI)觀察見:病變局部外觀呈褐色,放大后見病灶界線清晰,腺管結構紊亂,微血管擴張。病理診斷為胃黏膜高級別上皮內瘤變。為進一步明確診斷,遂到我院會診。行組織病理學檢查示:胃黏膜固有層增厚,正常腺體消失,局部有不規則腺管排列紊亂并向黏膜肌層浸潤,診斷為胃高分化腺癌(圖1、2)。后在當地醫院行部分胃切除術,術后病理報告:賁門部高分化腺癌,侵及黏膜肌層,斷端已切凈,淋巴結未見轉移(0/21)。現定期隨診中,病情未復發。
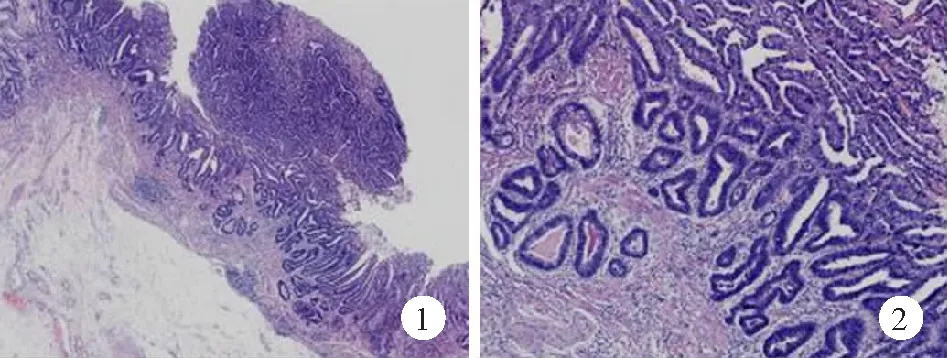
圖1 胃高分化腺數字切片癌病理檢查示:胃黏膜固有層增厚,正常腺體消失(HE×1.5)
圖2 胃高分化腺癌數字切片病理檢查示:局部有不規則腺管排列紊亂并向黏膜肌層浸潤(HE×5)
【例2】 男,56歲。因上腹部脹痛不適半年就診。在當地醫院行胃鏡檢查示:胃體下段有一2.0 cm×1.5 cm大小的病變,色澤蒼白,邊界清楚;NBI觀察見:病變與周邊非癌胃黏膜界線清晰,病變內規則毛細血管網消失,可見不規則微血管結構,且腺管微結構消失。病理診斷為胃黏膜高級別上皮內瘤變。為進一步明確診斷,來我院會診。行組織病理學檢查示:胃黏膜固有層正常腺體消失,腺管結構呈不規則尖角狀并出現分支和出芽改變,診斷為胃高分化腺癌伴黏膜慢性炎(圖3、4)。確診后在當地醫院行內鏡下黏膜剝離術(ESD),術后病理診斷為胃高分化腺癌,侵及黏膜肌層。目前已隨訪1年,未見復發。
【例3】 女,68歲。因間斷腹部不適伴反酸、胃灼熱4年余在當地醫院就診。4年前無明顯誘因出現間斷上腹部不適,伴反酸、胃灼熱,多于夜間進食后出現,服用胃復春及吉發酯后癥狀有所好轉,行胃鏡檢查并取活檢示:慢性萎縮性胃炎伴糜爛及幽門螺桿菌感染。后間斷服用抑酸和胃黏膜保護藥物,癥狀反復發作。此后每年復查一次胃鏡,均提示慢性萎縮性胃炎伴糜爛。本次入院后復查胃鏡示:胃竇小彎偏前壁見一0.3 cm×0.4 cm大小的病灶,表面略呈淡黃色;NBI觀察見:病灶與周圍正常組織邊界清晰。病理報告示:黏膜中度慢性炎,中度腸化生,部分腺體呈輕度異型增生。為進一步明確診斷,到我院會診。行組織病理學檢查示:胃黏膜固有層正常腺體消失,腺管結構不規則,細胞異型性較大,診斷為胃高分化腺癌(圖5、6)。確診后在當地醫院行部分胃切除術,術后病理報告:胃高分化腺癌,侵及黏膜下層,基底切緣及各水平切緣干凈,淋巴結未見轉移(0/15)。目前已隨訪7個月,未見復發。
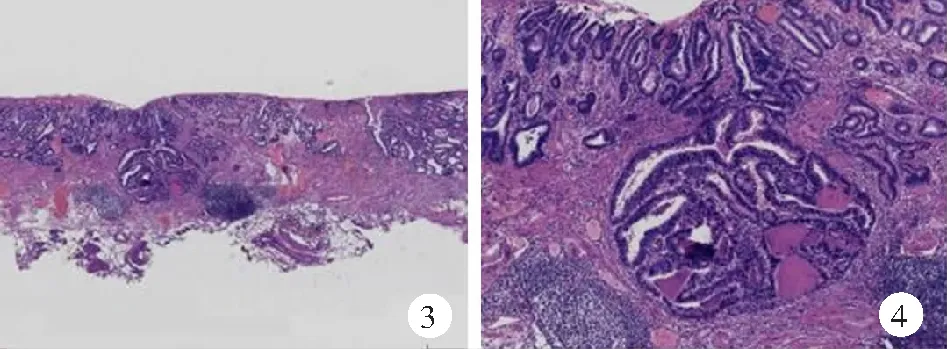
圖3 高分化腺癌數字切片病理檢查示:胃黏膜固有層增厚,正常腺體消失,腺體侵至黏膜肌層(HE×1.5)
圖4 高分化腺癌數字切片病理檢查示:局部見不規則腺管排列紊亂并向黏膜肌層浸潤,腺管尖角,呈篩網狀(HE×5)
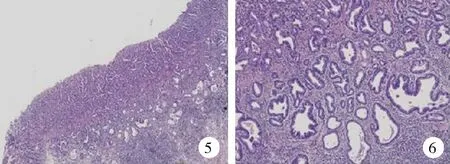
圖5 高分化腺癌數字切片病理檢查示:胃黏膜固有層增厚,正常腺體消失(HE×1.5)
圖6 高分化腺癌數字切片病理檢查示:局部見不規則腺管排列紊亂并向黏膜肌層浸潤,出現凋亡、壞死(HE×5)
2 討論
2.1 疾病概述 根據分化程度不同,胃腺癌分為高分化、中分化和低分化腺癌。中低分化腺癌由于組織結構和細胞的異型性大,易診斷。近年來隨著胃鏡檢查設備及技術的發展,早期胃癌行內鏡下黏膜切除術、ESD的病例逐漸增多,其中高分化腺癌約占早期胃癌的70%[10],因此胃高分化腺癌的病理檢查亦逐漸增多。其結構特點是腺管結構明顯,形狀及大小較規則,可見基底膜,癌細胞呈高柱狀或立方狀,核深染,有異型性,部分細胞核上移[11]。俎明等[12]研究分析胃鏡活檢為高級別上皮內瘤變21例,行ESD后11例病理檢查可見細胞癌變。孫學工等[13]分析胃鏡活檢診斷為胃黏膜高級別上皮內瘤變19例的術后病理檢查結果,發現僅1例維持術前診斷,余18例均為腺癌。顧榮民等[14]分析胃鏡活檢診斷為胃高級別上皮內瘤變65例,術后病理診斷為胃癌60例,其中高分化腺癌12例。
2.2 鑒別診斷 胃超高分化腺癌易與胃黏膜高級別上皮內瘤變相混淆,其鑒別要點如下:①結構異型性:兩者均有結構異型性,但胃超高分化腺癌的結構異型性更明顯,腺管可成尖角狀,異常融合腺管呈篩網狀,出現明顯復雜分支、鋸齒狀乳頭、腺中腺結構和出芽現象。本文3例病理檢查可見腺管細長成尖角狀并出現分支和出芽現象。②細胞異型性:兩者的細胞異型性相似,高分化腺癌異型性更大。③伴隨現象:高分化腺癌的腺管管腔內或上皮內可見凋亡背景壞死碎片,尤其是圓形擴張伴假性扁平腺上皮(缺乏胞質和黏液分泌)的腺管內出現凋亡背景壞死,異型腺管侵犯黏膜層;高級別上皮內瘤變中一般無凋亡壞死現象[15]。本文3例均可見細胞凋亡壞死。
2.3 誤診原因分析 ①臨床表現無特異性:早期胃癌的臨床表現多為腹脹、腹痛、食欲缺乏,與慢性胃炎、胃潰瘍相似,不易引起臨床醫生的重視[16-17]。②胃鏡活檢標本取材表淺:胃部疾病的主要診斷方法是通過胃鏡取活檢,相對于術后標本,胃鏡活檢組織較小,且多限于黏膜層,對于分化好的高分化腺癌,顯微鏡下結構和細胞的異型性小,與胃炎、增生的形態相似,加之在黏膜層很難發現確切的浸潤,故診斷高分化腺癌困難。③對組織病理形態認識不足:目前多根據組織學結構和細胞異型性對胃癌進行診斷。細胞異型性較好辨認,表現為細胞極性紊亂、深染、核漿比增大、核分裂象增多,但臨床對結構異型性認識不足,易漏診。然而,結構異型性對胃癌的診斷至關重要,尤其是對分化極好的胃腺癌,其細胞形態與正常胃黏膜細胞相似,對診斷最重要的依據是不規則腺體形態[8]。結構異型性為腺體吻合、腺體成角、擴張、分支及流產樣腺體,在鏡下類似于字母W、H、Y及X[18]。當黏膜層出現握手樣結構的腺體時其浸潤可能性較大[19]。
2.4 防范誤診措施 早期胃癌5年生存率為90%,進展期胃癌預后較差,5年生存率僅為20%[20],因此對于早期胃癌做到早發現、早治療可極大提高生存率。臨床對高分化腺癌和高級別上皮內瘤變的診治差異較大,故予病理診斷時應做到以下幾點:①結合胃鏡表現進行診斷:隨著胃鏡技術的發展(NBI、放大內鏡、染色內鏡),胃部病變更易發現,內鏡可見胃黏膜血管、表面微細結構的改變及病變范圍[21-24],根據內鏡所見,經驗豐富的醫師做出正確診斷的概率很高,予病理診斷時,參考胃鏡所見及診斷,及時與內鏡醫師溝通,解決疑惑。②結合免疫組織化學染色:當常規蘇木精-伊紅染色的病理切片觀察到可疑病變時,可做Ki-67和p53免疫標記輔助診斷[25-27]。
綜上所述,胃超高分化腺癌臨床表現無特異性,組織結構和細胞異型性較小,易誤診。因此,做出病理診斷時應仔細觀察組織學結構特征,注意結合胃鏡表現,必要時與內鏡醫師溝通,以明確診斷。
[1] Nagy P, Johansson S, Molloy-Bland M. Systematic review of time trends in the prevalence of Helicobacter pylori infection in China and the USA[J].Gut Pathog, 2016,8(1):8.
[2] 溫乃祖,王淑云.表現為上消化道出血的老年人胃癌70例[J].西北國防醫學雜志,1997,18(4):300.
[3] 師英強.胃癌臨床診斷與治療實踐中的問題[J].中華胃腸外科雜志,2007,10(5):411-413.
[4] 楊惠.1093例胃癌臨床病理分析[D].大連:大連醫科大學,2013.
[5] 司明遠.如何判讀活檢病理報告-胃上皮內瘤變[J].中國現代醫生,2008,46(36):41-42.
[6] Miyaoka Y, Izumi D, Mikami H,etal. A Case Report of an Extremely Well Differentiated Gastric Adenocarcinoma of the Fundic Gland Type Successfully Treated with ESD[J].Gastroenterological Endoscopy, 2011,53(7):1778-1785.
[7] 徐有坤,李煥萍,印敏,等.早期胃癌75例臨床病理特征與預后分析[J].臨床軍醫雜志,2012,40(6):1517-1519.
[8] Yao T, Utsunomiya T, Oya M,etal. Extremely well-differentiated adenocarcinoma of the stomach: clinicopathological and immunohistochemical features[J].World J Gastroenterol, 2006,12(16):2510-2516.
[9] 吳永梅.青年人胃癌臨床及胃鏡診斷分析[J].海南醫學院學報,2004,10(6):390-391.
[10]張棟棟.早期胃癌臨床及病理特點分析[D].濟南:山東大學,2015.
[11]Kushima R, Vieth M, Borchard F,etal. Gastric-type well-differentiated adenocarcinoma and pyloric gland adenoma of the stomach[J].Gastric Cancer, 2006,9(3):177-184.
[12]俎明,徐雪,周煒洵,等.伴癌與非伴癌胃高級別上皮內瘤變全基因表達譜的比較[J].中國醫學科學院學報,2015,37(1):23-29.
[13]孫學工,束寬山,蘇昭然.胃鏡活檢高級別上皮內瘤變19例臨床分析[J].安徽醫藥,2014,18(8):1515-1516.
[14]顧榮民,李剛,文旭,等.胃高級別上皮內瘤變的臨床處理[J].醫學研究生學報,2010,23(6):618-621.
[15]徐志巧,張燕,李寧.胃竇高級別上皮內瘤變伴遠處多發轉移的臨床探討[J].中國當代醫藥,2010,17(28):150-151.
[16]朱燕華,李晨,胡月亮,等.淺表擴散型早期胃癌的內鏡及臨床特點分析[J].胃腸病學和肝病學雜志,2012,21(1):17-20.
[17]陳國棟,劉玉蘭.36例早期胃癌臨床、內鏡和病理特點分析[J].中國內鏡雜志,2012,18(9):939-941.
[18]Ushiku T, Arnason T, Ban S,etal. Very well-differentiated gastric carcinoma of intestinal type: analysis of diagnostic criteria[J].Mod Pathol, 2013,26(12):1620-1631.
[19]Gomez J M, Wang A Y. Gastric Intestinal metaplasia and early gastric cancer in the west: a changing paradigm[J].Gastroenterol Hepatol(N Y), 2014,10(6):369-378.
[20]Borchard F. Forms and nomenclature of gastrointestinal epithelial expansion: what is invasion[J].Verh Dtsch Ges Pathol, 2000,84:50-61.
[21]劉松華,莫湘,文黛薇,等.NBI聯合放大內鏡對早期胃癌及癌前病變的觀察研究[J].中國醫藥科學,2016,6(8):23-26,131.
[22]靳西鳳,柴同海,崔梅,等.內鏡窄帶成像技術在頭頸食管多原發癌中的診斷價值[J].中華消化外科雜志,2011,10(4):302-303.
[23]冷明芳,王華義.內窺鏡所見的早期胃癌形態[J].華南國防醫學雜志,2000,14(4):50-51.
[24]任萬英,李華,張偉龍.早期胃癌的內鏡診斷與治療[J].武警醫學院學報,2004,13(2):141-143.
[25]劉偉,余英豪,歐陽學農,等.p53和Ki67在胃癌中的表達及其臨床意義[J].世界華人消化雜志,2011,19(4):367-373.
[26]呂旭,姜葉娟,王香,等.p53與Ki-67在胃癌組織中表達與淋巴轉移的關系[J].中華疾病控制雜志,2015,19(4):407-410.
[27]白賢女,呂建南,韓志偉.Bcl-2和P53蛋白在胃息肉及胃癌中的表達及意義[J].臨床誤診誤治,2004,17(8):538-539.
100039 北京,武警總醫院病理科[夏靖媛(在讀研究生)]
紀小龍,電話:13910028418;E-mail:13910028418@126.com
R735.2
B
1002-3429(2017)03-0012-03
10.3969/j.issn.1002-3429.2017.03.005
2017-12-12 修回時間:2017-01-09)

