以精神癥狀為首發表現的Fahr病誤診討論及家系調查
陳 莉,鐘 華
以精神癥狀為首發表現的Fahr病誤診討論及家系調查
陳 莉,鐘 華
目的 探討以精神癥狀為首發表現的Fahr病的臨床及診斷要點,減少誤診誤治。方法 對以精神癥狀為首發表現的Fahr病的臨床資料進行回顧性分析。結果 先證者因睡眠差、生活懶散10年,加重2年入院。曾在外院按顱內多發鈣化予對癥治療,癥狀未見好轉。專科查體:語速緩慢,面具臉,反應遲鈍,四肢肌張力增高,雙上肢運動性震顫且聯帶動作減少,行動遲緩,雙側指鼻試驗、跟膝脛試驗欠穩準,輪替試驗速度減慢、幅度降低,左側掌頜反射陽性。頭顱MRI示:雙側基底節區、丘腦、腦干、小腦、大腦半球皮層下廣泛鈣化。進一步追問病史得知,其父親、爺爺、弟弟均有類似癥狀,確診為家族性Fahr病。該病無特殊治療方法,僅予對癥治療,癥狀無明顯緩解后出院觀察。結論 接診以精神癥狀為首發表現的患者時,要考慮到Fahr病的可能,及時行基因檢測,盡早確診并早期干預,以避免或減少誤診誤治。
Fahr病;誤診;精神分裂癥
Fahr病由德國神經病學家Fahr于1930年首次報道并命名[1],國內于1983年由蔣雨平等[2]率先報道,為特發性雙側對稱性大腦基底節鈣化癥,目前病因尚不明確。近年有學者建議該病應更名為原發性家族性腦鈣化,指一種罕見的遺傳或散發的神經系統疾病,發病率低于1/100萬[3-4]。該病臨床表現復雜多變,易誤診。我院近期收治家族性Fahr病1例,現報告如下。
1 臨床資料
1.1 病例資料 男,46歲,先證者。因睡眠差、生活懶散10年,加重2年入院。10年前無明顯誘因出現夜間睡眠差,精神狀態欠佳,不愿與人交流,偶可被動接觸,但音量極小,常一個人呆立呆坐,生活懶散,做事需人督促,反應遲鈍,情感淡漠。2年前反應遲鈍加重,精神狀態更差,行動遲緩,走路緩慢,面無表情,基本不做家務,亦不與人接觸,出現反復撓頭等刻板動作。1年半前因右眼發紅于外院行頭顱CT檢查發現雙側基底節區、丘腦、小腦、半卵圓中心及額頂顳枕葉皮層下多發鈣化(圖1)。查甲狀旁腺激素(PTH)78.9 pg/ml(正常參考值12~65 pg/ml),當時診斷為顱內多發鈣化,予奧拉西坦、胞磷膽堿鈉等治療,效果不佳,癥狀逐漸加重,為進一步診治到我院就診。既往無特殊病史。查體:生命體征及心肺腹檢查未見明顯異常。專科查體:意識清楚,言語清晰,語速緩慢,面具臉,定向力、記憶力、計算力正常,反應遲鈍,顱神經檢查正常,四肢肌張力增高,肌力5級,雙上肢運動性震顫且聯帶動作減少,行動遲緩,步態正常,雙側指鼻試驗、跟膝脛試驗欠穩準,輪替試驗速度減慢、幅度降低,閉目難立征陰性,雙側腱反射(++),左側掌頜反射陽性,雙側病理征陰性。初步診斷為精神分裂癥,予口服帕羅西汀20 mg/d改善情緒、奧氮平5 mg/d控制癥狀及調節睡眠、中成藥改善大腦微循環等治療,癥狀改善不明顯。查血白細胞6.01×109/L,血紅蛋白130 g/L,血小板150×109/L;丙氨酸轉氨酶12 U/L,天冬氨酸轉氨酶17 U/L;尿素5.06 mmol/L,肌酐77.8 μmol/L,尿酸329.9 μmol/L;鈣2.23 mmol/L,磷0.98 mmol/L;三碘甲狀腺原氨酸1.49 nmol/L,甲狀腺素72.2 nmol/L,游離三碘甲狀腺原氨酸3.94 pmol/L,游離甲狀腺素12.73 pmol/L,促甲狀腺激素2.50 mU/L;PTH 51 pg/ml;降鈣素2.43 pg/ml(正常參考值0~8.4 pg/ml)。眼科裂隙燈觀察角膜正常,未見K-F環。頭顱MRI示:雙側基底節區、丘腦、腦干、小腦、大腦半球皮層下廣泛鈣化(圖2)。甲狀腺及甲狀旁腺超聲未見異常,腦電圖正常。蒙特利爾認知功能評估量表MoCA評分21分(中學文化水平),簡易智力狀態量表評分27分,日常生活能力量表評分100分。進一步追問病史得知,其父親、爺爺、弟弟均有類似癥狀,確診為家族性Fahr病,繼續予改善情緒、調節睡眠、控制精神癥狀及心理暗示等治療,患者癥狀無明顯緩解后出院。1月后隨訪,患者以睡眠為主,對所有事情漠不關心,行為懶散加重,步態緩慢,日常生活基本自理,無法工作。3個月后隨訪,患者訴無欲無求,食欲差,雙上肢不自主抖動明顯,邁步困難,行走緩慢,日常生活稍困難。目前仍在隨訪。
1.2 家系調查 該患者家系4代共26人,均無近親結婚,否認甲狀腺、甲狀旁腺、肝腎疾病史。先證者的1個同胞弟弟有精神病史,27歲發病,臨床表現與患者類似,后因精神障礙走失;其父親及爺爺均有精神病史,發病年齡分別為25歲及32歲,病情均與先證者類似,已去世;先證者育有1子,19歲,無癥狀(圖3)。
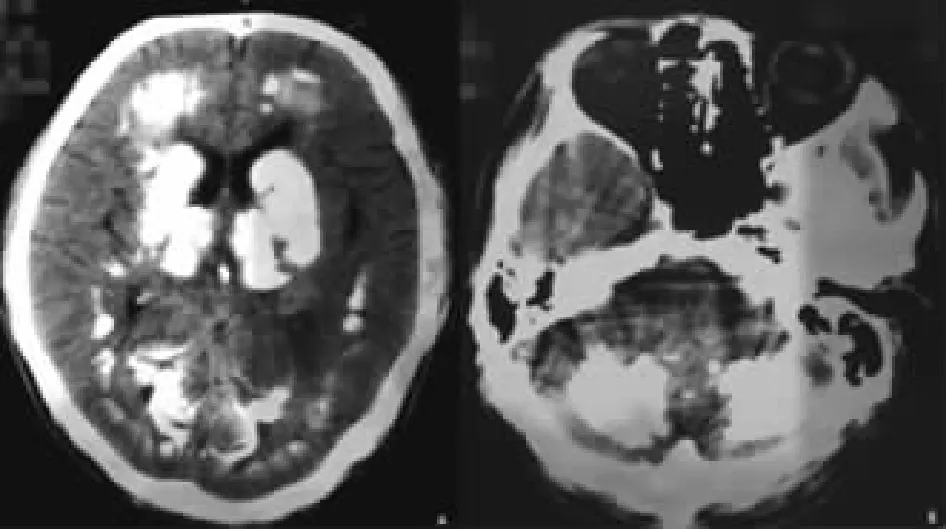
圖1 Fahr病患者頭顱CT檢查示:雙側基底節區、丘腦、小腦、半卵圓中心及額頂顳枕葉皮層下多發鈣化灶。
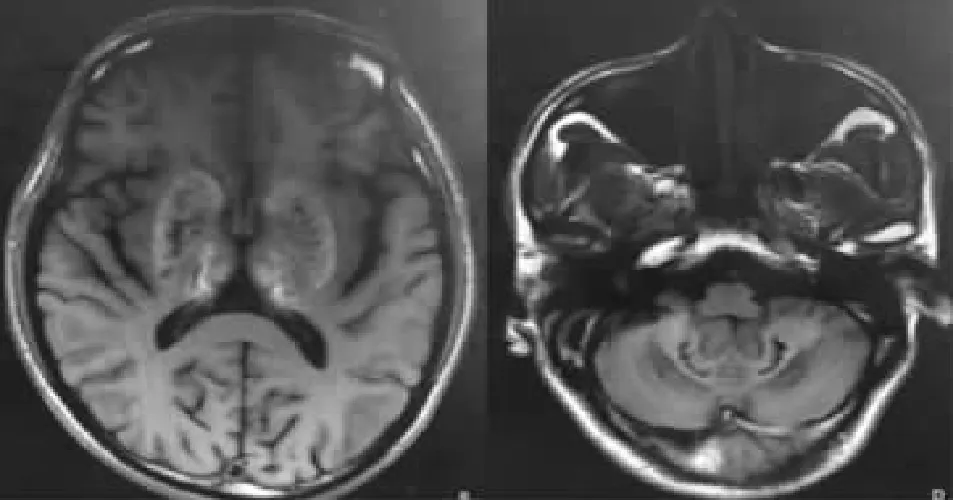
圖2 Fahr病患者頭顱MRI檢查示:雙側基底節區、丘腦、小腦對稱性Flair高信號,考慮鈣化可能。
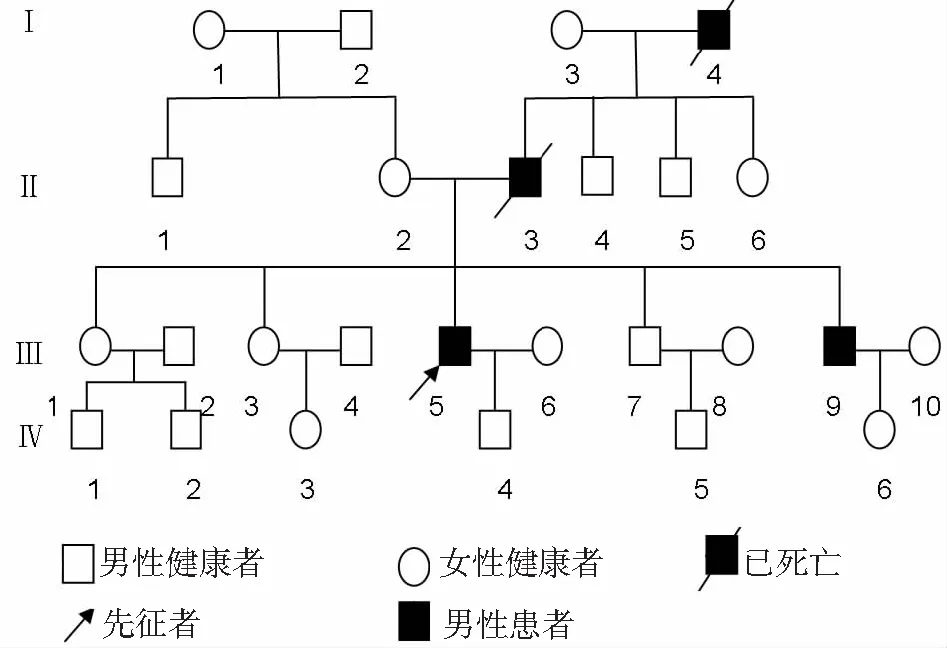
圖3 Fahr病患者家系圖譜
注:Ⅰ~Ⅳ為第一代~第四代;1~10為家庭成員編號
2 討論
2.1 病因及病理改變 Fahr病又稱為特發性基底節鈣化或家族性特發性基底節鈣化,是一種神經系統退行性疾病,多數具有家族遺傳的特點,為常染色體顯性遺傳,部分為常染色體隱性遺傳[4-7]。近年來,SLC20A2被認為是該病最常見的致病基因,占家族遺傳性Fahr病的41%[5,8]。本例有家族遺傳史,其父親、爺爺、弟弟均有類似表現,由于經濟原因未行基因檢測,無法進一步驗證,但患者有明確的家族聚集現象,考慮為家族遺傳性Fahr病。該病特征性病理改變為雙側基底節區、丘腦、小腦的齒狀核及皮層下中樞對稱性鈣質沉積,病變區廣泛對稱的終末小動脈和靜脈周圍鈣鹽沉著,包括黏多糖類物質、磷、鐵、鉛及鉀等鹽類沉著,其化學組成、結構與骨骼、牙齒等部位的生理性鈣化相同[9-12]。
2.2 臨床特點 Fahr病多于30~60歲起病[3],進展緩慢,男女均可發病。臨床表現根據受累部位的不同而表現各異,包括神經癥狀、精神癥狀及運動障礙,常見表現為帕金森癥狀、認知障礙、言語障礙、共濟失調、吞咽困難、精神錯亂、情緒萎靡、癲癇等[13-14]。Ellie等[15]總結分析了44例Fahr病,發現認知障礙占54.5%,錐體外系癥狀占50.3%,言語困難占43.2%,小腦體征占34.1%,精神異常占29.5%,錐體束征占13.6%,癲癇占4.5%。本例以精神癥狀為首發表現,接診醫生未及時發現其合并運動遲緩、肌張力增高等錐體外系癥狀、小腦共濟失調和原始反射體征,誤診為精神疾病,后完善甲狀腺素、電解質等實驗室檢查,且頭顱MRI發現顱內多發異常信號,進一步追問病史,得知其存在家族聚集現象,確診為Fahr病。
2.3 診斷與鑒別診斷 Fahr病的診斷主要依靠影像學檢查,表現為雙側基底節區對稱性鈣化灶,伴腦內廣泛分布的鈣化灶[12,16]。Fahr病的病情輕重與顱內鈣化程度有關,且隨著年齡的增長,顱內鈣化有進行性加重的趨勢[17]。頭顱CT是評價腦鈣化程度和定位的最佳方法。MRI顯示顱內鈣化灶的敏感性不如CT。有學者認為MRI顯示小腦病灶明顯優于CT,其梯度回波可改善對鈣化的顯示,多數表現為T1、T2低信號[18-19]。因此,將頭顱CT與MRI相結合能更加全面顯示病變范圍,為臨床診斷提供客觀依據[3]。本文先證者頭顱CT檢查見基底節區、丘腦、小腦、半卵圓中心、腦葉等多處對稱性鈣化灶。
Fahr病的診斷標準參考Manyam修改版[20]:①影像學檢查見雙側基底節區鈣化,可累及顱內其他部位,包括小腦、腦干、半卵圓中心等;②進行性神經功能缺損,包括運動障礙和(或)神經、精神癥狀;③發病年齡多為30~60歲,也可見于兒童或嬰兒;④生化檢查正常,無線粒體疾病、代謝性疾病和其他系統疾病的癥狀和體征;⑤無感染、中毒、外傷等誘因;⑥家族史符合常染色體顯性遺傳特征。
Fahr病需與以下疾病相鑒別:①原發性甲狀旁腺功能減退癥(甲旁減):臨床表現為手足抽搐、癲癇樣發作、智力發育遲緩、精神障礙等癥狀,顱內多發鈣化灶與Fahr病鑒別困難,但實驗室檢查可見PTH降低,出現低血鈣、高血磷,可與之相鑒別。②繼發性甲旁減:與原發性甲旁減臨床表現相似,有甲狀腺手術、頸部創傷及放療史,血PTH升高。③假性甲旁減:多為PTH抵抗所致,臨床表現與原發性甲旁減相似,PTH可升高或正常,屬多基因遺傳性疾病。④假假性甲旁減:為典型遺傳性骨營養不良癥,血PTH、鈣、磷均正常,無激素抵抗,多屬于基因突變。⑤線粒體腦肌病:有陽性家族史,多以卒中樣或癲癇起病,MRI可見DWI序列高信號花邊征,基因檢測或病理檢查可確診。⑥一氧化碳中毒:有一氧化碳接觸史,突發意識障礙多見,口唇呈櫻桃紅,一氧化碳測定陽性等可用于鑒別。⑦結節性硬化癥:為室管膜下多發的膠質結節或結節樣鈣化,沿側腦室外側壁分布,為較小的類圓形病灶,多向側腦室內凸出,臨床表現為癡呆、癲癇發作,面部多有皮脂腺瘤。⑧鉛中毒:有長期毒物接觸史,牙齦呈鉛線沉積,毒物篩查可鑒別。
2.4 治療 若為甲旁減引起的Fahr病,及早治療,預后相對較好。家族性Fahr病目前尚無根治的方法,主要予改善腦循環及對癥處理[21]。有學者提出,將螯合物如青霉胺、抗氧化劑和鈣離子拮抗劑聯合應用,可改善患者癥狀,但其療效尚未證實,有待大樣本的臨床試驗研究[22]。
2.5 誤診原因分析及防范措施 Fahr病臨床癥狀不典型,基層醫生缺乏對該病的認識,加之未詳細詢問病史及家族史,亦未仔細查體,致誤診誤治。提示臨床應加強專業知識的學習,尤其是提高對少見病的認識,收治有精神癥狀的患者時,應詳細詢問家族史,規范神經系統查體,及時行相關醫技檢查,必要時行分子基因檢測,以早期診斷,積極干預,改善預后,避免或減少誤診誤治。
[1] Fahr T. Idiopathische verkalkung der hirngefasse[J].Zentrabl Allg Pathol, 1930,50:129-133.
[2] 蔣雨平,秦芝九,印美韻.特發性兩側對稱性大腦基底節鈣化癥[J].中國神經精神疾病雜志,1983,9(2):95-97.
[3] 李睿婷,李濤.特發性基底節鈣化的研究進展[J].疑難病雜志,2014,13(8):862-865.
[4] Saleem S, Aslam H M, Anwar M,etal. Fahr's syndrome: literature review of current evidence[J].Orphanet J Rare Dis, 2013,8:156.
[5] Hsu S C, Sears R L, Lemos R R,etal. Mutations in SLC20A2 are a major cause of familial idiopathic basal ganglia calcification[J].Neurogenetics, 2013,14(1):11-22.
[6] Lemos R R, Oliveira D F, Zatz M,etal. Population and computational analysis of the MGEA6 P521A variation as a risk factor for familial idiopathic basal ganglia calcification (Fahr's disease)[J].J Mol Neurosc, 2011,43(3):333-336.
[7] Brunoni A R, Nakata A C, Tung T C,etal. Vitamin D-resistant rickets type Ⅱ-A, basal ganglia calcification, and catatonia: a casual or causal relationship[J].Psychosomatics, 2009,50(4):420-424.
[8] Wang C, Li Y, Shi L,etal. Mutations in SLC20A2 link familial idiopathic basal ganglia calcification with phosphate homeostasis[J].Nat Genet, 2012,44(3):254-256.
[9] 王萍.家族性Fahr病一家系報告并國內11家系分析[J].中國綜合臨床,2013,29(7):729-731.
[10]Narita K, Murata T, Ito T,etal. A case of diffuse neurofibrillary tangles with calcification[J].Psychiatry Clin Neurosci, 2002,56(1):117-120.
[11]Ahad M A, Bala C, Karim S. Fahr's syndrome[J].Bangladesh Medical Journal Khulna, 2013,45(1-2):33-35.
[12]直玉秋,楊迎偉,曹桂華,等.Fahr病和Fahr綜合征的影像學臨床研究[J].臨床心身疾病雜志,2014,20(3):22-24.
[13]李庭毅,李睿.Fahr病5例臨床分析[J].中國實用神經疾病雜志,2015,18(7):129-130.
[14]Saleem S, Aslam H M, Anwar M,etal. Fahr's syndrome: literature review of current evidence[J].Orphanet J Rare Dis, 2013,8:156.
[15]Ellie E, Julien J, Ferrer X. Familial idiopathic striopallidodentate calcification[J].Neurology, 1989,39(3):381-385.
[16]梁遠仲,普福順,羅家濱,等.一家系家族性Fahr病CT表現并文獻復習[J].中國臨床醫學影像雜志,2015,26(6):436-438.
[17]何亮,宋炳偉,甄勇,等.家族性Fahr病一家系報告[J].中國神經精神疾病雜志,2015,41(8):508-509.
[18]趙麗娜,楊麗娟,劉濤,等.特發性基底節鈣化病臨床分析[J].寧夏醫學雜志,2016,38(6):545-547.
[19]Ozerov S S, Semenova Zh B, Zubairaev M S,etal. Concurrence of Fahr's disease with cerebellar tumors[J].Zh Vopr Neirokhir Im N N Burdenko, 2004,(4):34-36.
[20]Manyam B V. What is and what is not Fahr's disease[J].Parkinsonism Relat Disord, 2005,11(2):73-80.
[21]Rastogi R, Beauchamp N J, Ladenson P W. Calcification of the basal ganglia in chronic hypoparathyroidism[J].J Clin Endocrinol Metab, 2003,88(4):1476-1477.
[22]燕麗娜,范學軍.伴錐體系損傷的Fahr病1例[J].中國當代醫藥,2012,19(10):166,168.
408400 重慶,重慶醫科大學附屬南川人民醫院神經內科
鐘華,電話:13452069683;E-mail:949535665@qq.com
R742.89
B
1002-3429(2017)03-0037-03
10.3969/j.issn.1002-3429.2017.03.016
2016-12-01 修回時間:2017-01-05)

