硫化氫對FeCl3誘導的小鼠頸動脈血栓模型中凝血和纖溶活性的影響*
卞冬燕, 劉紅旭, 梁鈺敏, 王 垚, 吳紅婷, 李朋朋, 黃琳燕
(徐州醫科大學醫學技術學院,江蘇 徐州 221004)
硫化氫對FeCl3誘導的小鼠頸動脈血栓模型中凝血和纖溶活性的影響*
卞冬燕, 劉紅旭, 梁鈺敏, 王 垚, 吳紅婷, 李朋朋, 黃琳燕△
(徐州醫科大學醫學技術學院,江蘇 徐州 221004)
目的: 探討外源性硫化氫(H2S)對三氯化鐵(FeCl3)誘導的小鼠頸動脈血栓模型凝血和纖溶活性的影響。方法: 本實驗分為空白對照組、模型組、不同濃度(12.5、25和50 μmol/kg)的硫氫化鈉(NaHS,H2S供體)處理組和30 mg/kg氯吡格雷(clopidogrel,陽性對照)。不同濃度NaHS腹腔注射及硫酸氫氯吡格雷灌胃給藥處理3 d后,采用10% FeCl3誘導小鼠頸動脈血栓模型。取各組頸動脈制成冰凍切片后,HE染色觀察血栓形成及血管病理變化;對形成的血栓重量進行測量,計算血栓形成抑制率;采用血凝儀檢測血漿凝血酶原時間(PT)、活化部分凝血活酶時間(APTT)、纖維蛋白原(FIB)和纖維蛋白降解產物(FDP)的變化;ELISA法檢測血漿中血栓烷素B2(TXB2)、6-酮-前列腺素F1α(6-keto-PGF1α)和纖溶酶原活化抑制劑(PAI)的含量。結果: 與模型組相比,NaHS劑量依賴性地抑制小鼠頸動脈血栓的形成;NaHS處理可延長血栓模型中PT和APTT,減少FIB含量,增加FDP含量;NaHS處理能夠降低頸動脈血栓模型中TXB2及PAI含量,恢復6-keto-PGF1α含量,并且6-keto-PGF1α/TXB2與血栓重量呈負相關。結論: 硫化氫通過抑制機體凝血功能并激活纖溶活性而抑制FeCl3誘導的頸動脈血栓形成。
硫化氫; 血栓; 凝血; 纖溶; 血栓烷素B2
硫化氫(hydrogen sulfide,H2S)作為一種氣體信號分子參與許多生物學過程。大量研究證實H2S在神經系統、消化系統、泌尿系統、心血管系統等中發揮著各種生理和病理作用[1-5]。在心血管系統中,H2S發揮舒張血管、促進血管新生、抑制血管平滑肌細胞增殖并調控其表型轉化[6]、調節血管平滑肌細胞酸化[7]、抑制血管內皮細胞炎癥和退化反應[8]等生物學效應。在大鼠心肌缺血模型中,硫化氫通過抑制核因子κB活性減少腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)、白細胞介素6(interleukin-6, IL-6)和白細胞介素1β(interleukin-1β,IL-1β)等炎性細胞因子的表達從而減輕心肌缺血對機體造成的損傷[9]。同時,硫化氫還能夠通過糖原合成激酶3β(glycogen synthase kinase 3β,GSK-3β)/β-聯蛋白(β-catenin)信號途徑介導抗心肌細胞凋亡作用[10]。此外,硫化氫能夠抑制血小板功能,包括血小板黏附、分泌和聚集[11-14]。已有研究表明,硫化氫可以抑制三氯化鐵(ferric chloride,FeCl3)誘導的小鼠頸動脈血栓形成,但是其發揮作用的具體機制尚不明確。本研究通過檢測H2S對FeCl3誘導的頸動脈血栓模型小鼠凝血和纖溶活性指標的變化,探討H2S抑制血栓形成的機制。
材 料 和 方 法
1 材料
水合氯醛、硫氫化鈉和三氯化鐵購自Sigma;硫酸氫氯吡格雷購自Sanofi;多聚甲醛和疏水性載玻片購自徐州微科曼得公司;蔗糖、ACD抗凝劑(120 mmol/L枸櫞酸納,110 mmol/L葡萄糖,80 mmol/L枸櫞酸,pH=7.4)和二甲苯購自國藥集團化學試劑有限公司;中性樹脂購自上海標本模型廠。冰凍切片機(Leica);光學顯微鏡(Olympus);酶標儀(Bio-Rad);血凝儀(Sysmex CA1500)。
2 方法
2.1 動物分組和模型建立 將購買于徐州醫科大學實驗動物中心的8~10周齡健康雄性小鼠,體重(22±2)g,共120只。隨機分為空白對照組、模型組、NaHS(12.5 μmol/kg) I組、NaHS (25 μmol/kg)II組、NaHS (50 μmol/kg)III組和氯吡格雷(clopidogrel,30 mg/kg)組共6組,每組20只。連續3 d每日定時給予NaHS或生理鹽水(0.9% NaCl溶液,溶劑對照)腹腔注射,造模當日,水合氯醛麻醉成功后取仰臥位,頸部正中線做直線切口,暴露右側頸總動脈,于動脈下墊塑料薄膜保護周圍組織。取Whatman濾紙,裁成1.2 cm×0.8 cm大小,10% FeCl3浸透后覆蓋暴露的血管2.5 min后,移去濾紙,生理鹽水沖洗3遍。
2.2 血栓稱重 FeCl3造模成功,暴露的血管經生理鹽水沖洗后,于包含血栓的血管上下兩端結扎血管,剪斷后放入EP管中,稱取血管和血栓總重量,而后用小鑷子輕輕將血管內血栓取出,稱取血管重量,兩者差值即為血栓濕重量。最后計算血栓形成抑制率=(A-A1)/A×100%,其中A代表模型組血栓質量,A1代表其它各處理組血栓質量。
2.3 蘇木素-伊紅(hematoxylin-eosin,HE)染色 經FeCl3處理造模成功后的小鼠,打開胸腔暴露心臟,沿左心室上行進入主動脈,同時剪開右心耳,持續用壓強約100 mmHg的PBS沖洗小鼠全身血管,觀察小鼠肝臟發白時,接著用冷的4%的多聚甲醛進行灌注15 min左右。灌注結束后剪取頸動脈血管制成冰凍切片,切片厚度約6 μm,按照步驟[15]進行HE染色,封片后在顯微鏡下進行形態觀察。采用Image-Pro Plus圖像處理軟件測定頸動脈血栓形成面積。
2.4 凝血指標和纖溶活性指標測定 小鼠心臟穿刺取血,迅速加入枸櫞酸鈉抗凝管(9∶1),4 ℃ 3 000 r/min 離心15 min,得到上層血漿,利用血凝儀檢測凝血酶原時間(prothrombin time,PT)、活化部分凝血酶時間(activated partial thromboplastin time,APTT)、纖維蛋白原(fibrinogen,FIB)和纖維蛋白降解產物(fibrinogen degradation product,FDP)變化,1 h內完成檢測。
2.5 ELISA實驗 小鼠心臟取血離心得到上層血漿,采用酶聯免疫試劑盒,按照說明書手工測定小鼠血漿中血栓烷素B2(thromboxane B2, TXB2)、6-酮-前列腺素F1α(6-keto-prostaglandin1α, 6-keto-PGF1α)和纖溶酶原活化抑制劑(plasminogen activator inhibitor, PAI)的含量,操作時每個樣本測定2個孔,結果取平均值。分光光度計測定相應的濁度后,根據各自的濃度標準曲線計算各待測樣本的濃度。
3 統計學處理
應用SPSS 16.0統計軟件處理數據,所有計量資料均采用均數±標準差(mean±SD)表示,多組間比較采用單因素方差分析,并采用SNK-q法進行兩兩比較,以P<0.05表示差異有統計學意義。
結 果
1 H2S抑制FeCl3誘導的小鼠頸動脈血栓形成
通過稱量各組血栓的濕重,我們發現正常組沒有血栓,模型組頸動脈血栓重量明顯增加,NaHS各劑量組血栓重量依次減少,硫酸氫氯吡格雷與25 μmol/kg NaHS具有相同的作用。HE染色結果顯示,正常組血管內膜完整,模型組有明顯血栓形成,血管內膜破壞嚴重。與模型組相比,NaHS各劑量組血栓依次減少。計算各組血栓面積結果顯示,硫氫化鈉處理后,血栓面積明顯較模型組減少,提示H2S抑制FeCl3誘導的小鼠頸動脈血栓形成,見圖1、表1。
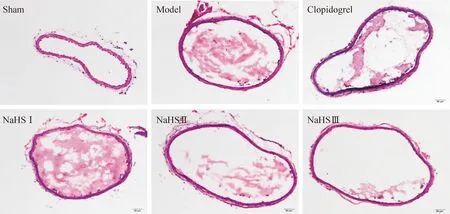
Figure 1.NaHS inhibited FeCl3-induced carotid artery thrombosis in a dose-dependent manner. Representative HE staining images of carotid artery thrombus in different groups were showed (×200).
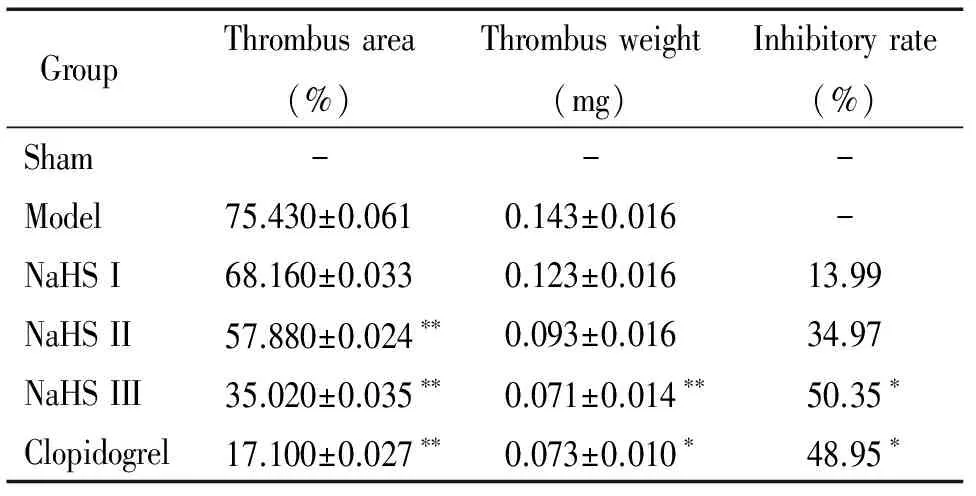
表1 不同濃度硫氫化鈉對 FeCl3誘導的頸動脈血栓形成的影響
*P<0.05,**P<0.01vsmodel.
2 H2S對 FeCl3誘導的小鼠頸動脈血栓模型中凝血指標和纖溶活性指標的影響
通過檢測各組凝血指標和纖溶活性指標發現,與假手術組相比,FeCl3誘導的小鼠頸動脈血栓模型組PT和APTT均明顯縮短,而NaHS處理后可分別延長PT和APTT。與假手術組相比,模型組FIB和FDP含量明顯增加,而NaHS處理后可減少FIB,但FDP含量增加更明顯,見表2。
3 H2S改變FeCl3誘導的血栓模型中6-keto-PGF1α/TXB2比值以及恢復PAI水平含量
實驗結果顯示,與對照組相比,模型組TXB2和PAI水平顯著增加,而6-keto-PGF1α的含量明顯減少;與模型組相比,NaHS劑量依賴性地降低TXB2和 PAI水平,增加6-keto-PGF1α的含量,見表 3。
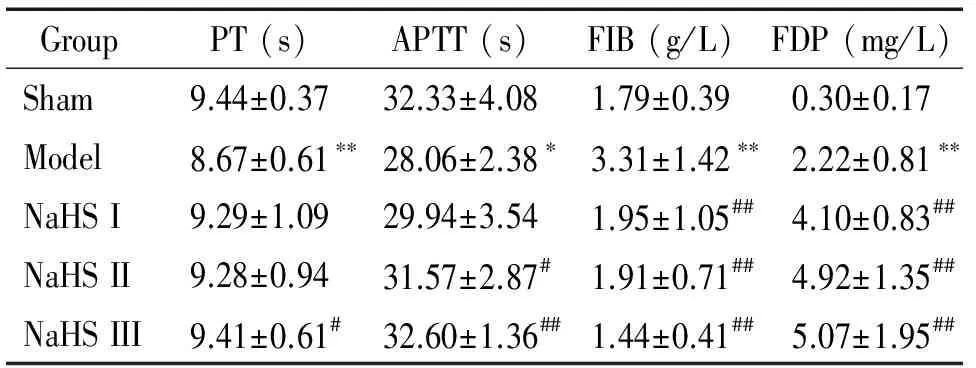
表2 不同濃度硫氫化鈉對 FeCl3誘導小鼠頸動脈血栓模型中凝血指標和纖溶活性指標的影響
*P<0.05,**P<0.01vssham;#P<0.05,##P<0.01vsmodel.
通過計算6-keto-PGF1α/TXB2的比值發現,與模型組相比,NaHS劑量依賴性地增加6-keto-PGF1α/TXB2,與血栓重量呈負相關(y=-0.0304x+0.2089,R2=0.8505),見圖2。
討 論
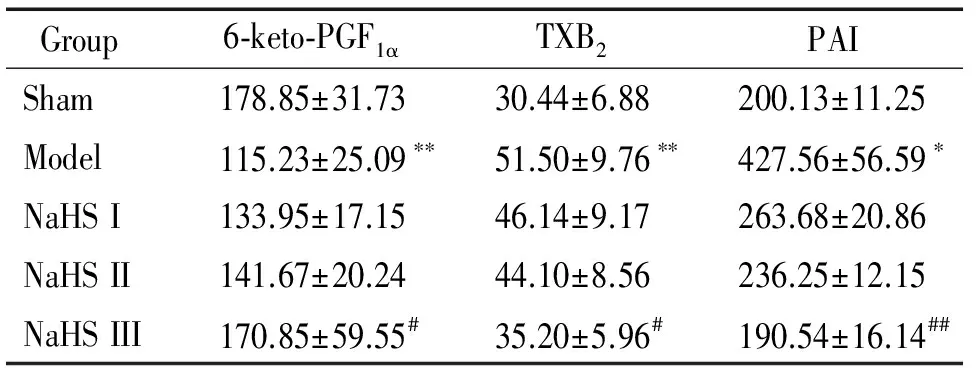
表3 不同濃度硫氫化鈉對FeCl3誘導頸動脈血栓模型中6-keto-PGF1α、TXB2及PAI的影響
*P<0.05,**P<0.01vssham;#P<0.05,##P<0.01vsmodel.
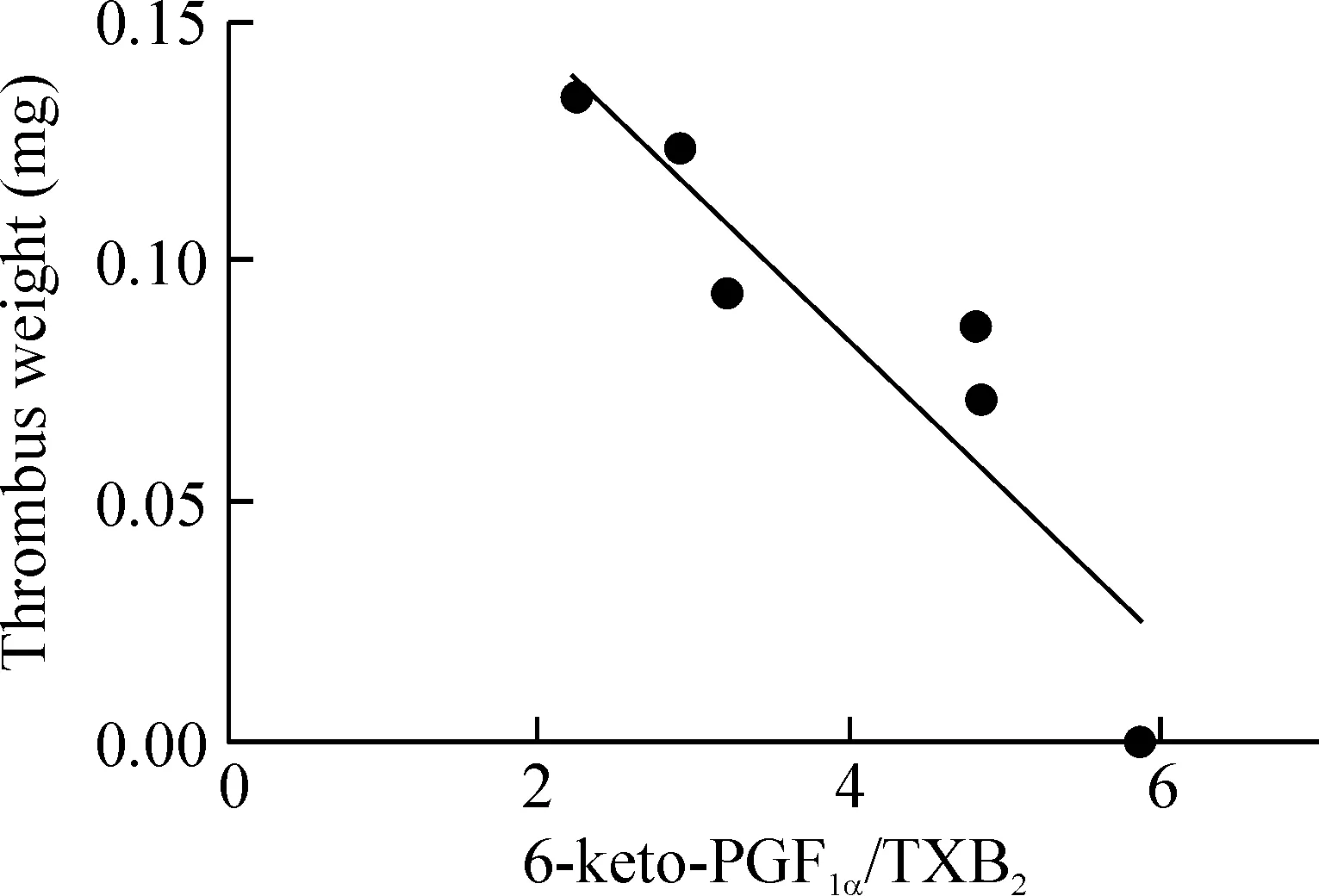
Figure 2.The correlation analysis between thrombus weight and the ratio of 6-keto-PGF1α/TXB2. y=-0.0304x+0.2089, R2=0.8505.
FeCl3誘導的頸動脈血栓是應用廣泛的血栓模型[16],通過氧化損傷血管內皮引起血小板黏附和聚表3 不同濃度硫氫化鈉對FeCl3誘導頸動脈血栓模型中6-keto-PGF1α、TXB2及PAI的影響集,導致血栓形成[17]。該模型對抗凝和抗血小板藥物敏感,已經在多種實驗性動物的動、靜脈上得到應用[18-19]。本研究中,我們通過稱量頸動脈血栓濕重,以及計算各組血栓抑制率,發現硫化氫具有抗血栓作用,并且高劑量NaHS作用更明顯,這與先前的報道有差異[20],可能與大小鼠模型對硫化氫的反應性不一致有關。FeCl3誘導的頸動脈血栓模型組PT和APTT縮短,提示機體處于高凝狀態,而硫化氫處理可延長凝血時間。在凝血系統被激活后,FIB被凝血酶水解后形成纖維蛋白單體,后者交聯成穩定的纖維蛋白多聚體;同時纖溶系統被激活,纖維蛋白在纖溶酶作用下降解成各種FDP,其中最小的片段為D-二聚體[21]。由于模型組中FIB含量增加,由于機體處于高凝狀態,已激活纖溶酶產生FDP,因此模型組FDP增加,而硫化氫處理后進一步激活機體纖溶系統,由FIB降解產生的FDP含量進一步增加。提示硫化氫可通過抑制凝血和激活纖溶系統抑制三氯化鐵誘導的血栓形成。PGI2和TXA2均是花生四烯酸的代謝產物,能夠動態調節血小板活化和血管張力。PGI2是一種有效的內源性血管擴張劑和血小板聚集抑制劑,能有效防止血小板黏附和聚集,并且通過保護血管內皮細胞的生物活性來抑制血栓形成。TXA2是血管重建和血小板聚集的有效誘導劑,并在血栓形成過程中起著關鍵作用[22]。在生理條件下,TXA2和PGI2維持血管張力和血液流變學的體內平衡。如果TXA2的合成增加,PGI2合成減少,TXA2/PGI2失去平衡,則會引起血管收縮,血小板黏附和聚集,進而血栓生成,并進一步導致動脈粥樣硬化,冠狀動脈痙攣,冠狀動脈血栓和心肌梗死[23- 24]。TXA2和PGI2是不穩定的,所以我們通過檢測相應的穩定代謝物TXB2和6-keto-PGF1α來反映TXA2和PGI2的水平。PAI-1是纖溶系統的主要調節劑。血漿過多的PAI-1使PA活性降低,進而降低纖溶活性,促進血栓形成。因此,我們通過檢測這些指標發現,模型組血漿中TXB2和PAI-1含量大大增加,6-keto-PGF1α顯著減少,血栓形成增多,并且6-keto-PGF1α/TXB2的比值與血栓重量呈負相關。而NaHS處理后明顯降低模型組中TXB2和PAI-1含量,增加6-keto-PGF1α含量,恢復6-keto-PGF1α/TXB2的比值。本實驗為研究硫化氫預防和治療血栓性疾病提供新的實驗依據。
[1] Fukami K, Kawabata A. Hydrogen sulfide and neuronal differentiation: focus on Ca2+channels[J]. Nitric Oxide, 2015, 46:50-54.
[2] Bekpinar S, Develi-Is S, Unlucerci Y, et al. Modulation of arginine and asymmetric dimethylarginine concentrations in liver and plasma by exogenous hydrogen sulfide in LPS-induced endotoxemia[J]. Can J Physiol Pharmacol, 2013, 91(12):1071-1075.
[3] Polhemus DJ, Calvert JW, Butler J, et al. The cardioprotective actions of hydrogen sulfide in acute myocardial infarction and heart failure.[J]. Scientifica (Cairo), 2014, 2014:768607.
[4] Eberhardt M, Dux M, Namer B, et al. H2S and NO cooperatively regulate vascular tone by activating a neuroendocrine HNO-TRPA1-CGRP signalling pathway[J]. Nat Commun, 2014, 5:4381.
[5] King AL, Polhemus DJ, Bhushan S, et al. Hydrogen sulfide cytoprotective signaling is endothelial nitric oxide synthase-nitric oxide dependent[J]. Proc Natl Acad Sci U S A, 2014, 111(8):3182-3187.
[6] Liu J, Hao DD, Zhang JS, et al. Hydrogen sulphide inhibits cardiomyocyte hypertrophy by up-regulating miR-133a[J]. Biochem Biophys Res Commun, 2011, 413(2):342-347.
[8] Lee SW, Cheng Y, Moore PK, et al. Hydrogen sulphide regulates intracellular pH in vascular smooth muscle cells[J]. Biochem Biophys Res Commun, 2007, 358(4):1142-1147.
[9] 謝英花, 馬燕山, 張 楠, 等. 硫化氫抑制大鼠急性心肌缺血引起的細胞炎癥反應[J]. 中國病理生理雜志, 2014, 30(9):1698-1702.
[10]張建新, 葛 寧, 劉 超, 等. 硫化氫通過GSK-3β/β-catenin信號途徑介導心肌損傷后抗細胞凋亡作用[J]. 中國病理生理雜志, 2016, 32(8):1505.
[11]Kimura H. Hydrogen sulfide: its production, release and functions[J]. Amino Acids, 2011, 41(1):113-121.
[12]Morel A, Malinowska J, Olas B. Antioxidative properties of hydrogen sulfide may involve in its antiadhesive action on blood platelets[J]. Clin Biochem, 2012, 45(18):1678-1682.
[13]Zagli G, Patacchini R, Trevisani M, et al. Hydrogen sulfide inhibits human platelet aggregation[J]. Eur J Pharmacol, 2007, 559(1):65-68.
[14]Nishikawa H, Hayashi H, Kubo S, et al. Inhibition by hydrogen sulfide of rabbit platelet aggregation and calcium mobilization[J]. Biol Pharm Bull, 2013, 36(8):1278-1282.
[15]Yeh JC, Huang KL, Hsiao YC, et al. A rat model of thrombosis in common carotid artery induced by implan-table wireless light-emitting diode device[J]. Biomed Res Int, 2014, 2014:724134.
[16]Whinna HC. Overview of murine thrombosis models[J]. Thromb Res, 2008, 122(Suppl 1):S64-S69.
[17]Du H, Zawaski JA, Gaber MW, et al. A recombinant protein and a chemically synthesized peptide containing the active peptides of the platelet collagen receptors inhibit ferric chloride-induced thrombosis in a rat model[J]. Thromb Res, 2007, 121(3):419-426.
[18]Kurz KD, Main BW, Sandusky GE. Rat model of arterial thrombosis induced by ferric chloride[J]. Thromb Res, 1990, 60(4):269-280.
[19]Chen K, Li W, Major J, et al. Vav guanine nucleotide exchange factors link hyperlipidemia and a prothrombotic state[J]. Blood, 2011, 117(21):5744-5750.
[20]Qin YR, You SJ, Zhang Y, et al. Hydrogen sulfide attenuates ferric chloride-induced arterial thrombosis in rats[J]. Free Radic Res, 2016, 50(6):654-665.
[21]Adam SS, Key NS, Greenberg CS. D-dimer antigen: current concepts and future prospects[J]. Blood, 2009, 113(13):2878-2887.
[22]FitzGerald GA, Healy C, Daugherty J. Thromboxane A2 biosynthesis in human disease[J]. Fed Proc, 1987, 46(1):154-158.
[23]Sambola A, Osende J, Hathcock J, et al. Role of risk factors in the modulation of tissue factor activity and blood thrombogenicity[J]. Circulation, 2003, 107(7):973-977.
[24]Qiu C, Muchant D, Beierwaltes WH, et al. Evolution of chronic nitric oxide inhibition hypertension: relationship to renal function.[J]. Hypertension, 1998, 31(1):21-26.
(責任編輯: 林白霜, 羅 森)
Effect of hydrogen sulfide on coagulation and fibrinolysis in FeCl3-induced mouse carotid artery thrombosis model
BIAN Dong-yan, LIU Hong-xu, LIANG Yu-min, WANG Yao, WU Hong-ting, LI Peng-peng, HUANG Lin-yan
(MedicalTechnologyCollege,XuzhouMedicalUniversity,Xuzhou221004,China.E-mail:huangly1985@xzhmu.edu.cn)
AIM: To explore the influence of exogenous hydrogen sulfide (H2S) on coagulation and fibrinolysis in ferric chloride (FeCl3)-induced mouse carotid artery thrombosis. METHODS: The mice were divided into sham control group, model group, different concentrations (12.5, 25 and 50 μmol/kg) of sodium hydrosulfide (NaHS, H2S donor) groups and 30 mg/kg clopidogrel (positive control) group. Intraperitoneal injection of NaHS at different concentrations and oral administration of clopidogrel bisulfate were performed for 3 d prior to FeCl3-induced carotid artery thrombosis. The frozen sections of the carotid artery were collected to perform HE staining, and the thrombus pattern and the changes of vascular pathology were observed. The thrombus was weighed to calculate thrombosis inhibitory rate. Prothrombin time (PT), activated partial thromboplastin time (APTT), fibrinogen (FIB) and fibrinogen degradation product (FDP) in the mice were also measured by a coagulometer. The plasma levels of thromboxane B2(TXB2), 6-keto-prostaglandin F1α(6-keto-PGF1α) and plasminogen activator inhibitor (PAI) were detected by ELISA. RESULTS: Compared with model group, NaHS dose-dependently inhibited the formation of carotid artery thrombus. NaHS treatment reduced the contents of TXB2and PAI, and recovered 6-keto-PGF1αcontent in thrombosis model group. In NaHS treatment groups, 6-keto-PGF1α/TXB2and thrombus weight was negatively correlated. NaHS treatment prolonged PT and APTT, reduced the content of FIB, but increased the level of FDP in thrombosis model group.CONCLUSION: Hydrogen sulfide prevents FeCl3-induced carotid artery thrombosis by inhibiting coagulation and activating fibrinolysis.
Hydrogen sulfide; Thrombus; Coagulation; Fibrinolysis; Thromboxane B2
1000- 4718(2017)03- 0523- 05
2016- 06- 27
2017- 01- 12
國家自然科學基金青年項目(No. 81402918);江蘇省科技廳青年項目(No.BK20140228); 2014年大學生創新創業訓練計劃(No.201410313072X)
△通訊作者 Tel: 0516-83262995; E-mail: huangly1985@xzhmu.edu.cn
R363; R543
A
10.3969/j.issn.1000- 4718.2017.03.023

