成纖維細胞生長因子10抑制脂多糖刺激下BV2細胞的活化*
潘舒琳, 何笑笑, 胡瑩瑩, 方明楚, 姜 槐, 肖 健, 林振浪△
(1溫州醫科大學附屬第二醫院、育英兒童醫院新生兒科,浙江 溫州 325027; 2溫州醫科大學藥學院,浙江 溫州 325035)
成纖維細胞生長因子10抑制脂多糖刺激下BV2細胞的活化*
潘舒琳1, 何笑笑1, 胡瑩瑩1, 方明楚1, 姜 槐1, 肖 健2△, 林振浪1△
(1溫州醫科大學附屬第二醫院、育英兒童醫院新生兒科,浙江 溫州 325027;2溫州醫科大學藥學院,浙江 溫州 325035)
目的: 探索成纖維細胞生長因子10(fibroblast growth factor 10,FGF10)對脂多糖(lipopolysaccharide,LPS)刺激下小膠質細胞BV2活化的影響。方法: 小鼠BV2小膠質細胞用細胞培養基DMEM培養,置于37 ℃、5% CO2、飽和濕度的培養箱中培養,1~2 d換液,4~5 d傳代。實驗分為對照組、LPS組和FGF10組,FGF10組的BV2細胞預先給予FGF10 1 mg/L 30 min后,在LPS組和FGF10組中加入500 mg/L的LPS,在不同時點進行檢測。用倒置顯微鏡觀察小膠質細胞的形態學改變, RT-qPCR和ELISA分別檢測腫瘤壞死因子α(TNF-α)轉錄和蛋白表達水平的改變來觀測BV2 細胞的活化情況。結果: 靜息狀態下BV2細胞形態呈圓形或橢圓形,經過24 h LPS刺激后,BV2細胞形狀向多極或紡錘樣改變,活化細胞數量比值明顯高于對照組;預先給予FGF10能抑制LPS刺激下的BV2細胞向活化形態改變,活化的BV2細胞明顯減少。給予LPS刺激6 h后,LPS組TNF-α的mRNA水平相比于對照組顯著升高,然而預先給予FGF10會顯著抑制TNF-α的轉錄。 LPS作用24 h后,細胞培養上清液內TNF-α的表達水平與對照組相比顯著上升,而預先給予FGF10在蛋白水平顯著抑制TNF-α的表達。結論: FGF10能夠成功抑制LPS刺激下BV2細胞的活化,有望成為治療經膠質細胞介導的神經系統炎癥性疾病的一種有效藥物。
成纖維細胞生長因子10; BV2細胞; 脂多糖; 腫瘤壞死因子α
炎癥反應是許多中樞神經系統性疾病中十分重要的病理過程。小膠質細胞是中樞神經系統炎癥和免疫反應的主效應細胞,約占所有膠質細胞的10%~20%[1]。正常情況下,小膠質細胞促進神經元的發育,維持中樞神經系統的穩態。當中樞神經系統受到炎癥,感染,缺氧等病理刺激時,小膠質細胞被激活,細胞功能向巨噬細胞轉化。當小膠質細胞受到脂多糖(lipopolysaccharide, LPS)持續激活后將釋放大量的炎癥介質如前列腺素E2(prostaglandin E2, PGE2)、腫瘤壞死因子α(tumor necrosis factor-α, TNF-α)、白細胞介素1β (interleukin-1β, IL-1β)、白細胞介素6 (interleukin-6, IL-6)等[2-3],這些炎癥因子一旦過度表達將加劇神經元損傷,同時參與一些與炎癥和神經變性相關的中樞神經系統疾病的病理過程,包括腦外傷、腦卒中、腦退行性疾病、感染等[4-5]。因此,抑制小膠質細胞過度活化可能是治療神經系統炎癥性疾病的一種有效方法。
成纖維細胞生長因子10(fibroblast growth factor 10,FGF10)是成纖維細胞生長因子家族的成員之一。FGF10與細胞的生長、增殖、分化和遷移有關,能促進四肢、肺、脂肪組織和前列腺的發育[6-8]。在對動物模型的研究發現,FGF10可以用于治療急性肺損傷、肺炎、干眼等疾病[9-11]。FGF10的治療作用可能與病理過程的炎癥反應被抑制有關系[9-10],但FGF10是否能夠通過抑制小膠質細胞活化從而減少炎癥反應尚未完全清楚。本研究希望證實FGF10能夠抑制LPS刺激下的BV2細胞活化,為FGF10治療由膠質細胞介導的神經系統炎癥性疾病提供理論依據。
材 料 和 方 法
1 主要試劑以及儀器
BV2細胞購于中國協和醫科大學細胞中心;DMEM培養基 (Gibco);TNF-α ELISA試劑盒(eBioscience);LPS (Sigma);FGF10 (Grostre Biotech);iQTMSYBR? Green Supermix (Bio-Rad);TRIzol試劑(Roche);PrimeScriptTMRT試劑盒 (TaKaRa)。CFX96 TouchTM熒光定量PCR儀(Bio-Rad);倒置顯微鏡(NIKON)。
2 方法
2.1 細胞培養與分組 小鼠BV2小膠質細胞用DMEM培養基(含1×105U/L青霉素、10 mg/L鏈霉素、10 mmol/L谷氨酰胺以及10%小牛血清)培養,置于37 ℃、5% CO2、飽和濕度的培養箱中培養,1~2 d換液,4~5 d傳代。實驗分為對照(control)組、LPS組和FGF10組。提前一晚將細胞均勻鋪在6孔板上,FGF10組的BV2細胞預先給予FGF10 1 mg/L 30 min后,在LPS組和FGF10組中加入500 μg/L的LPS,刺激6 h或24 h。
2.2 ELISA試劑盒檢測TNF-α蛋白表達情況 LPS刺激24 h后,收集上清液1.5 mL于Eppendorf管中,按照ELISA檢測試劑盒的說明書進行操作,測定上清液中TNF-α的表達情況。
2.3 RT-qPCR檢測TNF-α的轉錄水平 收集經LPS刺激6 h后的BV2細胞,用TRIzol抽提總RNA,抽提步驟根據生產商提供的方法進行,然后將總RNA逆轉錄成cDNA。逆轉錄后得到的cDNA通過熒光定量PCR的方法,檢測熒光信號強度,然后轉化成為Ct值。β-actin作為管家基因用以消除因標本處理、PCR反應和逆轉錄不同而出現的差異。因此,用TNF-α與內參照β-actin mRNA含量比值作為TNF-α的mRNA表達水平指標。TNF-α的正義鏈是5’-TGATCCGCGACGTGGAA-3’, 反義鏈是5’-ACCGCCTGGAGTTCTGGAA-3’; β-actin的正義鏈是5’-CCGTGAAAAGATGACCCAGA-3’,反義鏈是5’-TACGACCAGAGGCATACAG-3’。
2.4 倒置顯微鏡觀察細胞形態學變化 LPS刺激24 h后,將細胞放在倒置顯微鏡下觀察,放大倍數200倍。每組樣品取3個視野計數,重復3次。活化的BV2細胞的相對值=(多極型細胞+紡錘樣雙極細胞)/總細胞數量。
3 統計學處理
用GraphPad Prism 5軟件中單因素方差分析的Tukey法來分析數據。計量數據用均數±標準差(mean±SD)表示,以P<0.05為差異有統計學意義。
結 果
1 FGF10對LPS刺激下BV2細胞形態學的影響
我們在200倍顯微鏡下觀察了對照組、LPS組和FGF10組BV2細胞的形態學改變。處于靜息狀態下的BV2細胞形態呈圓形或橢圓形,體積較小。經過LPS刺激24 h后,LPS組的BV2細胞因受到激活體積相對于對照組增大,且形狀從圓形或橢圓形向分枝樣改變。活化的BV2細胞中一些向多極細胞轉變,一些向兩極延長、呈紡錘樣改變。然而,FGF10組在預先給予FGF10 (1 mg/L)的情況下,活化的BV2細胞相對于LPS組明顯減少。通過統計活化的小膠質細胞數占總細胞數量的比值我們可以得到相同的結果。LPS組活化的小膠質細胞占總細胞數量的比值明顯高于對照組(P<0.01),而預先給予FGF10可以降低活化細胞比值(P<0.05),見圖1。
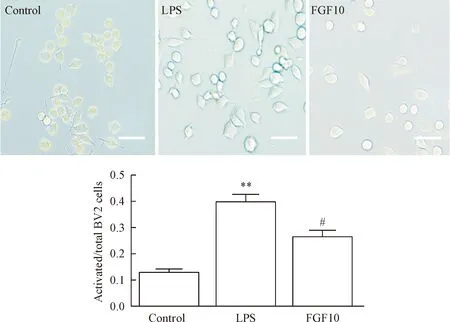
Figure 1.The effect of FGF10 on the morphological changes of LPS-induced BV2 microglia. The scale bar=200 μm. Mean±SD. n=3. **P<0.001 vs control group; #P<0.05 vs LPS group.
2 FGF10抑制LPS刺激下BV2細胞TNF-α的轉錄水平
給予LPS刺激6 h后,用RT-qPCR檢測促炎癥因子TNF-α的轉錄水平。如圖2所示,予以500 μg/L LPS刺激后,LPS組TNF-α的mRNA水平相比于對照組顯著升高(P<0.01),然而FGF10組TNF-α的mRNA表達量相比LPS組顯著下降(P<0.05)。
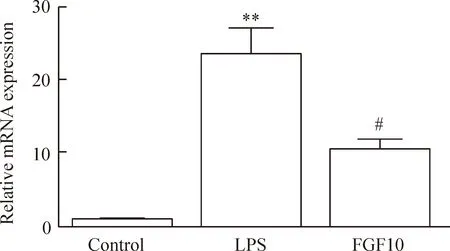
Figure 2.The effect of FGF10 on the mRNA expression of TNF-α in the BV2 microglial cells stimulated with LPS. Mean±SD. n=3. **P<0.01 vs control group; #P<0.05 vs LPS group.
3 FGF10抑制LPS刺激下BV2細胞TNF-α的蛋白表達
我們分別用100 μg/L、250 μg/L、500 μg/L、1.0 mg/L和1.5 mg/L LPS濃度刺激BV2小膠質細胞,然后通過檢測24 h后TNF-α的蛋白表達量來選擇合適的LPS劑量。結果如圖3所示,隨著LPS劑量增加TNF-α表達量與對照組相比明顯增加(P<0.05),且當LPS濃度為500 μg/L時達到最大值,而1.0 mg/L組和1.5 mg/L組與500 μg/L組比較TNF-α表達量的差異無統計學顯著性。因此,我們將LPS濃度500 μg/L作為最適刺激濃度。LPS作用24 h后,細胞培養上清液內TNF-α的水平與對照組相比顯著上升(P<0.01),這種表現與轉錄水平的上升趨勢是一致的。而預先給予FGF10在蛋白水平顯著抑制TNF-α的表達(P<0.01),見圖4。
討 論
成纖維細胞生長因子家族具有多種生化和生物學功能。它們在胚胎發育,維持穩態,應對損傷反應,調節細胞的電生理興奮性等方面中扮演著十分重要的角色[12]。FGF10是成纖維細胞生長因子家族中的成員,參與了多種生理和病理過程,包括了修復和再生等[13]。FGF10在治療肺部疾病中的效果明顯且應用廣泛,包括了博來霉素引起的肺纖維化[14],高原肺水腫[15],缺血再灌注肺損傷[16]等。Tong等[9]在FGF10對LPS引起的急性肺損傷的影響的研究中發現,FGF10促進肺組織的修復,明顯抑制支氣管肺泡灌洗液和肺組織中的IL1β、TNFα等促炎癥因子表達。Feng 等[10]用FGF10治療銅綠假單胞菌肺炎不但可以增加7 d生存率而且肺部的IL-6和TNF-α水平明顯降低。以上的研究結果提示,FGF10可能通過抑制炎癥反應從而改善肺部疾病的修復情況。

Figure 3.The effect of LPS at different concentrations on protein expression of TNF-α in the activated BV2 microglia. Mean±SD. n=3. **P<0.01 vs 0 μ/L.
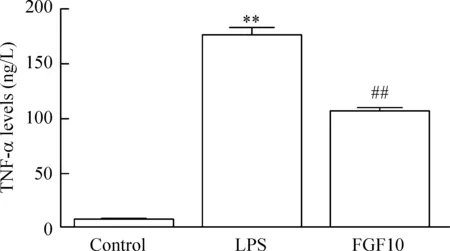
Figure 4.The effect of FGF10 on the protein of TNF-α in the BV2 microglial cells stimulated with LPS. Mean±SD. n=3. **P<0.01 vs control group; ##P<0.01 vs LPS group.
許多中樞神經系統疾病的病理過程中均有炎癥反應的參與,如帕金森綜合征,阿爾茲海默疾病,多發性硬化,腦外傷,感染,腦缺血再灌注損傷等。而中樞神經系統中的小膠質細胞在炎癥反應過程中占據著重要的位置。正常情況下,小膠質細胞具有神經保護的作用,但是一旦受到病理因素的刺激后,它的形態會從靜息態轉變成活化態[17]。LPS是一種常見的細胞內毒素,它能夠激活細胞中重要的病理機制,并且這些病理機制常常存在于炎癥反應的病理過程中。LPS被廣泛應用于模擬革蘭氏陰性菌感染引起的小膠質細胞活化。因此,LPS激活小膠質細胞的模型可用于研究與炎癥反應有關的中樞神經系統疾病中的小膠質細胞活化的機制以及小膠質細胞對神經元的損傷機制。
本研究采用LPS作為刺激BV2細胞活化的病理刺激原。在LPS激活BV2小膠質細胞的相關文獻中,LPS的參考劑量一般在100 μg/L~1 mg/L范圍內[1, 18]。我們用不同濃度 LPS刺激BV2小膠質細胞,然后通過檢測24 h后TNF-α的蛋白表達量來選擇合適的LPS劑量。結果顯示濃度500 μg/L LPS作為最適刺激濃度。激活狀態下的小膠質細胞會大量轉錄和翻譯促炎癥因子,如一氧化氮(nitric oxide,NO)、PGE2、TNF-α、IL-1β和IL-6 等。本研究發現,BV2細胞在500 μg/L LPS刺激時細胞形態發生明顯的改變,細胞胞體增大且細胞向紡錘樣的雙極細胞或多極細胞轉變。在給予LPS刺激后,BV2細胞的TNF-α轉錄和蛋白表達水平明顯提高了。促炎癥因子TNF-α在轉錄和蛋白表達水平顯著升高以及小膠質細胞形態上向活化態改變的表現均提示了小膠質細胞在LPS刺激下發生了明顯的活化轉變。而大量促炎癥因子的產生將大大加重中樞神經系統的炎癥反應,加劇神經元的損傷。
有研究顯示促炎癥因子過表達與一些中樞神經系統退行性疾病有關,如阿爾茲海默、帕金森綜合癥、多發性硬化[19-20]等。因此,抑制炎癥因子產生成為控制中樞神經系統炎癥反應的重要機制。本研究發現,在給予LPS刺激后,BV2細胞的TNF-α轉錄和蛋白表達水平明顯提高了,而預先給予FGF10則明顯減少了在形態學上向活化態轉變的小膠質細胞,同時抑制了促炎癥因子TNF-α的轉錄和蛋白表達。說明FGF10具有抑制小膠質細胞活化的作用。這個結果提示,FGF10可能具有抑制中樞神經系統炎癥反應的功能。一項支氣管肺發育不良的研究發現,FGF10與Toll樣受體的炎癥信號通路有關[21]。既往的研究已經證實,中樞神經系統中的炎癥反應與Toll樣受體信號通路激活有關[22]。因此我們推測,FGF10有可能通過作用于BV2細胞上Toll樣受體信號通路對炎癥反應產生影響,這需要我們在后續實驗中進一步證實。
綜上所述,預先給予FGF10夠能抑制LPS刺激下的BV2細胞形態向活化方向改變,同時減少小膠質細胞BV2細胞對促炎癥因子TNF-α的轉錄和蛋白表達,表明FGF10有可能對膠質細胞介導的神經系統炎癥性疾病具有保護作用。FGF10有望成為治療經膠質細胞介導的神經系統炎癥性疾病的一種有效藥物。
[1] Dang Y, Mu Y, Wang K, et al. Papaverine inhibits lipopolysaccharide-induced microglial activation by suppressing NF-κB signaling pathway[J]. Drug Des Dev Ther, 2016, 10:851-859.
[2] Park J, Min JS, Kim B, et al. Mitochondrial ROS govern the LPS induced pro-inflammatory response in microglia cells by regulating MAPK and NF-κB pathways[J]. Neurosci Lett, 2015, 584:191-196.
[3] Velagapudi R, Aderogba M, Olajide OA. Tiliroside, a dietary glycosidic flavonoid,inhibits TRAF-6/NF-κB/p38-mediated neuroinflammation in activated BV2 microglia[J]. Biochim Biophys Acta, 2014, 1840(12):3311-3319.
[4] Walker DG, Whetzel AM, Lue LF. Expression of suppressor of cytokine signaling genes in human elderly and Alzheimer’s disease brains and human microglia[J]. Neuroscience, 2015, 302:121-137.
[5] Kim YS, Joh TH. Microglia, major player in the brain inflammation: their roles in the pathogenesis of Parkinson’s disease[J]. Exp Mol Med, 2006, 38(4):333-347.
[6] Sekine K, Ohuchi H, Fujiwara M, et al. Fgf10 is essential for limb and lung formation[J]. Nat Genet, 1999, 21(1):138-141.
[7] Sakaue H, Konishi M, Ogawa W, et al. Requirement of fibroblast growth factor 10 in development of white adipose tissue[J]. Genes Dev, 2002, 16(8):908-912.
[8] Thomson AA, Cunha GR. Prostatic growth and development are regulated by FGF10[J]. Development, 1999, 126(16):3693-3701.
[9] Tong L, Bi J, Zhu X, et al. Keratinocyte growth factor-2 is protective in lipopolysaccharide-induced acute lung injury in rats[J]. Respir Physiol Neurobiol, 2014, 201:7-14.
[10]Feng N, Wang Q, Zhou J, et al. Keratinocyte growth factor-2 inhibits bacterial infection withPseudomonasaeruginosapneumonia in a mouse model[J]. J Infect Chemo-ther, 2016, 22(1):44-52.
[11]Zheng W, Ma M, Du E, et al. Therapeutic efficacy of fibroblast growth factor 10 in a rabbit model of dry eye[J]. Mol Med Rep, 2015, 12(5):7344-7350.
[12]Itoh N, Ornitz DM. Fibroblast growth factors: from molecular evolution to roles in development, metabolism and disease[J]. J Biochem, 2011, 149(2):121-130.
[13]Jurjus A, Atiyeh BS, Abdallah IM, et al. Pharmacological modulation of wound healing in experimental burns[J]. Burns, 2007, 33(7):892-907.
[14]Gupte VV, Ramasamy SK, Reddy R, et al. Overexpression of fibroblast growth factor-10 during both inflammatory and fibrotic phases attenuates bleomycin-induced pulmonary fibrosis in mice[J]. Am J Respir Crit Care Med, 2009, 180(5):424-436.
[15]She J, Goolaerts A, Shen J, et al. KGF-2 targets alveolar epithelia and capillary endothelia to reduce high altitude pulmonary oedema in rats[J]. J Cell Mol Med, 2012, 16(12):3074-3084.
[16]Fang X, Wang L, Shi L, et al. Protective effects of keratinocyte growth factor-2 on ischemia-reperfusion-induced lung injury in rats[J]. Am J Respir Cell Mol Biol, 2014, 50(6):1156-1165.
[17]曾 琪, 戚仁斌, 胡巢鳳, 等. PYNOD對LPS活化的BV2小膠質細胞炎癥因子釋放的影響[J]. 中國病理生理雜志, 2014, 30(11):1954-1959.
[18]Sun HN, Shen GN, Jin YZ, et al. 2-cyclohexylamino-5, 8-dimethoxy-1, 4-naphthoquinone inhibits LPS-induced BV2 microglial activation through MAPK/NF-κB signaling pathways[J]. Heliyon, 2016, 2(7):e00132.
[19]Tansey MG, McCoy MK, Frank-Cannon TC, et al. Neuroinflammatory mechanisms in Parkinson’s disease: potential environmental triggers, pathways, and targets for early therapeutic intervention[J]. Exp Neurol, 2007, 208(1):1-25.
[20]Wilms H, Zecca L, Rosenstiel P, et al. Inflammation in Parkinson’s diseases and other neurodegenerative diseases: cause and therapeutic implications[J]. Curr Pharm Des, 2007, 13(18):1925-1928.
[21]Benjamin JT, Smith RJ, Halloran BA, et al. FGF-10 is decreased in bronchopulmonary dysplasia and suppressed by Toll-like receptor activation[J]. Am J Physiol Lung Cell Mol Physiol, 2007, 292(2): L550-L558.
[22]Wang D, Shi J, Lv S, et al. Artesunate attenuates lipopolysaccharide-stimulated proinflammatory responses by suppressing TLR4, MyD88 expression, and NF-κB activation in microglial cells[J]. Inflammation, 2015, 38(5): 1925-1932.
(責任編輯: 林白霜, 羅 森)
Fibroblast growth factor 10 inhibits lipopolysaccharide-induced microglial activation
PAN Shu-lin1, HE Xiao-xiao1, HU Ying-ying1, FANG Ming-chu1, JIANG Huai1, XIAO Jian2, LIN Zhen-lang1
(1DepartmentofNeonatology,TheSecondAffiliatedHospital&YuyingChildren’sHospitalofWenzhouMedicalUniversity,Wenzhou325027,China;2SchoolofPharmacy,WenzhouMedicalUniversity,Wenzhou325035,China.E-mail:xfxj2000@126.com;linzhenlang@hotmail.com)
AIM: To investigate the effects of fibroblast growth factor 10 (FGF10) on lipopolysaccharide (LPS)-induced microglial activation. METHODS: Mouse BV2 microglial cells were maintained in DMEM in a humidified incubator with 95%/5% (V/V) mixture of air and CO2at 37 ℃. The medium was changed every 1 or 2 d. The cells were digested and passaged every 4 or 5 d. The BV2 microglial cells were first pretreated with FGF10 (1 mg/L) for 30 min and then stimulated with LPS (500 μg/L). The medium and the cells were collected at different time points. The morphological changes of microglia were visualized under microscope. To evaluate the microglial activation, the transcription and production of proinflammatory factor tumor necrosis factor-α (TNF-α) were examined by real-time quantitative polymerase chain reaction (RT-qPCR) and enzyme-linked immunosorbent assay (ELISA), respectively. RESULTS: The morphology of control BV2 microglia showed circular or oval shape. After exposure to LPS for 24 h, the microglia revealed spindle shaped or multipolar morphology, and the percentage of activated cells was significantly increased compared with control group. Pretreatment with FGF10 successfully inhibited the morphological change from normal to activated shape. LPS sti-mulation for 6 h significantly increased the transcription of TNF-α, while FGF10 pretreatment remarkably reversed the effect. In addition, the production of TNF-α increased in the presence of LPS stimulation for 24 h compared with control group. Pretreatment with FGF10 suppressed LPS-induced TNF-α expression.CONCLUSION: Pretreatment with FGF10 inhibits the morphological change from normal to activated shape, and remarkably suppressed the transcription and production of TNF-α. FGF10 successfully suppresses LPS-induced BV2 microglial activation, indicating that FGF10 is a therapeutic agent for the treatment of glia-mediated neuroinflammatory diseases.
Fibroblast growth factor 10; BV2 cells; Lipopolysaccharide; Tumor necrosis factor-α
1000- 4718(2017)03- 0534- 05
2016- 10- 09
2016- 12- 15
2014年度溫州市科技局公益性科技計劃(No. Y20140681)
△通訊作者 肖健 Tel: 0577-85773087; E-mail: xfxj2000@126.com; 林振浪 Tel: 0577-88002798; E-mail: linzhenlang@hotmail.com
R363.2
A
10.3969/j.issn.1000- 4718.2017.03.025

