腺病毒介導的shRNA下調PTEN表達對活化肝星狀細胞骨架蛋白F-actin的影響*
郝禮森, 宋小杰, 章廣玲, 王 靜, 劉 博, 張朋壘, 張明婷, 靳麗敏
(華北理工大學 1附屬醫院消化內科, 2基礎醫學院,河北 唐山 063000)
腺病毒介導的shRNA下調PTEN表達對活化肝星狀細胞骨架蛋白F-actin的影響*
郝禮森1△, 宋小杰1, 章廣玲2, 王 靜1, 劉 博1, 張朋壘1, 張明婷1, 靳麗敏1
(華北理工大學1附屬醫院消化內科,2基礎醫學院,河北 唐山 063000)
目的: 探討腺病毒介導的shRNA下調第 10 號染色體缺失的磷酸酶張力蛋白同源物(PTEN)基因表達對體外培養的活化肝星狀細胞(HSC)纖絲狀肌動蛋白(F-actin)的影響。方法: 體外培養大鼠活化HSC(HSC-T6),將攜帶靶向PTEN的RNA干擾序列[短發夾RNA(shRNA)]并表達綠色熒光蛋白(GFP)的重組腺病毒Ad-shRNA/PTEN及僅表達GFP的對照空病毒Ad-GFP轉染HSC,實時熒光定量PCR及Western blotting實驗檢測HSC的PTEN mRNA及蛋白表達;利用激光掃描共聚焦顯微鏡檢測HSC的形態、F-actin的分布及熒光強度、偽足以及應力纖維的變化,并采用鈣熒光探針Rhod-2/AM負載檢測HSC內Ca2+濃度的變化。實驗分為對照(control)組(在腺病毒轉染步驟以DMEM代替腺病毒液)、Ad-GFP組(轉染表達GFP的空病毒Ad-GFP)和Ad-shRNA/PTEN組(轉染重組腺病毒Ad-shRNA/PTEN)。結果: 靶向PTEN的shRNA成功轉染體外活化HSC,顯著下調HSC的PTEN mRNA及蛋白表達(P<0.05);PTEN表達下調使活化HSC呈星形向四周伸展,F-actin排列緊密規則,數量增多,偽足充分向外伸展,應力纖維絲增長增粗;Ad-shRNA/PTEN組F-actin的熒光強度較control組及Ad-GFP組顯著增強(P<0.05),而control組與Ad-GFP組間差異無統計學顯著性;Ad-shRNA/PTEN組HSC內Ca2+濃度較control組及Ad-GFP組明顯升高(P<0.05),而control組與Ad-GFP組間差異無統計學顯著性。結論: PTEN表達下調使體外活化肝星狀細胞骨架蛋白F-actin的形成及細胞骨架的重構增強,并增加了HSC內的Ca2濃度。
PTEN; RNA干擾; 肝星狀細胞; 細胞骨架; 纖絲狀肌動蛋白
肝纖維化是肝臟對各種損傷產生修復反應的病理過程,其特征是以膠原為主的細胞外間質在肝臟中的過度沉積,而肝星狀細胞(hepatic stellate cell, HSC)是參與此過程的主要細胞。HSC活化時伸展為星芒狀的肌成纖維樣細胞,并在損傷部位黏附、遷移,進而表達各種細胞信號分子,產生大量細胞外間質[1-2]。研究發現細胞遷移與細胞骨架重構有關[3-4]。而肌動蛋白(actin)則是構成細胞骨架的重要骨架蛋白,其功能除了參與維持細胞的正常形態外,還參與調控細胞的應力纖維形成、黏附、遷移、凋亡、物質運輸、跨膜信息傳遞以及受體聚集等[5]。Actin以可溶性的單體球形肌動蛋白(globular actin, G-actin)和聚合體纖絲狀肌動蛋白(filamentous actin, F-actin)2種形式存在,且只有F-actin具有生物學活性作用[6]。而第 10 號染色體缺失的磷酸酶張力蛋白同源物(phosphatase and tensin homology detected on chromosome 10,PTEN)基因是迄今發現的第一個具有脂質磷酸酶活性及蛋白磷酸酶活性的腫瘤抑制基因,其低表達或缺失可影響腫瘤細胞的細胞骨架重構[7-8]。近年來對PTEN的研究已從腫瘤領域逐漸延伸到非腫瘤領域,有研究發現大鼠纖維化肝組織及在體肝星狀細胞中的PTEN表達均下調[9-10]。但PTEN表達下調對肝星狀細胞骨架蛋白F-actin的影響仍不清楚。為此,本研究利用RNA干擾技術,將靶向PTEN的RNA干擾序列——短發夾RNA(short hairpin RNA, shRNA)轉染體外培養的活化HSC,構建HSC的PTEN低表達模型,以觀察下調PTEN表達對活化肝星狀細胞骨架蛋白F-actin的影響。
材 料 和 方 法
1 細胞與試劑
表型活化的大鼠肝星狀細胞系HSC-T6及293A細胞購于中國醫學科學院腫瘤醫院;將冷凍保存的肝星狀細胞復蘇后接種于含10%胎牛血清(Biological Industries)DMEM(Gibco)完全培養基的細胞培養瓶中,于37 ℃、5% CO2培養箱內培養并傳代;攜帶靶向PTEN的shRNA并表達綠色熒光蛋白(green fluorescent protein, GFP)的重組腺病毒Ad-shRNA/PTEN由武漢浙瑪生物技術公司協助構建,僅表達GFP的空病毒由第三軍醫大學祝善俊教授惠贈,通過反復感染293A細胞的方法進行擴增,并測定其滴度;熒光素四甲基異硫氰酸羅丹明(tetramethylrhodamine isothiocyanate, TRITC)標記的鬼筆環肽購于上海翊圣生物有限公司;DAPI及Triton X-100購于Sigma;熒光防淬滅封片劑購于Bioworld;鈣熒光探針Rhod-2/AM購于Invitrogen;小鼠抗PTEN單克隆抗體購于Abcam;兔抗3-磷酸甘油醛脫氫酶(glyseraldehyde-3-phosphate dehydrogenase, GAPDH)單克隆抗體購于Affinity;Platinum SYBR Green qPCR SuperMix-UDG和逆轉錄反應體系均購于上海英俊生物技術有限公司;HRP標記的山羊抗兔及山羊抗小鼠IgG購于KRL。
2 方法
2.1 腺病毒轉染體外活化的HSC 以含10%胎牛血清的DMEM培養液培養HSC,當細胞生長至80%融合時,以感染復數(multiplicity of infection, MOI)為100進行腺病毒轉染。確定所需病毒顆粒量(細胞數×MOI),用不含血清及抗生素的DMEM培養液稀釋后加入細胞培養瓶,使其均勻分布于培養瓶底部,于37 ℃、5% CO2細胞培養箱中孵育2 h,每隔20 min輕輕搖晃培養瓶以促進感染。2 h后補充適量完全培養基后繼續培養至實驗所需時間。分別于腺病毒轉染HSC 12、24、48和72 h在倒置熒光顯微鏡下觀察細胞的熒光表達,并計算轉染效率,48 h時轉染效率>80%,48 h與72 h GFP陽性表達的HSC數量無明顯差別,但感染72 h時細胞脫落現象更廣泛,表明腺病毒轉染HSC 48 h時轉染效率已達到最高,后續實驗將采用腺病毒轉染48 h的HSC。于倒置熒光顯微鏡下觀察HSC的熒光表達率達80%以上。實驗分為對照(control)組(在腺病毒轉染步驟以DMEM代替病毒液)、 Ad-GFP組(轉染表達GFP的空病毒)和 Ad-shRNA/PTEN組(轉染攜帶靶向PTEN的shRNA并表達GFP的重組腺病毒Ad-shRNA/PTEN)。
2.2 Western blotting實驗檢測HSC的PTEN蛋白表達 按上述實驗分組及腺病毒轉染方法將腺病毒轉染體外活化HSC,腺病毒感染HSC 48 h,消化、收集上述各組細胞,提取細胞蛋白后應用BCA蛋白定量法測定蛋白含量;SDS-PAGE分離蛋白,于冰上濕轉,含5% BSA的TBST中封閉2 h,加入小鼠抗PTEN單克隆抗體(1∶100)和兔抗GAPDH抗體(1∶1 000),4 ℃孵育過夜后,TBST振搖洗膜 10 min×4次,以封閉液稀釋的辣根過氧化物酶標記的山羊抗小鼠及山羊抗兔IgG(1∶5 000)室溫孵育2 h,TBST洗膜 10 min×4次。加入ECL顯色液避光1 min后放入生物分子成像儀進行免疫顯色,所得圖像用ImageJ 1.47H軟件定量分析,結果以目的蛋白與GAPDH的積分吸光度值的比值表示。
2.3 實時熒光定量PCR技術檢測HSC的PTEN mRNA表達 腺病毒感染HSC 48 h,消化并收集各組HSC,采用TRizol提取總RNA,反轉錄合成cDNA。PTEN及內參照GAPDH的引物均由上海生工生物公司協助設計合成。引物序列:PTEN的上游引物為5’-TCCTGCAGAAAGACTTGAAGGT-3’,下游引物為5’-GCTGTGGTGGGTTATGGTCT-3’,擴增產物大小為182 bp;GAPDH的上游引物為5’-GGCTCATGACCACAGTCCAT-3’,下游引物為5’-ACATTGGGGGTAGGAACACG-3’,擴增產物大小為202 bp。在Mastercycler ep RealPlex4實時熒光定量PCR儀上進行實時定量擴增。SYBR反應體系20 μL。PCR 的反應條件:為 95 ℃ 3 min; 95 ℃ 12 s, 58 ℃ 40 s, 72 ℃延伸30 s,共40個循環。各反應體系擴增后,定量PCR儀顯示S形擴增曲線平滑完整,上升迅速陡峭并很快到達平臺期,熔解曲線單峰,提示擴增產物單一,無非特異性擴增。采用相對定量2-ΔΔCt法比較各組HSC的PTEN mRNA表達[11]。
2.4 HSC的形態、應力纖維、偽足及F-actin的觀察 腺病毒感染HSC 48 h,吸去上述各組細胞培養液,加入PBS清洗細胞5 min;吸去PBS,加入4%多聚甲醛溶液進行細胞固定,室溫固定30 min;吸去多聚甲醛,室溫下PBS清洗細胞3次,每次5 min;室溫條件下,加入0.1% Triton X-100溶液透化處理5 min;室溫條件下,用PBS清洗細胞3次,每次5 min;吸去PBS,用濾紙輕輕吸去玻片上的液體,滴加200 μL 2% BSA封閉液,室溫下封閉15 min;吸去封閉液,PBS洗滌3次,每次5 min;吸去PBS,滴加1∶125稀釋的TRITC標記鬼筆環肽工作液200 μL,覆蓋住培養皿中央圓孔處的細胞,室溫避光孵育2 h;PBS清洗3次,每次5 min;用濃度為5 mg/L的 DAPI溶液復染細胞核5 min;用PBS清洗片刻后,在培養皿底部滴加熒光防淬滅封片劑使其完全覆蓋住中央圓孔處,置于激光掃描共聚焦顯微鏡(laser scanning confocal microscope, LSCM)下,隨機選取6個視野進行觀察并分析熒光圖像。
2.5 肝星狀細胞內Ca2+濃度測定 腺病毒感染HSC 48 h,取出各組細胞,除去培養基,以 HBSS溶液沖洗細胞3次;加入配制的濃度為5 μmol/L的Rhod-2/AM工作液,充分覆蓋培養皿底部中央圓孔處的細胞;置于37 ℃、5% CO2細胞培養箱避光孵育30 min,除去Rhod-2/AM工作液;以HBSS溶液沖洗細胞3次,置于LSCM下,隨機選取6個視野進行觀察,激發波長557 nm,發射波長581 nm,以熒光強度表示細胞內Ca2+水平,Ca2+濃度越大,熒光強度越強。
3 統計學處理
用SPSS 17.0統計學軟件處理,實驗結果用均數±標準差(mean±SD)表示,3組樣本均數間差異比較采用Bonferroni校正的t檢驗,以P<0.05為差異有統計學意義。
結 果
1 靶向PTEN的shRNA下調體外活化HSC的PTEN表達
腺病毒感染HSC 48 h,實時熒光定量PCR檢測各組HSC的PTEN mRNA表達,以control組PTEN的mRNA表達量為1,則Ad-GFP組及Ad-shRNA/PTEN組的PTEN mRNA表達量分別為control組的92%和64%,Ad-shRNA/PTEN組PTEN mRNA表達量明顯低于control組及Ad-GFP組(P<0.05);而control組與Ad-GFP組之間差異無統計學顯著性。Western blotting實驗檢測各組HSC的PTEN蛋白表達,Ad-shRNA/PTEN組(1.088±0.036)明顯低于control組(1.438±0.038)及Ad-GFP組(1.413±0.058)(P<0.05),而control組與Ad-GFP組之間的差異無統計學顯著性。上述結果顯示靶向PTEN的shRNA成功轉染體外活化HSC,敲減了HSC的PTEN表達,成功構建了HSC的PTEN低表達模型,見圖1、2。
2 PTEN低表達對HSC形態、應力纖維、偽足及F-actin的影響
HSC經TRITC標記的鬼筆環肽染色后,于LSCM下觀察,可見細胞內F-actin被激發出紅色熒光。Control組與Ad-GFP組HSC內可見應力纖維,纖維絲短而稀疏,排列不規則,很少偽足形成;轉染攜帶靶向PTEN的shRNA的重組腺病毒48 h,可觀察到HSC內F-actin排列緊密規則,纖維絲明顯增粗增長,偽足向外充分延伸。Ad-shRNA/PTEN組F-actin的熒光強度較control組及Ad-GFP組顯著增強(P<0.05),而control組與Ad-GFP組間差異無統計學顯著性,見圖3、表1。

Figure 1.PTEN mRNA expression of HSC in each group at 48 h after adenovirus infection. Mean±SD. n=6. *P<0.05 vs Ad-shRNA/PTEN group.
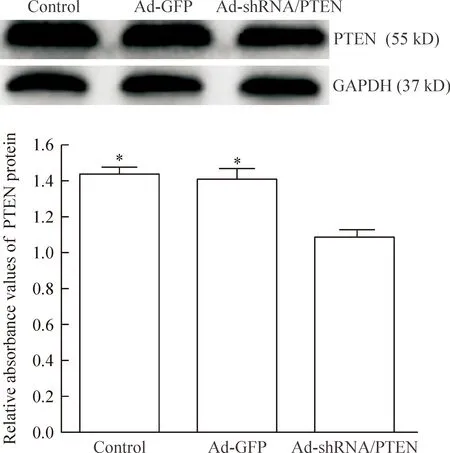
Figure 2.PTEN protein expression of HSC was detected by Western blotting at 48 h after adenovirus infection. Mean±SD. n=6. *P<0.05 vs Ad-shRNA/PTEN group.
3 PTEN低表達對HSC內Ca2+濃度的影響
HSC經Rhod-2/AM鈣熒光探針處理后,于LSCM下觀察,可見胞漿內呈現紅色熒光。Ad-shRNA/PTEN組HSC內Ca2+濃度較control組及Ad-GFP組明顯增強(P<0.05),而control組與Ad-GFP組間差異無統計學顯著性,見圖4、表1。
*P<0.05vsAd-shRNA/PTEN group.
討 論
細胞骨架是指細胞中的蛋白纖維網狀結構,包括微管、中間纖維和微絲三部分。Actin是微絲的主要組成成分,也是構成細胞骨架的重要骨架蛋白,F-actin則是其具有生物學活性作用的形式。F-actin不僅參與細胞形態和空間結構的維持,而且在細胞附著、遷移、凋亡、物質運輸、跨膜信息傳遞以及受體的聚集等許多細胞生命活動中發揮重要作用[12-14]。當受到外界刺激時,細胞通過多種信號轉導途徑介導F-actin發生重構,形成應力纖維、偽足,細胞形態也隨之改變。而PTEN是迄今發現的第一個具有磷酸酶活性的腫瘤抑制基因,編碼的蛋白產物是具有脂質磷酸酶活性和蛋白磷酸酶活性的雙重特異性磷酸酶。已有研究發現,PTEN突變可影響膠質母細胞瘤細胞骨架蛋白F-actin的重構,表現為優先形成絲狀及層狀偽足[15]。但PTEN低表達對在肝纖維化病理過程中發揮重要作用的肝星狀細胞骨架蛋白F-actin的影響尚不清楚。為此,本實驗利用RNA干擾技術,以腺病毒為載體,將靶向PTEN的 shRNA轉染體外培養的活化HSC,在證實靶向PTEN的 shRNA成功轉染于HSC并下調PTEN表達后,應用TRITC標記的鬼筆環肽和LSCM成像技術,觀察了HSC的形態、F-actin分布、應力纖維、偽足及F-actin熒光強度變化。結果顯示,下調PTEN表達后HSC內F-actin數量增多,熒光強度增強,應力纖維絲增長增粗,偽足充分向外延伸。這提示PTEN表達下調使體外活化肝星狀細胞骨架蛋白F-actin的形成及細胞骨架的重構增強。而我們前期的研究已發現大鼠纖維化肝組織及在體肝星狀細胞的PTEN表達均下調[9],或許PTEN低表達使活化肝星狀細胞骨架蛋白F-actin的形成及細胞骨架的重構增強是PTEN參與肝纖維化病理過程的機制之一。
Actin以可溶性的單體G-actin和聚合體的F-actin存在,2種形式的actin可以根據細胞功能狀態相互轉化,維持動態平衡,而細胞內 Ca2+濃度可調節這一平衡[6]。并且,Ca2+作為重要的細胞內第二信使,在細胞興奮、增殖、收縮等一系列細胞功能中也發揮重要作用[16]。為明確PTEN低表達對肝星狀細胞內Ca2+濃度的影響,本研究在證實靶向PTEN的 shRNA下調HSC的PTEN表達后,也檢測了肝星狀細胞內Ca2+濃度。結果顯示, PTEN低表達可顯著升高肝星狀細胞內Ca2+濃度,這提示PTEN低表達增強肝星狀細胞F-actin的形成與其細胞內Ca2+濃度升高有關。
綜上所述,本研究發現下調PTEN表達可引起體外活化肝星狀細胞骨架蛋白F-actin的形成及細胞骨架的重構增強,并導致活化HSC內Ca2+濃度升高,但發生上述變化的具體機制及相關信號轉導還有待于進一步研究。
[1] Lee UE, Friedman SL. Mechanisms of hepatic fibrogenesis [J]. Best Pract Res Clin Gastroenterol, 2011, 25(2):195-206.
[2] Friedman SL. Hepatic stellate cells: protean,multifunctional, and enigmatic cells of the liver [J]. Physiol Rev, 2008, 88(1): 125-172.
[3] Tufvesson E, Westergren-Thorsson G. Biglycan and decorin induce morphological and cytoskeletal changes involving signaling by the small GTPases RhoA and Rac1 resulting in lung fibroblast migration [J]. J Cell Sci, 2003, 116(Pt 23): 4857-4864.
[4] Bear JE, Haugh JM. Directed migration of mesenchymal cells: where signaling and the cytoskeleton meet [J]. Curr Opin Cell Biol, 2014, 30: 74-82.
[5] 靖 旭, 孫金隆, 張曉蕓, 等. Jasplakinolide通過穩定細胞骨架調控內皮細胞功能[J]. 中國藥理學通報, 2013, 29(8):1079-1083.
[6] 張利軍, 魏 蕾. WAVE2與細胞骨架的研究進展[J]. 武漢大學學報: 醫學版, 2005, 26(5): 678-682.
[7] Gao F, Huang W, Zhang Y, et al. Hes1 promotes cell proliferation and migration by activating Bmi-1 and PTEN/Akt/GSK3β pathway in human colon cancer [J]. Oncotarget, 2015, 6(36): 38667-38680.
[8] Ahn YT, Shin IJ, Kim JM, et al. Counteracting the activation of pAkt by inhibition of MEK/Erk inhibition reduces actin disruption-mediated apoptosis in PTEN-null PC3M prostate cancer cell lines [J]. Oncol Lett, 2013, 6(5): 1383-1389.
[9] 郝禮森, 張曉嵐, 田曉鵬, 等. 大鼠肝纖維化組織中PTEN蛋白的定位分布[J]. 基礎醫學與臨床, 2009, 29(4): 356-359.
[10]郝禮森, 張曉嵐, 安君艷, 等. PTEN在肝纖維化大鼠肝組織中的動態表達[J]. 中國病理生理雜志, 2009, 25(6):1137-1141.
[11]Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25(4): 402-408.
[12]Yang DH, Lee JW, Lee J, et al. Dynamic rearrangement of F-actin is required to maintain the antitumor effect of trichostatin A [J]. PLoS One, 2014, 9(5): e97352.
[13]Genesca M, Sola A, Hotter G. Actin cytoskeleton derangement induces apoptosis in renal ischemia/reperfusion [J]. Apoptosis, 2006, 11(4): 563-571.
[14]Coppola S, Cardarelli F, Pozzi D, et al. The role of cytoskeleton networks on lipid-mediated delivery of DNA [J]. Ther Deliv, 2013, 4(2):191-202.
[15]Djuzenova CS, Fiedler V, Memmel S, et al. Actin cytoskeleton organization, cell surface modification and invasion rate of 5 glioblastoma cell lines differing in PTEN and p53 status [J]. Exp Cell Res, 2015, 330(2): 346-357.
[16]劉 剛, 胡蘊玉, 趙建寧, 等.Ⅰ型膠原促進骨髓基質干細胞粘附的細胞機制[J].中華創傷骨科雜志, 2006, 8(6): 549-552.
(責任編輯: 林白霜, 羅 森)
Effects of adenovirus-mediated shRNA targetingPTENon cytoskeletal protein F-actin in activated hepatic stellate cells
HAO Li-sen1, SONG Xiao-jie1, ZHANG Guang-ling2, WANG Jing1, LIU Bo1, ZHANG Peng-lei1, ZHANG Ming-ting1, JIN Li-min1
(1DepartmentofGastroenterology,theAffiliatedHospital,2SchoolofBasicMedicalSciences,NorthChinaUniversityofScienceandTechnology,Tangshan063000,China.E-mail:haolisen125@163.com)
AIM: To investigate the effects of down-regulation of phosphatase and tensin homology detected on chromosome 10 (PTEN) gene by adenovirus-mediated short hairpin RNA (shRNA) on cytoskeletal protein filamentous actin (F-actin) in activated hepatic stellate cells (HSC)invitro. METHODS: The activated HSC (HSC-T6 cells) were culturedinvitroand transfected with recombinant adenovirus carrying shRNA targeting PTEN and expressing green fluorescent protein (GFP), Ad-shRNA/PTEN, and the control adenovirus expressing GFP only, Ad-GFP. The expression of PTEN in the HSC was measured by Western blotting and real-time fluorescent quantitative PCR (RT-qPCR). Under the laser scanning confocal microscope, the cellular morphology, distribution and fluorescence intensity of F-actin, stress fibers and pseudopodia in activated HSC were examined by phalloidin marked with tetramethylrhodamine isothiocyanate (TRITC). The concentration of intracellular Ca2+in the HSC was detected by calcium fluorescent probe Rhod-2/AM. The HSC were divided into control group (using DMEM instead of adenovirus for transfection), Ad-GFP group (the HSC were transfected with the empty adenovirus expressing GFP alone) and Ad-shRNA/PTEN group (the HSC were transfected with recombinant adenovirus Ad-shRNA/PTEN). RESULTS: The shRNA targetingPTENwas successfully transfected into activated HSCinvitro, and significantly down-regulated the expressions of PTEN at protein and mRNA levels in the HSC (P<0.05). The HSC withPTENknockdown showed starlike and stretched to the surrounding. The F-actin of the cells was closely arranged in order and had the increasing number. The pseudopodia fully extended outward, and stress fibers got larger and thicker. The fluorescence intensity of F-actin in Ad-shRNA/PTEN group significantly enhanced (P<0.05) compared with control group and Ad-GFP group, while no significant difference between control group and Ad-GFP group was observed. Intracellular Ca2+concentration of the HSC in Ad-shRNA/PTEN group was statistically higher (P<0.05) than that in control group and Ad-GFP group, and no significant difference between control group and Ad-GFP group was found. CONCLUSION: Down-regulation of PTEN expression promotes the formation of F-actin and reorganization of cytoskeleton in activated HSC, and increases the intracellular Ca2+concentration in activated HSCinvitro.
PTEN; RNA interference; Hepatic stellate cells; Cytoskeleton; Filamentous actin
1000- 4718(2017)03- 0557- 06
2016- 08- 01
2016- 12- 01
河北省自然科學基金資助項目(No. H2013209327); 中國肝炎防治基金會天晴肝病研究基金資助項目(No. CFHPC20132078)
△通訊作者 Tel: 0315-2308012; E-mail: haolisen125@163.com
R363.2
A
10.3969/j.issn.1000- 4718.2017.03.030

