氰化氫對磷銨體系氣液平衡的影響*
張馨予,趙長龍,張繼軍
(1.河北工業大學化工學院,天津300130;2.河北工業大學海水資源高效利用化工技術教育部工程研究中心;3.石家莊工大化工設備有限公司河北省蒸發結晶及干燥工程技術研究中心)
氰化氫對磷銨體系氣液平衡的影響*
張馨予1,趙長龍1,張繼軍2,3
(1.河北工業大學化工學院,天津300130;2.河北工業大學海水資源高效利用化工技術教育部工程研究中心;3.石家莊工大化工設備有限公司河北省蒸發結晶及干燥工程技術研究中心)
采用磷銨吸氨法對氰化氫生產中混合氣中的氨進行回收,研究了氰化氫對磷銨體系氣液平衡的影響。首先對含有氰化氫的磷銨吸氨體系進行理論分析,由化學平衡、物料平衡、電荷平衡得到酸性環境下氣相中氨的分壓與液相中氨濃度的平衡關系;采用流動法建立了氣液平衡測定裝置,以氨和氰化氫混合氣為研究對象,得到了氰化氫-磷酸一銨-磷酸二銨-水體系氣液平衡數據,探討了不同溫度、不同吸收液濃度、不同氰化氫含量混合氣時,氰化氫對氨-磷銨系統氣液平衡的影響,為今后的吸收試驗提供依據。
氰化氫;氣液平衡;氨吸收
目前,氰化氫的生產主要采用安氏法[1],此法對氨的利用率較低[2]。在焦爐煤氣凈化中應用磷銨吸氨法回收煤氣中的氨,具有氨回收率高、自動化程度高、環保等優勢,是先進的氨回收工藝[3]。張繼軍等[4]提出將磷銨吸氨工藝應用于氰化氫生產混合氣中氨的回收,此方法能將未轉化的氨制成無水氨,并重新作為反應物利用,實現了吸收液的循環利用。焦爐煤氣與氰化氫混合氣的區別是氨氣和氰化氫的濃度不同,氰化氫混合氣中氰化氫的濃度遠大于焦爐煤氣中氰化氫的濃度,而且氰化氫與氨氣的質量濃度之比高達3∶1。因此得到氰化氫-氨氣-磷銨系統氣液平衡數據,充分研究氰化氫對氨氣-磷銨系統氣液平衡的影響極為重要。筆者對含有氰化氫的磷銨吸氨體系進行了理論分析,由化學平衡、物料平衡、電荷平衡得到體系的預測模型;采用流動法建立了氣液平衡測定裝置,以NH3和HCN混合氣為研究對象,用磷酸一銨溶液吸收,得到了HCN-NH4H2PO4-(NH4)2HPO4-H2O體系氣液平衡數據,探討了不同吸收溫度、不同吸收液濃度、不同氰化氫含量混合氣體時氰化氫對氨-磷銨系統氣液平衡的影響。
1 含氰化氫磷銨吸氨體系分析
1.1 液相中主要化學反應
混合氣中主要是HCN、NH3和H2O。液相中主要是NH4H2PO4、(NH4)2HPO4和H2O。在吸收過程中存在HCN-NH4H2PO4-(NH4)2HPO4-H2O體系,在解吸過程中存在NH3-NH4H2PO4-(NH4)2HPO4-H2O體系。物理吸收與化學吸收相比溶解量很少,因此吸收過程主要取決于化學平衡[5]。此體系屬于易揮發性電解質溶液,體系的熱力學性質與理想溶液有一定偏差,應該作為非理想溶液處理。
根據反應機理,液相中發生的主要化學反應:
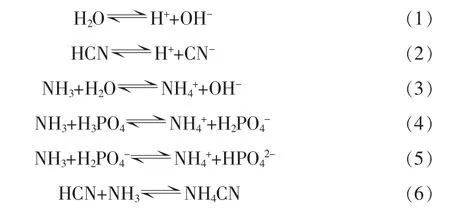
從上述反應中可以看出:在HCN-NH4H2PO4-(NH4)2HPO4-H2O體系中,液相中存在 NH3、HCN、H2O、H+、OH-、CN-、NH4+、H2PO4-、HPO42-共9種組分。液相中H2PO4-、HPO42-總和在吸收液濃度確定之后就已經確定。為明確各組分之間關系,分析體系化學平衡、物料平衡、電荷平衡和氣液平衡得到體系相平衡關系。
1.2 液相反應平衡常數
反應(1)~(5)平衡常數:
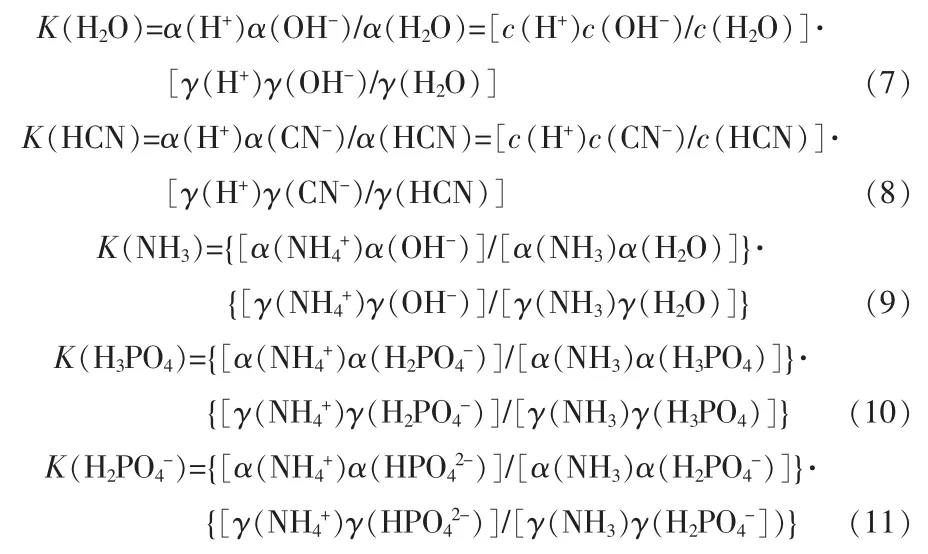
式中:K為平衡常數;α為組分的活度;c為組分的濃度;γ為組分的活度系數。上述公式中平衡常數K只是溫度的函數,即:
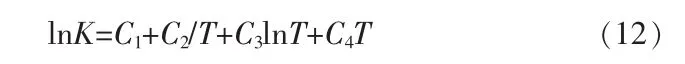
式中:C1、C2、C3、C4為各反應平衡常數系數;T為溫度。各相關系數見表1。
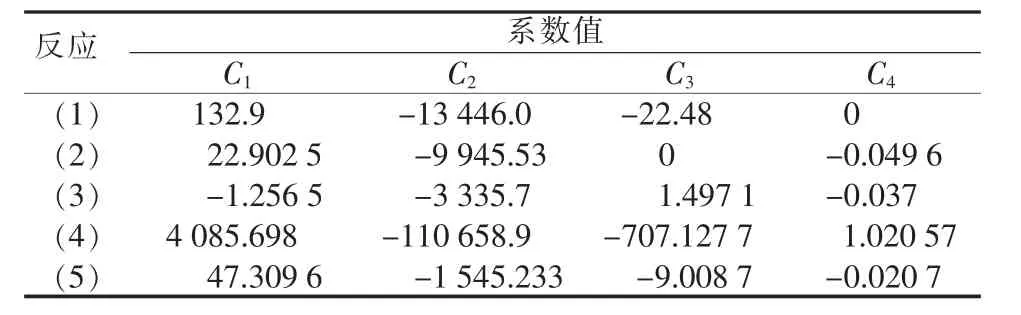
表1 各反應平衡常數系數值
1.3 液相反應物料平衡和電荷平衡
HCN-NH4H2PO4-(NH4)2HPO4-H2O體系中,NH3、HCN、PO43-物料守恒如下:
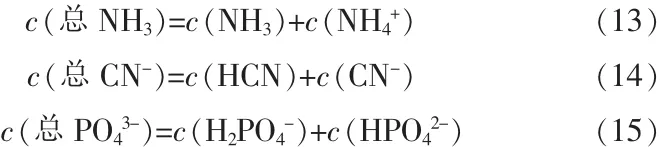
體系電中性方程:
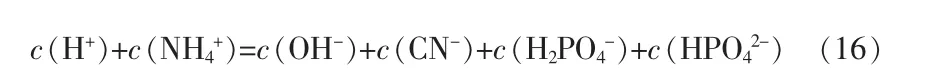
HCN和 NH3在水中會反應生成 NH4CN,但NH4CN不穩定,尤其是在酸性環境下會迅速分解為HCN和NH3。氰化氫是酸性氣體,氨氣是堿性氣體,在氰化氫混合氣中要想吸收氨的同時不吸收氰化氫,必須保證整個吸收過程處于酸性環境。因此,在進行模型預測時,考慮體系在酸性環境下,就可以忽略HCN和NH3在水中的不穩定反應帶來的影響。
用c(總H3PO4)表示總磷酸濃度,液相中游離氨濃度用c(NH3)表示:
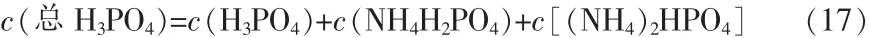
液相中氨與總磷酸物質的量比用R表示:
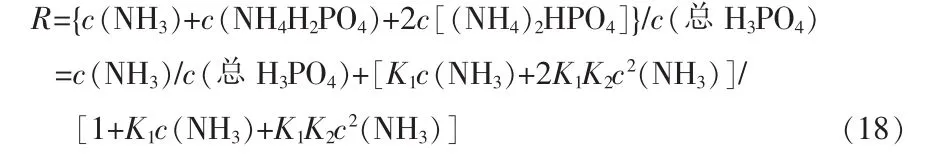
式中:K1、K2為反應的平衡常數。
K1=c(NH4H2PO4)/[c(H3PO4)c(NH3)]
K2=c[(NH4)2HPO4]/[c(NH4H2PO4)c(NH3)]
因為液相中c(NH3)遠小于c(總H3PO4),所以c(NH3)/c(總H3PO4)可以忽略不計,則:

體系中,液相中 c(NH3)、c(HCN)與氣相中p(NH3)、p(HCN)符合亨利定律:p(NH3)=Hc(NH3)。
由式(20)可以得到液相中c(NH3)與K1、K2、R有關,其中K1和K2是溫度T的函數、R與初始氣相組成和吸收液濃度有關,因此得到了酸性環境下p(NH3)與c(NH3)的平衡關系。
2 含氰化氫的磷銨體系氣液平衡實驗
2.1 實驗裝置(見圖1)
采用流動法進行氣液平衡實驗[6]。測定混合氣體在常壓、溫度為40~70℃、吸收液濃度為2mol/L、初始混合氣中氨和氰化氫質量濃度都為20 g/m3時的氣液平衡數據。
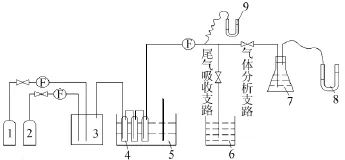
圖1 氰化氫-氨-磷銨系統氣液平衡實驗裝置
2.2 實驗步驟
1)關閉裝置各個接口,用循環水真空泵抽真空,排盡系統內空氣,關閉真空泵。將吸收液磷酸一銨打入3個平衡器中,將硫酸標準液打入氨回收瓶中。2)氨氣由氨氣瓶提供,由于氰化氫是劇毒氣體,工業中以氰化鉀、氰化鈉的形式儲運。采用氰化鈉和稀硫酸反應,生成HCN氣體[7]。反應方程見式(21)。3)打開恒溫槽電源,將溫度調到需要的溫度。打開尾氣吸收閥門,通入NH3排盡空氣。4)氰化氫發生器開始反應生成氰化氫,通過調節流量計控制混合氣組成。HCN與NH3氣進入配氣瓶,當配氣瓶中的壓力適當時進入三級平衡器,3h后測液相pH,30min后再測pH,當pH不變時系統達到平衡。5)當系統達到平衡后,先分析液相組分,再打開氣體分析支路,由硫酸標準液分析氣相中氨的濃度,并測得HCN體積。液相中Ⅰ銨和Ⅱ銨的分析采用甲醛法[8],HCN的分析采用硝酸銀滴定法[9]。吸收液用磷酸一銨配制,可得出總磷酸濃度。6)操作關鍵:①進入吸收液平衡瓶中的混合氣必須要有較慢的流速,控制氣體流量為0.3 L/min;②平衡器進出口管路要保溫,保持管內氣體溫度。
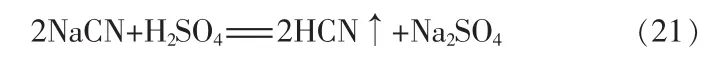
2.3 參數計算
液相中R由液相組分算出:
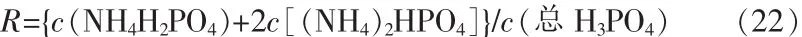
由量氣管計算出HCN的體積,氣相中的氨由硫酸標準液得到,計算此時氨的體積。
氣相中水的分壓:

式中:x(H2O)為吸收液中水的摩爾分率。氣相中NH3的分壓:

氣相中HCN的分壓:
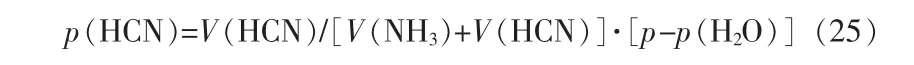
3 結果討論
3.1 不同溫度對磷銨系統氣液平衡的影響
實驗測定了吸收液濃度為2mol/L、溫度為40、50、60、70℃時NH3-NH4H2PO4-(NH4)2HPO4體系和HCN-NH4H2PO4-(NH4)2HPO4體系的氣液平衡數據,結果見圖2a、b。橫坐標R表示NH3與H3PO4物質的量比,NH3與 H3PO4反應生成 NH4H2PO4和(NH4)2HPO4,即氨氣被吸收,R值實質表示了液相中各組分濃度,即氨的吸收率。p(NH3)表示了氣相中氨的濃度。
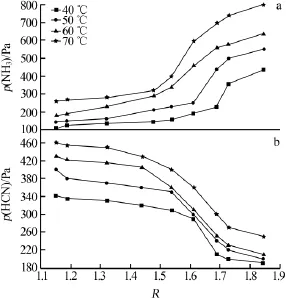
圖2 NH3-NH4H2PO4-(NH4)2HPO4體系(a)和HCN-NH4H2PO4-(NH4)2HPO4體系(b)氣液平衡測定數據
NH3轉化為NH4H2PO4并逐漸達到平衡,p(NH3)變化平穩,再轉化為(NH4)2HPO4。磷酸二銨溶液呈堿性,隨著氨的吸收,圖中的突變點是NH4H2PO4轉化為(NH4)2HPO4的過程,此時吸收液pH>7,NH3的吸收速率降低,p(NH3)會突然增大。如圖2b所示,在NH3轉化為NH4H2PO4時,pH<7,HCN只有微量溶解,但當 NH3大部分轉化為(NH4)2HPO4時,pH>7時,HCN會大量溶解,p(HCN)突然下降,并且會促進HCN和NH3在水中的反應。兩種氣體都有突變點,此后平衡破壞,pH增大,HCN被大量吸收,氨的吸收效果下降。
HCN和NH3混合氣的整個吸收過程必須保持系統處于酸性環境下,并嚴格控制富液的中和度。當pH<7時,HCN不與吸收液中的組分反應,只有少量電離;NH3在吸收液中存在于NH4H2PO4和(NH4)2HPO4的兩級平衡中。因此平衡數據中,當pH<7時,對應的較大R值作為吸收塔的控制點[10]。
3.2 不同吸收液濃度對磷銨系統氣液平衡的影響
實驗測定了常壓、45℃下磷酸一銨溶液濃度為1.783、2.086、2.321、2.723mol/L時的氣液平衡數據,結果見圖3。由圖3看出,在同一濃度的磷酸一銨吸收液中,氣相中氨氣的分壓隨著R的增加而增加。在R一定時,隨著磷酸一銨濃度的增加氣相中氨氣的分壓降低。在氣相氨氣分壓相同的情況下,R隨著吸收液濃度的增加而增加。在R較高的區域(1.7~1.9)時,磷酸一銨濃度對R的影響較小,這是因為R較高時,已接近飽和狀態,無法再進行吸收。
實驗中發現,隨著吸收的進行,當R升高時,氨的分壓會有一個突變點。這是因為,在較低的吸收液濃度下,氨吸收的量少,一部分溶解在水中,造成pH上升;在吸收液接近飽和時,氨的吸收量大,pH增大很快,氨的分壓也就越大。當R較高時,在較高濃度的吸收液中會出現大量結晶。
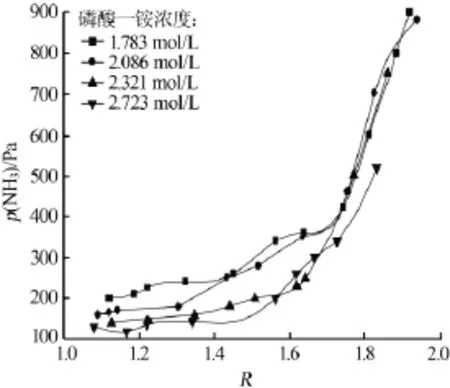
圖3 不同濃度磷酸一銨吸收液p(NH3)與R的關系
3.3 不同氰化氫濃度對磷銨系統氣液平衡的影響
實驗測定了常壓、45℃、吸收液濃度為2mol/L條件下,初始混合氣NH3質量濃度為20 g/m3、HCN質量濃度分別為10、20、40、60 g/m3時,氨氣分壓與R的關系,結果見圖4。當增大氰化氫濃度時,氨氣分壓變化并不明顯,有稍微下降趨勢,并且隨著氰化氫濃度的繼續增大,對氨氣吸收速率的影響逐漸變大。在突變點之前體系呈酸性,氰化氫濃度的增加主要影響氨氣分壓,但磷銨吸氨的反應屬于極易發生的反應,主要取決于化學平衡,氨氣分壓對吸氨反應的影響不大。但氰化氫的濃度與氨氣濃度之比較大時會使化學平衡向負反應方向轉移,從而影響氨的吸收率。由圖4看出,當氰化氫質量濃度與氨氣質量濃度之比為3∶1時,氨氣分壓下降趨勢明顯增加,說明氰化氫濃度過高時會影響氨的吸收速率。
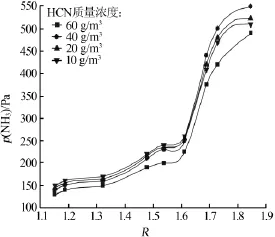
圖4 不同氰化氫濃度混合氣p(NH3)與R的關系
4 結論
1)通過對含有氰化氫的磷銨吸氨體系進行理論分析,明確了各組分之間的反應關系,由化學平衡、物料平衡、電荷平衡得到液相游離c(NH3)與K1、K2、R有關,其中K1、K2是溫度的函數,R與初始氣相組成和吸收液濃度有關,得到了酸性環境下p(NH3)與c(NH3)的平衡關系。
2)通過對含有氰化氫的磷銨體系的氣液平衡實驗,得到了HCN-NH4H2PO4-(NH4)2HPO4-H2O體系氣液平衡數據。實驗表明:對氰化氫混合氣,要保證吸氨效果必須保持酸性并嚴格控制富液中和度,避免HCN的影響和富液出現結晶;同一濃度的磷酸一銨吸收液中,氣相中氨氣的分壓隨著R的增加而增加。在R一定時,隨著磷酸一銨濃度的增加,氣相中氨氣的分壓降低。在氣相氨氣分壓相同的情況下,R隨著吸收液濃度的增加而增加;當初始氣相組成中氰化氫質量濃度與氨氣質量濃度之比小于3∶1時,對吸氨過程影響不大。
[1] 趙隨民.合成氫氰酸技術研究進展[J].科技情報開發與經濟,2008(9):105-106.
[2] 陳長斌.中國氰化物行業發展現狀及發展趨勢[J].無機鹽工業,2012,44(6):1-4.
[3] 王燕霞,王增忱.焦爐煤氣磷酸法脫氨工藝及應用[J].煤化工,2015,43(4):25-28.
[4] 張繼軍,李玉珠,趙海寶.氰化氫生產中混合氣的氨回收方法:中國,101264901[P].2008-09-17.
[5] 上官炬,常麗萍,苗茂謙.氣體凈化分離技術[M].北京:化學工業出版社,2012.
[6] 余關懷.磷銨溶液汽液平衡的研究[J].燃料與化工,2000,31(1):25-28.
[7] 吳再明,余關懷,謝炳華.焦爐煤氣磷銨吸氨新工藝的研究[J].遼寧化工,1980(2):1-8.
[8] 趙長龍,張繼軍,張馨予,等.氰化氫生產中磷酸吸氨的工藝研究[J].現代化工,2016,36(2):152-155.
[9] HJ484—2009水質:氰化物的測定——容量法和分光光度法[S].
[10] 黃彬弟,臧士刻,陶蘭芬,等.氰化氫在煤氣和冷凝液中的相平衡[J].燃料與化工,2002,33(6):308-310.
Influence of HCN on vapor-liquid equilibrium ofammonium phosphate system
Zhang Xinyu1,Zhao Changlong1,Zhang Jijun2,3
(1.SchoolofChemical Engineering and Technology,HebeiUniversity of Technology,Tianjin 300130,China;2.Engineering Research Centerof Seawater Utilization Technology Ministry of Education;3.Evaporation Crystallization and Drying Engineering Technology Research CenterofHebeiProvince,Shijiazhuang University ChemicalEquipmentCo.,Ltd.)
Theammonia in production ofhydrogen cyanidewas recycled by ammonium phosphateabsorbingammonia process,and the influence ofhydrogen cyanide on vapor-liquid equilibrium ofammonium phosphate system was studied.Firstly,theoretical analysis for the ammonium phosphate containing hydrogen cyanide ammonia absorption system was carried out.The equilibrium relationship between partial pressure of ammonium in vapor phase and concentration of ammonium in liquid phase was obtained by chemical balance,material balance,and charge balance.The vapor-liquid balance device was built based on the flowmethod,vapor-liquid equilibrium data ofHCN-NH4H2PO4-(NH4)2HPO4-H2Owas obtained with themixed gas of NH3and HCN as the study objective.Under the conditions of different temperatures,concentrations,and hydrogen cyanide contents,the influence ofhydrogen cyanideon vapor-liquid equilibrium ofammonium phosphate system was researched.This study provided the basis forabsorption experimentin future.
hydrogen cyanide;vapor-liquid equilibrium;ammonium absorption
TQ110.6
A
1006-4990(2017)03-0022-04
2016-09-16
張馨予(1992— ),女,碩士研究生,從事化工過程多相流方向研究。
張繼軍
河北省高等學校科學技術研究重點項目(ZH2011226)。
聯系方式:zhangjj2888@163.com

