西南地區(qū)pH影響紫色土硝化作用機(jī)制研究
孟瑤,王智慧,羅紅燕,蔣先軍(西南大學(xué)資源環(huán)境學(xué)院,重慶 400715)
?
西南地區(qū)pH影響紫色土硝化作用機(jī)制研究
孟瑤,王智慧,羅紅燕*,蔣先軍*
(西南大學(xué)資源環(huán)境學(xué)院,重慶 400715)
硝化作用是一個(gè)對(duì)pH高度敏感的典型過(guò)程,但pH影響土壤硝化作用的機(jī)制尚不完全明了。本研究以西南地區(qū)3種發(fā)育于同一母質(zhì)的不同pH的紫色土(酸性紫色土 pH=5.7,中性紫色土 pH=7.3,石灰性紫色土 pH=8.0)作為供試材料,研究pH對(duì)紫色土硝化強(qiáng)度及氨氧化微生物的長(zhǎng)期效應(yīng);通過(guò)人為添加酸(H2SO4)或堿(NaOH)短期改變土壤pH的方法,研究pH對(duì)紫色土硝化作用強(qiáng)度、氨氧化微生物活性及豐度的短期效應(yīng)。結(jié)果表明,pH的短期改變對(duì)酸性與石灰性紫色土的硝化作用無(wú)顯著影響(P>0.05),但對(duì)中性紫色土的硝化速率影響顯著(P<0.05);氨氧化古菌(AOA)的amoA基因在酸性土壤環(huán)境中的表達(dá)更高(3.04×108/g干土,AOA/AOB=31.8),而氨氧化細(xì)菌(AOB)則更適應(yīng)于石灰性紫色土環(huán)境(2.35×108/g干土,AOA/AOB=0.07)。研究表明,紫色土的硝化作用強(qiáng)度受pH的影響顯著,且在不同pH土壤中其作用機(jī)制各不相同。硝化微生物群落和活性主導(dǎo)了酸性和石灰性紫色土中的硝化作用,而中性紫色土中的硝化作用則是由底物濃度所主導(dǎo)。研究推測(cè)長(zhǎng)期穩(wěn)定的pH是影響硝化微生物群落和活性的關(guān)鍵因素,而pH的短期改變則主要影響硝化反應(yīng)的底物有效性。
硝化作用;氨氧化古菌;氨氧化細(xì)菌;土壤pH;實(shí)時(shí)熒光定量PCR
土壤中的硝化作用是一個(gè)對(duì)pH高度敏感的典型過(guò)程[1]。實(shí)驗(yàn)室模擬試驗(yàn)[2-3]與田間試驗(yàn)[4-6]結(jié)果均表明:當(dāng)pH在4.8~8.5的范圍內(nèi)時(shí),硝化作用隨著pH的升高而增強(qiáng)。例如,北美白樺森林土壤pH在5.5~7.5范圍內(nèi),凈硝化速率逐漸增大,且在pH 7.5時(shí),土壤凈硝化速率是pH 5.5時(shí)的4倍[7]。但令人驚訝的是,土壤pH的短期改變(如施用石灰等人為活動(dòng))對(duì)硝化作用的影響,卻有著不同的研究結(jié)果。瑞典pH小于4.8的酸性森林土壤中開(kāi)展的研究表明:施入石灰顯著提高了土壤硝化作用,即添加3 t/hm2石灰后,表層土壤的硝態(tài)氮濃度是原始土壤的67.5倍[8]。然而,在日本茶園強(qiáng)酸性土壤中,施用CaCO3并沒(méi)有提高其硝化活性[7]。甚至,有研究發(fā)現(xiàn)中國(guó)西湖和太湖地區(qū)的酸性森林土壤中施用石灰還會(huì)顯著降低土壤的凈硝化率[9]。
土壤pH影響硝化作用的機(jī)制至少包括兩個(gè)方面。首先,pH影響了硝化反應(yīng)底物的化學(xué)形態(tài)與濃度,從而影響其有效性[10]。因?yàn)橄趸饔玫牡孜锸荖H3分子而非NH4+離子[11-12],而高pH可以使得NH3分子與NH4+轉(zhuǎn)換的化學(xué)平衡式趨向于生成NH3分子,從而提高NH3分子的有效性。其次,土壤pH對(duì)參與硝化反應(yīng)的土壤微生物的分布會(huì)有所影響。例如:在酸性土壤(pH 4.5~6.9)中,存在大量的AOA(氨氧化古菌 ammonia-oxidizing archaea),但卻檢測(cè)不到AOB(氨氧化細(xì)菌 ammonia-oxidizing bacteria)[13],Di等[14]發(fā)現(xiàn)在新西蘭高氮草地土壤中施氮會(huì)增加AOB的數(shù)量和土壤硝化活性。
本實(shí)驗(yàn)假設(shè)長(zhǎng)期pH的影響主要針對(duì)硝化微生物的群落組成,而pH的短期改變主要針對(duì)反應(yīng)底物有效性;硝化活性則是硝化微生物與底物相互作用的表現(xiàn),所以不同性質(zhì)的土壤中,硝化作用對(duì)pH的響應(yīng)有所不同。因此,本實(shí)驗(yàn)采集相似母質(zhì)發(fā)育的酸性、中性和石灰性紫色土,研究pH對(duì)紫色土硝化強(qiáng)度、氨氧化微生物活性及豐度的長(zhǎng)期影響;通過(guò)添加酸(H2SO4)或堿(NaOH)的方式,調(diào)節(jié)3種土壤的pH,研究短期pH變化對(duì)紫色土硝化強(qiáng)度、氨氧化微生物活性及豐度的影響,從而探索土壤pH影響紫色土硝化過(guò)程的作用機(jī)制,為土壤氮素管理策略提供理論支撐。
1 材料與方法
1.1 供試土壤
本實(shí)驗(yàn)開(kāi)展于2014年4月,3種供試紫色土壤分別是釆集于重慶市永川的酸性紫色土(pH 5.7)、中性紫色土(pH 7.3)及采集于四川鹽亭的石灰性紫色土(pH 8.0),其基本理化性質(zhì)見(jiàn)表1。隨機(jī)選擇3個(gè)采樣點(diǎn),釆集表層土壤(≤20 cm),采集時(shí)盡量保持原狀土壤結(jié)構(gòu)。將采回的濕土在室內(nèi)沿其自然結(jié)構(gòu)將土塊小心掰成小土塊,除去植物殘?bào)w石塊以及蚯蚓等小動(dòng)物,自然風(fēng)干。土樣風(fēng)干后磨細(xì)過(guò)2 mm篩,供實(shí)驗(yàn)分析測(cè)定。

表1 供試土壤的基本性質(zhì)Table 1 Basic properties of the selected soils
1.2 培養(yǎng)實(shí)驗(yàn)
稱(chēng)取適量酸性、中性、石灰性紫色土風(fēng)干土,分別分為3等份。一份只加純水,其余兩份用0.1 mol/L的NaOH溶液或0.5 mol/L的H2SO4溶液調(diào)節(jié)土壤pH,且保持田間最大持水量60%,置于28 ℃恒溫培養(yǎng)箱預(yù)培養(yǎng)7 d等待調(diào)節(jié)的pH達(dá)到平衡。經(jīng)淋洗后過(guò)2 mm篩,獲得不同pH系列土壤樣品:酸性紫色土(pH 5.7、6.5、7.1)、中性紫色土(pH 6.5、7.3、8.1)、石灰性紫色土(pH 6.5、7.4、8.0)。在250 mL三角瓶中分別加入10 g上述9種樣品,并加入8 mmol/kg氮源,每個(gè)樣品均有3個(gè)重復(fù),保持田間最大持水量60%,置于28 ℃恒溫培養(yǎng)箱進(jìn)行9 d的正式培養(yǎng)。正式培養(yǎng)的第0天(未加氮源時(shí))、第9天,采集土壤樣品進(jìn)行其硝態(tài)氮濃度的測(cè)定并計(jì)算凈硝化速率,且在第0、5、9天采集土壤樣品進(jìn)行氨氧化微生物amoA基因拷貝數(shù)的測(cè)定。
1.3 測(cè)定方法
土壤樣品用濃度為2 mol/L的KCl溶液進(jìn)行浸提,用紫外分光光度法測(cè)定浸提液中硝態(tài)氮的濃度,并用培養(yǎng)前后硝氮濃度變化計(jì)算凈硝化速率[15]。
本實(shí)驗(yàn)所有樣品均采用E.Z.N.A TM Soil DNA kit試劑盒(Omega Bio-tek,美國(guó))提取土壤總DNA,提取步驟按試劑盒說(shuō)明書(shū)操作,提取出的DNA樣品保存于-20 ℃冰箱中備用。
隨后進(jìn)行AOB和AOA中amoA基因的實(shí)時(shí)熒光定量PCR:采用引物amoA-1F (5′-GGGGTTTCTACTGGTGGT-3′) 和amoA-2R (5′-CCCCTCKGSAAAGCCTTCTTC-3′ )[K=G or T;S=G or C]直接擴(kuò)增總DNA中氨氧化細(xì)菌(AOB)amoA的基因片段。采用引物Arch-amoA F (5′-STAATGGTCTGGCTTAGACG-3′) [K=G or T;S=G or C]和Arch-amoA R (5′-GCGGCCATCCATCTGTATGT-3′)直接擴(kuò)增總DNA中氨氧化古菌(AOA)amoA基因片段。PCR反應(yīng)體系為20 μL,包括1 μL DNA模板、10 μL SYBR Premix Ex TaqTM Perfect Real Time,前、后引物各0.5 μL (10 μmol/L)及8 μL的滅菌雙蒸水。實(shí)驗(yàn)空白用滅菌雙蒸水代替DNA作為反應(yīng)模板。AOA、AOB的熒光定量 PCR 擴(kuò)增程序皆為95 ℃預(yù)變性30 s;95 ℃變性30 s,54 ℃退火30 s,72 ℃延伸45 s,40個(gè)循環(huán)。
1.4 數(shù)據(jù)處理
測(cè)定所得數(shù)據(jù)采用Excel與Origin 8.6軟件進(jìn)行數(shù)據(jù)處理和圖表繪制,采用SPSS 19.0中的單因素方差分析(ANOVA)進(jìn)行數(shù)據(jù)的顯著性檢驗(yàn),其中多重比較采用最小顯著差數(shù)法(LSD)進(jìn)行檢驗(yàn)(P<0.05)。
2 結(jié)果與分析
2.1 pH對(duì)紫色土中硝化作用的影響
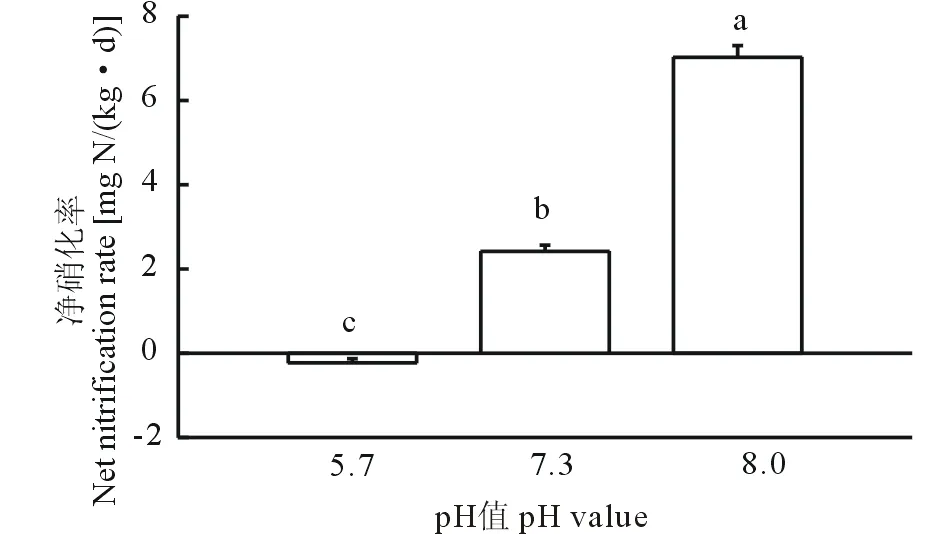
圖1 3種不同pH紫色土的硝化作用Fig.1 Nitrification in three purple soil with different pH 不同字母代表P<0.05水平上差異顯著。 Different letters mean the significant differences at P<0.05. 誤差線(xiàn)表示標(biāo)準(zhǔn)差Error bars represent standard deviations, n=3.下同 The same below.
在經(jīng)過(guò)9 d的培養(yǎng)后,3種紫色土的凈硝化率差異顯著(P<0.05)(圖1)。其中,酸性紫色土的凈硝化率為負(fù)值[-0.23 mg N/(kg·d)],表明該土壤中沒(méi)有發(fā)生明顯的硝化作用。而在pH較高的中性紫色土與石灰性紫色土中,其凈硝化率分別為2.42、7.02 mg N/(kg·d),發(fā)生了較為強(qiáng)烈的硝化作用。結(jié)果表明土壤的pH越高,發(fā)生的硝化作用越強(qiáng)烈,土壤中的硝化作用隨土壤pH的升高而增強(qiáng)。
2.2 pH短期改變對(duì)紫色土硝化作用的影響
在經(jīng)過(guò)9 d的培養(yǎng)后,酸性紫色土的凈硝化率為:-0.23, -0.22, -0.23 mg N/(kg·d),石灰性紫色土的凈硝化率為:7.05, 7.11, 7.02 mg N/(kg·d),顯著性分析結(jié)果表明酸性土壤中pH的短期上升與石灰性土壤中pH的短期下降對(duì)這兩種土壤中硝化作用影響并不顯著(P>0.05)。而中性紫色土中的凈硝化率隨著pH的增大,依次為1.23、2.42、3.27 mg N/(kg·d),具有顯著性差異(P<0.05)(圖2)。
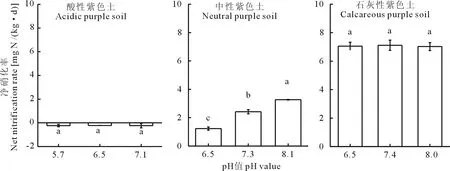
圖2 pH短期改變對(duì)3種不同pH紫色土硝化作用的影響Fig.2 Effect of short-term pH change on nitrification in three purple soil with different pH
2.3 不同pH紫色土中氨氧化細(xì)菌和古菌的豐度
如圖3所示,培養(yǎng)過(guò)程中,中性紫色土中的AOA豐度先升高再降低,酸性紫色土中AOA豐度培養(yǎng)期間的變化趨勢(shì)與中性紫色土相似,而石灰性紫色土的AOA豐度在培養(yǎng)期間幾乎沒(méi)有變化,且中性紫色土中的AOA豐度大于酸性和石灰性紫色土。中性紫色土中AOB的豐度先升高再降低,石灰性紫色土中AOB豐度培養(yǎng)期間的變化趨勢(shì)與中性土相似,而酸性紫色土中的AOB豐度在培養(yǎng)期間幾乎沒(méi)有變化,且石灰性紫色土中的AOB豐度大于中性和酸性紫色土。而且AOA與AOB豐度的比值在酸性、中性、石灰性3種不同pH的紫色土中分別為31.8,1.55和0.07,AOA/AOB大小為:酸性>中性>石灰性。
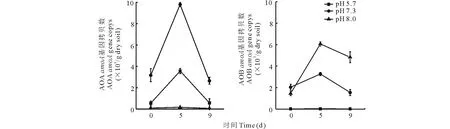
圖3 3種不同pH紫色土中氨氧化微生物的豐度Fig.3 Abundance of ammonia-oxidizing bacteria (AOB) and ammonia-oxidizing archaea (AOA) amoA gene in three purple soil with different pH
2.4 pH的短期改變對(duì)紫色土中硝化微生物豐度的影響
如圖4所示,短期改變酸性及石灰性紫色土中的pH,其AOA豐度并無(wú)顯著變化。但在中性紫色土中,pH的短期改變使得AOA呈下降趨勢(shì),且在pH上升為8.1的中性紫色土中培養(yǎng)第5天時(shí),AOA的豐度極顯著下降,由原樣土的9.79×108/g干土下降至2.53×108/g干土。AOB豐度在酸性紫色土中pH改變前后無(wú)顯著變化,石灰性紫色土pH的短期降低使AOB有增長(zhǎng)趨勢(shì),而在中性土中,pH的上升使得其AOB豐度增大,pH下降則對(duì)AOB豐度無(wú)明顯影響(圖5)。
3 討論
pH的短期變化對(duì)酸性與石灰性土壤中的硝化活性無(wú)顯著影響,而對(duì)中性土壤有顯著影響。該結(jié)果表明不同pH的紫色土可能有不同的硝化反應(yīng)機(jī)制。
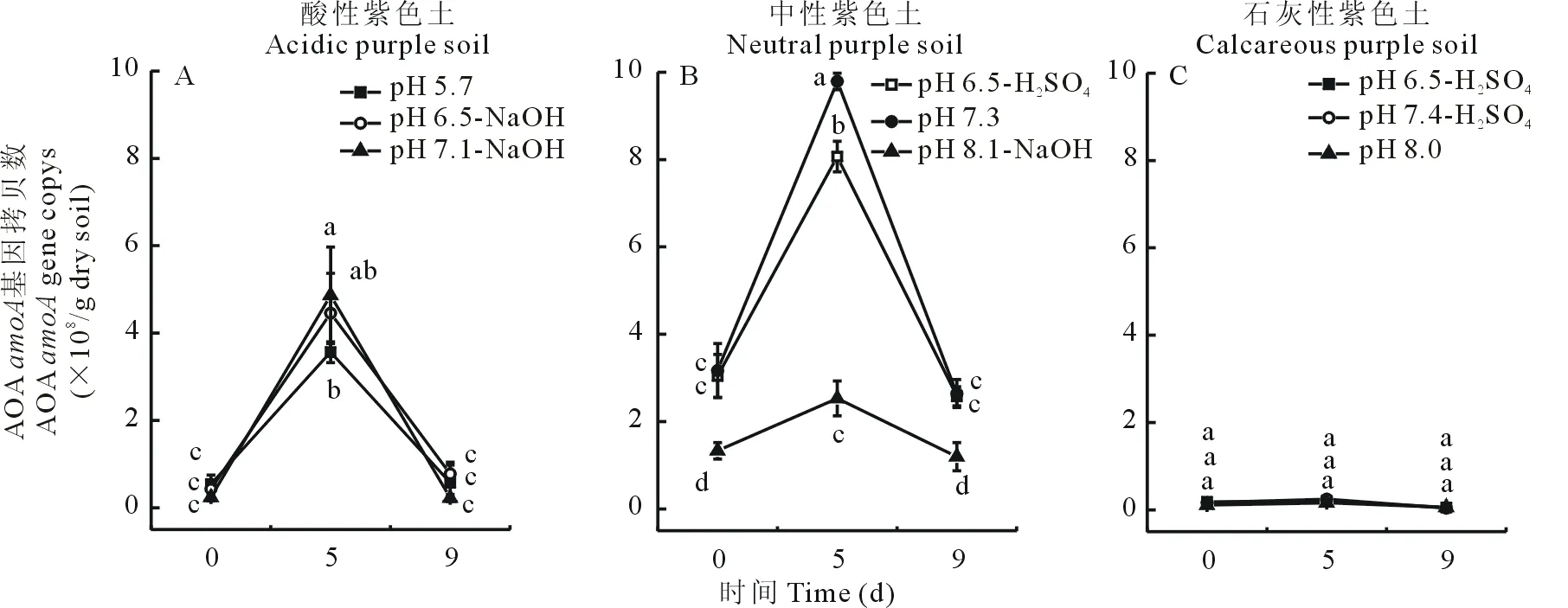
圖4 3種不同pH紫色土pH短期改變后對(duì)AOA豐度的影響Fig.4 Effect of short-term pH change on abundance of ammonia-oxidizing archaea (AOA) amoA gene in three purple soil with different pH
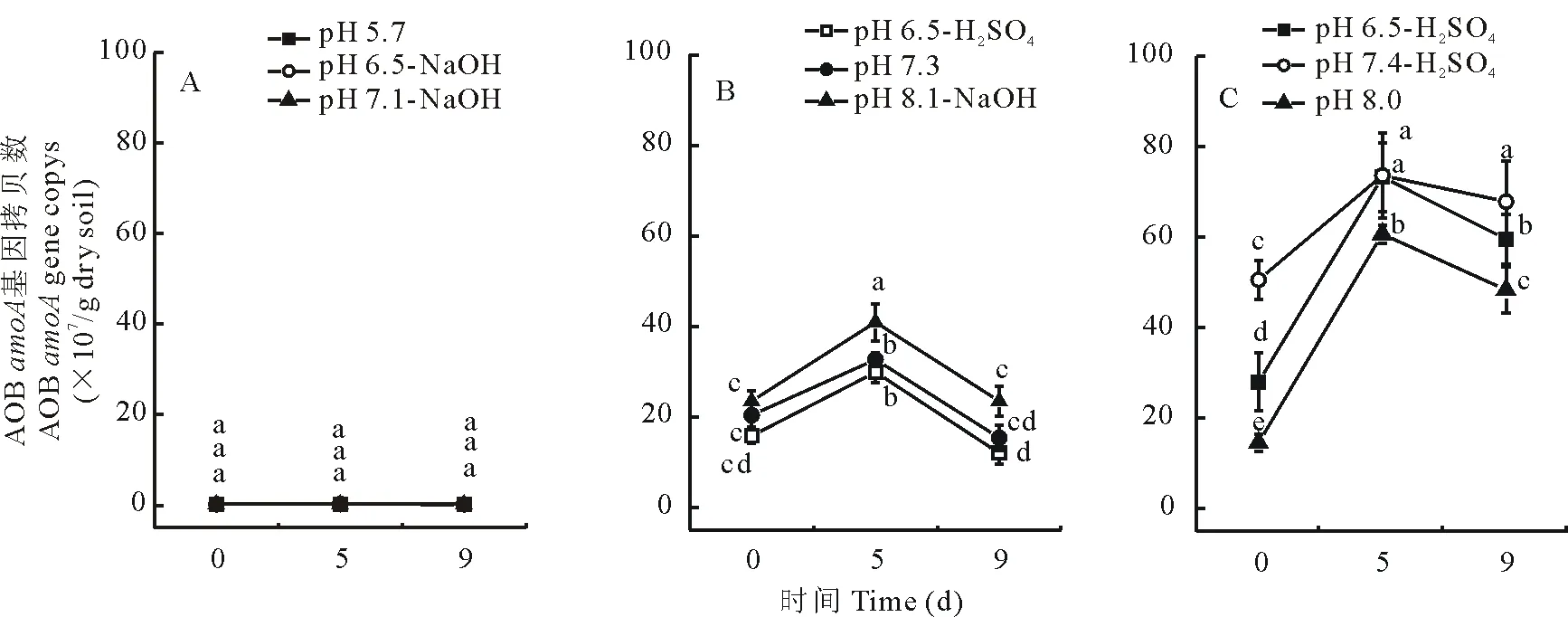
圖5 3種不同pH紫色土pH短期改變對(duì)AOB豐度的影響Fig.5 Effect of short-term pH change on abundance of ammonia-oxidizing bacterial(AOB) amoA gene in three purple soil with different pH
已有研究均發(fā)現(xiàn)pH在4.8~8.5的范圍內(nèi)時(shí),土壤的硝化速率隨著pH的增加而提高[16-18]。本實(shí)驗(yàn)中的石灰性紫色土的硝化作用最強(qiáng),而酸性紫色土中幾乎不發(fā)生硝化作用,與以往的研究結(jié)果[4-5,19]一致。但是,也有研究結(jié)果表明低pH的土壤中也會(huì)發(fā)生硝化作用[20-21]。例如,Nugroho等[22](2005)在荷蘭和芬蘭的9種酸性森林土(pH 2.9~3.4)中發(fā)現(xiàn)了強(qiáng)烈的硝化作用[5 mg N/(kg·d)];且He等[23]在pH 3.7的土壤中獲得了細(xì)菌和古菌的amoA基因,說(shuō)明強(qiáng)酸性土壤中有發(fā)生硝化作用的可能。而在本實(shí)驗(yàn)pH為5.7的土壤中卻沒(méi)有發(fā)生顯著的硝化作用,經(jīng)計(jì)算得到pH為5.7的土壤中NH3分子的濃度為500 nmol N/kg 干土(NH3+H+?NH4+; pKa=9.25),是Nugroho等[22]試驗(yàn)中土壤(pH 3.4)NH3分子濃度的200倍。但在加拿大酸性森林土(pH 2.9~3.4)中卻發(fā)生了強(qiáng)烈的硝化作用,所以酸性紫色土沒(méi)有發(fā)生顯著的硝化反應(yīng)并非缺少反應(yīng)底物;而更可能是與相關(guān)硝化微生物的活性有關(guān)。同時(shí),酸性紫色土采用NaOH調(diào)高pH后,反應(yīng)底物NH3分子濃度呈數(shù)量級(jí)增加,但凈硝化率并沒(méi)有增加;這一實(shí)驗(yàn)結(jié)果也為該猜測(cè)提供了充分證據(jù)。
pH的短期降低對(duì)堿性土壤中的凈硝化作用也無(wú)顯著影響。硝化反應(yīng)速率主要受氨單加氧酶(ammonia monooxygenase, AMO)催化的氨氧化速率控制[20,24-25]。因此,硝化反應(yīng)符合酶促反應(yīng)動(dòng)力學(xué)方程,如果底物濃度高于酶促反應(yīng)常數(shù)[26],則限制反應(yīng)速率的是酶活性,而不是反應(yīng)底物濃度。因此,堿性紫色土采用H2SO4調(diào)低pH后,反應(yīng)底物NH3分子濃度呈數(shù)量級(jí)降低,但凈硝化速率并沒(méi)有降低;這一實(shí)驗(yàn)結(jié)果說(shuō)明制約堿性紫色土硝化作用的因子不是氮源,而是相關(guān)硝化微生物的活性。
pH值的短期改變對(duì)酸性和堿性土壤的硝化作用沒(méi)有影響,但對(duì)中性土壤的硝化作用影響顯著。pH短期上升,硝化作用顯著增強(qiáng),pH短期下降,硝化作用隨之顯著減小。這表明底物濃度(NH3)控制著中性紫色土的硝化速率。
氨氧化細(xì)菌(AOB)以及氨氧化古菌(AOA)都擁有氨單加氧酶amoA基因編碼,這意味著AOB和AOA都在硝化作用起著關(guān)鍵作用[27-31]。越來(lái)越多的證據(jù)表明,土壤pH值在7.0以上時(shí),硝化作用是由氨氧化細(xì)菌主導(dǎo)[14,32-33],而氨氧化古菌則更可能在酸性土壤中主導(dǎo)了硝化作用[33-35]。本實(shí)驗(yàn)研究結(jié)果顯示了3種不同pH值紫色土中氨氧化微生物的生態(tài)位差異顯著。AOA主要分布于酸性紫色土,而AOB主要分布于堿性紫色土;而在中性紫色土(pH=7.4)中,AOA和AOB的豐度都很高,這可能意味著AOB和AOA在中性紫色土中共存,且都可能是硝化作用的推動(dòng)者。
4 結(jié)論
綜上所述,本研究可得出以下結(jié)論:1)pH短期改變對(duì)酸性與石灰性土壤中的硝化作用無(wú)顯著影響,但對(duì)中性土壤影響顯著,說(shuō)明不同pH的紫色土具有不同的硝化作用機(jī)制;2)紫色土中氨氧化微生物的生態(tài)位分布差異顯著,且受到pH的影響。AOA主要分布于酸性紫色土,而AOB主要分布于堿性紫色土;而在中性紫色土中,AOA和AOB共存。
References:
[1] Strayer R F, Lin C J, Alexander M. Effect of simulated acid rain on nitrification and nitrogen mineralization in forest soils. Journal of Environmental Quality (USA), 1981, 10: 547-551.
[2] Robertson G P. Factors regulating nitrification in primary and secondary succession. Ecology, 1982, 63: 1561-1573.
[3] Tietema A, De Boer W, Riemer L,etal. Nitrate production in nitrogen-saturated acid forest soils: vertical distribution and characteristics. Soil Biology & Biochemistry, 1992, 24: 235-240.
[4] Dancer W S, Peterson L A, Chesters G. Ammonification and nitrification of N as influenced by soil pH and previous N treatment. Soil Science Society of America Proceedings, 1973, 37: 67-69.
[5] Persson T, Wireén A. Nitrogen mineralization and potential nitrification at different depths in acid forest soils. Plant and Soil, 1995, 168-169: 55-65.
[6] Ste-Marie C, Pare D. Soil, pH and N availability effects on net nitrification in the forest floors of a range of boreal forest stands. Soil Biology & Biochemistry, 1999, 31: 1579-1589.
[7] Hayatsu M, Kosuge N. Autotrophic nitrification in acid tea soils. Soil Science and Plant Nutrition, 1993, 39: 209-217.
[8] B?ckman J S, Hermansson A, Tebbe C C,etal. Liming induces growth of a diverse flora of ammonia-oxidizing bacteria in acid spruce forest soil as determined by SSCP and DGGE. Soil Biology & Biochemistry, 2003, 35: 1337-1347.
[9] Yao H, Gao Y, Nicol G W,etal. Links between ammonia oxidizer community structure, abundance, and nitrification potential in acidic soils. Applied and Environmental Microbiology, 2011, 77: 4618-4625.
[10] Kemmitt S J, Wright D, Goulding K W T,etal. pH regulation of carbon and nitrogen dynamics in two agricultural soils. Soil Biology & Biochemistry, 2006, 38: 898-911.
[11] Burton S A, Prosser J I. Autotrophic ammonia oxidation at low pH through urea hydrolysis. Applied and Environmental Microbiology, 2001, 67: 2952-2957.
[12] Stark J M, Firestone M K. Kinetic characteristics of ammonium-oxidizer communities in a california oak woodland-annual grassland. Soil Biology & Biochemistry, 1996, 28: 1307-1317.
[13] Hansel C M, Fendorf S, Jardine P M,etal. Changes in bacterial and archaeal community structure and functional diversity along a geochemically variable soil profile. Applied and Environmental Microbiology, 2008, 74(5): 1620-1633.
[14] Di H J, Cameron K C, Shen J P,etal. Nitrification driven by bacteria and not archaea in nitrogen-rich grassland soils. Nature Geoscience, 2009, 2: 621-624.
[15] Davidson E A, Hart S C, Firestone M K. Internal cycling of nitrate in soils of a mature coniferous forest. Ecology, 1992, 73(4): 1148-1156.
[16] Wood P M. Mechanisms for biological ammonia oxidation[M]//Cole J A, Ferguson S J. The Nitrogen and Sulphur Cycles. SGM Special Publication, Cambridge University Press, 1988: 219-243.
[17] Killham K. Nitrification in coniferous forest soils. Plant and Soil, 1990, 128: 31-44.
[18] Paul E A, Clack F E. Soil Microbiology and Biochemistry[M]. San Diego: Academic Press, 1989.
[19] Curtin D, Campbell C A, Jalil A. Effects of acidity on mineralization: pH-dependence of organic matter mineralization in weakly acidic soils. Soil Biology & Biochemistry, 1998, 30: 57-64.
[20] De Bore W, Kowalchuk G A. Nitrification in acid soils: micro-organisms and mechanisms. Soil Biology & Biochemistry, 2001, 33: 853-866.
[21] Nugroho R A, R?ling W F M, Laverman A M,etal. Low nitrification rates in acid Scots pine forest soils are due to pH-related factors. Microbial Ecology, 2007, 53: 89-97.
[22] Nugroho R A, R?ling W F M, Laverman A M,etal. Presence of Nitrosospira cluster 2 bacteria corresponds to N transformation rates in nine acid Scots pine forest soils. FEMS Microbiology Ecology, 2005, 53: 473-481.
[23] He J, Shen J, Zhang L. Quantitative analyses of the abundance and composition of ammonia-oxidizing bacteria and ammonia-oxidizing archaea of a Chinese upland red soil under long-term fertilization practices. Environmental Microbiology, 2007, 9: 2364-2374.
[24] Ardakani M S, Schulz R K, McLaren A D. A kinetic study of ammonium and nitrite oxidation in a soil field plot. Soil Science Society of America Proceedings, 1974, 38: 273-277.
[25] Jiang Q Q, Bekken L R. Comparison of nitrosospira strains isolated from terrestrial environments. FEMS Microbiology Ecology, 1999, 30: 171-186.
[26] Levine I. Physical Chemistry[M]. New York: Kingsport, 1983: 542.
[27] Francis C A, Roberts K J, Beman J M,etal. Ubiquity and diversity of ammonia-oxidizing archaea in water columns and sediments of the ocean. Proceedings of the National Academy of Science, 2005, 102: 14683-14688.
[28] Lam P, Jensen M M, Lavik G,etal. Linking crenarchaeal and bacterial nitrification to anammox in the Black Sea. Proceedings of the National Academy of Science, 2007, 104: 7104-7109.
[29] Leininger S, Urich T, Schloter M,etal. Archaea predominate among ammonia-oxidizing prokaryotes in soils. Nature, 2006, 442: 806-809.
[30] Nugroho R A, R?ling W F M, van Straalen N M,etal. Changes in nitrification and bacterial community structure upon cross-inoculation of Scots pine forest soils with different initial nitrification rates. Soil Biology and Biochemistry, 2009, 41: 243-250.
[31] Wuchter C, Abbas B, Coolen M J L,etal. Archaeal nitrification in the ocean. Proceedings of the National Academy of Science, 2006, 103: 1231-12322.
[32] Jia Z J, Conrad R. Bacteria rather than archaea dominate microbial ammonia oxidation in an agricultural soil. Environment Microbiology, 2009, 11: 1658-1671.
[33] Jiang X J, Hou X Y, Zhou X,etal. pH regulates key players of nitrification in paddy soils. Soil Biology & Biochemistry, 2015, 81: 9-16.
[34] Erguder T H, Boon N, Wittebolle L,etal. Environmental factors shaping the ecological niches of ammonia-oxidizing archaea. FEMS Microbiology Reviews, 2009, 33: 855-869.
[35] Wessén E, Nyberg K, Jansson J K,etal. Responses of bacterial and archaeal ammonia oxidizers to soil organic and fertilizer amendments under long-term management. Applied Soil Ecology, 2010, 45: 193-200.
Mechanisms research on how pH affects nitrification in purple soils of Southwest China
MENG Yao, WANG Zhi-Hui, LUO Hong-Yan*, JIANG Xian-Jun*
CollegeofResourcesandEnvironment,SouthwestUniversity,Chongqing400715,China
Nitrification processes are highly sensitive to soil pH but the mechanisms through which pH affects soil nitrification are not fully understood. In the present study, three types of purple soils with different pH values were identified from the same parent material in southwest China (acid purple soil pH=5.7, neutral purple soil pH=7.3, calcareous purple soil pH=8.0). These soil types were used to investigate the long-term effects of soil pH on nitrification and ammonia oxidizers and the short-term effects of soil pH on nitrification and the activities and abundance of ammonia oxidizers. Tests were undertaken by artificially adding acid (H2SO4) or alkali (NaOH) to change soil pH. The results showed that short-term pH changes had no significant effect (P>0.05) on nitrification in acidic and calcareous purple soils whereas they had a significant effect (P<0.05) on nitrification in the neutral purple soil. The geneamoAof ammonia-oxidizing archaea (AOA) was expressed much more fully in the acid soil (3.04×108/g dry soil, AOA/AOB=31.8), whereas ammonia-oxidizing bacteria (AOB) were more adapted to the calcareous purple soil environment (2.35×108/g dry soil, AOA/AOB=0.07). These results indicate that soil pH can significantly affect nitrification in purple soils and that different pH levels have different mechanisms. The activities and community of nitrifying microorganisms were the dominant factors for nitrification in acidic and calcareous purple soils, while substrate concentration was the dominant factor in neutral purple soil. The key factor affecting the activity and community of nitrifying microorganisms is the long-term stable soil pH, while short-term pH changes mainly influence the substrate availability of nitrification.
nitrification; ammonia-oxidizing archaea(AOA); ammonia-oxidizing bacteria(AOB); soil pH; real-time quantitative PCR
10.11686/cyxb2016164
http://cyxb.lzu.edu.cn
2016-04-19;改回日期:2016-06-28
國(guó)家自然科學(xué)基金項(xiàng)目(41271267, 41301315)和重慶市自然科學(xué)基金 (Cstc2012JJA80024)資助。
孟瑤(1992-),女,廣西桂林人,在讀碩士。E-mail: 937196302@qq.com*通信作者Corresponding author. E-mail: hongyan5282@163.com, jiangxj@swu.edu.cn
孟瑤, 王智慧, 羅紅燕, 蔣先軍. 西南地區(qū)pH影響紫色土硝化作用機(jī)制研究. 草業(yè)學(xué)報(bào), 2017, 26(4): 73-79.
MENG Yao, WANG Zhi-Hui, LUO Hong-Yan, JIANG Xian-Jun. Mechanisms research on how pH affects nitrification in purple soils of Southwest China. Acta Prataculturae Sinica, 2017, 26(4): 73-79.

