甜高粱青貯有氧暴露的穩定性及微生物變化的研究
周斐然,張蘇江,王明,肖丹,郭雪峰(塔里木畜牧科技兵團重點實驗室,塔里木大學動物科學學院,新疆 阿拉爾843300)
?
甜高粱青貯有氧暴露的穩定性及微生物變化的研究
周斐然,張蘇江*,王明,肖丹,郭雪峰
(塔里木畜牧科技兵團重點實驗室,塔里木大學動物科學學院,新疆 阿拉爾843300)
為了更好地開發利用甜高粱青貯飼料,本研究以高糖甜高粱青貯(HSS)、低糖甜高粱青貯(LSS)和玉米青貯(MZS)為材料,研究了在有氧暴露0、5、10、15、20和25 d時干物質、水溶性碳水化合物(WSC)、pH、溫度和微生物數量的變化。結果表明,在有氧暴露前期(0~5 d),與LSS和MZS比較,HSS具有較低的pH值,較高的乳酸菌含量和較高的溫度;在有氧暴露的后期(15~25 d),HSS酵母菌、霉菌和好氧菌數量均顯著大于LSS和MZS (P<0.05),LSS的溫度和pH值顯著低于HSS和MZS(P<0.05);在整個有氧過程中,WSC含量在HSS中最高,干物質含量在LSS中最高(P<0.05)。可見,在有氧暴露環境下,LSS有氧穩定性最好,酵母菌、霉菌和好氧細菌數量增加最少;HSS有氧穩定性最差,酵母菌、霉菌和好氧細菌數量增加最多;MZS有氧穩定性和好氧性微生物數量居中。本研究結果提示,HSS在有氧暴露環境下更容易發生二次發酵,因此,有必要在青貯中使用添加劑,以保證HSS在使用過程的營養品質。
甜高粱;青貯;有氧穩定性;微生物
甜高粱(Sorghumbicolor/sweet sorghum)屬C4作物,是粒用高粱的一個變種,起源于非洲。由于其光合效率高、生物產量高、含糖量高,具有抗旱、耐貧瘠、耐鹽堿等特性,甜高粱作為能源、飼料和糖源作物已受到世界各國的普遍重視,被認為是最具開發潛力的能源植物之一[1-2]。作為飼料作物,制作青貯是目前甜高粱應用的主要形式。研究表明,青貯甜高粱粗纖維、蛋白質含量與青貯玉米(Zeamays)相當或優于青貯玉米[3],干物質降解率、中性洗滌纖維消化率高于玉米青貯,pH值、乳酸含量與玉米青貯相近[4-5]。
目前,青貯飼料是奶牛、肉牛養殖過程必不可少的重要飼料,而且在其他草食動物,如羊和鹿養殖中也有廣泛應用。青貯的質量對家畜的生產和生長都有直接影響,因此,青貯的品質倍受關注。豐富的水溶性碳水化合物(water soluble carbohydrate WSC)和適宜的水分含量是制作優質青貯飼料的基礎。然而,在開窖、取料、配制全混合日糧以及飼喂過程中,青貯飼料因接觸空氣容易發生二次發酵的問題[6]。青貯二次發酵使腐敗菌大量繁殖,造成青貯飼料營養物質損失,產生難聞的氣味,進而影響到家畜的采食量和生產性能[7]。
研究表明,青貯飼料的有氧穩定性不僅可以受到有機酸[8]和微生物[9]添加劑的影響,而且可以受到飼料原料組成[10-11]的影響。然而,作為一種在干旱、半干旱地區極具開發潛力的青貯飼料作物[2,12],甜高粱青貯飼料有氧穩定性方面的研究尚少見報道,為此,本研究選擇了含糖量存在差異的兩種甜高粱和普通玉米加工而成的甜高粱青貯和玉米青貯為材料,通過跟蹤分析有氧環境條件下3種青貯飼料中微生物數量的動態變化、溫度及pH變化,進而評價甜高粱青貯的有氧穩定性,為甜高粱青貯飼料的科學利用提供依據。
1 材料與方法
1.1 青貯飼料制作
高糖甜高粱(high sugar sweet sorghum, HS)品種為麗歐,糖錘度為22.1%,低糖甜高粱(low sugar sweet sorghum, LS)品種為X096,糖錘度為9.4%,玉米(maize, MZ)品種為包玉2號,糖錘度為9.2%。兩個品種甜高粱與玉米于2015年4月28日播種,每個播種小區面積約為100 m2(20 m×5 m),每個品種重復播種3個小區。播種行距為60 cm,株距20 cm,人工播種,按常規方法進行田間管理,臘熟期甜高粱和玉米2015年10月10日收割,分別制作高糖甜高粱青貯(high sugar sweet sorghum silage, HSS)、低糖甜高粱青貯(low sugar sweet sorghum silage, LSS)和玉米青貯(maize silage, MZS),青貯原料的化學成分見表1。
HS: High sugar sweet sorghum; LS: Low sugar sweet sorghum; MZ: Maize; DM: Dry matter; CP: Crude protein; WSC: Water soluble carbohydrate; NDF: Neutral detergent fibre; ADF: Acid detergent fibre; ADL: Acid detergent lignin. 下同The same below.
用普通粉草機將收割的玉米及甜高粱粉碎至2~3 cm,人工填裝于青貯塑料罐中。在填裝青貯原料的過程中,用粗細適宜的短木棒不斷用力搗壓,最大限度確保每罐青貯原料被壓實壓緊。之后,在罐口上附密封墊,擰緊蓋口,標記后于室溫(15~25 ℃)避光保存,每種青貯制作10罐青貯。
1.2 有氧穩定性分析
青貯飼料在2016年4月1日開罐,以一個發酵罐為重復單位,每種青貯取3個重復。松動開窖后青貯使之與空氣能充分接觸。把多路溫度記錄儀(NZ93-6,南京能兆科技有限公司)探頭放置于青貯飼料的中心位置,之后覆蓋2層紗布,放置于室溫下。在開罐有氧暴露后0,5,10,15,20,25 d時,從每個青貯罐中分別取樣,測定青貯飼料各時間點pH值、干物質、微生物數量。有氧穩定性定義為青貯飼料接觸空氣后核心物料溫度比外界溫度高出2 ℃時所需要的小時(h)數[13]。
1.3 溫度、干物質、WSC及pH值測定
pH值的測定:取出15 g青貯飼料樣品,浸于135 mL蒸餾水中攪拌1 min,并用2層濾紙進行過濾處理。濾液經離心后用電子酸度計(PHSJ-5,上海儀電科學儀器股份有限公司)測定pH值。干物質采用烘干法測定。WSC采用硫酸-蒽酮比色法測定[14]。溫度由多路溫度記錄儀測定。
大學生自身專業學習能力、日常興趣愛好、思想價值觀念也是影響就業觀形成的主要因素。在面臨就業問題的時候,大學生通常會根據自己的能力、愛好、物質追求等來確立自身的就業方向。
1.4 微生物菌落測定
從每種青貯飼料中各取5 g樣品,剪碎放入45 mL的無菌蒸餾水中封口,置于37 ℃恒溫搖床中慢速搖40 min后,即成10-1稀釋液。用裝有無菌槍頭的移液槍吸取100 μL的10-1稀釋液移入裝有900 μL無菌水的離心管中混合均勻,即成10-2稀釋液。按此方法連續稀釋,制成10-3、10-4、10-5、10-6、10-7稀釋菌液[15]。取選擇性培養基,用記號筆在培養皿的底部劃分10-3、10-4、10-5、10-6、10-7五種扇形稀釋梯度,分別吸取不同稀釋梯度的菌液10 μL滴在相應的扇形區域內,用涂抹棒均勻涂抹,每個稀釋梯度做3個重復。
按Ashbell等[16]的方法,乳酸菌、好氧細菌和酵母菌分別采用Rogosa瓊脂培養基、營養瓊脂培養基和孟加拉紅培養基,霉菌采用葡萄糖麥芽浸膏培養基。乳酸菌用CO2培養箱(BC-J80S,上海博訊實業有限公司)、好氧細菌和酵母菌用生化培養箱(SPX-150B,北京光明醫療儀器有限公司)、霉菌放在霉菌培養箱(MJX-160,寧波江南儀器廠),37 ℃培養48 h,用菌落計數器(YLN-30A,北京中興偉業儀器有限公司)統計菌落形成單位(colony forming unit, CFU)。
1.5 數據處理
使用Excel 2007對pH、微生物數量、溫度和DM數據進行數據整理,微生物數據進行以10為底的對數轉換。采用統計軟件SPSS 19.0進行方差分析,采用Duncan法進行多重比較,顯著性檢驗水平為0.05。
2 結果與分析
2.1 有氧暴露過程pH、DM、WSC和溫度的變化
HSS、LSS和MZS飼料有氧暴露過程pH、DM、WSC和溫度的變化情況見表2。在0到第15天期間,3種青貯DM含量由高到低依次為LSS,MZS,HSS(P<0.05)。在20和25 d時, DM在HSS和MZS達到同一水平(P>0.05),但依然顯著低于LSS(P<0.05)。在25 d的有氧暴露過程中,HSS增加了21.7%,MZS增加了10.1%,LSS增加了8.6%。
從pH值看,在0 d時,HSS顯著低于LSS和MZS(P<0.05),在第10天時,3種青貯pH達到同一水平(P>0.05),而在第25天時,MZS的pH最大,LSS最低,HSS居中,三者之間差異達到顯著水平(P<0.05)。3種青貯pH值都隨著有氧暴露時間的延長而上升。
從溫度變化來看,3種青貯飼料在0 d時溫度基本一致,但在有氧環境下,在5、10和15 d期間青貯飼料溫度持續升高,HSS和MZS溫度顯著大于LSS(P<0.05);從0到第5天,HSS溫度增加了3 ℃,MZS溫度增加了1.9 ℃,LSS溫度增加了1.4 ℃。在15和20 d時,各組青貯溫度均有所下降,在25 d時,各青貯溫度依然高于室溫。
2.2 有氧暴露過程微生物的數量變化
3種青貯飼料在有氧暴露過程中微生物數量的變化見表3。有氧暴露第0天時,HSS中乳酸菌數量最多,顯著大于LSS(P<0.05),MZS居中。在5至25 d期間,3種青貯的乳酸菌數量持續減少,在25 d時,乳酸菌數量在3種青貯中差異不顯著(P>0.05)。酵母菌和霉菌的數量變化相似,在有氧暴露的0 d時,3種青貯飼料之間酵母菌、霉菌數量無顯著差異(P>0.05),但在10至25 d期間,酵母菌和霉菌數量持續增加,HSS的酵母菌和霉菌數量顯著大于LSS(P<0.05),MZS居中。有氧暴露后,3種青貯中的好氧細菌數量均逐漸增加,在整個有氧暴露期間,好氧細菌數量在HSS中顯著高于LSS(P<0.05),而MZS的好氧菌數量基本處于二者之間。
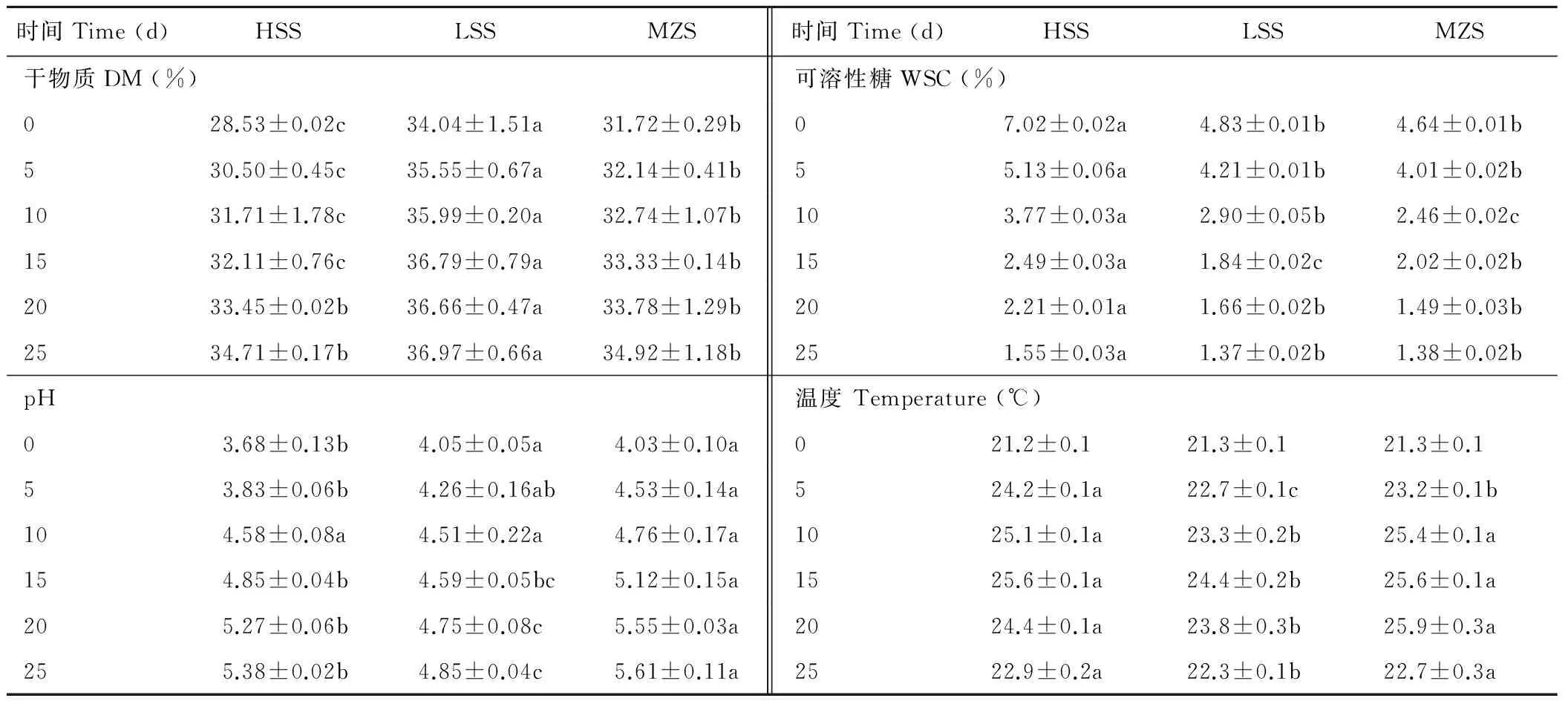
表2 青貯有氧暴露過程DM、pH、WSC和溫度的變化Table 2 The change of DM, pH, WSC and temperature during aerobic exposure of the silages
注:HSS:高糖甜高粱青貯;LSS:低糖甜高粱青貯;MZS:玉米青貯。表中同一指標同行比較,標注不同小寫字母表示差異顯著(P<0.05)。下同。
Note: HSS:High sugar sweet sorghum silage;LSS:Low sugar sweet sorghum silage;MZS:Maize silage.The values within rows under the same items are significantly different (P<0.05). The same below.

表3 青貯有氧暴露過程微生物數量的變化Table 3 The change of microbial populations in the silages during aerobic exposure log cfu/g FM
注: log cfu/g FM為每g青貯中菌落的對數值。
Note: log cfu/g FM means logarithm of bacterial colonies in 1 g silage.
3 討論
3.1 有氧條件下青貯pH、DM、WSC和溫度的變化
青貯DM與青貯原料本身的含水量有直接的關系。LS含水量最低,因此在LSS中DM也最大;HS持綠期較長,HS甜高粱表面富含的蠟質也阻止了水分的散失,在收割時含水量較多,導致HSS中DM較低;而MZ的水分在秋季很容易散失,導致含水量下降,使MZS的DM含量也較大。
青貯飼料pH值是評判青貯質量的關鍵性指標,是青貯乳酸發酵的結果。一般來講pH值越低,酸度越大,青貯越容易保存[17-18]。在有氧環境條件下,青貯飼料pH值會隨接觸空氣時間的延長而增加,這主要是好氣性微生物快速增殖所引起的[18]。在有氧暴露的前5 d,HSS的pH值顯著低于LSS和MZS,這是由HSS初始pH較低(pH=3.68)所引起的。在25 d時,LSS的pH值最低,MZS最高,HSS居中,這可能與三者可發酵糖的含量有關。
原料中豐富的WSC是保證青貯成功的關鍵因素之一,WSC是一類易發酵的物質,可以為青貯乳酸菌的增殖提供營養物質,產生有機酸而使pH下降。在0 d時,HSS、MZS和LSS中的WSC是青貯發酵后殘余的WSC。HSS中較高的WSC說明了HS在青貯發酵達到穩定階段后殘余的WSC較多,這與青貯原料HS中富含WSC(18.40%)有關。而在有氧條件下,HSS中豐富的WSC可以為好氧微生物的大量增殖提供養分,導致WSC的快速下降,同樣,LSS和MZS中殘留的WSC也可以為好氧菌的生長提供養分而下降。
產熱是青貯飼料在有氧環境條件下最顯著的變化之一,它是大量微生物活動的結果,也是青貯養分損失的過程。一般人們用有氧穩定性來判斷青貯飼料在有氧條件下變質的速度。有氧穩定性低,說明青貯遇氧變質速度越快[19]。在本研究中,環境溫度為21 ℃,因此,按有氧穩定性的定義,有氧穩定性LSS最高,HSS最低,而MZS居中。這種差異反映了青貯飼料中易發酵物質的多少,容易發酵物質越多,在有氧條件下,由于好氣性微生物快速增殖而使變質速度加快。因此,HSS較多的WSC可能是導致其有氧穩定性差的主要原因,此外,HSS較高含水量也加速了其變質過程;相反,LSS較低WSC含量是導致其在有氧條件下溫度上升較慢的主要原因,而MZS雖然WSC含量也比較低,但MZS所含的豐富淀粉也屬于易發酵物質,可以為好氧菌的生長提供養分,導致其在有氧條件下溫度上升也較快。
3.2 有氧條件下青貯微生物的變化
青貯過程是一個復雜的微生物發酵過程,其中乳酸菌被認為是決定青貯發酵能否成功的關鍵微生物[20],青貯過程添加乳酸菌制劑往往也可以明顯提高青貯的品質[21]。研究表明[3],HS和MZ比LS更容易青貯,與LSS相比,HSS殘留了更多的WSC,MZS則殘留了較多的淀粉。殘留在HSS中較多的WSC和MZS中的淀粉均屬易發酵糖類,在有氧的環境條件下,很容易被微生物利用而發生二次有氧發酵,導致HSS和MZS在有氧環境下酵母菌、霉菌和好氧細菌的快速增殖,而乳酸菌受到抑制而數量下降,更容易引起青貯飼料腐爛變質。LSS中較少的WSC和較低的含水量,可能是導致酵母、霉菌和好氧菌增殖較慢的重要原因。酵母菌和霉菌等好氣性微生物通過氧化青貯有機酸而引起青貯飼料的有氧變質[22],是導致青貯二次發酵過程營養損失的主要因素。有研究估計,在青貯發酵過程中的有氧變質損失可高達10%~15%[23]。由此,在有氧暴露環境下,酵母菌和霉菌等好氣性微生物所引起的HSS和MZS營養損失也是不可忽視的。
青貯乳酸菌的發酵類型,可以影響有氧條件下青貯的微生物數量和有氧穩定性。有研究表明,異型發酵乳酸菌產乳酸的能力雖然不如同型發酵乳酸菌,但它能夠增加青貯中乙酸、丙酸的比例,而乙酸和丙酸具有抑制酵母菌和霉菌生長的特性[24-26]。由此推測,在有氧條件下,LSS中酵母菌和霉菌數量較少,很可能由于LSS是以異型乳酸菌發酵為主,產生了較多的乙酸和丙酸,后者抑制了酵母菌和霉菌等好氣性微生物的增殖。但具體作用機制尚需進一步研究。
此外,不同的青貯原料附著的微生物種類和數量存在很大差異,這些微生物在青貯酸性環境條件下生長增殖受到了抑制,一旦環境發生變化,受抑制的微生物就會重新生長增殖。因此,HSS、MZS和LSS在有氧環境條件下不同微生物的數量變化也可能與其原料附著的微生物數量有關。
4 結論
有氧暴露條件下,LSS有氧穩定性最好,酵母菌、霉菌和好氧細菌數量增加最少;HSS有氧穩定性最差,酵母菌、霉菌和好氧細菌數量增加最多;MZS有氧穩定性和好氧性微生物數量居中。本研究結果提示,HSS在有氧暴露環境下更容易發生二次發酵,因此,有必要在青貯過程中使用添加劑,以保證HSS在使用過程中的營養品質。
References:
[1] Corredor D Y, Salazar J M, Hohn K L,etal. Evaluation and characterization of forage sorghum as feedstock for fermentable sugar production. Applied Biochemistry & Biotechnology, 2009, 158(1): 164-179.
[2] Xiao D, Zhang S J, Chen L Q,etal. Prospect analysis on the development of sweet sorghum as forage resources in Southern Xinjiang. Grass-Feeding Livestock, 2014, (6): 22-27. 肖丹, 張蘇江, 陳立強, 等. 甜高粱飼料在南疆粗飼料資源開發中的前景分析. 草食家畜, 2014, (6): 22-27.
[3] Zhang S J, Chaudhry A S, Ramdani D,etal. Chemical composition andinvitrofermentation characteristics of high sugar forage sorghum as an alternative to forage maize for silage making in Tarim Basin, China. Journal of Integrative Agriculture, 2016, 15(1): 175-182.
[4] Marco O N D, Ressia M A, Arias S,etal. Digestibility of forage silages from grain, sweet and bmr sorghum types: Comparison ofinvivo,insituandinvitrodata. Animal Feed Science & Technology, 2009, 153(3): 161-168.
[5] Amer S, Seguin P, Mustafa A F. Short communication: Effects of feeding sweet sorghum silage on milk production of lactating dairy cows. Journal of Dairy Science, 2012, 95(2): 859-863.
[6] Guo X S, Zhou H, Yu Z. Effects of different additives on the aerobic stability of silage. China Dairy Cattle, 2006, (9): 18-21. 郭旭生, 周禾, 玉柱. 不同添加劑對青貯飼料有氧穩定性的影響. 中國奶牛, 2006, (9): 18-21.
[7] Zhou D B. Research, development and actuality for corn stover silage. Amino Acids and Biotic Resources, 2004, 26(2): 32-34. 周德寶. 青貯飼料的研究、發展及現狀. 氨基酸和生物資源, 2004, 26(2): 32-34.
[8] Ma X G, Liu J J, Zheng Z H,etal. Effects of acetic and lactic acid in corn stover silage on aerobic stability and methane yield rate. Journal of China Agricultural University, 2015, 20(1): 44-52. 馬旭光, 劉晶晶, 鄭澤慧, 等. 乙酸和乳酸對玉米秸稈青貯料有氧穩定性和甲烷產率的影響. 中國農業大學學報, 2015, 20(1): 44-52.
[9] Guan W T, Ashbell G, Hen Y,etal. Effects of microbial inoculants applied to sorghum at ensiling on silage characteristics and aerobic stability. Scientia Agricultura Sinica, 2002, 35(11): 1401-1405. 管武太, Ashbell G, Hen Y, 等. 微生物添加劑對青貯高粱發酵品質和穩定性的影響. 中國農業科學, 2002, 35(11): 1401-1405.
[10] Wang Y, Yuan X J, Guo G,etal. Fermentation and aerobic stability of mixed ration forages in Tibet. Acta Prataculturae Sinica, 2014, 23(6): 95-102. 王勇, 原現軍, 郭剛, 等. 西藏不同飼草全混合日糧發酵品質和有氧穩定性的研究. 草業學報, 2014, 23(6): 95-102.
[11] Xu Q F, Yu Z, Li Z Q,etal. A study on aerobic stability of alfalfa and corn silage. Acta Agrestia Sinica, 2007, 15(6): 519-524. 許慶方, 玉柱, 李志強, 等. 苜蓿、玉米青貯飼料有氧穩定性研究. 草地學報, 2007, 15(6): 519-524.
[12] Zhang S J, Osman A, Xue X Z,etal. Quality analysis on different sweet sorghum silages in Southern Xinjiang compared with a corn silage. Acta Prataculturae Sinica, 2014, 23(3): 232-240. 張蘇江, 艾買爾江·吾斯曼, 薛興中, 等. 南疆玉米和不同糖分甜高粱的青貯品質分析. 草業學報, 2014, 23(3): 232-240.
[13] Hu W, Schmidt R J, Mcdonell E E,etal. The effect ofLactobacillusbuchneri40788 orLactobacillusplantarumMTD-1 on the fermentation and aerobic stability of corn silages ensiled at two dry matter contents. Journal of Dairy Science, 2009, 92(8): 3907-3914.
[14] Yu R H, Zhao L H, Mo F,etal. Determination of water soluble carbohydrate in corn straw silage. Feed Industry, 2003, 24(9): 38-39. 余汝華, 趙麗華, 莫放, 等. 玉米秸稈青貯飼料中水溶性碳水化合物測定方法研究. 飼料工業, 2003, 24(9): 38-39.
[15] Zhang G N, Zhang Q. Study on microbial culture method in silage. Feed Industry, 2010, 31(7): 19-22. 張高娜, 張騫. 青貯飼料中微生物培養方法的研究. 飼料工業, 2010, 31(7): 19-22.
[16] Ashbell G, Pahlow G, Barbara D,etal. Dynamics of orange peel fermentation during ensilage. Journal of Applied Microbiology, 1987, 63(4): 275-279.
[17] Yang Y G, Zhang Y L, Du X,etal. Study on the major microorganism changes during the silage processing of two kinds of corn silage. Chinese Journal of Animal & Veterinary Sciences, 2012, 43(3): 397-403. 楊云貴, 張越利, 杜欣, 等. 2種玉米青貯飼料青貯過程中主要微生物的變化規律研究. 畜牧獸醫學報, 2012, 43(3): 397-403.
[18] Wang B P, Dong X Y, Dong K H,etal. Effects of organic acid on the aerobic stability of whole-crop corn silage. Acta Agrestia Sinica, 2013, 21(5): 991-997. 王保平, 董曉燕, 董寬虎, 等. 有機酸對全株玉米青貯有氧穩定性的影響. 草地學報, 2013, 21(5): 991-997.
[19] Qin L G. Study on aerobic stability of corn silage with different additives. China Dairy, 2010, (8): 40-42. 秦立剛. 不同添加劑對青貯玉米的有氧穩定性研究. 中國乳業, 2010, (8): 40-42.
[20] Stokes M R. Effects of an enzyme mixture, an inoculant, and their interaction on silage fermentation and dairy production. Journal of Dairy Science, 1992, 75(3): 764-773.
[21] Guo H M, Zhu W, Zhang Y,etal. Effect of additives on the quality of asparagus officinalis stem leaf silage. Acta Prataculturae Sinica, 2016, 25(5): 134-140. 郭海明, 朱雯, 張勇, 等. 青貯添加劑對蘆筍莖葉青貯品質的影響. 草業學報, 2016, 25(5): 134-140.
[22] Spoelstra S F, Driehuis F, Elferink S J. Anaerobic lactic acid degradation during ensilage of whole crop maize inoculated with. Journal of Applied Microbiology, 1999, 87(4): 583-593.
[23] Ashbell G, Lisker N. Aerobic deterioration in maize silage stored in a bunker silo under farm conditions in a subtropical climate. Journal of the Science of Food & Agriculture, 1987, 45(4): 307-315.
[24] Kung L, Taylor C C, Lynch M P,etal. The effect of treating alfalfa withLactobacillusbuchneri, 40788 on silage fermentation, aerobic stability, and nutritive value for lactating dairy cows. Journal of Dairy Science, 2002, 85(7): 1793-1800.
[25] Weinberg Z G, Ashbell G, Hen Y,etal. The effect of applying lactic acid bacteria at ensiling on the aerobic stability of silages. Journal of Applied Microbiology, 2008, 75(6): 512-518.
[26] Taylor C C, Kung L. The effect ofLactobacillusbuchneri, 40788 on the fermentation and aerobic stability of sigh moisture corn in laboratory silos. Journal of Dairy Science, 2002, 85(6): 1526-1532.
Aerobic stability and microbial populations in sweet sorghum silages during aerobic exposure
ZHOU Fei-Ran, ZHANG Su-Jiang*, WANG Ming, XIAO Dan, GUO Xue-Feng
KeyLaboratoryofTarimAnimalHusbandryScience&Technology,CollegeofAnimalScience,TarimUniversity,Alar843300,China
In order to promote the exploitation and utilization of sweet sorghum silage, three kinds of silages (high sugar sweet sorghum silage, HSS; low sugar sweet silage, LSS; maize silage, MZS) were used to analyze the changes in dry matter (DM), water soluble carbohydrates (WSC), pH, temperature and microbial populations during aerobic exposure over 0, 5, 10, 15, 20 and 25 days. The results showed that HSS had a lower pH and higher LAB (lactic acid bacteria) population and higher temperature compared with LSS and MZS (P<0.05) in the early stage of aerobic exposure (0-5 d). The numbers of yeast, mould and aerobic bacteria in HSS were higher than that in LSS and MZS (P<0.05), while temperature and pH were lower in LSS than those in HSS and MZS (P<0.05) in the latter stages of aerobic exposure (15-25 d). HSS had the highest WSC and LSS had the lowest dry matter content (P<0.05) over all exposure periods. Overall, LSS had the greatest aerobic stability with less yeast, mould and aerobic bacteria which were highest in HSS which had the lowest aerobic stability; bacteria numbers and aerobic stability were intermediate in in MZS. The results of this study suggest that it is necessary to use additives when making HSS to assure quality because it is more prone to secondary fermentation under aerobic exposure.
sweet sorghum; silage; aerobic stability; microbe
10.11686/cyxb2016304
http://cyxb.lzu.edu.cn
2016-08-17;改回日期:2016-11-14
國家自然科學基金項目(31160472)資助。
周斐然(1991-),男,新疆喀什人,在讀碩士。E-mail: 710298044@qq.com*通信作者Corresponding author. E-mail: zsjdky@126.com
周斐然, 張蘇江, 王明, 肖丹, 郭雪峰. 甜高粱青貯有氧暴露的穩定性及微生物變化的研究. 草業學報, 2017, 26(4): 106-112.
ZHOU Fei-Ran, ZHANG Su-Jiang, WANG Ming, XIAO Dan, GUO Xue-Feng. Aerobic stability and microbial populations in sweet sorghum silages during aerobic exposure. Acta Prataculturae Sinica, 2017, 26(4): 106-112.

